Главный элемент органической химии: главный элемент органических соединений А)С В)H C)Fe D)O E)S
- Комментариев к записи Главный элемент органической химии: главный элемент органических соединений А)С В)H C)Fe D)O E)S нет
- Разное
- [Прелесть химии] Органическая химия
- Строение органических веществ — урок. Химия, 8–9 класс.
- Главный элемент органической химии.
- Медиум органической химии – Наука – Коммерсантъ
- ЕГЭ по химии, подготовка к ЕГЭ по химии 2021 в Москве, сложность, оценки, задачи, шкала перевода баллов — Учёба.ру
- Кафедра неорганической химии имени А.Н. Реформатского – Структура института
- История МГТУ им Н.Э.Баумана
- Какие три основных элемента составляют структуру органических молекул?
- 1.9: Значение углерода – Biology LibreTexts
- Органические соединения
- органических молекул
- Органическая химия
- Активизация химических реакций твердого тела
- К преодолению проблем растворимости в органической химии
- Следующий шаг в производстве магнитных органических молекул
- Склеивание блинов как новый инструмент для создания новых магнитных материалов на основе металлов
- Режим Маркуса в органических устройствах: механизм межфазной передачи заряда подтвержден
- Невинные и сильно окисляющие вещества
- Органический ферромагнетизм: захват спинов в стеклообразном состоянии
- Эффективное образование амидных связей в мягких условиях
- Обнаружен новый синтез сложных органических молекул
- Возможна селективная конверсия реакционноспособных соединений лития
- Типы органических соединений в химии и биологии
- Глава 5 – Введение в органическую химию – Химия
[Прелесть химии] Органическая химия
Все статьи из цикла “В чем прелесть предмета”
Другие статьи из цикла “В чем прелесть химии”:
Строительные блоки материи
Зачем учить физхимию?
Неорганическая химия
Полимеры
Синтез жизни
Чистый воздух
Химия и медицина: химическое оружие, аспирин и плесень
Почти каждый учебник химии встречает нас словами: “Химия – наука о веществах, их составе, строении и взаимодействиях между ними”. Только-только познакомившись с химической наукой, ученик начинает изучать первые вещества, принадлежащие к неорганическому миру, – кислоты (серная кислота \(H_2SO_4\)), основания (гидроксид натрия \(NaOH\)), а также соли (сульфат калия \(K_2SO_4\)) – продукты взаимодействия последних. Пусть список кислот и оснований немал, они все же описывают лишь малую долю такого огромного мира атомов и молекул. Человеческий организм состоит из множества клеток, но что за молекулы образуют эти самые клетки? Генетическая информация ведь не что-то абстрактное, а реальная молекула.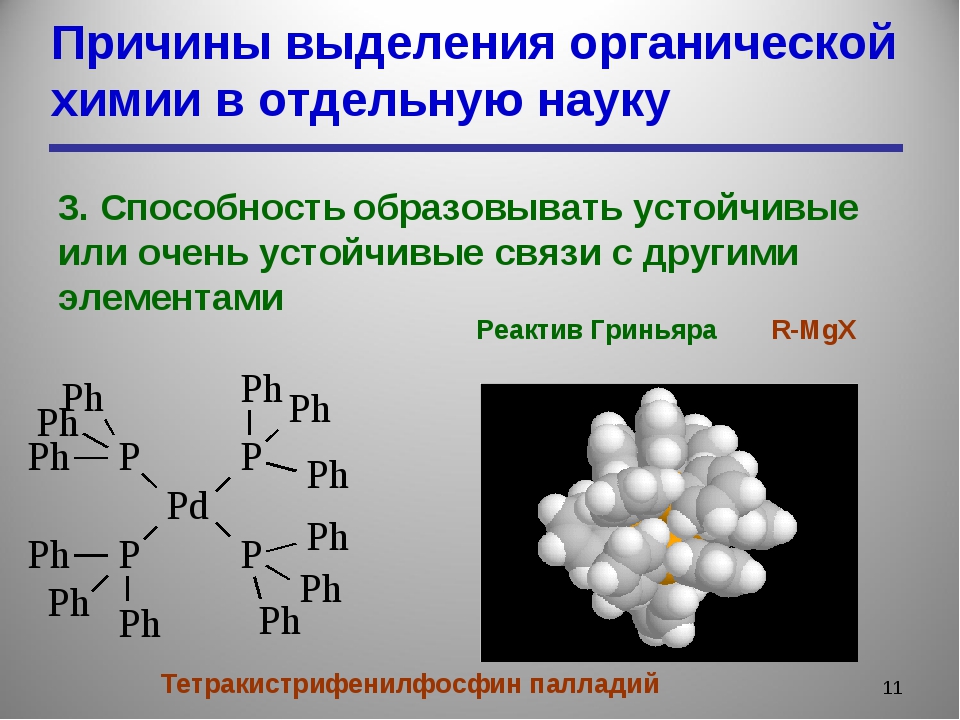 Но если так, то в каком виде она существует? А что за странные, замудренные названия молекул написаны на этикетке любимого йогурта? Ответить на эти и многие другие вопросы может один из самых больших и поистине многогранных разделов химии наших дней – органическая химия.
Но если так, то в каком виде она существует? А что за странные, замудренные названия молекул написаны на этикетке любимого йогурта? Ответить на эти и многие другие вопросы может один из самых больших и поистине многогранных разделов химии наших дней – органическая химия.
Главный органический элемент
В неорганической химии в каждом соединении мы могли наблюдать огромное разнообразие химических элементов со всех уголков таблицы Менделеева. В органической химии все немного иначе: органические вещества могут состоять из гораздо меньшего набора элементов, при этом, однако, разнообразие самих органических соединений нисколько не умаляется, а, напротив, остается безмерным.
Дальше ситуация становится куда более интересной. В каждом органическом соединении присутствует химический элемент, без которого органики и не было бы. Этот элемент – углерод, царь-батюшка всея органической химии. Вся органика – это химия соединений углерода, а все органические соединения – углеродные цепочки разных масштабов и форм. Именно благодаря способности углерода образовывать длинные и прочные цепочки на свете существует бесконечное множество органических молекул, которые образуют и полиэтиленовый пакет в магазине, и ферменты, помогающие переваривать вкусный обед.
Именно благодаря способности углерода образовывать длинные и прочные цепочки на свете существует бесконечное множество органических молекул, которые образуют и полиэтиленовый пакет в магазине, и ферменты, помогающие переваривать вкусный обед.
Разнообразие мира органической химии
На этом достаточно формального представления, давайте познакомимся поближе с самой органической химией! В школе органика начинается с углеводородов (не путать с углеводами). Вспомним, что углеводороды – это простейшие соединения углерода и водорода. Углеводороды могут образовывать линейные (алифатические) и циклические структуры, а также могут формировать различные молекулярные каркасы.
В органических соединениях углерод может связываться только с четырьмя атомами, но для образования молекулы необязательно нужны все четыре атома – углерод вполне независим. Он способен образовывать двойные и даже тройные связи, если это позволяют атомы другого элемента. Это явление описывается понятием кратности связи – количества связей между двумя соседствующими атомами.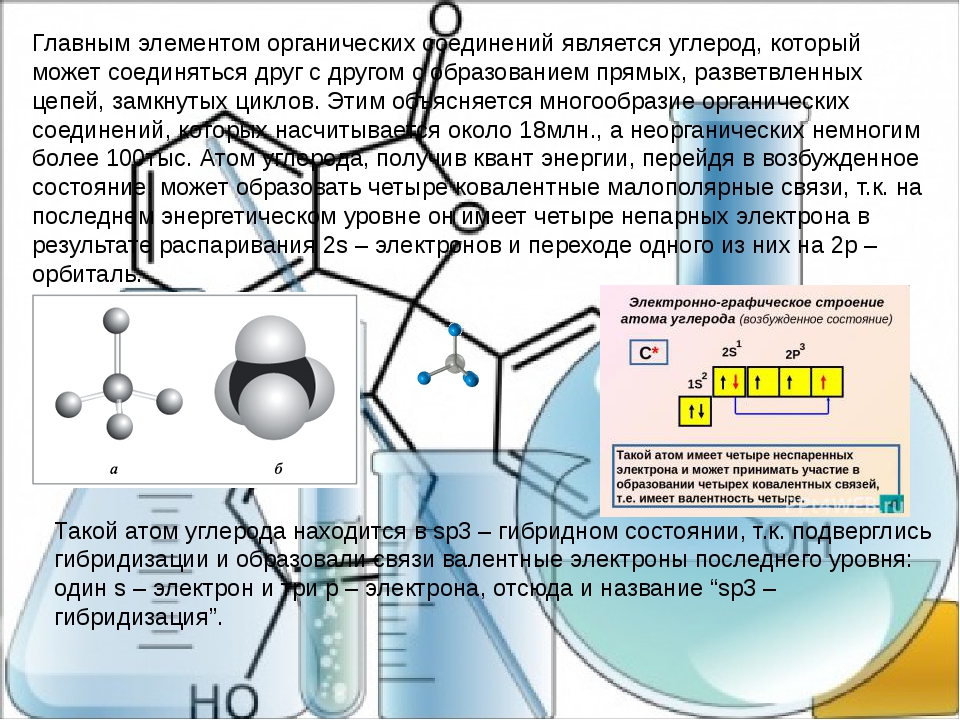
Если мы начнем замещать атомы водорода в углеводородных цепочках на другие атомы, скажем, кислород, серу или азот, то мы выйдем за рамки углеводородов, тем самым увеличив разнообразие органических соединений в миллионы раз. Так на свет появляется новое понятие из мира органики – функциональная группа, то есть часть молекулы, отвечающая за её химические свойства.
Хорошим примером разнообразия в химии считаются аминокислоты. Все канонические аминокислоты имеют общий каркас: амино- и карбоксильную группы, разделенные одним атомом углерода. К этому же атому углерода присоединяется радикал, который характеризует каждую аминокислоту по-своему: радикал может позволить аминокислоте раствориться в воде или жирах, или же создать дополнительные связи с другими аминокислотами.
5 примеров аминокислот, имеющих разные свойства из-за своих боковых цепей. Синим цветом выделены аминогруппы, красным – карбоксильные группыОгромные углеводородные цепочки, каркасы и функциональные группы – разве этого достаточно, чтобы создать то огромное разнообразие молекул, коим известна органика? В органической химии все куда сложнее, чем кажется на первый взгляд. В органической химии большую роль играет расположение связей относительно друг друга. Например, существует две молекулы с общей формулой \(C_2H_6O\), но по своей структуре они совершенно различны. Данное явление называется изомерией.
В органической химии большую роль играет расположение связей относительно друг друга. Например, существует две молекулы с общей формулой \(C_2H_6O\), но по своей структуре они совершенно различны. Данное явление называется изомерией.
Следующий фактор, который вносит разнообразие в нашу систему – это та самая кратность связи. Самая обычная одинарная связь позволяет атомам на обоих концах вращаться вокруг своей оси в самых разных направлениях. Однако двойная связь не способна на такую мобильность, в результате чего заместители около неё прочно зафиксированы друг относительно друга. Из-за такого “скованного” вращения, структура молекулы также изменяется, давая начало новому явлению – геометрической изомерии.
Два соединения отличаются из-за изомерии двойной связиОптическая изомерия
Кажется, структурной и геометрической изомерии уже достаточно для известного разнообразия соединений в органической химии. Не тут-то было, встречайте, оптическая изомерия! Этот вид изомерии сложно заметить на первый взгляд, поэтому давайте рассмотрим следующие \(3\)D модели.
Если мы попытаемся наложить одну молекулу на другую, то обнаружим, что они неидентичны. Хорошая аналогия такому явлению – наши руки. Руки пусть и одинаковые, но никакое их вращение не приведёт к тому, что правая рука идеально наложится на левую. Оптическая изомерия возникает в случае присутствия около атома углерода четырех разных по природе и строению заместителей. Такой атом углерода называется хиральным, а изомеры, являющиеся зеркальными отображениями друг друга, называются энантиомерами. Энантиомеры обладают одинаковыми физическими свойствами, единственное отличное их свойство – направление вращения плоскости поляризованного света: в то время как один оптический изомер вращает плоскость поляризованного света по часовой стрелки, другой – против.
Вот мы и разобрали с вами основные причины огромного разнообразия органических соединений. Но, где есть разнообразие, там есть и специфичность…
Хоть энантиомеры и имеют одинаковые физические свойства, их химические свойства могут значительно отличаться. Оптическая изомерия биологических молекул (в том числе лекарств) очень специфична – в то время как один оптический изомер будет работать в качестве лекарственного препарата, другой – в качестве яда. Хорошим примером этому служит противовоспалительное лекарство (S)-Naproxen.
Оптическая изомерия биологических молекул (в том числе лекарств) очень специфична – в то время как один оптический изомер будет работать в качестве лекарственного препарата, другой – в качестве яда. Хорошим примером этому служит противовоспалительное лекарство (S)-Naproxen.
В то время как (S)-изомер Naproxen-а является лекарственным средством, (R)-изомер – опасный токсин, поражающий почки.
Биологическая специфичность оптических изомеров связана с пространственной специфичностью активных сайтов ферментов: только верная конфигурация молекулы будет эффективно связываться с ферментом, тогда как неверная конфигурация может прочно “связать” фермент и деактивировать его.
Как исследуют органические молекулы
Органическая химия невероятна по своему разнообразию: вкупе с множественными каркасами, разветвлениями, функциональными группами и изомерией, любая связь может сделать молекулу особенной. Однако весь этот бесчисленный спектр молекул не может взяться из ниоткуда. Пусть львиная доля органических соединений синтезируется живыми организмами, существует целый ряд веществ, создающихся человеческими руками в лабораториях. Отсюда рождается вопрос: каким образом учёные манипулируют молекулами и синтезируют из них желаемые вещества – лекарства, суперпрочные материалы и многое другое?
Отсюда рождается вопрос: каким образом учёные манипулируют молекулами и синтезируют из них желаемые вещества – лекарства, суперпрочные материалы и многое другое?
Давайте попробуем разобраться в этом на примере антималярийного лекарственного препарата хинина.
Слева – структура хинина, справа – кора хинного дерева. Источник изображенияЕсли бы мы стали первооткрывателями хинина, обладая всем технологическим потенциалом двадцать первого века, то первым же делом нам потребовалось бы получить чистую пробу интересующего нас вещества. В природе хинин встречается в составе коры хинного дерева, из которой путем сушки и промывки растворителями, а затем последующим разделением компонентов смеси можно получить чистое вещество в нужных для химического анализа количествах. Стоит заметить, что под анализом подразумеваются утонченные методы элементного анализа и расшифровка структуры вещества.
Одним из широко используемых методов химического анализа при изучении природных веществ является масс-спектрометрия. Из названия несложно догадаться, что главной целью этого метода есть установление массы интересующей нас молекулы. Масс-спектрометр ионизирует молекулы образца, “выбивая” из них электроны электронными лучами. Затем ионизированное вещество, называемое катион-радикалом, попадает в ускоритель, где под действием магнитного поля его траектория отклоняется от прямого полёта под определенным углом, который напрямую зависит от массы частицы. Таким образом, данное чудо инструментального анализа позволяет измерить точную массу катион-радикала в зависимости от точки столкновения с чувствительной стенкой детектора.
Из названия несложно догадаться, что главной целью этого метода есть установление массы интересующей нас молекулы. Масс-спектрометр ионизирует молекулы образца, “выбивая” из них электроны электронными лучами. Затем ионизированное вещество, называемое катион-радикалом, попадает в ускоритель, где под действием магнитного поля его траектория отклоняется от прямого полёта под определенным углом, который напрямую зависит от массы частицы. Таким образом, данное чудо инструментального анализа позволяет измерить точную массу катион-радикала в зависимости от точки столкновения с чувствительной стенкой детектора.
Однако, установив молекулярную массу вещества, ученым необходимо нечто большее, чтобы понять структуру вещества – вспомните о различных изомерах, описанных в первой части. Для получения более детальной картины мира химики прибегают к другим видам анализа, а именно использованию электромагнитного излучения. Например, инфракрасным (ИК) излучением можно измерить частоту колебаний связей между атомами. Так как у каждой химической связи есть своя характерная длина и сила, то частота колебаний для каждой связи будет уникальной, что позволяет проверить наличие функциональных групп в неизвестной для нас структуре. Таким образом ИК-спектрометрия находит чрезвычайно важные фрагменты структурного пазла – функциональные группы.
Так как у каждой химической связи есть своя характерная длина и сила, то частота колебаний для каждой связи будет уникальной, что позволяет проверить наличие функциональных групп в неизвестной для нас структуре. Таким образом ИК-спектрометрия находит чрезвычайно важные фрагменты структурного пазла – функциональные группы.
Помимо этого, среди наиболее распространенных видов анализа стоит выделить ультрафиолетовую (УФ) и ядерно-магнитно-резонансную (ЯМР) спектрометрии. Первая основана на применение УФ–излучения и помогает оценить масштабы сопряженных систем из пи-связей, которые, например, отвечают за цвет органических пигментов. ЯМР, в свою очередь, использует радиоволны, способные взаимодействовать с магнитным моментом ядра каждого атома в магнитном поле спектрометра, давая информацию об относительном расположении атомов в каркасе молекулы. Так, используя и комбинируя разные методики анализа, ученые могут получить наиболее точные данные о строении вещества, включая такие характеристики, как оптическая и геометрическая изомерии.
Органический синтез
Что ж, у нас есть «чертёж» молекулы, теперь нужно разобраться, как её сконструировать из более простых и коммерчески доступных веществ, или, говоря научным языком, синтезировать интересующее нас вещество в лабораторных условиях. Синтез происходит в обычных колбах, где, используя различные химические реактивы, химики шаг за шагом модифицируют исходную молекулу, постепенно подбираясь к ключевым фрагментам целевого продукта. После же остаётся скрепить между собой все детали молекулярного конструктора и внести последние штрихи, дабы в конце получить целевой химический продукт, который ничем не будет отличаться от своего природного аналога.
Важно отметить, что химические реакции не всегда протекают по одной схеме, ведь каждое химическое превращение уникально. К тому же, всегда нужно учитывать особенности строения молекулы, над которой предстоит работать. Так, например, молекулы ацетальдегида в присутствии щелочи (\(NaOH\)) способны вступать в межмолекулярную альдольную реакцию, показанную ниже.
По аналогии с ацетальдегидами, молекулы гептандиаля, в структуре которых присутствуют две альдегидные группы, должны так же вступать в межмолекулярную реакцию друг с другом.
Однако не все так просто, ведь две необходимые альдегидные группы уже присутствуют на обоих концах молекулы, из-за чего протекает внутримолекулярная реакция, в ходе которой два конца молекулы реагируют друг с другом, образуя основной циклический продукт.
Несмотря на наличие одинаковых функциональных групп, молекулы способны реагировать по совершенно разным механизмам, отличных от шаблонных. Только понимая логику превращений, химики могут объяснить образование того или иного продукта. Поэтому органический синтез – это настоящее искусство во всей красе, а для его понимания нужно уметь строить гипотезы, пробовать синтез на практике и детально анализировать происхождение каждого полученного продукта.
Производство искусственных химических веществ завоевало большой интерес на политической арене прошлого века. В частности, американские ученые пытались разработать полный синтез хинина для широкомасштабного обеспечения своих войск медикаментами, так как союзные силы, сражавшиеся во Второй мировой войне, были отрезаны от единственного источника противомалярийного препарата из-за оккупации Юго-Восточной Азии Японской Империей. Благодаря деятельности выдающихся американских учёных Роберта Вудворда и Уильяма Дёринга, в \(1944\) году всё-таки получилось впервые провести полный синтез хинина из доступных реагентов.
В частности, американские ученые пытались разработать полный синтез хинина для широкомасштабного обеспечения своих войск медикаментами, так как союзные силы, сражавшиеся во Второй мировой войне, были отрезаны от единственного источника противомалярийного препарата из-за оккупации Юго-Восточной Азии Японской Империей. Благодаря деятельности выдающихся американских учёных Роберта Вудворда и Уильяма Дёринга, в \(1944\) году всё-таки получилось впервые провести полный синтез хинина из доступных реагентов.
Тут-то и начинается вся прелесть органического синтеза, в котором, основываясь на логических принципах взаимодействия валентных электронов между молекулами, химики способны понять механизм органических превращений и даже предугадать ход всей химической реакции.
Основополагающим механизмом органических реакций является взаимодействие нуклеофилов, молекул с большей электронной плотностью, которые так и норовят поделиться лишней парой электронов, с электрофилами, молекулами с низкой электронной плотностью, готовыми принять лишнюю пару электронов. +\) у атома азота в результате всей реакции образуется имин (продукт реакции), который в дальнейшем продолжит синтетическую цепочку превращений вплоть до заветного хинина.
+\) у атома азота в результате всей реакции образуется имин (продукт реакции), который в дальнейшем продолжит синтетическую цепочку превращений вплоть до заветного хинина.
Важно отметить, что на самом деле Р. Вудворд и У. Дёринг открыли путь к синтезу хинотоксина, токсичного изомера хинина, содержащегося в коре того же хинного дерева, положившись на ранее изученный опыт немецких учёных Пауля Рабе и Карла Киндлера, которые в \(1918\) году сумели химическим путем превратить хинотоксин в хинин. Вот так работа из прошлого вдохновила американских учёных собрать синтетический пазл именно в этом направлении!
Синтез хинина из хинотоксинаНесмотря на то, что синтез Р. Вудворда и Дёринга не получил продолжение в виде широкомасштабного производства из-за дороговизны процесса, само научное достижение стало основоположником новой эры органического синтеза, доказав, что человечество способно получить чуть ли не каждое природное вещество искусственным путем.
В последующие десятилетия химики-синтетики один за другим совершенствовали синтез хинина, предлагая стратегии синтеза из альтернативных исходных веществ. Например, синтез хинина из цикличного лактама, открытый Гилбертом Сторком:
Например, синтез хинина из цикличного лактама, открытый Гилбертом Сторком:
Синтез Эрика Якобсена исходя из \(3\)-гидрокси-пропаналя:
Или же синтез группы Юичи Кобаяши, которая выбрала схожий метод синтеза предпоследнего вещества:
Синтез одного и того же вещества можно осуществить множеством разных путей, именно поэтому органический синтез – это сфера, требующая от исследователей креативности и нестандартного мышления, а сам органический синтез можно назвать своего рода искусством!
Заключение
Органическая химия – наука, которая окружает нас повсюду. Многие современные материалы – это синтетические органические полимеры, а лекарства в вашей домашней аптечке – биологически активные органические молекулы. Несмотря на ограниченность состава молекул углеродом, органические соединения разнообразны до бесконечности, а сам органический синтез подобен конструктору LEGO, из которого можно собрать самые разнообразные структуры с самыми различными свойствами, какими только душа пожелает. Но для того, чтобы уметь собрать сложный механизм из многотысячного конструктора, необходимо понимать логику органической химии: почему одни реакции протекают лучше других и как добиться образования стабильного продукта. Это и многое другое открывает врата в бесконечно интересный мир химии. Изучайте органику, она вас не обманет!
Но для того, чтобы уметь собрать сложный механизм из многотысячного конструктора, необходимо понимать логику органической химии: почему одни реакции протекают лучше других и как добиться образования стабильного продукта. Это и многое другое открывает врата в бесконечно интересный мир химии. Изучайте органику, она вас не обманет!
Фонд «Beyond Curriculum» публикует цикл материалов «В чем прелесть предмета» в партнерстве с проектом «Караван знаний» при поддержке компании «Шеврон». Караван знаний – инициатива по исследованию и обсуждению передовых образовательных практик с участием ведущих казахстанских и международных экспертов.
Редактор статьи: Дарина Мухамеджанова
Строение органических веществ — урок. Химия, 8–9 класс.
Атомы углерода отличаются от атомов других элементов тем, что способны образовывать устойчивые химические связи друг с другом. Они могут связываться в цепи разной длины. Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Цепи бывают линейные и разветвлённые. Атомы углерода соединяются также в циклы разной величины.
Между атомами углерода могут образовываться одинарные, двойные и тройные связи.
Молекулы органических веществ состоят обычно из атомов неметаллов, поэтому в них присутствуют ковалентные связи. Число ковалентных связей, которые образует атом, определяет его валентность.
В основе органической химии лежит теория химического строения органических веществ А. М. Бутлерова. Её основные положения:
Атомы в молекулах органических веществ соединены в определённом порядке в соответствии с их валентностью.
Углерод в органических соединениях всегда четырёхвалентен, кислород — двухвалентен, а водород и галогены — одновалентны.
В молекуле метилового спирта атом углерода соединён ковалентными связями с четырьмя другими атомами, атом кислорода — с двумя, а каждый атом водорода образует одну ковалентную связь.
Свойства веществ зависят не только от состава молекул, но и от порядка соединения атомов в них,
т. е. от химического строения.
Рассмотрим второе положение на примере вещества, имеющего состав: C2h5Cl2.
Состав веществ одинаковый, а порядок соединения атомов в них разный. В молекуле первого вещества атомы хлора соединены с разными атомами углерода, а в молекуле второго — с одним. Свойства веществ отличаются. Так, температура кипения первого вещества — \(–96,7\) °С, а второго — \(–42,0\) °С.
При составлении структурных формул органических веществ сначала записывают символы углерода, связывая их между собой; затем с учётом четырёхвалентности атома углерода записывают символы других элементов.
Структурная формула углеводорода, состоящего из трёх атомов углерода и восьми атомов водорода, строится следующим образом:
Главный элемент органической химии.
 История развития органической химии. Предмет и значение органической химии. Классификация органических реакций
История развития органической химии. Предмет и значение органической химии. Классификация органических реакцийВ справочнике, адресованном выпускникам 9 классов общеобразовательных организаций, представлен материал курса «Обществознание» в объёме, проверяемом на основном государственном экзамене.
Структура книги соответствует современному кодификатору элементов содержания по предмету, на основе которого составлены контрольные измерительные материалы ОГЭ.
Содержательные линии курса сгруппированы в шесть блоков-модулей: «Человек и общество», «Сфера духовной культуры», «Экономика», «Социальная сфера», «Сфера политики и социального управления», «Право».
Полнота, компактность, наглядность и чёткость изложения обеспечивают максимальную эффективность подготовки к экзамену.

Примеры.
Что свойственно и человеку, и животному?
1) преобразование мира
2) накопление знаний
3) необходимость в отдыхе
4) стремление к прекрасному
Павел учится во втором классе общеобразовательной школы. В свободное время он любит играть в настольные игры. Сравните две формы деятельности, упомянутые в условии задания, – учение и игру. Выберите и запишите в первую колонку таблицы порядковые номера черт сходства, а во вторую колонку – порядковые номера черт отличия.
1) способствует развитию личности
2) имитирует реальные действия
3) вооружает системными знаниями и умениями
4) помогает познанию окружающего мира
Содержание
Предисловие 6
БЛОК-МОДУЛЬ 1. ЧЕЛОВЕК И ОБЩЕСТВО
Тема 1.1. Общество как форма жизнедеятельности людей 12
Тема 1.2. Взаимодействие общества и природы 14
Тема 1.3. Основные сферы общественной жизни, их взаимосвязь 16
Тема 1.4. Биологическое и социальное в человеке 17
Тема 1.
 5. Личность. Особенности подросткового возраста 19
5. Личность. Особенности подросткового возраста 19Тема 1.6. Деятельность человека, её основные формы (труд, игра, учение) 23
Тема 1.7. Человек и его ближайшее окружение. Межличностные отношения. Общение 30
Тема 1.8. Межличностные конфликты, их конструктивное разрешение 40
БЛОК-МОДУЛЬ 2. СФЕРА ДУХОВНОЙ КУЛЬТУРЫ
Тема 2.1. Сфера духовной культуры и её особенности 43
Тема 2.2. Наука в жизни современного общества 44
Тема 2.3. Образование и его значимость в условиях информационного общества. Возможности получения общего и профессионального образования в Российской Федерации 48
Тема 2.4. Религия, религиозные организации и объединения, их роль в жизни современного общества. Свобода совести 52
Тема 2.5. Мораль 58
Тема 2.6. Гуманизм. Патриотизм, гражданственность 61
БЛОК-МОДУЛЬ 3. ЭКОНОМИКА
Тема 3.1. Экономика, её роль в жизни общества 65
Тема 3.2. Товары и услуги, ресурсы и потребности, ограниченность ресурсов 68
Тема 3.3. Экономические системы и собственность 72
Тема 3.
 4. Производство, производительность труда. Разделение труда и специализация 78
4. Производство, производительность труда. Разделение труда и специализация 78Тема 3.5. Обмен, торговля 83
Тема 3.6. Рынок и рыночный механизм 85
Тема 3.7. Предпринимательство. Малое предпринимательство и фермерское хозяйство 92
Тема 3.8. Деньги 103
Тема 3.9. Заработная плата и стимулирование труда 107
Тема 3.10. Неравенство доходов и экономические меры социальной поддержки 111
Тема 3.12. Экономические цели и функции государства 119
БЛОК-МОДУЛЬ 4. СОЦИАЛЬНАЯ СФЕРА
Тема 4.1. Социальная структура общества 122
Тема 4.2. Семья как малая группа. Отношения между поколениями 124
Тема 4.3. Многообразие социальных ролей в подростковом возрасте 127
Тема 4.4. Социальные ценности и нормы 130
Тема 4.5. Отклоняющееся поведение. Опасность наркомании и алкоголизма для человека и общества. Социальная значимость здорового образа жизни 134
Тема 4.6. Социальный конфликт и пути его решения. 138
Тема 4.
 7. Межнациональные отношения 142
7. Межнациональные отношения 142БЛОК-МОДУЛЬ 5. СФЕРА ПОЛИТИКИ И СОЦИАЛЬНОГО УПРАВЛЕНИЯ
Тема 5.1. Власть. Роль политики в жизни общества 146
Тема 5.2. Понятие и признаки государства 148
Тема 5.3. Разделение властей 151
Тема 5.4. Формы государства 153
Тема 5.5. Политический режим. Демократия 157
Тема 5.6. Местное самоуправление 162
Тема 5.7. Участие граждан в политической жизни 167
Тема 5.8. Выборы, референдум 169
Тема 5.9. Политические партии и движения, их роль в общественной жизни 173
Тема 5.10. Гражданское общество и правовое государство 178
БЛОК-МОДУЛЬ 6. ПРАВО
Тема 6.1. Право, его роль в жизни общества и государства 187
Тема 6.2. Норма права. Нормативный правовой акт 188
Тема 6.3. Понятие правоотношений 192
Тема 6.4. Признаки и виды правонарушений. Понятие и виды юридической ответственности 195
Тема 6.5. Конституция Российской Федерации. Основы конституционного строя Российской Федерации 200
Тема 6.
 6. Федеративное устройство России 206
6. Федеративное устройство России 206Тема 6.7. Органы государственной власти Российской Федерации 209
Тема 6.8. Правоохранительные органы. Судебная система. Взаимоотношения органов государственной власти и граждан 219
Тема 6.10. Права ребёнка и их защита. Особенности правового статуса несовершеннолетних 227
Тема 6.11. Механизм реализации и защиты прав и свобод человека и гражданина 230
Тема 6.12. Международно-правовая защита жертв вооружённых конфликтов 233
Тема 6.13. Гражданские правоотношения. Права собственности. Права потребителей 236
Тема 6.14. Семейные правоотношения. Права и обязанности родителей и детей 245
Тема 6.15. Право на труд и трудовые правоотношения. Трудоустройство несовершеннолетних 254
Тема 6.16. Административные правоотношения, правонарушения и наказания 259
Тема 6.17. Основные понятия и институты уголовного права.
 Уголовная ответственность несовершеннолетних 263
Уголовная ответственность несовершеннолетних 263Тренировочный вариант экзаменационной работы по обществознанию 271
Ответы 282
Литература 285.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Обществознание, Полный справочник для подготовки к ОГЭ, 9 класс, Баранов П.А., 2016 – fileskachat.com, быстрое и бесплатное скачивание.
Подготовка к ОГЭ по обществознанию с нуля
Для поступления на многие экономические, социологические, правовые специальности необходимо успешно сдать экзамен по обществознанию. В ином случае, из-за низкого балла учащийся не сможет продолжить обучение в лучших вузах страны. Поэтому если школьное образование недостаточно качественное, выпускникам нужна с нуля. Только курсы, на которых будет проработана каждая тема, принесут сверхрезультат и помогут научиться использовать знания в повседневной жизни.
В ситуации, когда дети ощущают, что у них нет достаточного базиса, им ни в коем случае нельзя заниматься самостоятельной подготовкой.
Уже давно завоевал популярность не только среди школьников города Москвы. Филиалы УЦ есть в 65 других городах Российской Федерации . Все учащиеся, которые посещали курсы в «Годографе» отмечают, что там к ним относились, как к единомышленникам, приветствовали нестандартные подходы, всегда отвечали на вопросы и помогали в сложных, непонятных моментах.
Такой высокой оценки учебному заведению получилось добиться благодаря прекрасному педагогическому составу. Все учителя, работающие в УЦ – это специалисты, прошедшие многоуровневое собеседование. Они знают, как мотивировать подростков, убеждать, вызывать настоящий интерес к предмету. Для педагогов самой важной целью становится успешное прохождение тестов их подопечными. Поэтому они прилагают все силы и используют разные психологические приемы.
Все учителя, работающие в УЦ – это специалисты, прошедшие многоуровневое собеседование. Они знают, как мотивировать подростков, убеждать, вызывать настоящий интерес к предмету. Для педагогов самой важной целью становится успешное прохождение тестов их подопечными. Поэтому они прилагают все силы и используют разные психологические приемы.
Плюсы «Годографа»
Среди основных преимуществ центра стоит выделить:
- небольшие группы от 2-х до 7-и человек;
- индивидуальный график и дополнительные занятия;
- специально разработанная и одобренная Министерством Образования методичка;
- лояльные цены, скидки, акции;
- выполнение всех тестовых заданий и написание эссе;
- дружественная атмосфера;
- наличие куратора и связь с учителями через Телеграм.
Поэтому все дети, которые запишутся в «Годограф» гарантированно поступят в лучшие вузы страны.
Медиум органической химии – Наука – Коммерсантъ
Бутлеров начинал научную карьеру как энтомолог, специалист по дневным бабочкам, а стал отцом современной органической химии, основанной на разработанной им теории строения веществ.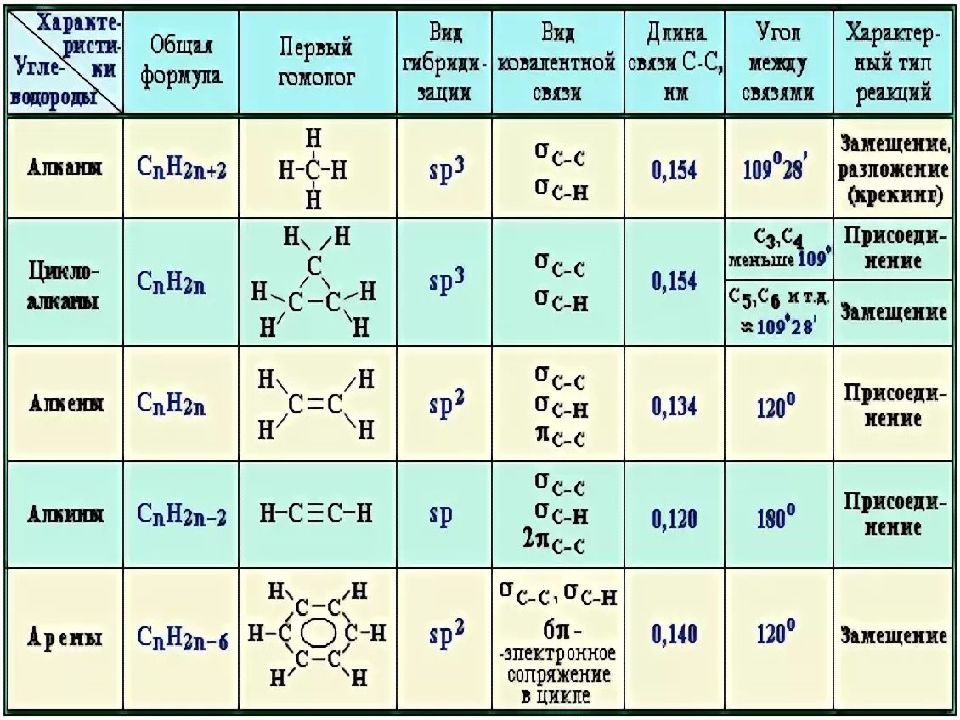
В истории науки считается, что толчком к созданию Бутлеровым теории строения органических веществ послужил его научный спор с французским химиком Жераром. Жерар считал, что от положения атомов в молекуле вещества его свойства не зависят.
Сегодня в школьном учебнике химии, где нарисованы цепочки атомов углерода, соединенные черточками валентностей между собой и с атомами других элементов в разных конфигурациях, бутлеровская теория строения органических веществ выглядит простой и логичной. Но тогда даже понятия валентности еще не было. Были лишь наблюдения химиков, что два вещества, совершенно одинаковые по содержанию в них химических элементов, демонстрируют совершенно разные физические и химические свойства.
Бутлеров предположил, что это происходит, если атомы одних и тех химических элементов в молекуле соединены между собой по-разному. А потом и доказал это в опытах. Например, если у простейшего бутана, состоящего всего из четырех атомов углерода, их соединить не цепочкой один за другим, а один поставить в середину молекулы и прикрепить к нему по сторонам три других, придав молекуле конфигурацию трехгранной пирамиды, то получится «изомер» бутана — изобутан. Он демонстрирует свойство хладагента, какого у обычного бутана нет. Но химики еще долго сопротивлялись бутлеровской теории. Даже Менделеев не поверил в теорию Бутлерова, вероятно, из-за ее простоты.
Он демонстрирует свойство хладагента, какого у обычного бутана нет. Но химики еще долго сопротивлялись бутлеровской теории. Даже Менделеев не поверил в теорию Бутлерова, вероятно, из-за ее простоты.
Это, кстати, было не единственное разногласие в науке между двумя великими химиками. Бутлеров верил, что за явлениями спиритизма кроется какое-то их объяснение. Менделеев же считал общение медиума с душами умерших лженаучным шарлатанством. В 1876 году он собрал и возглавил научную комиссию, которая пришла к такому выводу. Бутлеров, приглашенный в эту комиссию, вышел из нее после первых ее заседаний, обвинив коллег в предвзятости и напомнив им о том, что «во все времена, когда люди науки априорно отвергали заявленные наблюдателями факты, они ошибались каждый раз».
Бутлеров умер в 1886 году, так и не дожив до окончательного признания своей химической теории строения веществ. Теперь ее никто не рискнет опровергать. Что касается спиритизма, то время его объяснения не пришло до сих пор.
Сергей Петухов
ЕГЭ по химии, подготовка к ЕГЭ по химии 2021 в Москве, сложность, оценки, задачи, шкала перевода баллов — Учёба.ру
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
Для этого нужно следовать трем простым правилам:
1. Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
2. Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
3. При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Кафедра неорганической химии имени А.Н. Реформатского – Структура института
Состав ППС и НПР:|
Должность |
Количество ППС |
|
Профессора |
3 |
|
Доценты |
5 |
|
Преподаватели и ассистенты |
7 |
|
НПР |
0 |
- Актуальные задачи современной химии
- Бионеорганическая химия
- Методы получения неорганических соединений
- Общая и неорганическая химия
- Расчетные методы в химии
- Синтез и методы исследования координационных соединений
- Термодинамическая теория растворов и межмолекулярное взаимодействие
- Техника лабораторного эксперимента в химии
- Химия d-элементов
- Химия комплексных соединений
- Химия лантаноидов
- Химия переходных элементов
- Экспериментальные методы неорганической химии
-
04.
 03.01 «Химия», профиль «Фундаментальная и прикладная химия»;
03.01 «Химия», профиль «Фундаментальная и прикладная химия»; - 04.04.01 «Химия», магистерская программа «Фундаментальная и прикладная химия»,
- 04.06.01 «Химические науки», шифр научной специальности 02.00.01 «Неорганическая химия».
- синтез и исследования комплексов переходных и редкоземельных элементов с бор-, кислород- и азотсодержащими лигандами, в том числе с биологически активными лигандами, которые могут быть перспективны в различных областях техники и медицины, например, в радиофармацевтике;
- химия легких элементов и кластеров на их основе;
- неорганические соединения, которые могут быть использованы в качестве материалов, таких как полифункциональные покрытия или фотокатализаторы;
- физико-химические свойства жидкокристаллических материалов.
За 5 лет сотрудниками кафедры опубликовано 52 статьи в рецензируемых журналах WoS и Scopus.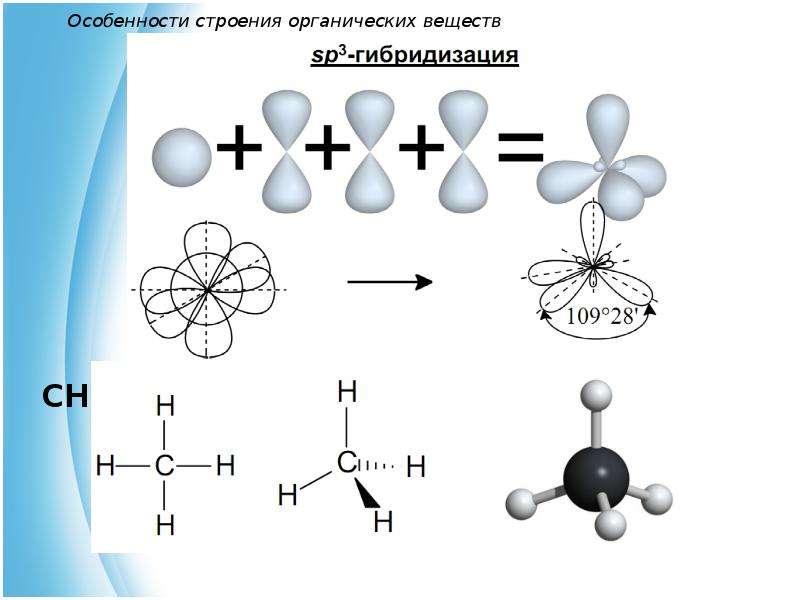
- N S. Rukk, L. G. Kuzmina, R. S. Shamsiev, G. A. Davydova, E.A. Mironova, A. M. Ermakov, G. A. Buzanov, A.Yu. Skryabina, A. N. Streletskii, G. A. Vorob’eva, V.M. Retivov, P.A. Volkov, S. K. Belus, E. I. Kozhukhova, V. N. Krasnoperova. Zinc(II) and cadmium(II) halide complexes with caffeine: synthesis, X-ray crystal structure, cytotoxicity and genotoxicity studies. Inorg. Chim. Acta. 2019. V. 487. P. 184-200.
- Nataliya S. Rukk, Lyudmila G. Kuz’mina, Galina A. Davydova, Grigory A. Buzanov, Vasilii M. Retivov, Svetlana K. Belus, Evgeniya I. Kozhukhova, Alexander E. Barmashov, Alexey A. Khrulev, Mariya A. Simonova and Valeriya N. Krasnoperova. Synthesis, structure and cytotoxicity of a zinc(ii) bromide complex with caffeine. Mend. Commun. 2019. V. 29. 640-642.
- Savinkina E.V., Golubev D.V., Grigoriev M.S. Synthesis, characterization, and crystal structures of iodides and polyiodides of scandium complexes with urea and acetamide.
 J. Coord. Chem., 2019, vol. 72, no. 2, P. 347–357.
J. Coord. Chem., 2019, vol. 72, no. 2, P. 347–357. - Isbjakowa, A.S., Grigoriev, M.S., Golubev, D.V., Savinkina, E.V. Synthesis and characterization of acetylurea complexes with rare-earth metal halides: Polymorphism of the praseodymium complexes. J. Mol. Structure, 2020. 1201, 127141.
- E.Yu. Matveev, I. P. Limarev, A. I. Nichugovskii, A. Yu. Bykov, K. Yu. Zhizhin, N.T.Kuznetsov. Derivatives of closo-decaborate anion with polyamines. Russian Journal of Inorganic Chemistry, 2019, V. 64, № 8, p. 977–983.
- E. Yu. Matveev, S. S. Akimov, A. S. Kubasov, V. M. Retivov, K. Yu. Zhizhin, and N. T. Kuznetsov. Synthesis and study of derivatives of the [B10h20]2– anion with amino acids. Russ. J. of Inorg. Chem., 2019, Vol. 64, No. 12, pp. 1513–1521.
История МГТУ им Н.Э.Баумана
Иван Людвигович Кнунянц родился 4 июня 1906 г. в г. Шуша Нагорно-Карабахской АО в семье нефтяников. Отца по роду работы отправили сначала в г. Баку, а затем в г. Грозный руководителем нефтяных приисков, где Иван Людвигович в 1923 г. с отличием окончил школу и решил поступить на электротехнический факультет МВТУ. Но в тот год прием на электротехнический факультет не проводился и Кнунянц поступил на специальность химика-органика. Учителем И.Л.Кнунянца был известный российский ученый А.Е.Чичибанин, под влиянием которого он увлекся химией и добился значительных успехов в данной области.
Баку, а затем в г. Грозный руководителем нефтяных приисков, где Иван Людвигович в 1923 г. с отличием окончил школу и решил поступить на электротехнический факультет МВТУ. Но в тот год прием на электротехнический факультет не проводился и Кнунянц поступил на специальность химика-органика. Учителем И.Л.Кнунянца был известный российский ученый А.Е.Чичибанин, под влиянием которого он увлекся химией и добился значительных успехов в данной области.В 1928 г. Иван Людвигович с отличием окончил МВТУ и стал лаборантом кафедры органической химии. В период с 1928 по 1932 г. он работал ассистентом, а затем преподавателем кафедры органической химии МВТУ. Одновременно с 1929 г. – в Лаборатории АН СССР по исследованию и синтезу растительных и животных продуктов. В 1931 г. сделал свое первое открытие в области фармакологии, которое во многом способствовало улучшению эффективности лечения малярии отечественными препаратами.
С 1932 г. И.Л.Кнунянц работал в Военной академии химической защиты сначала в должности доцента, а затем профессора кафедры органической химии, став в 30 лет кандидатом, а в 33 года — доктором химических наук и профессором. В 1940 г. его избрали заведующим данной кафедры. Уже тогда Иван Людвигович считался крупным химиком-органиком, видным специалистом в области химии красителей, фармацевтических препаратов и физиологически активных веществ. Вступив в руководство кафедрой, он в короткий срок перестроил подготовку слушателей в соответствии с требованиями военного времени, что нашло отражение в июле 1943-го в специальной директиве Верховного Главнокомандующего от 07.06.1943 «О реальной
угрозе применения химического оружия».
В 1940 г. его избрали заведующим данной кафедры. Уже тогда Иван Людвигович считался крупным химиком-органиком, видным специалистом в области химии красителей, фармацевтических препаратов и физиологически активных веществ. Вступив в руководство кафедрой, он в короткий срок перестроил подготовку слушателей в соответствии с требованиями военного времени, что нашло отражение в июле 1943-го в специальной директиве Верховного Главнокомандующего от 07.06.1943 «О реальной
угрозе применения химического оружия».
В 1949 г. ему было присвоено воинское звание – генерал-майор-инженер. В эти же годы Иван Людвигович читал лекции в Московском институте тонкой химической технологии им. М.В.Ломоносова. Одновременно с 1929 по 1954 г. И.Л.Кнунянц был старшим научным сотрудником лаборатории химии гетероциклических соединений Института элементоорганических соединений АН СССР. В 1933 г. Кнунянц получил авторское свидетельство на способ получения ацетобутиролактона – исходного продукта для получения многих лекарственных соединений, за создание которого в 1943 г. ему была присуждена Сталинская премия.
ему была присуждена Сталинская премия.
В 1948 году за проведённые научные исследования в области фторорганических соединений и внедрение результатов в практику народного хозяйства он был удостоен второй Сталинской премии. В 1950 году он вновь был удостоен Сталинской премии за то, что в конце 1940-х годов им с группой сотрудников был разработан и внедрён в производство оригинальный метод получения капролактама.
Во время войны Иван Людвигович неоднократно выезжал на фронт в качестве военного химика-эксперта, исследующего возможности применения фашистской Германией отравляющих веществ. Победу встретил 9 мая в Берлине. После войны Иван Людвигович стал начальником Центрального научно-исследовательского военно-технического института Советской армии и одновременно руководил кафедрой в академии, а с 1953 года до ухода на пенсию заведовал и лабораторией фторорганических соединений Института элементоорганических соединений АН СССР.
В 1946 г. Кнунянц был избран член-корреспондентом, а в 1953 г.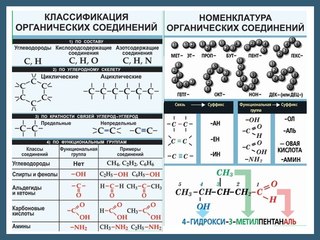 действительным членом
Академии наук СССР. По инициативе и под редакцией И.Л.Кнунянца в 1961-1967 гг. была издана «Краткая химическая энциклопедия» в пяти томах.
действительным членом
Академии наук СССР. По инициативе и под редакцией И.Л.Кнунянца в 1961-1967 гг. была издана «Краткая химическая энциклопедия» в пяти томах.
Кафедрой Военной академии химзащиты Иван Людвигович руководил более 33 лет. Им был создан уникальный курс химии физиологически активных веществ, базирующийся на представлениях о связи между строением вещества, его свойствами и физиологической активностью. Научные интересы И. Кнунянца всегда были нацелены на новые, еще не освоенные направления в химии. Именно им разработаны и внедрены в производство технологические способы получения акрихина, ацетобутиролактона, сенсибилизаторов для кинопленок, открыт метод полимеризации капролактама. Производство отечественной промышленностью всем известных капрона, нейлона без исследований военного химика Кнунянца было бы невозможным.
Мировая химическая общественность признала работы И. Кнунянца в области фторорганических соединений классическими. Он выпестовал отечественную школу химиков-фтороргаников и по праву считается создателем химии фтора. За большие заслуги в развитии фундаментальных научных исследований в области химии фторорганических соединений и изучение их свойств в 1986 году И.Л.Кнунянц был удостоен премии и почётной медали имени Анри Муассана, выдающегося французского химика, Нобелевского лауреата, учреждённой в 1986 году в честь 100-летия открытия фтора. Эта награда присуждается международным Нобелевским комитетом за выдающиеся исследования в области фторсодержащих соединений. В 1986 году эта премия присуждалась впервые.
За большие заслуги в развитии фундаментальных научных исследований в области химии фторорганических соединений и изучение их свойств в 1986 году И.Л.Кнунянц был удостоен премии и почётной медали имени Анри Муассана, выдающегося французского химика, Нобелевского лауреата, учреждённой в 1986 году в честь 100-летия открытия фтора. Эта награда присуждается международным Нобелевским комитетом за выдающиеся исследования в области фторсодержащих соединений. В 1986 году эта премия присуждалась впервые.
Вот как оценили коллеги Ивана Людвиговича его успехи в научной работе «…Увлеченность и быстродействие, феноменальная память, эрудиция и яркая оригинальность мышления. Обладает необыкновенным научным чутьем и удивительной способностью мгновенно улавливать главный элемент неизвестного и найти его единственное место в ряду имеющихся сведений».
Указом Президиума Верховного Совета СССР от 3 июня 1966 года за выдающиеся заслуги в развитии химической науки и промышленности и в связи с шестидесятилетием со дня рождения академику Кнунянцу Ивану Людвиговичу присвоено звание Героя Социалистического Труда с вручением ордена Ленина и золотой медали «Серп и Молот».
Уникальные свойства фторпроизводных, полученных в лаборатории И. Кнунянца, открыли широкие возможности их применения в столь важных для укрепления обороноспособности страны областях техники, как радиоэлектроника, сверхзвуковая авиация, ракетная и космическая техника.. За исследования в области фторорганических соединений алифатического ряда заведующему лабораторией института элементорганических соединений АН СССР академику И. Л. Кнунянцу в 1972 году была присуждена Ленинская премия.
Иван Людвигович занимался одновременно средствами поражения и защиты, решал оборонные и народнохозяйственные задачи. Он был неутомимым исследователем, светилом мирового масштаба в своей отрасли знаний и офицером действующей армии, блестящим педагогом, чутким наставником и жестким руководителем.
И.Л.Кнунянц регулярно публиковал результаты своих исследований. Им опубликовано более 900 научных статей, монографий и учебников. Ему принадлежит более 200 изобретений и зарубежных патентов. Под его научным руководством защищено около 500 кандидатских и 30 докторских и 30 докторских диссертаций. Наряду с научной и преподавательской деятельностью Кнунянц активно занимался литературной и редакторской деятельностью.
Наряду с научной и преподавательской деятельностью Кнунянц активно занимался литературной и редакторской деятельностью.
Он был членом Главной редакции Малой советской энциклопедии (1958-1960) и членом Главной редакции Большой советской энциклопедии (с1959). 1956-1959 гг. – главный редактор журнала «Химическая наука и промышленность», а с 1959 г. – созданного им проблемно-тематического журнала Всесоюзного химического общества им. Д.И.Менделеева. Много времени уделял общественно-организационной работе. С 1953 по 1975 г. – член бюро Отделения химических наук АН СССР, с 1953 г. – член Президиума Всесоюзного химического общества им. Д.И. Менделеева. Более 15 лет был членом Комитета по ленинским и государственным премиям в области науки и техники при Совете Министров СССР.
Скончался Иван Людвигович Кнунянц 21 декабря 1990 года. Похоронен на Новодевичьем кладбище.
Какие три основных элемента составляют структуру органических молекул?
Три элемента, которые составляют более 99 процентов органических молекул, – это углерод, водород и кислород. Эти три компонента вместе образуют почти все химические структуры, необходимые для жизни, включая углеводы, липиды и белки. Кроме того, азот в сочетании с этими элементами также образует важную органическую молекулу в форме нуклеиновых кислот.
Эти три компонента вместе образуют почти все химические структуры, необходимые для жизни, включая углеводы, липиды и белки. Кроме того, азот в сочетании с этими элементами также образует важную органическую молекулу в форме нуклеиновых кислот.
Углерод
Углерод является наиболее важным элементом в образовании органических молекул; действительно, жизнь на Земле упоминается как «основанная на углероде» из-за преобладания углерода в формировании основных соединений для организмов.Углерод настолько распространен в органических соединениях из-за его способности образовывать до шести стабильных связей с другими атомами; в результате углерод часто находится в середине молекулы с несколькими разными атомами, и именно это разнообразие позволяет жизни процветать. Углерод составляет примерно 10 процентов человеческого тела.
Водород
Водород – самый распространенный атом во Вселенной, а также самый распространенный элемент в органических молекулах. Из-за своей уникальной электронной природы атомы водорода в больших количествах присутствуют в нескольких органических молекулах, часто действуя как связующее звено между центральным атомом углерода и другими атомами.Кроме того, водород образует прочную связь с углеродом, что придает большую стабильность органической молекуле, чем средней молекуле. Кислород составляет примерно 63 процента человеческого тела.
Из-за своей уникальной электронной природы атомы водорода в больших количествах присутствуют в нескольких органических молекулах, часто действуя как связующее звено между центральным атомом углерода и другими атомами.Кроме того, водород образует прочную связь с углеродом, что придает большую стабильность органической молекуле, чем средней молекуле. Кислород составляет примерно 63 процента человеческого тела.
Кислород
Кислород является важным элементом в органических молекулах, потому что, как и углерод, он может удерживать несколько различных связей (хотя и не с такой же прочностью углерода, поэтому обычно он не находится в середине органической молекулы) и, что важно, , он добавляет достаточно разнообразия, чтобы образовать почти бесконечное количество молекул.Углерод, водород и кислород вместе образуют белки, углеводы (которые представляют собой комбинацию углерода с водой) и липиды – все соединения, необходимые для жизни. Кислород составляет примерно 26 процентов человеческого тела.
Азот
Хотя он и не так распространен, как углерод, водород и кислород, азот присутствует в чрезвычайно важном типе органических молекул, называемых нуклеиновой кислотой. Два типа нуклеиновых кислот, обнаруженных в клетках, – это ДНК и РНК, которые составляют генетический план клетки и содержат всю кодифицированную информацию, необходимую для функционирования и воспроизводства клетки.Азот составляет примерно 1 процент человеческого тела.
1.9: Значение углерода – Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Значение углерода
- Соединения
- Углерод
- Энергия из углерода?
- Сводка
- Узнать больше
- Обзор
Углерод.Элемент номер шесть. Прямо в середине первой строки Периодической таблицы. И что?
Углерод – самый важный элемент жизни. Без этого элемента жизни, какой мы ее знаем, не существовало бы. Как вы увидите, углерод является центральным элементом в соединениях, необходимых для жизни.
Значение углерода
Соединение, обнаруживаемое в основном в живых существах, известно как органическое соединение . Органические соединения составляют клетки и другие структуры организмов и осуществляют жизненные процессы.Углерод является основным элементом органических соединений, поэтому углерод необходим для жизни на Земле. Без углерода жизнь в том виде, в котором мы ее знаем, не могла бы существовать.
Соединения
Соединение – это вещество, состоящее из двух или более элементов. Соединение имеет уникальный состав, который всегда одинаков. Самая маленькая частица соединения называется молекулой. Возьмем, к примеру, воду. Молекула воды всегда содержит один атом кислорода и два атома водорода. Состав воды выражается химической формулой H 2 O.Модель молекулы воды показана на рис. ниже. Вода не является органическим соединением.
Молекула воды всегда имеет такой состав: один атом кислорода и два атома водорода.
Что заставляет атомы молекулы воды «слипаться»? Ответ – химические связи. Химическая связь – это сила, которая удерживает молекулы вместе. Химические связи образуются, когда вещества реагируют друг с другом. Химическая реакция – это процесс, при котором одни химические вещества превращаются в другие.Для образования соединения необходима химическая реакция. Другая химическая реакция необходима для разделения веществ в составе.
Углерод
Почему углерод так важен для жизни? Причина в способности углерода образовывать стабильные связи со многими элементами, в том числе с самим собой. Это свойство позволяет углероду образовывать огромное количество очень больших и сложных молекул. Фактически, в живых существах содержится около 10 миллионов углеродных соединений! Однако миллионы органических соединений можно сгруппировать всего в четыре основных типа: углеводов , липидов , белков и нуклеиновых кислот .Вы можете сравнить четыре типа в Таблице ниже. Каждый тип также описан ниже.
| Тип соединения | Примеры | Элементы | Функции | Мономер | |
|---|---|---|---|---|---|
| Углеводы | сахара, крахмалы | , энергия образуют углерод, водород 9012, накапливает кислород 9012 структуры тела | моносахарид | ||
| Липиды | жиры, масла | углерод, водород, кислород | накапливает энергию, формирует клеточные мембраны, несет сообщения | ||
| Белки | ферменты | углерод, антитела | , кислород, азот, сера | помогает клеткам сохранять свою форму, укрепляет мышцы, ускоряет химические реакции, передает сообщения и материалы | аминокислота |
| Нуклеиновые кислоты | ДНК, РНК | углерод, водород, кислород, азот, фосфор | содержит инструкции для белки, передают инструкции от родителей потомству, помогают производить белки | нуклеотид |
Углеводы, белки и нуклеиновые кислоты – это большие молекулы (макромолекулы), построенные из более мелких молекул (мономеров) в результате реакций дегидратации.В реакции дегидратации вода удаляется, когда два мономера соединяются вместе.
Чудо жизни: углеводы, белки, липиды и нуклеиновые кислоты Видео можно посмотреть на http://www.youtube.com/watch?v=nMevuu0Hxuc (3:28).
Энергия из углерода?
Можно ли извлечь энергию из остатков еды? Могут ли органические отходы стать полезными? Это может показаться расточительством, но для некоторых это зеленая энергия. Узнайте, как молочные фермы и рестораны, где накрывают белую скатерть в Калифорнии, перерабатывают оставшиеся отходы в экологически чистую энергию.См. From Waste To Watts: Biofuel Bonanza на сайте www.kqed.org/quest/television/from-waste-to-watts-biofuel-bonanza для получения дополнительной информации.
Резюме
- Углерод является основным элементом в органических соединениях. Углерод может образовывать прочные связи со многими элементами, включая сам себя.
- Существует четыре основных типа органических соединений: углеводы, липиды, белки и нуклеиновые кислоты.
Узнать больше
Воспользуйтесь этим ресурсом, чтобы ответить на следующие вопросы.
- Важность углерода на www.boundless.com/biology/the-chemical-foundation-of-life/carbon/the-importance-of-carbon/.
- Заполните это заявление. Углерод является основным компонентом четырех макромолекул, включая __________, __________, __________ и __________.
- Укажите правило октетов.
- Что позволяет углероду служить основой органических макромолекул?
- Что такое ковалентная связь?
Обзор
- Что такое соединение?
- Объясните, почему углерод необходим для всей известной жизни на Земле.
- Какие четыре основных типа органических соединений?
- Какие типы органических соединений обеспечивают энергию?
- Какое органическое соединение хранит генетическую информацию?
- Примеры белков включают ____________.
Органические соединения
Химические соединения живых существ известны как органических соединений из-за их связи с организмами и потому, что они являются углеродсодержащими соединениями.Органические соединения, которые представляют собой соединения, связанные с жизненными процессами, являются предметом органической химии. Среди многочисленных типов органических соединений во всем живом есть четыре основные категории: углеводы, липиды, белки и нуклеиновые кислоты.Углеводы
Почти все организмы используют углеводов в качестве источников энергии. Кроме того, некоторые углеводы служат конструкционными материалами. Углеводы – это молекулы, состоящие из углерода, водорода и кислорода; отношение атомов водорода к атомам кислорода и углерода составляет 2: 1.
Простые углеводы, обычно называемые сахарами , могут быть моносахаридами, , если они состоят из одиночных молекул, или дисахаридами, , если они состоят из двух молекул. Наиболее важным моносахаридом является глюкоза, углевод с молекулярной формулой C 6 H 12 O 6 . Глюкоза – это основная форма топлива для живых существ. В многоклеточных организмах он растворим и транспортируется жидкостями организма ко всем клеткам, где метаболизируется, чтобы высвободить свою энергию.Глюкоза является исходным материалом для клеточного дыхания и основным продуктом фотосинтеза (см. Главы 5 и 6).
Три важных дисахарида также содержатся в живых организмах: мальтоза, сахароза и лактоза. Мальтоза представляет собой комбинацию двух ковалентно связанных единиц глюкозы. Сахароза столового сахара образуется путем связывания глюкозы с другим моносахаридом, называемым фруктозой. (Рисунок 2-2 показывает, что при синтезе сахарозы образуется молекула воды. Поэтому процесс называется реакцией дегидратации . Обратный процесс – это гидролиз, процесс, в котором молекула расщепляется и добавляется вода.) Лактоза состоит из единиц глюкозы и галактозы.
Рисунок 2-2 Молекулы глюкозы и фруктозы объединяются, образуя дисахарид сахарозу.
Сложные углеводы известны как полисахариды . Полисахариды образуются путем связывания бесчисленных моносахаридов. Среди наиболее важных полисахаридов – крахмал, который состоит из сотен или тысяч единиц глюкозы, связанных друг с другом.Крахмал служит формой хранения углеводов. Большая часть населения мира удовлетворяет свои потребности в энергии с помощью крахмала в виде риса, пшеницы, кукурузы и картофеля.
Два других важных полисахарида – это гликоген и целлюлоза. Гликоген также состоит из тысяч единиц глюкозы, но эти единицы связаны другим образом, чем в крахмале. Гликоген – это форма, в которой глюкоза хранится в печени человека. Целлюлоза используется в основном как структурный углевод.Он также состоит из единиц глюкозы, но единицы не могут высвобождаться одна из другой, за исключением нескольких видов организмов. Древесина состоит в основном из целлюлозы, как и стенки растительных клеток. Хлопковая ткань и бумага – это товарные целлюлозные продукты.
Липиды
Липиды представляют собой органические молекулы, состоящие из атомов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в липидах намного выше, чем в углеводах. Липиды включают стероиды (материал, из которого состоят многие гормоны), воски и жиров.
Молекулы жира состоят из молекулы глицерина и одной, двух или трех молекул жирных кислот (см. Рис. 2-3). Молекула глицерина содержит три гидроксильные (–ОН) группы. Жирная кислота представляет собой длинную цепочку из атомов углерода (от 4 до 24) с карбоксильной (–COOH) группой на одном конце. Все жирные кислоты в жире могут быть одинаковыми или разными. Они связаны с молекулой глицерина в процессе удаления воды.
Некоторые жирные кислоты имеют в своих молекулах одну или несколько двойных связей.Жиры, в состав которых входят эти молекулы, представляют собой ненасыщенных жиров. Другие жирные кислоты не имеют двойных связей. Жиры, в состав которых входят эти жирные кислоты, представляют собой насыщенных жиров. В большинстве ситуаций, связанных со здоровьем человека, потребление ненасыщенных жиров предпочтительнее насыщенных жиров.
Жиры, хранящиеся в клетках, обычно образуют прозрачные масляные капли, называемые глобулами , потому что жиры не растворяются в воде. Растения часто хранят жиры в своих семенах, а животные – в больших прозрачных шариках в клетках жировой ткани.Жиры в жировой ткани содержат много концентрированной энергии. Следовательно, они служат резервным источником энергии для организма. Фермент липаза расщепляет жиры на жирные кислоты и глицерин в пищеварительной системе человека.
Рис. 2-3 Молекула жира создается путем объединения молекулы глицерина с тремя молекулами жирных кислот. (Две насыщенные жирные кислоты и одна ненасыщенная жирная кислота показаны для сравнения.) Сконструированная молекула находится внизу.
Белки
Белки, среди самых сложных из всех органических соединений, состоят из аминокислот (см. Рис. 2-4), которые содержат атомы углерода, водорода, кислорода и азота.Некоторые аминокислоты также содержат атомы серы, фосфора или других микроэлементов, таких как железо или медь.
Рисунок 2-4 Структура и химический состав аминокислот. Когда две аминокислоты соединяются в дипептид, –OH одной аминокислоты удаляется, а –H второй удаляется. Итак, вода удалена. Дипептидная связь (справа) образует соединение аминокислот вместе.
Многие белки огромны и чрезвычайно сложны. Однако все белки состоят из длинных цепочек относительно простых аминокислот.Есть 20 видов аминокислот. Каждая аминокислота (см. Левую иллюстрацию на рис. 2-4) имеет амино (–NH 2 ) группу, карбоксильную (–COOH) группу и группу атомов, называемую –R группой (где R обозначает радикал ). Аминокислоты различаются в зависимости от природы группы –R, как показано на средней иллюстрации Рисунка 2-4. Примерами аминокислот являются аланин, валин, глутаминовая кислота, триптофан, тирозин и гистидин.
Удаление молекул воды связывает аминокислоты с образованием белка.Процесс называется дегидратационным синтезом, и побочным продуктом синтеза является вода. Связи между аминокислотами составляют пептидных связей, и небольшие белки часто называют пептидами.
Все живое зависит от белков. Белки – это основные молекулы, из которых построены живые существа. Некоторые белки растворены или суспендированы в водянистом веществе клеток, а другие включены в различные структуры клеток.Белки также являются поддерживающими и укрепляющими материалами в тканях вне клеток. Кости, хрящи, сухожилия и связки состоят из белков.
Одна из важнейших функций белков – это фермент. Ферменты катализируют химические реакции, происходящие в клетках. Они не расходуются в реакции; скорее, они остаются доступными для катализа последующих реакций.
Каждый вид производит белки, уникальные для этого вида. Информация для синтеза уникальных белков находится в ядре клетки.Так называемый генетический код определяет аминокислотную последовательность в белках. Следовательно, генетический код регулирует химию, происходящую внутри клетки. Белки также могут служить резервным источником энергии для клетки. Когда аминогруппа удаляется из аминокислоты, полученное соединение богато энергией.
Нуклеиновые кислоты
Как и белки, нуклеиновых кислот – очень большие молекулы. Нуклеиновые кислоты состоят из более мелких единиц, называемых нуклеотидами. Каждый нуклеотид содержит молекулу углевода (сахар), фосфатную группу и азотсодержащую молекулу, которая в силу своих свойств является азотистым основанием .
У живых организмов есть две важные нуклеиновые кислоты. Один тип – это дезоксирибонуклеиновая кислота, или ДНК. Другой – это рибонуклеиновая кислота, или РНК. ДНК находится в основном в ядре клетки, в то время как РНК обнаруживается как в ядре, так и в цитоплазме , – полужидкое вещество, составляющее объем клетки (см. Главу 3).
ДНК и РНКотличаются друг от друга по своим компонентам. ДНК содержит углевод дезоксирибозу, а РНК – рибозу. Кроме того, ДНК содержит тимин, а РНК – урацил. Структура ДНК и ее значение в жизни клеток рассматриваются в главе 10.
органических молекул
Углерод
Если разделить живой организм на молекулярные части, вы обнаружите около 70% воды. Остальная часть каждого организма состоит из органических молекул, необходимых для жизни на Земле.Ковалентные связи между атомами углерода и водорода составляют основу органических молекул. Другие элементы, такие как кислород, азот и фосфор, играют ключевую роль в жизненных процессах, изменяя структуру и химические свойства органических молекул
Каждый живой организм зависит от набора органических молекул, составляющих его структуру и обеспечивающих жизненные функции. Органические молекулы, называемые биомолекулами, создают живые клетки, собираясь в клеточные мембраны, формируя внутренние структуры, а также сохраняя и связывая наследственную информацию.Биомолекулы также выполняют действия, необходимые для роста, развития и воспроизводства клеток. Понимание химической структуры каждой из этих биомолекул необходимо, прежде чем мы сможем начать понимать сложные процессы дыхания, фотосинтеза, деления клеток и экспрессии генов.
В основе всех органических молекул лежит элемент углерод, универсальность которого является ключом ко всем структурам биомолекул. В большинстве органических молекул связанная цепочка атомов углерода образует основу, к которой присоединяются другие атомы.Уникальное количество и расположение связей между атомами углерода создают в природе структурно разнообразный набор органических молекул. Эти молекулы могут быть сконструированы в виде прямых, разветвленных или кольцевых углеродных цепей и могут включать различное количество углерод-углеродных одинарных, двойных или тройных связей.
Из-за универсальной связывающей способности углерода несколько молекул могут иметь идентичные молекулярные формулы, но иметь разные трехмерные структуры. Эти изомеры используют одно и то же количество и вид атомов, но по-разному организуют химические связи между атомами.Несмотря на соответствующий набор атомов, каждый изомер обладает уникальными функциональными характеристиками из-за своей уникальной структуры. Структурные формулы трех изомеров, каждый из которых имеет молекулярную формулу C 5 H 12 , проиллюстрированы, показывая, как один набор атомов может создавать по крайней мере три разные структуры.
Простейшие органические молекулы, углеводороды, содержат только атомы водорода, связанные с углеродным скелетом. Углеродный каркас варьируется от одного атома углерода в метане или природном газе до тысяч атомов углерода, например, в полиэтилене, широко используемом пластике.Образуя структурную основу многих биомолекул в живых клетках, углеводороды используются в качестве исходных материалов и выделяются как продукты распада во время многих химических реакций.
Многие студенты ошибочно полагают, что «гидро» в углеводородах относится к воде, что приводит ко второму предположению, что углеводороды содержат кислород, а также водород и углерод. «Гидро» в слове «углеводород» на самом деле относится к водороду; кислород отсутствует в этих органических молекулах. Понимание структуры углеводородов позволяет нам лучше понять, как изменение этой базовой структуры добавляет функциональности биомолекулам.
Несмотря на то, что углеводороды содержат только атомы углерода и водорода, они представляют собой структурно разнообразную группу молекул, включая ископаемое топливо, несколько видов пластика и парафиновый воск. Ископаемые виды топлива, такие как уголь, нефть и природный газ, легко горят, реагируя с кислородом с выделением энергии, поскольку молекулы углеводородов распадаются на части с образованием диоксида углерода и воды. Ископаемое топливо не всегда признается органическим материалом, хотя название намекает на его происхождение. Однако ископаемое топливо является органическим и создается в результате разложения живых организмов за миллионы лет.Поскольку для создания большого количества ископаемого топлива требуются миллионы лет, эти углеводородные источники энергии невозобновляемы, по крайней мере, в этом тысячелетии! Одним из социально-политических результатов этого биологического факта являются горячие дебаты и даже откровенная война по поводу владения и использования богатых энергией ископаемых видов топлива.
Расшифровка структурных моделей
Эти анимации демонстрируют, как атомы представлены в химических изображениях органических молекул.
Сравнение структур
Сокращенные структуры I
Сокращенные структуры II
Сокращенные структуры III
Сокращенные структуры IV
Гоинг Молекулярный
В этом упражнении вы оцените каждую структурную модель и определите соответствующую молекулярную формулу.
Органическая химия
Активизация химических реакций твердого тела
11 февраля 2019 г. – Добавление олефина позволяет проводить эффективные реакции кросс-сочетания без растворителей, что приводит к экологически безопасному синтезу широкого спектра органических …
К преодолению проблем растворимости в органической химии
18 мая 2021 г. – Ученые разработали быстрый и эффективный протокол реакций кросс-сочетания, значительно расширяющий пул химических веществ, которые можно использовать для синтеза полезных органических веществ…
Следующий шаг в производстве магнитных органических молекул
30 июля 2019 г. – команда создала новые молекулы с магнитными свойствами. В отличие от многих более ранних органических магнитов, молекулы были стабильны в присутствии воды и кислорода. Их магнитные свойства были …
Склеивание блинов как новый инструмент для создания новых магнитных материалов на основе металлов
13 августа 2020 г. – Новое исследование привело к открытию нового магнитного соединения, в котором два магнитных иона металла диспрозия соединены двумя ароматическими органическими радикалами, образующими блинную связь.Результаты этого …
Режим Маркуса в органических устройствах: механизм межфазной передачи заряда подтвержден
9 мая 2019 г. – Новое исследование показывает, как электроны ведут себя при инжекции в органические полупроводниковые пленки. Моделирование и эксперименты четко идентифицировали различные виды транспорта …
Невинные и сильно окисляющие вещества
3 июня 2020 г. – Химики производят новые окислители как средство для …
Органический ферромагнетизм: захват спинов в стеклообразном состоянии
Сен.17, 2018 – Группа исследователей представляет альтернативные подходы к универсальному применению пластика в будущем …
Эффективное образование амидных связей в мягких условиях
27 января 2021 г. – Соединение молекулярных компонентов амидными связями – одна из важнейших реакций в исследованиях и химической промышленности. Ученые ввели новый тип реакции для получения амида …
Обнаружен новый синтез сложных органических молекул
6 июня 2019 г. – Ученые впервые разработали эффективный способ создания органических молекул, которые до сих пор было трудно синтезировать из-за их общей громоздкой структуры и в целом…
Возможна селективная конверсия реакционноспособных соединений лития
12 августа 2020 г. – Исследователи разработали новый катализатор, который может катализировать реакции для производства фармацевтических препаратов или химикатов, используемых в сельском хозяйстве. Он создает углерод-углеродные связи между тем, что известно как …
Типы органических соединений в химии и биологии
Органические соединения называются «органическими», потому что они связаны с живыми организмами.Эти молекулы составляют основу жизни и очень подробно изучаются в химических дисциплинах органической химии и биохимии.
Существует четыре основных типа или класса органических соединений, обнаруженных во всем живом: углеводы, липиды, белки и нуклеиновые кислоты. Кроме того, существуют и другие органические соединения, которые могут быть обнаружены в некоторых организмах или продуцированы ими. Все органические соединения содержат углерод, обычно связанный с водородом (также могут присутствовать другие элементы).Давайте подробнее рассмотрим ключевые типы органических соединений и рассмотрим примеры этих важных молекул.
Углеводы – органические соединения
Масанянка / Getty Images
Углеводы – это органические соединения, состоящие из элементов углерода, водорода и кислорода. Отношение атомов водорода к атомам кислорода в молекулах углеводов составляет 2: 1. Организмы используют углеводы в качестве источников энергии, структурных единиц и для других целей. Углеводы – это самый большой класс органических соединений, содержащихся в организмах.
Углеводы классифицируются по количеству содержащихся в них субъединиц. Простые углеводы называются сахарами. Сахар, состоящий из одной единицы, является моносахаридом. Если две единицы соединяются вместе, образуется дисахарид. Более сложные структуры образуются, когда эти более мелкие единицы соединяются друг с другом с образованием полимеров. Примеры этих более крупных углеводных соединений включают крахмал и хитин.
Примеры углеводов:
- Глюкоза
- Фруктоза
- Сахароза (сахар столовый)
- Хитин
- Целлюлоза
- Глюкоза
Липиды – органические соединения
дулезидар / Getty Images
Липиды состоят из атомов углерода, водорода и кислорода.Липиды имеют более высокое отношение водорода к кислороду, чем углеводы. Три основные группы липидов – это триглицериды (жиры, масла, воски), стероиды и фосфолипиды. Триглицериды состоят из трех жирных кислот, соединенных с молекулой глицерина. Каждый стероид имеет основу из четырех углеродных колец, соединенных друг с другом. Фосфолипиды напоминают триглицериды, за исключением того, что вместо одной из цепей жирных кислот есть фосфатная группа.
Липиды используются для хранения энергии, построения структур и в качестве сигнальных молекул, помогающих клеткам общаться друг с другом.
Примеры липидов:
- Холестерин
- Парафин
- Оливковое масло
- Маргарин
- Кортизол
- Эстроген
- Фосфолипидный бислой, образующий клеточную мембрану
Белки – органические соединения
Максимилиан Сток Лтд. / Getty Images
Белки состоят из цепочек аминокислот, называемых пептидами. Белок может быть получен из одной полипептидной цепи или может иметь более сложную структуру, в которой полипептидные субъединицы упаковываются вместе, образуя единицу.Белки состоят из атомов водорода, кислорода, углерода и азота. Некоторые белки содержат другие атомы, такие как сера, фосфор, железо, медь или магний.
Белки выполняют в клетках множество функций. Они используются для создания структуры, катализатора биохимических реакций, иммунного ответа, упаковки и транспортировки материалов, а также для воспроизведения генетического материала.
Примеры белков:
- Ферменты
- Коллаген
- Кератин
- Альбумин
- Гемоглобин
- Миоглобин
- Фибрин
Нуклеиновые кислоты – органические соединения
Stocktrek Images / Getty Images
Нуклеиновая кислота – это тип биологического полимера, состоящего из цепочек нуклеотидных мономеров.Нуклеотиды, в свою очередь, состоят из азотистого основания, молекулы сахара и фосфатной группы. Клетки используют нуклеиновые кислоты для кодирования генетической информации организма.
Примеры нуклеиновых кислот:
- ДНК (дезоксирибонуклеиновая кислота)
- РНК (рибонуклеиновая кислота)
Другие виды органических соединений
Ирина Имаго / Getty Images
В дополнение к четырем основным видам органических молекул, обнаруженных в организмах, существует множество других органических соединений.К ним относятся растворители, лекарства, витамины, красители, искусственные ароматизаторы, токсины и молекулы, используемые в качестве предшественников биохимических соединений. Вот некоторые примеры:
- ацетальдегид
- Ацетаминофен
- Ацетон
- Ацетилен
- Бензальдегид
- Биотин
- Бромфеноловый синий
- Кофеин
- Тетрахлорметан
- Фуллерен
- Гептан
- Метанол
- Горчичный газ
- Ванилин
Глава 5 – Введение в органическую химию – Химия
Глава 5 – Введение в органическую химиюЭто содержимое также можно загрузить в виде интерактивного PDF-файла.Для интерактивного PDF-файла требуется Adobe Reader для полной функциональности.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Разделы: 5,1 Боль, удовольствие и органическая химия 5,2 Рисование органических молекул В поисках лучшей структуры Льюиса 5.3 различных представления органических молекул Молекулярные формулы Структурные формулы и трехмерные модели Скелетные или линейные формулы Сокращенный чертеж органической структуры 5,4 Стереоизомеры, энантиомеры и хиральность Хиральность Талидомид – История непредвиденных последствий 5.5 Важность хиральности в белковых взаимодействиях 5.6 Распознавание общих органических функциональных групп Алканы Алкены и алкины Ароматические углеводороды Алкилгалогениды Спирты, фенолы и тиолы Эфиры и сульфиды Амины Органические фосфаты Альдегиды и кетоны Карбоновые кислоты и их производные Нитрилы Практика распознавания функциональных групп в молекулах 5.7 Краткий обзор номенклатуры органических продуктов 5.8 Ссылки5,1 Боль, удовольствие и органическая химия
перец Хабанеро (источник: https://www.flickr.com/photos/jeffreyww/)
Жаркий августовский вечер в парке в центре Северного Гудзона, штат Висконсин, деревни с населением чуть менее 4000 человек на реке Санта-Крус на западной окраине штата. Очередь людей сидит за столиками, расставленными внутри брезентовой палатки.Перед ликующей толпой друзей, родственников и соседей эти храбрые души собираются сразиться. . .с фруктовой тарелкой.
К несчастью для участников, рассматриваемый фрукт – хабанеро, один из самых острых сортов перца чили, обычно встречающихся на рынках Северной Америки. В этом конкретном мероприятии команды из пяти человек будут соревноваться, чтобы первыми съесть полный фунт перца. Когда начинается еда, сначала все кажется хорошо. Однако в течение тридцати секунд то, что начинает происходить, становится полностью предсказуемым и понятным для любого, кто когда-либо по ошибке налил слишком много острого соуса на обеденную тарелку.
Лица краснеют, пот и слезы текут, выпивается обильное количество холодной воды.
Хотя технически участники соревнуются друг с другом, реальный противник в этом соревновании – причина всей боли и страданий – это химическое соединение «капсаицин», источник тепла в остром перце чили.
Состоящий из четырех элементов: углерода, водорода, кислорода и азота, капсаицин вырабатывается растением перца для отпугивания голодных млекопитающих.Молекула связывается с белком-рецептором млекопитающих под названием TrpV1 и активирует его, который в нормальных условиях должен определять высокие температуры и посылать сигнал в мозг – «жарко, держись подальше!» Эта стратегия хорошо работает для всех видов млекопитающих, кроме Во-первых, мы, люди (по крайней мере, некоторые из нас), кажется, одиноки в своей склонности искать ожог острого перца в своей пище.
Интересно, что у птиц также есть белок теплового рецептора, который очень похож на рецептор TrpV1 у млекопитающих, но птицы совсем не чувствительны к капсаицину.В этом есть эволюционная логика: перец полезнее, если его будет есть птица, а не млекопитающее, потому что птица может распространять семена перца на гораздо более обширной территории. Область рецептора, отвечающая за чувствительность к капсаицину, кажется довольно специфичной. В 2002 году ученым удалось вставить небольшой сегмент (чувствительного к капсаицину) гена рецептора TrpV1 крысы в нечувствительную куриную версию гена, и полученный химерный (смешанный вид) рецептор оказался чувствительным к капсаицину ( Cell ). 2002 , 108 , 421).
Вернувшись на Пепперфест в Северном Гудзоне, люди с немного более здравым смыслом отказываются от болезненных последствий перегрузки капсаицином и вместо этого предаются более приятным химическим явлениям. Маленькая девочка, наслаждающаяся рожком мороженого, частично реагирует на химическое действие другого органического соединения, называемого ванилином.
Что такого в капсаицине и ванилине, что заставляет эти два соединения оказывать столь разительно разные эффекты на наше сенсорное восприятие? Оба производятся растениями, и оба состоят из элементов углерода, водорода, кислорода и (в случае капсаицина) азота.С момента зарождения химии как науки химики были очарованы – и на протяжении большей части этой истории озадачены – бесчисленными свойствами соединений, которые происходят от живых существ. К этим соединениям применялся термин «органические» от греческого organikos , и считалось, что они содержат некую «жизненную силу», которая отличает их от «неорганических» соединений, таких как минералы, соли и металлы. , Что позволило им действовать по совершенно другому набору химических принципов.Как иначе, как не под действием «жизненной силы», такая небольшая подгруппа элементов могла объединиться, чтобы образовать соединения с таким количеством различных свойств?
Сегодня, как вы, вероятно, уже знаете, термин «органический» в применении к химии относится не только к молекулам живых существ, но и ко всем соединениям, содержащим элемент углерод, независимо от их происхождения. Начиная с начала 19 века, когда химики в ходе тщательных экспериментов узнали о составе и свойствах «органических» соединений, таких как жирные кислоты, уксусная кислота и мочевина, и даже выяснили, как синтезировать некоторые из них, начиная с исключительно «неорганических» компонентов. , они начали понимать, что концепция «жизненной силы» недействительна и что свойства как органических, так и неорганических молекул на самом деле можно понять, используя одни и те же фундаментальные химические принципы.
Они также начали более полно ценить уникальные свойства элемента углерода, который делает его настолько важным в химии живых существ, что это требует отдельного химического подполя. Углерод образует четыре стабильные связи либо с другими атомами углерода, либо с водородом, кислородом, азотом, серой, фосфором или галогеном. Характерные способы связывания углерода позволяют ему служить скелетом или каркасом для построения больших сложных молекул, которые включают цепи, разветвления и кольцевые структуры.
Хотя «органическая химия» больше не означает исключительно изучение соединений из живых существ, тем не менее именно желание понять химию жизни и повлиять на нее является движущей силой большей части работы химиков-органиков, независимо от того, является ли их целью изучение чего-то принципиально нового. о реакционной способности углерод-кислородной связи, чтобы открыть новый лабораторный метод, который можно использовать для синтеза жизненно важного лекарства, или лучше понять сложный химический танец, который происходит в активном центре фермента или рецепторного белка.Хотя люди веками ели острый перец и продукты со вкусом ванили, мы только сейчас, в последние несколько десятилетий, начинаем понимать, как и почему один из них вызывает жгучую боль, а другой – чистое вкусовое удовольствие. Мы понимаем, что точное геометрическое расположение четырех элементов в капсаицине позволяет ему поместиться внутри связывающего кармана теплового рецептора TrpVI, но на сегодняшний день у нас еще нет подробного трехмерного изображения белка TrpVI, связанного с капсаицином.Мы также знаем, что различное расположение атомов углерода, водорода и кислорода в ванилине позволяет ему связываться со специфическими обонятельными рецепторами, но, опять же, еще многое предстоит узнать о том, как именно это происходит.
В этой главе вы познакомитесь с некоторыми из самых фундаментальных принципов органической химии. С концепциями, о которых мы узнаем, мы можем начать понимать, как углерод и очень небольшое количество других элементов в периодической таблице могут предсказуемым образом объединяться для создания практически безграничного химического репертуара.
По мере прочтения вы поймете, что в главе содержится много обзоров тем, которые вы, вероятно, уже изучили на вводном курсе химии, но, вероятно, также будет несколько новых для вас понятий, а также некоторые темы. которые вам уже знакомы, но освещены более подробно и с большим упором на биологически значимые органические соединения.
Мы начнем с напоминания о том, как химики изображают связи в органических молекулах с помощью схемы «структура Льюиса», уделяя особое внимание концепции «формального заряда».Мы рассмотрим общие схемы связывания шести элементов, необходимых для всех форм жизни на Земле: углерода, водорода, азота, кислорода, серы и фосфора, а также галогенов (фтора, хлора, брома и йода). Затем мы продолжим изучение некоторых базовых навыков, связанных с рисованием и обсуждением органических молекул: понимание схемы рисования «линейная структура» и другие полезные способы сокращения и упрощения структурных чертежей, изучение функциональных групп и изомеров и рассмотрение как систематически называть простые органические молекулы.Наконец, мы соберем все это вместе с обзором структур наиболее важных классов биологических молекул – липидов, углеводов, белков и нуклеиновых кислот, на которые мы будем постоянно ссылаться на протяжении всей оставшейся части книги.
( Вернуться к началу )
5.2 Рисование органических молекул
Как видно из приведенных выше молекул капсаицина и ванилина, наиболее распространенными атомами, обнаруженными в органических соединениях, являются углерод и водород.Другие атомы, которые обычно образуют ковалентные связи в органических структурах, также включают кислород, азот, серу и фосфор. Реже галогены, такие как хлор, бром и йод, также могут быть включены в органические молекулы. Вспомните из главы 4, что правило октетов помогло нам определить, что углерод обычно образует четыре ковалентные связи, азот и фосфор – по три, кислород и сера – по две, а галогены – только по одной связи. Водород является исключением из правила октетов, поскольку это самый маленький элемент, а его валентная оболочка заполнена двумя электронами.Таким образом, водород может образовывать одну связь с другим атомом. Сера и фосфор также могут иметь образцы связывания, которые являются исключением из правила октетов. Оба они имеют расширенную орбитальную связь с фосфором, который также обычно образует пять ковалентных связей, а сера способна образовывать четыре или шесть ковалентных связей. Таблица 5.1 дает графическое представление этих шаблонов. Когда вы рисуете органические молекулы, важно обращать внимание на правила связывания, чтобы все атомы достигли своих предпочтительных состояний связывания.
Таблица 5.1: Паттерны ковалентных связей атомов, обычно встречающиеся в органических молекулах
* Примечание. Водород на самом деле не следует правилу октетов, поскольку его валентная оболочка заполнена 2 e –
В поисках лучшей структуры ЛьюисаПродвигаясь вперед в изучении органических молекул, мы обнаруживаем, что они становятся намного более сложными, чем простые ионные и ковалентные соединения, обсуждаемые в главе 3.Из-за этой сложности органические соединения часто имеют более одного конкретного структурного состояния, в котором они могут существовать, и нередко молекула может перемещаться туда и обратно между этими состояниями. Когда электроны в молекуле могут перемещаться из одной области молекулы в другую, чтобы создать эти альтернативные структуры. Это определяется как резонанс , и результирующие состояния из этих сдвигов как резонансные структуры . Обратите внимание, что резонансные структуры дают химикам более конкретное представление о молекулах.Однако настоящие молекулы не существуют в том или ином структурном состоянии. Вместо этого они существуют в более аморфном переходном состоянии, которое находится где-то посередине между всеми возможными комбинациями. Некоторые резонансные формы могут быть более стабильными, чем другие, и будут иметь большее влияние на общую структуру молекулы, чем другие резонансные формы. Таким образом, нам нужен способ точно предсказать, какие резонансные структуры могут возникать внутри молекулы и какие состояния будут наиболее стабильными.Это можно сделать, используя формальный метод заряда построения структур Льюиса. Формальный заряд на атоме рассчитывается как количество валентных электронов атома за вычетом количества электронов, которыми атом «владеет». Число электронов, принадлежащих атому, можно рассчитать, сложив количество неподеленных электронов + половину числа общих электронов. Помните, что 2 e – используются для каждой линии, проведенной между двумя атомами (одна линия = 2 e – ).Например, если кислород связан с двумя другими атомами, мы могли бы вычислить формальный заряд кислорода, вычтя количество электронов, «принадлежащих» кислороду, из количества электронов его валентной оболочки:
Что, если кислород связан вот так?
Как бы вы рассчитали формальный сбор?
Это не предпочтительная конфигурация для кислорода, но поскольку кислород настолько электроотрицателен, он может нести отрицательный формальный заряд легче, чем атомы с меньшей электроотрицательностью.
Теперь рассмотрим структуру аниона фосфата (PO 4 3- ). Это наиболее распространенная форма фосфора, обнаруженная во всех живых организмах на планете, включая человека. Он обычно включается в органические молекулы, такие как ДНК, белки и АТФ (аденозинтрифосфат), хранилище энергии клетки (рис. 5.1).
Рис. 5.1 Структуры аденозинтрифосфата (АТФ) и дезоксирибонуклеиновой кислоты (ДНК). Ион фосфата является важным компонентом обоих (A.) Структура АТФ и (В) структура ДНК.
Схема модели ДНК предоставлена: Zephyris – Собственная работа, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=15027555
Как нам нарисовать структуру Льюиса для фосфат-иона?
(1) Определите наименее электроотрицательный элемент (ы) в молекуле. Это будет центральный атом (атомы), вокруг которого связаны другие, более электроотрицательные атомы. (Обратите внимание, что водород никогда не может быть центральным атомом, поскольку он может образовывать только одну ковалентную связь).
Для заказа на поставку 4 3- перечислите все атомы с фосфором в центре. Кроме того, перечислите любые дополнительные электроны из-за отрицательного заряда всей молекулы и ваши ожидания относительно связывающей способности каждого атома по достижению октета. Обратите внимание, что у нас есть четыре атома кислорода, которые должны связываться с фосфором. Таким образом, мы ожидаем, что P будет находиться в состоянии связи 5 для этой молекулы (т.е. 3 будет недостаточно). Обратите внимание, что неподеленная пара электронов в P расщеплена, и каждый электрон используется для расширенной орбитальной связи с другими атомами.
(2) Подсчитайте общее количество валентных электронов, присутствующих в молекуле. Для этого сложите все валентные электроны для каждого присутствующего атома.
- Если на молекуле нет общего заряда, это число будет представлять общее количество валентных электронов в молекуле.
- Если в молекуле имеется отрицательный заряд, добавьте дополнительные электроны к количеству валентных электронов для всех присутствующих атомов, чтобы вычислить общее количество валентных электронов в молекуле.Эта молекула будет существовать как анион.
- Если молекула имеет чистый положительный заряд, вычтите общий положительный заряд из числа валентных электронов для всех присутствующих атомов, и это будет представлять общее количество валентных электронов в молекуле. Эта молекула будет существовать в виде катиона.
(3) Постройте оболочку для связанных атомов с центральным атомом (ами) и вычислите формальный заряд (ы).
Поместите связи между внешними атомами и центральным атомом
Добавьте все оставшиеся электроны, чтобы завершить правило октета / дуэта (или расширенные орбитали, если необходимо) для оставшихся атомов
Если у вас закончатся электроны до того, как все атомы заполнили валентные оболочки, начните создавать двойные связи там, где это необходимо
Вычислите формальный заряд каждого атома в молекуле, а затем используйте полученную сумму для вычисления формального заряда всей молекулы.
Посмотрите видеоурок выше, который поможет вам нарисовать структуру Льюиса фосфата. Вы увидите, что вам нужно начать с центрального фосфора. Обратите внимание, что вместо октета необходимо использовать расширенное правило орбиталей, чтобы иметь возможность связываться со всеми атомами кислорода. Мы знаем, что для фосфора он образует 5 связей в расширенном орбитальном формате (таблица 5.1) и потребует всего 10 электронов вместо обычных 8, которые мы привыкли видеть с помощью правила октетов.Итак, начните с рисования этих 5 облигаций. Вы заметите, что вам нужно создать одну двойную связь с одним из атомов кислорода, чтобы завершить 5 связей. После этого заполните неподеленную пару электронов для всех атомов, пока не получите в общей сложности 32 электрона. (убедитесь, что каждый кислород достигает состояния октета. Затем вычислите формальные заряды на каждом атоме. Как показано выше, кислород, который имеет две связанные пары электронов и две пары заимствованных, имеет формальный заряд ноль, в то время как атомы кислорода, которые имеют одну связанную пара электронов и три неподеленные пары имеют формальный заряд 1 – .Если мы вычислим формальный заряд фосфора, мы увидим, что P имеет 5 валентностей e минус электроны неподеленной пары и половина электронов связанной пары. P не имеет неподеленных пар и имеет 10 связанных парных электронов. Таким образом, половина 10 = 5. 5 – 5 = 0. Таким образом, P имеет формальный заряд ноль. Поскольку три атома кислорода имеют заряд 1 –, а два других атома равны нулю, общий заряд молекулы составляет 3 –. Завершенная структура Льюиса для фосфата должна выглядеть так:
(4) При необходимости изобразите резонансные структуры.
Для нашей фосфатной структуры (PO 4 3- ), приведенной выше, если мы рассмотрим каждый из атомов кислорода в молекуле, они по своей сути не отличаются друг от друга. Таким образом, каждый кислород, окружающий фосфор, должен иметь равные возможности для образования двойной связи. Мы показали, что двойная связь образуется в нижнем положении, но у нее есть равновероятная вероятность образования с любым из трех других атомов кислорода. Таким образом, мы можем показать структуру с положением двойной связи во всех других возможных конформациях:
На самом деле ни одна из резонансных структур не представляет собой истинную структуру.Истинная структура находится где-то посередине между всеми возможными резонансными формами. Однако рисование резонансных структур дает ученым возможность обсудить истинную конформацию структуры и дает возможность предсказать химическую реакционную способность молекулы.
(Вернуться к началу)
5.3. Различные представления органических молекул Молекулярные формулы
Органические молекулы, по сравнению с простыми солями и ковалентными соединениями, показанными в главах 3 и 4, могут быть довольно большими и разветвленными структурами с множеством ответвлений.Таким образом, важно понимать, как рисовать органические молекулы, чтобы вы могли понять трехмерную форму молекулы. Молекулярная формула – это самый простой способ представить соединение, подсчитав все различные типы атомов и перечислив их по порядку. Например, сахар глюкоза содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Тогда молекулярная формула будет записана как C 6 H 12 O 6 . По соглашению на первом месте указывается углерод, на втором месте водород, за ним следуют кислород, азот, сера, фосфор и, наконец, любые галогены.Однако для органической химии молекулярные формулы не дают много информации. Они просто предоставляют номера каждого типа атомов, присутствующих в молекуле, но они ничего не говорят вам о том, как атомы соединяются вместе в пространстве. Таким образом, молекулярные формулы очень редко используются в органической химии, потому что они не дают полезной информации о связи в молекуле. Одно из немногих мест, где вы можете встретить их, – это уравнения горения простых углеводородов, например:
C 5 H 12 + 😯 2 → 5CO 2 + 6H 2 O
В подобных случаях порядок связывания в органической молекуле не имеет значения.Однако для большинства биологически важных реакций форма молекулы обычно имеет решающее значение для функции молекулы, очень похоже на ключ, вставляемый в замок. Таким образом, порядок склеивания становится очень важным. Например, C 5 H 12 , показанные в приведенном выше уравнении, могут быть связаны вместе более чем одним способом:
Две вышеуказанные структуры представляют действительные структуры с молекулярной формулой C 5 H 12 .Однако каждая из этих структур представляет собой отдельную молекулу с немного разными химическими свойствами. Когда соединения имеют одну и ту же молекулярную формулу, но имеют другой порядок связывания атомов, они известны как структурные изомеры . (вы также можете увидеть термин конституционные изомеры ). Перечислили ли мы все возможные структурные изомеры для формулы C 5 H 12 ? Нет! Используйте приведенный ниже пример, чтобы увидеть, можете ли вы создать третий структурный изомер.
(Вернуться к началу)
Структурные формулы и трехмерные модели
Структурная формула показывает, как связаны различные атомы, и может быть более полезной, чем просто написание молекулярной формулы для соединения. Существуют различные способы рисования структурных формул, и вам необходимо знать все из них. Они включают отображаемую формулу, сокращенные формулы и линейные структуры.
Отображаемые формулыОтображаемая формула показывает все связи в молекуле в виде отдельных строк, где каждый атом записан в конце каждой строки с использованием его элементной аббревиатуры из периодической таблицы.Все структуры C 6 H 12 , указанные выше, записаны в отображаемых формулах . Вы должны помнить, что каждая линия представляет собой пару общих электронов. Например, на рисунке 5.2 ниже показана отображаемая формула метана рядом с трехмерными изображениями.
Рисунок 5.2: Три различных представления CH 4 Слева – модель мяча и клюшки, в центре – отображаемая формула, а справа – модель заполнения пространства.
Обратите внимание, что отображаемая формула метана не представляет трехмерную форму молекулы, показанную на диаграмме заполнения пространства справа. Метан не плоский с углами связи 90 °. Несоответствие между тем, что вы рисуете, и тем, как на самом деле выглядит молекула, может привести к проблемам, если вы не будете осторожны. Таким образом, для органической химии важно начать думать о структурах в их трехмерной форме. Чем больше вы практикуетесь, тем больше вы сможете визуализировать и вращать молекулу в своей голове.Например, рассмотрим простую молекулу с молекулярной формулой CH 2 Cl 2 . Вы можете подумать, что существует два разных способа расположения этих атомов, если начертите отображаемую формулу.
Но эти две структуры на самом деле абсолютно одинаковые. Наше моделирование VSEPR из главы 4 показало, что углерод принимает тетраэдрическое подтверждение, где каждый валентный угол составляет 109 o . Молекула не плоская, в плоскости бумаги.Посмотрите видео ниже, чтобы увидеть, как они выглядят как модели вращающихся шариков и клюшек.
Одна конструкция на самом деле представляет собой простое вращение другой. Рассмотрим немного более сложную молекулу: C 2 H 5 Cl. Отображаемая формула может быть записана как:
Но, опять же, это точно так же. Посмотрите на модели ниже.
Продолжая практиковаться в составлении структурных формул, вы научитесь лучше распознавать и различать изомеры, которые действительно отличаются друг от друга, и версии одной и той же молекулы, написанные с разных трехмерных точек зрения.
Краткие формулыДля чего-либо, кроме самых простых молекул, рисование полностью отображаемой формулы может быть громоздким и занимать слишком много места – особенно все углерод-водородные связи. Вы можете упростить – или упростить – формулу, написав, например, CH 3 или CH 2 вместо отображения всех связей C-H. Например, этановая (C 2 H 4 O 2 ) кислота может быть представлена в полностью отображаемой форме, частично конденсированной форме и полностью конденсированной форме.
Обратите внимание, что частично конденсированная структура по-прежнему дает очень четкую картину того, где каждый из атомов связан в пространстве. Однако с полностью уплотненной структурой может быть сложно точно увидеть рисунки склеивания. Полностью конденсированная форма содержит больше информации о порядке связывания, чем молекулярная формула, так что атомы, которые непосредственно связаны с соседним атомом, размещаются рядом с этим атомом в конденсированной форме, а не просто подсчет всех видов атомов как в молекулярной формуле.
Работая в обратном направлении, мы можем использовать конденсированную структуру этановой кислоты в качестве примера для воссоздания частично конденсированной структуры. Если посмотреть на положение первого углерода, становится очевидным, что с первым углеродом связаны три атома водорода и один углерод:
Обратите внимание, что это удовлетворяет правилу октетов для первого углерода (четыре связи с другими атомами). Три атома водорода также имеют одинарные связи с первым углеродом. Второму углероду теперь присвоена одна связь с первым углеродом.Нам нужно назначить оставшиеся три облигации.
Из сжатой формулы ясно, что первый кислород присоединен ко второму углероду, однако после этого мы не уверены в положении второго кислорода.
Мы можем ясно вывести, что последний атом водорода связан со вторым кислородом, поскольку он находится в этом положении. Однако, поскольку кислород может образовывать две связи, мы не можем быть уверены, основываясь только на одной конденсированной структуре, что второй кислород связан со вторым углеродом или с первым кислородом.
Если вы не уверены, какой атом к какому связан, лучше всего выделить потенциальные структуры и оценить их потенциальную правильность.
Из анализа вышеупомянутых потенциальных структур ясно, что ни одна из структур не удовлетворяет правилу октетов для одного или нескольких атомов в молекуле, как в настоящее время написано. Однако нижняя структура менее удовлетворительна, чем верхняя структура, поскольку у второго углерода отсутствуют 2 ковалентные связи, в то время как все другие атомы удовлетворяют требованиям связывания октетов.На верхней диаграмме и у второго атома углерода, и у первого атома кислорода отсутствует одна связь. Эта структура может легко удовлетворять правилу октетов, помещая в молекулу двойную связь между углеродом 2 и кислородом 1. Принимая во внимание, что решение для недостающих двух углеродных связей для второго углерода в нижней структуре нелегко исправить. Таким образом, верхняя структура является более вероятной структурой, чем нижняя структура с добавлением двойной связи между углеродом и кислородом.
Хотя конденсированные структуры легче написать, чем отображаемые или частично конденсированные структуры, они могут оказаться немного более сложными для определения трехмерного рисунка связи атомов.
Линейные или скелетные формулыВ строке или скелетной формуле все атомы водорода не показаны, и все атомы углерода не помечены, а указаны в конце или изгибаются в каждой линии, оставляя только углеродный скелет с присоединенными к нему функциональными группами. . Любые гетероатомы (любой другой атом, кроме углерода или водорода) и атомы водорода, присоединенные к гетероатомам, показаны в конденсированной форме.Например, отображаемая структура, частично конденсированная структура и формула линии для 2-бутанола (C 4 H 10 O) выглядят следующим образом:
На линейной или скелетной диаграмме можно сделать следующие допущения:
есть атом углерода на каждом стыке линий и в конце каждой линии.
, к каждому углероду присоединено достаточно атомов водорода, чтобы общее количество связей на этом углероде равнялось 4.
: все гетероатомы (и атомы водорода, присоединенные к гетероатомам) показаны в сжатом формате на скелетной структуре.
В органической химии и биохимии ученые склонны использовать комбинацию этих различных форматов для представления химических структур. Важно научиться рисовать и интерпретировать все возможные изображения.
Как рисовать структурные формулы в 3-х измеренияхБывают случаи, когда важно иметь возможность показать точное трехмерное расположение частей некоторых молекул при использовании структурного представления.Для этого облигации обозначаются условными обозначениями:
Например, вы можете захотеть показать трехмерное расположение групп вокруг углерода, который имеет группу -ОН в 2-бутаноле.
(Вернуться к началу)
Сокращенные чертежи органических структур
Часто при рисовании органических структур химики находят удобным использовать букву «R» для обозначения части молекулы за пределами интересующей области.Если мы просто хотим в целом сослаться на функциональную группу, не показывая, например, конкретную молекулу, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Группа R представляет собой удобный способ сокращения структур больших биологических молекул, особенно когда нас интересует что-то, что происходит конкретно в одном месте молекулы. Например, в главе 15, когда мы рассматриваем биохимические окислительно-восстановительные реакции с участием молекулы флавина, мы будем сокращать большую часть структуры флавина (т. Е.R = FAD), который вообще не меняется в интересующих реакциях:
В качестве альтернативы мы можем использовать символ «разрыва», чтобы указать, что мы смотрим на небольшой кусок или участок более крупной молекулы. Это обычно используется в контексте групп рисования на больших полимерах, таких как белки или ДНК.
Наконец, группы R можно использовать для краткой иллюстрации ряда родственных соединений, таких как семейство антибиотиков на основе пенициллина.
Правильное использование сокращений – очень важный навык, который нужно развивать при изучении органической химии в биологическом контексте, потому что, хотя многие биомолекулы очень большие и сложные (и их рисование занимает вечность!), Обычно мы сосредотачиваемся только на одной небольшой части молекулы. где происходят изменения.
Как правило, вам никогда не следует сокращать любой атом, участвующий в событии разрыва связи или образования связи. , которое проиллюстрировано: сокращает только ту часть молекулы, которая не участвует в интересующей реакции.
Например, углерод № 2 в реагенте / продукте, приведенном ниже, наиболее определенно участвует в изменениях связывания, и поэтому его не следует включать в группу «R».
Если вы не уверены, рисовать ли часть конструкции или сокращать ее, самое безопасное, что можно сделать, – это нарисовать ее.
(Вернуться к началу)
5.4 Стереоизомеры, энантиомеры и хиральность
Как видно из раздела 5.3, органическая химия включает в себя бесконечно разнообразные структуры, возникающие в результате того, как атомы собраны в трехмерном пространстве. Предоставления только молекулярной формулы соединения часто недостаточно для определения соединения, поскольку многие молекулярные формулы имеют многочисленные структурные изомеры. Например, молекулярная формула C 2 H 6 O, молекула всего из 9 атомов, может относиться к диметиловому эфиру или этанолу, в зависимости от того, находится ли кислород в середине или на конце углеродной цепи.
Помните, что структурных изомеров имеют одинаковые атомы, но порядок, в котором атомы связаны друг с другом, отличается, что приводит к различным физическим и химическим свойствам. Например, этанол является жидким при комнатной температуре, а диэтиловый эфир – газом.
Если атомы соединения, соединенного вместе, имеют одинаковый порядок, но их трехмерное расположение в пространстве отличается, они считаются изомером особого типа, называемым стереоизомером . Молекулы сахара глюкоза и галактоза являются стереоизомерами. Они различаются положением одной -ОН-группы, как показано на диаграмме ниже:
Существует особый вид стереоизомеров, называемых энантиомерами , которые являются зеркальным отображением друг друга, но не могут накладываться друг на друга. Это означает, что как бы вы ни повернули их в космосе, вы никогда не сможете положить их друг на друга и получить одно и то же соединение. Одним из примеров является 2-бутанол, который можно представить в виде пары энантиомеров (рис.5.3).
Рис. 5.3: Энантиомеры 2-бутанола. Энантиомеры показаны в трехмерной структурной формуле, отображаемой на верхней диаграмме, и модели мяча и клюшки на нижней диаграмме.
(Вернуться к началу)
Хиральность
Энантиомеры обладают свойством c хиральностью . Хиральность – это термин, применяемый к объектам, которые являются зеркальными отражениями, но не могут быть наложены друг на друга.Термин «хиральный» происходит от греческого слова «рукоятка», т. Е. праворукость или левшу. Ваши руки хиральны: ваша правая рука является зеркальным отражением вашей левой руки, но если вы положите одну руку поверх другой, обе ладони опущены, вы увидите, что они не накладываются друг на друга. (Рис 5.4). Таким образом, хиральные объекты являются зеркальным отображением друг друга, но не могут накладываться друг на друга. Углерод становится хиральным, когда к нему присоединяются четыре разных заместителя. В приведенном выше примере вы заметите, что к центральному углероду присоединены четыре разные группы: группа -ОН, группа -H, группа -CH 3 и группа -CH 2 CH 3 .
Рисунок 5.4: Природа хиральности. Углерод становится хиральным, когда к нему присоединяются четыре различных заместителя. Как бы вы ни повернули молекулу слева, вы не можете наложить ее на молекулу справа.
Источник: Хиральность с руками.jpg: Неизвестная производная работа: – πϵρ ήλιο ℗ – Хиральность с руками.jpg
Стереоизомеры, которые не являются энантиомерами, такие как глюкоза и галактоза, показанные выше, – имеют хиральные центры и не могут накладываться друг на друга, но они не являются зеркальным отображением друг друга.Энантиомерами называют только стереоизомеры, которые также являются зеркальными отражениями и не могут накладываться друг на друга. Энантиомеры очень трудно отделить друг от друга. Они практически идентичны по своим физическим и химическим свойствам. У них одинаковая молекулярная масса, одинаковая полярность, одинаковые температуры плавления и кипения и т. Д. На самом деле энантиомеры настолько похожи, что даже имеют одно и то же имя! На рисунке 5.3 показаны два энантиомера 2-бутанола. Обе молекулы представляют собой 2-бутанол. Но это , а не точно такая же молекула, точно так же, как ваш левый ботинок не , а точно такой же, как ваш правый.Они представляют собой неперекрывающиеся зеркальные отражения друг друга. Как нам сообщить об этой разнице?
Одно небольшое различие между энантиомерами – это направление вращения поляризованного света при попадании на молекулу. Один энантиомер будет вращать свет по часовой стрелке, а другой – против часовой стрелки. Версия по часовой стрелке называется «D» для правовращающего (или правостороннего), а версия против часовой стрелки называется «L» для левовращающего (или левостороннего).Однако вращение света нельзя использовать в качестве прогнозирующего способа для определения абсолютной стереоконфигурации молекулы (то есть вы не можете сказать, какой энантиомер будет вращать свет вправо или влево, пока вы действительно не проведете эксперимент).
Таким образом, необходима другая система для описания абсолютной конфигурации. Система приоритетов Кана-Ингольда-Прелога (CIP) была разработана для определения абсолютной стереоконфигурации энантиомеров как зловещей (S) или прямой (R). В этой системе группам, которые присоединены к хиральному углероду, отдается приоритет на основе их атомного номера ( Z ).Атомам с более высоким атомным номером (большим количеством протонов) дается более высокий приоритет (то есть S> P> O> N> C> H).
Для определения стереохимии поместите группу с наименьшим приоритетом подальше от вас, чтобы остальные три удерживаемые группы были обращены к вам.
Назначьте приоритет остальным группам.
Правила этой системы стереохимической номенклатуры на первый взгляд довольно просты. В качестве первого примера мы будем использовать простой трехуглеродный сахарный глицеральдегид.Попробуйте сделать модель стереоизомера глицеральдегида, показанную ниже. Если у вас нет набора для химического моделирования, простой альтернативой являются зубочистки и мармеладки. Убедитесь, что вы делаете правильный энантиомер!
Первое, что мы должны сделать, это присвоить приоритет каждому из четырех заместителей, связанных с хиральным углеродом . В этой системе номенклатуры приоритеты основаны на атомном номере, причем более высокие атомные номера имеют более высокий приоритет.Сначала мы рассмотрим атомы, которые напрямую связаны с хиральным углеродом: это H, O (в гидроксиле), C (в альдегиде) и C (в группе CH 2 OH).
Два приоритета просты: водород с атомным номером 1 является самым низким (№4) приоритетом, а гидроксильный кислород с атомным номером 8 является приоритетом №1. Углерод имеет атомный номер 6. Какая из двух групп «C» является приоритетной №2, альдегид или CH 2 OH? Чтобы определить это, мы отодвигаем еще одну связь от стереоцентра: для альдегида у нас есть двойная связь с кислородом, а в группе CH 2 OH у нас есть одинарная связь с кислородом.Если атом одинаковый, двойные связи имеют более высокий приоритет, чем одинарные. Следовательно, альдегидной группе присвоен приоритет №2, а группе CH 2 OH – приоритет №3. Распределив приоритеты, мы затем убеждаемся, что группа приоритета №4 (водород) направлена назад от нас, в плоскость страницы (это уже так).
Затем мы обводим круг, определяемый группами приоритетов №1, №2 и №3, в порядке возрастания. В нашем примере с глицеральдегидом этот круг повернут по часовой стрелке, что говорит нам о том, что этот углерод имеет конфигурацию «R», и что эта молекула является (R) -глицеральдегидом.Для (S) -глицеральдегида круг, описываемый приоритетными группами №1, №2 и №3, направлен против часовой стрелки (но сначала мы должны перевернуть молекулу так, чтобы буква H указывала на плоскость страницы) .
В случае 2-бутанола (рис. 5.5) легко назначить первый и четвертый приоритеты. -OH является первым приоритетом, а -H – четвертым приоритетом. Как вы назначаете 2-й и 3-й приоритет, если оба эти атома являются углеродом? Если приоритет у присоединенного атома такой же, вам нужно перейти на следующий уровень и оценить приоритет там.Для 2-бутанола одна группа – -CH 3 , а одна группа – -CH 2 CH 3 . В первой ситуации, если мы посмотрим на следующий уровень, этот углерод связан с тремя другими атомами водорода (все с очень низким приоритетом). Во второй ситуации углерод связан с двумя атомами водорода и одним углеродом. Поскольку C имеет более высокий приоритет, чем H, группа -CH 2 CH 3 будет иметь более высокий приоритет по сравнению с группой -CH 3 . Как только всем группам будет присвоен приоритет, вы можете определить, в каком направлении будет двигаться приоритет.Если она направлена по часовой стрелке, молекуле будет присвоено обозначение «R». Приоритет движения против часовой стрелки обозначается буквой «S». В нашем примере 2-бутанол слева показывает приоритет движения в направлении против часовой стрелки, отдавая S-энантиомер. Молекула справа показывает R-энантиомер с приоритетом, движущимся по часовой стрелке.
Рисунок 5.5: Стереохимия 2-бутанола. Система приоритета CIP может использоваться для определения абсолютной стереоконформации энантиомеров
(Вернуться к началу)
Талидомид – история непредвиденных последствий
Интересно, что энантиомеры имеют одинаковые физические свойства и точно такие же химические свойства, за исключением при взаимодействии с другими хиральными молекулами.Таким образом, хиральные молекулы потенциально сильно различаются в физиологии и медицине. Например, в 1960-х годах в Западной Европе широко прописывали лекарство под названием талидомид для облегчения утреннего недомогания беременных женщин.
Талидомид ранее использовался в других странах в качестве антидепрессанта и считался безопасным и эффективным. Однако вскоре врачи поняли, что что-то пошло не так: многие дети, рожденные женщинами, принимавшими талидомид во время беременности, страдали серьезными врожденными дефектами.
B aby , рожденный от матери, принимавшей талидомид во время беременности.
Позже исследователи поняли, что проблема заключалась в том, что талидомид поставлялся в виде смеси двух различных изомерных форм, называемой рацемической смесью .
Один из изомеров является эффективным лекарством, а другой вызывает побочные эффекты. Обе изомерные формы имеют одинаковую молекулярную формулу и одинаковую связь между атомами, поэтому они не являются просто структурными изомерами.Они отличаются расположением в трехмерном пространстве одного тетраэдрического хирального углерода. Таким образом, эти две формы талидомида представляют собой энантиомеров .
Обратите внимание, что рассматриваемый углерод имеет четыре разных заместителя (два из них просто связаны кольцевой структурой). Тетраэдрические атомы углерода с четырьмя различными группами заместителей называются стереоцентрами .
Глядя на структуры того, что мы называем двумя изомерами талидомида, вы можете не полностью убедиться, что на самом деле это две разные молекулы.Чтобы убедиться, что они действительно разные, давайте создадим обобщенную картину тетраэдрического стереоцентра углерода с четырьмя заместителями, обозначенными R 1 -R 4 . Два стереоизомера нашей упрощенной модели выглядят так:
Если вы внимательно посмотрите на рисунок выше, вы заметите, что молекула A и молекула B являются зеркальным отображением друг друга (линия с надписью «σ» представляет собой зеркальную плоскость). Кроме того, они не могут быть наложены друг на друга : если мы возьмем молекулу A, перевернем ее и поместим рядом с молекулой B, мы увидим, что две структуры не могут быть наложены друг на друга.Это две разные молекулы!
Если вы сделаете модели двух стереоизомеров талидомида и сделаете то же самое, вы увидите, что они тоже являются зеркальными изображениями и не могут быть наложены друг на друга (это поможет посмотреть на цветную версию рисунка ниже).
Талидомид представляет собой хиральную молекулу .
Вот еще несколько примеров хиральных молекул, которые существуют в виде пар энантиомеров. В каждом из этих примеров есть один стереоцентр, обозначенный стрелкой.(Многие молекулы имеют более одного стереоцентра, но мы вернемся к этому чуть позже!)
Вот несколько примеров молекул, которые являются ахиральными (не хиральными). Обратите внимание, что ни одна из этих молекул не имеет стереоцентра (атома, связанного с четырьмя разными заместителями).
При оценке молекулы на хиральность важно понимать, что использование штрихового / сплошного рисунка клина не обязательно означает, что молекула хиральна.Иногда хиральные молекулы рисуют без использования клиньев. И наоборот, клинья могут использоваться для атомов углерода, которые не являются стереоцентрами – посмотрите, например, на рисунки глицина и цитрата на рисунке выше. Просто потому, что вы видите пунктирные и сплошные клинья в структуре, не следует автоматически предполагать, что вы смотрите на стереоцентр.
Стереоцентрами могут быть и другие элементы, помимо углерода. Фосфорный центр фосфат-иона и органических фосфатных эфиров, например, является тетраэдрическим и, таким образом, потенциально является стереоцентром.
Возникли проблемы с визуализацией хиральности и энантиомеров? Может быть полезно посмотреть этот
видеоурок
(Вернуться к началу)
5.5 Важность хиральности в белковых взаимодействиях
Талидомид, который использовался в 1960-х годах для лечения депрессии и утреннего недомогания, продавался в виде смеси 50:50 как R-, так и S-энантиомеров – это называется рацемической смесью .«Волнистая» связь в химической структуре указывает на рацемическую смесь – таким образом, рацемический ( R / S ) талидомид будет иметь вид:
Проблема с рацемическим талидомидом, как мы узнали выше, заключается в том, что только R-энантиомер является эффективным лекарством, тогда как S-энантиомер вызывает мутации у развивающегося плода. Как такая, казалось бы, тривиальная структурная вариация приводит к столь драматическому (и в данном случае трагическому) различию в биологической активности? Практически все лекарства работают, так или иначе взаимодействуя с важными белками в наших клетках: они могут связываться с белками рецепторов боли, например, блокировать передачу болевых сигналов или закупорить активный сайт фермента, который участвует в синтезе холестерин.Белки представляют собой хиральные молекулы и очень чувствительны к стереохимии: так же, как перчатка для правой руки не поместится на вашей левой руке, белок, способный прочно связываться с ( R ) -талидомид, может вообще не связываться. к ( S ) -талидомид (это поможет просмотреть цветную версию рисунка ниже).
Вместо этого, похоже, что ( S ) -талидомид каким-то образом взаимодействует с белком, участвующим в развитии растущего плода, в конечном итоге вызывая наблюдаемые врожденные дефекты.
Рис. 5.5 Сайты связывания лекарств на белках стереоспецифичны.
Источник: www.kshitij-iitjee.com/Study/Chemistry/Part2/Chapter3/109.jpg
Безрецептурный болеутоляющий ибупрофен в настоящее время продается в виде рацемической смеси, но эффективен только энантиомер S .
К счастью, энантиомер R не вызывает каких-либо опасных побочных эффектов, хотя его присутствие, похоже, увеличивает количество времени, необходимое для ( S ) -ибупрофена, чтобы подействовать.
С помощью своего инструктора вы можете непосредственно ощутить биологическое значение стереоизомерии. Карвон – это хиральная молекула растительного происхождения, которая пахнет мятой в форме R и тмином (специя) в форме S .
Два энантиомера по-разному взаимодействуют с белками рецепторов обоняния в вашем носу, генерируя передачу различных химических сигналов в обонятельный центр вашего мозга.
(Вернуться к началу)
5.6 Распознавание общих органических функциональных групп
Число известных органических соединений довольно велико. Фактически, органических соединений известно во много раз больше, чем всех других (неорганических) соединений, открытых к настоящему времени, всего около 7 миллионов органических соединений. К счастью, органические химические вещества состоят из относительно небольшого числа схожих частей, объединенных по-разному, что позволяет нам предсказать, как соединение, которое мы никогда раньше не видели, может реагировать, сравнивая, как, как известно, реагируют другие молекулы, содержащие такие же типы частей.
Эти части органических молекул называются функциональными группами и состоят из определенных схем связи с атомами, наиболее часто встречающимися в органических молекулах (C, H, O, N, S и P). Идентификация функциональных групп и способность предсказывать реакционную способность на основе свойств функциональных групп является одним из краеугольных камней органической химии.
Функциональные группы – это определенные атомы, ионы или группы атомов, обладающие одинаковыми свойствами.Функциональная группа составляет часть более крупной молекулы.
Например, -ОН, гидроксильная группа, которая характеризует спирты, представляет собой кислород с присоединенным водородом. Его можно найти на любом количестве различных молекул.
Так же, как элементы обладают отличительными свойствами, функциональные группы имеют характерный химический состав. Функциональная группа -ОН в одной молекуле будет иметь тенденцию реагировать аналогично, хотя, возможно, и не идентично, с -ОН в другой молекуле.
Органические реакции обычно происходят в функциональной группе, поэтому изучение реакционной способности функциональных групп подготовит вас к пониманию многих других вещей об органической химии.
Функциональные группы – это структурные единицы в органических соединениях, которые определяются особыми связями между определенными атомами. Структура капсаицина, соединения, обсуждаемого в начале этой главы, включает несколько функциональных групп, обозначенных на рисунке ниже и объясненных в этом разделе.
По мере того, как мы прогрессируем в изучении органической химии, становится чрезвычайно важным иметь возможность быстро распознавать наиболее распространенные функциональные группы, потому что они являются ключевыми структурными элементами, которые определяют реакцию органических молекул .Пока мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению того, как различные функциональные группы ведут себя в органических реакциях. Ниже приводится краткое введение в основные органические функциональные группы.
(Вернуться к началу)
Алканы
«По умолчанию» в органической химии (по существу, не хватает каких-либо функциональных групп) дается термин алкан , характеризующийся одинарными связями между углеродом и углеродом или между углеродом и водородом.Метан, CH 4 , представляет собой природный газ, который вы можете сжигать в своей печи. Октан, C 8 H 18 , входит в состав бензина.
Алкены и алкины
Алкены (иногда называемые олефинами) имеют двойные углерод-углеродные связи, а алкины имеют тройные углерод-углеродные связи. Этен, простейший пример алкена, представляет собой газ, который служит клеточным сигналом в фруктах для стимулирования созревания.(Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком – яблоко выделяет газ этен (также называемый этиленом), запускающий процесс созревания бананов). Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
В главе 6 мы изучим природу связи алкенов и алкинов и узнаем, что связь в алкенах является плоской тригональной, а в алкинах – линейной. Кроме того, многие алкены могут принимать две геометрические формы: цис или транс .Формы цис и транс данного алкена представляют собой разные изомеры с разными физическими свойствами, потому что, как мы узнаем в главе 6, существует очень высокий энергетический барьер для вращения вокруг двойной связи. В приведенном ниже примере разница между алкенами цис и транс очевидна.
Алканы, алкены и алкины классифицируются как углеводородов , потому что они состоят исключительно из атомов углерода и водорода.Говорят, что алканы – это насыщенные углеводороды , потому что атомы углерода связаны с максимально возможным числом атомов водорода – другими словами, они насыщены атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньшее количество связанных с ними атомов водорода – поэтому они обозначаются как ненасыщенные углеводороды . Как мы увидим в более поздней главе, водород может быть добавлен к двойным и тройным связям в реакции, называемой «гидрирование».
(Вернуться к началу)
Ароматические углеводороды
Ароматическая группа представлена бензолом (который раньше был широко используемым растворителем в органической лаборатории, но оказался канцерогенным) и нафталином, соединением с характерным запахом «нафталина». Ароматические группы представляют собой плоские (плоские) кольцевые структуры и широко распространены в природе.
Когда углерод алкана связан с одним или несколькими галогенами, группа упоминается как алкилгалогенид или галогеналкан .Хлороформ является полезным растворителем в лаборатории и был одним из первых анестетиков, используемых в хирургии. Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогениды в биомолекулах встречаются довольно редко.
Спирты, фенолы и тиолы
В функциональной группе спирта углерод одинарно связан с группой ОН (группа ОН, когда она является частью более крупной молекулы, называется гидроксильной группой ).За исключением метанола, все спирты можно разделить на первичные, вторичные или третичные. В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа непосредственно связана с ароматическим кольцом, полученная группа называется фенолом . Серный аналог спирта называется тиолом (от греческого thio – сера).
Обратите внимание, что определение фенола гласит, что гидроксильный кислород должен быть , непосредственно, присоединенным к одному из атомов углерода ароматического кольца. Таким образом, указанное ниже соединение представляет собой , а не фенол – это первичный спирт.
Это различие важно, потому что, как мы увидим позже, существует значительная разница в реакционной способности спиртов и фенолов
(Вернуться к началу)
Эфиры и сульфиды
В функциональной группе эфира кислород связан с двумя атомами углерода.Ниже представлена структура диэтилового эфира, распространенного лабораторного растворителя, а также одного из первых соединений, которые будут использоваться в качестве анестетика во время операций. Серный аналог простого эфира называется тиоэфиром или сульфидом .
(Вернуться к началу)
Амины
Амины характеризуются атомами азота с одинарными связями с водородом и углеродом.Так же, как существуют первичные, вторичные и третичные спирты, существуют первичные, вторичные и третичные амины. Аммиак – это особый случай, когда нет атомов углерода.
Одним из наиболее важных свойств аминов является то, что они являются основными и легко протонируются с образованием катионов аммония. В случае, когда азот имеет четыре связи с углеродом (что несколько необычно для биомолекул), его называют ионом четвертичного аммония.
Примечание: вас не смущает то, как термины «первичный», «вторичный» и «третичный» применяются к спиртам и аминам – определения разные.В спиртах имеет значение, со сколькими другими атомами углерода связан углерод спирта , в то время как в аминах важно то, с каким количеством атомов углерода связан азот .
(Вернуться к началу)
Органические фосфаты
Фосфат и его производные функциональные группы повсеместно встречаются в биомолекулах. Фосфат, связанный с одной органической группой, называется сложным фосфатным эфиром ; когда он имеет две связи с органическими группами, он называется сложным диэфиром фосфата.Связь между двумя фосфатами создает фосфатный ангидрид.
Альдегиды и кетоныСуществует ряд функциональных групп, содержащих двойную связь углерод-кислород, которую обычно называют карбонилом . Кетоны и альдегиды представляют собой две тесно связанные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетоне атом углерода карбонила связан с двумя другими атомами углерода.В альдегиде , карбонильный углерод с одной стороны связан с водородом, а с другой стороны – с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
(Вернуться к началу)
Карбоновые кислоты и их производные
Когда карбонильный углерод связан с одной стороны с углеродом (или водородом), а с другой стороны с кислородом, азотом или серой, функциональная группа считается одним из «производных карбоновой кислоты», обозначение, которое описывает набор связанных функциональных групп.Основным членом этого семейства является функциональная группа карбоновой кислоты , в которой карбонил связан с гидроксильной группой. Форма карбоксилат-иона внесла в раствор H + . Другие производные – это сложные эфиры карбоновых кислот (обычно называемые просто «сложные эфиры»), тиоэфиры, амиды, ацилфосфаты, хлорангидриды и ангидриды кислот . За исключением хлорангидридов и ангидридов кислот, производные карбоновых кислот очень часто встречаются в биологических молекулах и / или метаболических путях, и их структура и реакционная способность будут обсуждаться более подробно в следующих главах.
Наконец, группа нитрила характеризуется тройной связью углерод-азот, как показано в структуре ацетонитрила.
Практика распознавания функциональных групп в молекулахОдно соединение часто содержит несколько функциональных групп, особенно в биологической органической химии. Например, шестиуглеродные молекулы сахара, глюкоза и фруктоза, содержат альдегидные и кетоновые группы соответственно, и обе содержат пять спиртовых групп.Соединение с несколькими спиртовыми группами часто упоминается как «полиол» .
Гормон тестостерон, аминокислота фенилаланин и дигидроксиацетонфосфат метаболита гликолиза содержат несколько функциональных групп, как указано ниже.
Хотя это ни в коем случае не полный список, этот раздел охватывает большинство важных функциональных групп, с которыми мы столкнемся в биохимии.Таблица 5.2 содержит сводку по всем группам, перечисленным в этом разделе.
Таблица 5.2 Общие органические функциональные группы Упражнение 5.6.1Укажите функциональные группы (кроме алканов) в следующих органических соединениях. Укажите, являются ли спирты и амины первичными, вторичными или третичными.
Упражнение 5.6.2Нарисуйте по одному примеру каждого соединения, подходящего к описанию ниже, используя линейные структуры.Обязательно укажите местонахождение всех ненулевых официальных сборов. Все атомы должны иметь полные октеты (фосфор может превышать правило октетов). На эти вопросы есть много возможных правильных ответов, поэтому обязательно проверьте свои конструкции у своего инструктора или репетитора.
a) соединение с молекулярной формулой C 6 H 11 NO, которое включает функциональные группы алкена, вторичного амина и первичного спирта
b) ион с молекулярной формулой C 3 H 5 O 6 P 2-, который включает альдегидные, вторичные спиртовые и фосфатные функциональные группы.
c) Соединение с молекулярной формулой C 6 H 9 NO, которое имеет амидную функциональную группу, а не имеет алкеновой группы.
(Вернуться к началу)
5.7 Краткий обзор номенклатуры органических продуктов
Международный союз теоретической и прикладной химии разработал систему (IUPAC, обычно произносится как eye -you-pack ) для обозначения органических соединений.Хотя система IUPAC удобна для обозначения относительно небольших простых органических соединений, она обычно не используется для обозначения биомолекул, которые, как правило, довольно большие и сложные. Тем не менее, неплохо (даже для биологов) ознакомиться с базовой структурой системы ИЮПАК и уметь рисовать простые структуры на основе их названий ИЮПАК.
Название органического соединения обычно начинается с определения того, что называется «родительской цепью» , которая представляет собой самую длинную прямую цепь из атомов углерода.Мы начнем с простейших структур алканов с прямой цепью. CH 4 называется метан , а C 2 H 6 этан . В таблице ниже приведены названия длинноцепочечных алканов: обязательно сохраните их в памяти, так как они являются основой для остальной части номенклатурной системы ИЮПАК (а также широко используются для наименования биомолекул).
Названия алканов с прямой цепью:1 углерод: метан
2 атома углерода: этан
3 атома углерода: пропан
4 атома углерода: бутан
5 атомов углерода: пентан
6 атомов углерода: гексан
7 атомов углерода: гептан
8 атомов углерода: октан
9 атомов углерода: нонан
10 атомов углерода: декан
Заместители, ответвляющиеся от основной родительской цепи, обозначены числом атомов углерода, при этом используется наименьшее возможное число (например, обратите внимание ниже, что соединение слева называется 1-хлорбутаном, а не 4-хлорбутаном).Когда заместителями являются небольшие алкильные группы, используются термины метил , этил и пропил .
Другие общие названия углеводородных заместителей включают изопропил, трет -бутил и фенил .
Обратите внимание, что в приведенном ниже примере «этильная группа» (выделена синим цветом) не рассматривается как заместитель, а скорее включается как часть родительской цепи, а метильная группа рассматривается как заместитель.Название ИЮПАК для углеводородов с прямой цепью всегда основано на самой длинной из возможных родительских цепей , которая в данном случае состоит из четырех атомов углерода, а не трех.
Циклические алканы называются циклопропаном, циклобутаном, циклопентаном, циклогексаном и т. Д .:
В случае нескольких заместителей используются префиксы di , tri и tetra .
Функциональные группы имеют характерные суффиксы.Спирты, например, имеют добавление « ol » к названию родительской цепи вместе с числом, обозначающим расположение гидроксильной группы. Кетоны обозначаются как « один ».
Алкены обозначаются окончанием «ен», и при необходимости указываются расположение и геометрия двойной связи. Соединения с кратными двойными связями называются диенами, триенами и т. Д.
Некоторые группы могут присутствовать только на концевом атоме углерода, и, таким образом, номер местоположения не требуется: альдегиды оканчиваются на «al», карбоновые кислоты – на «oic acid», а карбоксилаты – на «oate».
Простые эфиры и сульфиды обозначаются двумя группами по обе стороны от кислорода или серы.
Если амид имеет незамещенную группу –NH 2 , суффикс будет просто «амид». В случае замещенного амида группа, присоединенная к амидному азоту, названа первой вместе с буквой « N », чтобы пояснить, где находится эта группа. Обратите внимание, что обе структуры, представленные ниже, основаны на трехуглеродной (пропановой) родительской цепи.
Для сложных эфиров суффикс – «оат». Группа, связанная с кислородом, называется первой.
Все примеры, которые мы видели до сих пор, были простыми в том смысле, что в каждой молекуле присутствовала только одна функциональная группа. Конечно, в системе ИЮПАК гораздо больше правил, и, как вы можете себе представить, присвоение ИЮПАК имен более крупных молекул с множеством функциональных групп, кольцевых структур и заместителей может очень быстро стать очень громоздким.Незаконный наркотический кокаин, например, имеет название ИЮПАК «метил (1 R , 2 R , 3 S , 5 S ) -3- (бензоилокси) -8-метил-8-азабицикло [ 3.2.1] октан-2-карбоксилат »(это название включает обозначения для стереохимии).
Вы можете понять, почему система IUPAC не так часто используется в биохимии – молекулы слишком большие и сложные. Еще одна сложность заключается в том, что даже вне биологического контекста многие простые органические молекулы известны почти повсеместно под их «общим названием», а не именами ИЮПАК.Соединения уксусной кислоты, хлороформа и ацетона – лишь несколько примеров.
В биохимии обычно используются несистематические названия (например, «кокаин», «капсаицин», «пируват» или «аскорбиновая кислота»), а когда используется систематическая номенклатура, она часто специфична для рассматриваемого класса молекулы: разные системы имеют эволюционировали, например, для жиров и углеводов. В этом тексте мы не будем особо сосредотачиваться на номенклатуре ИЮПАК или любой другой номенклатурной системе, но если вы предпримете более углубленное исследование в области органической или биологической химии, вы можете ожидать более детального изучения одной или нескольких систем именования.
(Вернуться к началу)Артикул:
Материалы Главы 5 были адаптированы и изменены из следующих ресурсов Creative Commons, если не указано иное:
1. Викиучебники. (2015) Органическая химия. Доступно по адресу: https://en.wikibooks.org/wiki/Organic_Chemistry.
2. Кларк, Дж. (2014) Как рисовать органические молекулы. Доступно по адресу: http://chem.libretexts.org/Core/Organic_Chemistry/Fundamentals/How_to_Draw_Organic_Molecules
3.Содерберг, Т.
(2016).
Органическая химия с акцентом на биологию. Опубликовано по лицензии Creative Commons by-NC-sa 3.0.
4. Аноним. (2012) Введение в химию: общие, органические и биологические (V1.0). Опубликовано по лицензии Creative Commons by-NC-sa 3.0. Доступно по адресу: http://2012books.lardbucket.org/books/introduction-to-chemistry-general-organic-and-biological/index.html
.

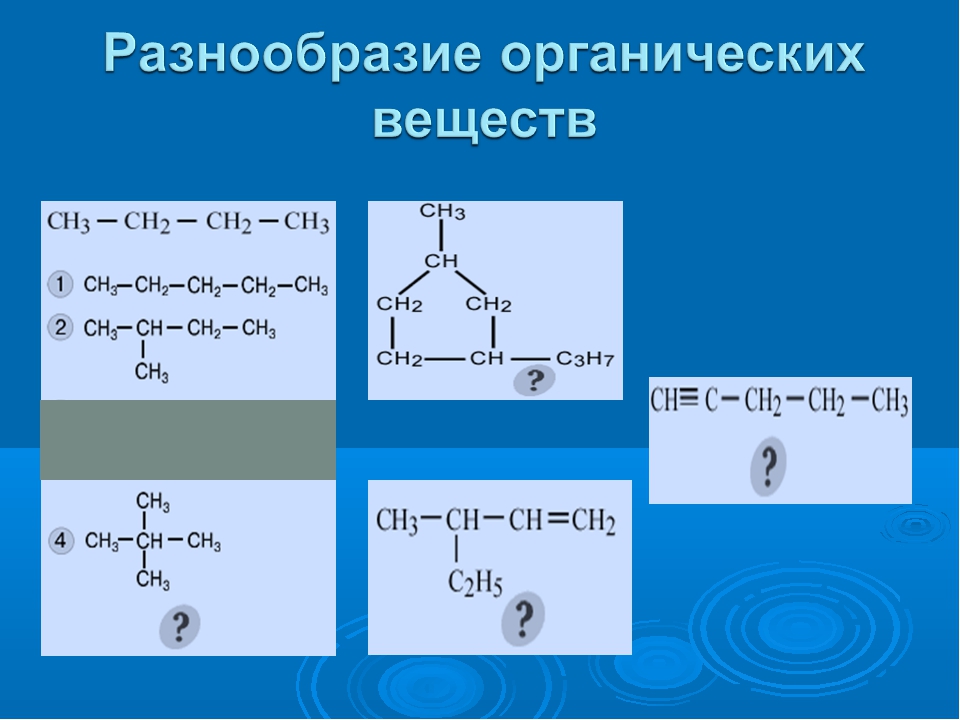 03.01 «Химия», профиль «Фундаментальная и прикладная химия»;
03.01 «Химия», профиль «Фундаментальная и прикладная химия»; J. Coord. Chem., 2019, vol. 72, no. 2, P. 347–357.
J. Coord. Chem., 2019, vol. 72, no. 2, P. 347–357.