Уравнение идеального газа формула – Формула идеального газа
- Уравнение состояния идеального газа | Все формулы
- Уравнение состояния идеального газа. Газовые законы.
- Уравнение состояния идеального газа Менделеева-Клапейрона с выводом
- Уравнение состояния идеального газа – Класс!ная физика
- § 27. Уравнение состояния идеального газа.
- Уравнение состояния идеального газа в физике
- 3.Уравнение состояния идеального газа.
Уравнение состояния идеального газа | Все формулы
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
где
- — давление,
- — молярный объём,
- — универсальная газовая постоянная
- — абсолютная температура,К.
Так как , где—количество вещества, а , где— масса,—молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
— закон Бойля — Мариотта.
— Закон Гей-Люссака.
— закон
1 Объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
— закон Бойля — Мариотта. Закон Бойля — Мариотта назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году. В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где —показатель адиабаты, — внутренняя энергия единицы массы вещества.Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. И это обстоятельство может быть прояснено на основании молекулярных представлений.С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки. С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведениеувеличивается.
xn--b1agsdjmeuf9e.xn--p1ai
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). | |
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние. В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул. |
|
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m. Мы знаем, что . Следовательно, . Учитывая, что , получим: . |
|
Произведение постоянных величин есть величина постоянная, следовательно: – универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая). | |
Таким образом, имеем: – уравнение состояния (уравнение Менделеева – Клапейрона). | |
Другие формы записи уравнения состояния идеального газа. | |
1.Уравнение для 1 моля вещества. Если n=1 моль, то, обозначив объем одного моля Vм, получим: . Для нормальных условий получим: | |
2. Запись уравнения через плотность: – плотность зависит от температуры и давления! | |
3. Уравнение Клапейрона. Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда: |
|
Эта запись означает, что для данной массы данного газа справедливо равенство: |
|
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: . | |
Газовые законы. | |
1. Закон Авогадро. В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов). Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn |
|
Доказательство:
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково. |
|
2. Закон Дальтона. Давление смеси газов равно сумме парциальных (частных) давлений каждого газа. Доказать: p=p1+p2+…+pn Доказательство: |
|
Давление, производимое на жидкость или газ, передается во все стороны без изменения. |
|
www.eduspb.com
Уравнение состояния идеального газа Менделеева-Клапейрона с выводом
Уравнение состояния идеального газа показывает корреляцию его основных макропараметров, а именно: объема V, давления P, а также температуры T.
P – давление [Па]
V- объем [м3]
ν – количество вещества [моль]
R – универсальная газовая постоянная, 8,31 [Дж/(моль · К)]
T – температура [K]
Данную формулу также называют уравнением Менделеева-Клапейрона для идеального газа в честь двух ученых впервые получившего (Бенуа Клапейрон (1799 – 1864)) и применившего (Дмитрий Иванович Менделеев (1834 – 1907)) его.
Вывод уравнения Менделеева-Клапейрона
Давление идеального газа зависит от концентрации частиц и температуры тела:
n – концентрация частиц [м-3]
k – константа Больцмана k = 1,38 · 10-23 [Дж/К]
Т – абсолютная температура, в кельвинах [К]
Возьмем основное уравнение МКТ, выведенное через кинетическую энергию:
Подставим nkT вместо давления и выразим кинетическую энергию:
Концентрация частиц газа n равна:
N – число молекул газа в емкости объемом V [м3]. N также можно представить как произведение количества вещества ν и числа Авогадро NA:
Подставим эти величины в уравнение давления идеального газа (p=nkT):
Произведение числа Авогадро NA и константы Больцмана k дает универсальную газовую постоянную R, которая равна 8,31 [Дж/(моль · К)]. Используя это, упростим уравнение давления и получим искомое уравнение состояния идеального газа:
Учитывая, что количество вещества ν также можно определить, если известны масса вещества m и его молярная масса M:
можно привести уравнение к следующему виду:
Частными случаями уравнения являются газовые законы, описывающие изопроцессы в идеальных газах, т.е. процессы, при которых один из макропараметров (T, P, V) в закрытой изолированной системе постоянный. Всего этих частных случаев 3.
Закон Бойля-Мариотта – изотермический процесс
Проходит при постоянной температуре: T= const.
P·V = const, то есть для конкретного вещества произведение давления на объем остается постоянным:
P1·V1 = P2·V2.
Закон Гей-Люссака – изобарный процесс
Проходит при постоянном давлении: P = const.
V/T = const, то есть для конкретного вещества отношение объема и температуры остается постоянным:
V1/T1 = V2/T2.
Закон Шарля – изобарный процесс
Проходит при постоянном объеме: V = const.
P/T = const, то есть для конкретного вещества отношение давления и температуры остается постоянным:
P1/T1 = P2/T2.
Понравилась статья, расскажите о ней друзьям:
Скорее всего, Вам будет интересно:
people-ask.ru
Уравнение состояния идеального газа – Класс!ная физика
Уравнение состояния идеального газа
«Физика – 10 класс»
В этой главе речь пойдёт о следствиях, которые можно извлечь из понятия температуры и других макроскопических параметров. Основное уравнение молекулярнокинетической теории газов вплотную приблизило нас к установлению связей между этими параметрами.
Как можно рассчитать массу воздуха в кабинете физики?
Какие параметры воздуха будут необходимы для определения этой массы?
Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу (9.17)).
На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра р, V и Т, характеризующие состояние идеального газа данной массы.
Формулой (9.17) можно пользоваться только до давления порядка 10 атм.
Уравнение, связывающее три макроскопических параметра р, V и Т, называют уравнением состояния идеального газа.
Подставим в уравнение р = nkT выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:
где NA — постоянная Авогадро, m — масса газа, М — его молярная масса. После подстановки формулы (10.1) в выражение (9.17) будем иметь
Произведение постоянной Больцмана k и постоянной Авогадро NA называют универсальной (молярной) газовой постоянной и обозначают буквой R:
R = kNA = 1,38 • 10-23 Дж/К • 6,02 • 1023 1/моль = 8,31 Дж/(моль • К). (10.3)
Подставляя в уравнение (10.2) вместо kNA универсальную газовую постоянную R, получаем уравнение состояния идеального газа произвольной массы
Единственная величина в этом уравнении, зависящая от рода газа, — это его молярная масса.
Из уравнения состояния вытекает связь между давлением, объёмом и температурой идеального газа, который может находиться в двух любых состояниях.
Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 — параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы
Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:
Известно, что один моль любого газа при нормальных условиях (р0 = 1 атм = 1,013 • 105 Па, t = 0 °С или Т = 273 К) занимает объём 22,4 л. Для одного моля газа, согласно соотношению (10.5), запишем:
Мы получили значение универсальной газовой постоянной R.
Таким образом, для одного моля любого газа
Уравнение состояния в форме (10.4) было впервые получено великим русским учёным Д. И. Менделеевым. Его называют уравнением Менделеева—Клапейрона.
Уравнение состояния в форме (10.5) называется уравнением Клапейрона и представляет собой одну из форм записи уравнения состояния.
Б. Клапейрон в течение 10 лет работал в России профессором в институте путей сообщения. Вернувшись во Францию, участвовал в постройке многих железных дорог и составил множество проектов по постройке мостов и дорог.
Его имя внесено в список величайших учёных Франции, помещённый на первом этаже Эйфелевой башни.
Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной:
R = 8,31 Дж/(моль • К).
До сих пор мы говорили о давлении идеального газа. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов, которые при определённых условиях можно считать идеальными.
Самый важный пример смеси газов — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. Чему же равно давление смеси газов?
Для смеси газов справедлив закон Дальтона.
Закон Дальтона
Давление смеси химически невзаимодействующих газов равно сумме (ЦЩй их парциальных давлений
p = p1 + p2 + … + pi + … .
где рi — парциальное давление i-й компоненты смеси.
Источник: «Физика – 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления – Физика, учебник для 10 класса – Класс!ная физика
Почему тепловые явления изучаются в молекулярной физике — Основные положения молекулярно-кинетической теории. Размеры молекул — Примеры решения задач по теме «Основные положения МКТ» — Броуновское движение — Силы взаимодействия молекул. Строение газообразных, жидких и твёрдых тел — Идеальный газ в МКТ. Среднее значение квадрата скорости молекул — Основное уравнение молекулярно-кинетической теории газов — Примеры решения задач по теме «Основное уравнение молекулярно-кинетической теории» — Температура и тепловое равновесие — Определение температуры. Энергия теплового движения молекул — Абсолютная температура. Температура — мера средней кинетической энергии молекул — Измерение скоростей молекул газа — Примеры решения задач по теме «Энергия теплового движения молекул» — Уравнение состояния идеального газа — Примеры решения задач по теме «Уравнение состояния идеального газа» — Газовые законы — Примеры решения задач по теме «Газовые законы» — Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»
class-fizika.ru
§ 27. Уравнение состояния идеального газа.
Определение:Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые собственные размеры.
Определение:Уравнением Клайперона
называется соотношение, справедливое
для постоянной массы идеального газа:  .
.
Определение:Молярной массой любого тела называется физическая величина, равная отношению массы тела к количеству молей, которое в нём содержится: = m/, = m/ ; = 10 –3 m/mo , где m масса молекулы данного тела, mo масса одной двенадцатой массы атома углерода.
Определение:Молярным объёмом называется физическая величина, равная отношению объёма газа к числу молей, содержащихся в газе: V =V/ .
Уравнение состояния идеального газа одного моля p V = R T.
Rуниверсальная газовая постояннаяR = 8,31 Дж/(K моль).
Определение:Уравнением
МенделееваКлайперона
называется соотношение, справедливое
для любого идеального газа: 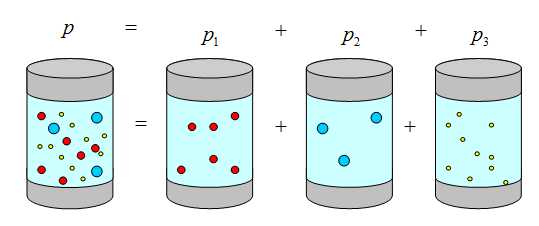 .
.
Постоянная Больцмана .
Использование постоянной Больцмана, молярного объёма в уравнении МенделееваКлайперона приведёт к следующему результату:эта формула также является уравнением состояния идеального газа, гдеn0концентрация молекул идеального газа, т.е. их число в единице объёма. Применяя формулу плотности вещества получим ещё один вариант уравнения состояния идеального газа:
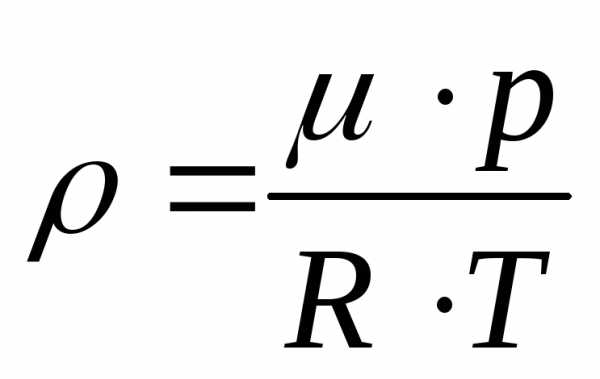 .
.
§ 28. Основное уравнение кинетической энергии газов.
Определение:Основным уравнение кинетической
энергии газов есть соотношение: 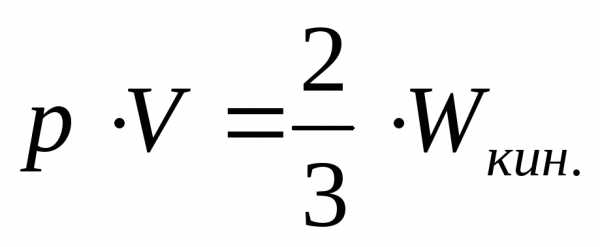 .
.
Это уравнение выполняется при N = constобщее число молекул в газе, то есть при отсутствии химических реакций; газ может состоять из разнородных молекул.
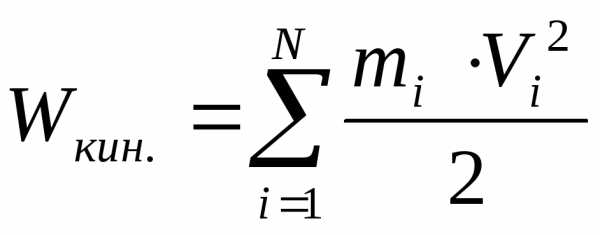 суммарная энергия поступательного
движения молекул газа, находящихся в
сосуде, гдеmiмасса, аViскорость«i ой» молекулы.
суммарная энергия поступательного
движения молекул газа, находящихся в
сосуде, гдеmiмасса, аViскорость«i ой» молекулы.
Для однородного газа mi=mo, тогда .
.
Введём
средне квадратичную скорость Vквадр.поступательного движения молекул
газа: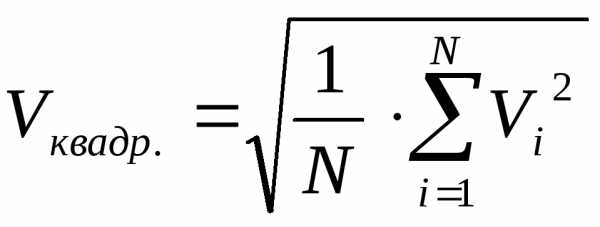 .
.
Тогда
Подставим данный результат в основное уравнение кинетической теории газов
(*),mмасса всего газа.
Сопоставим полученный результат с уравнением МенделееваКлайперона:
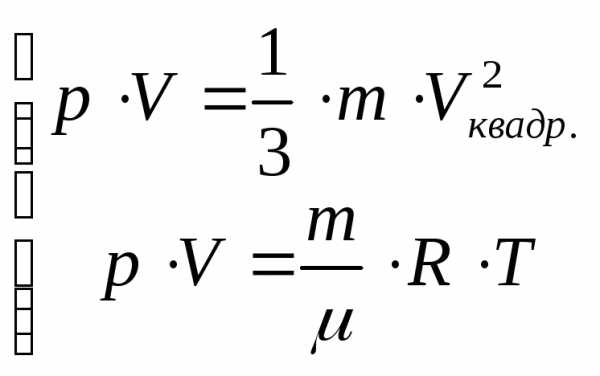 ,
здесь использовалось полезное соотношение:
,
здесь использовалось полезное соотношение: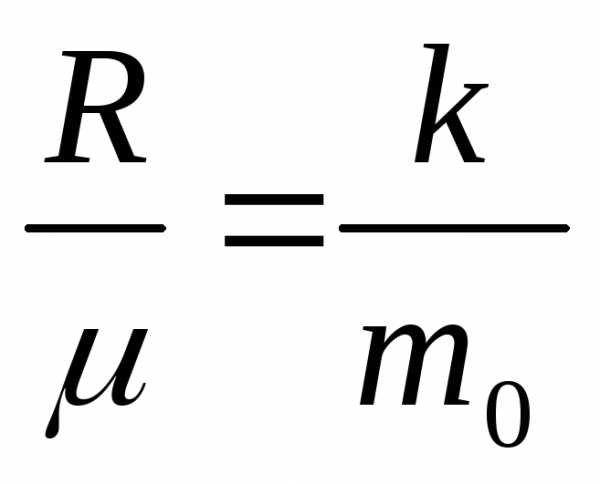 .
.
Связь давления, плотности газа и средней
квадратичной скорости следует (*): 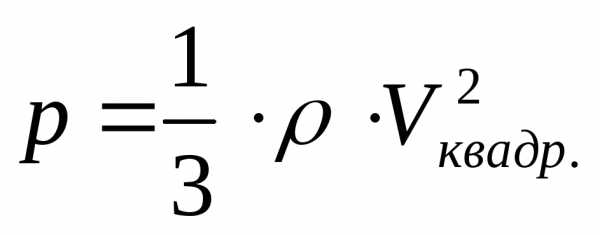
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
.
После подстановки явного выражения для
средней квадратичной скорости, получим:  .
.
§ 29. Закон распределения молекул идеального газа по скоростям Максвелла.
Закон распределения молекул идеального газа по скоростям определяет долевое участие молекул однородного газа в тепловом движении при данной температуре со скоростями, заключёнными в интервале от V доV +V. Он выведен теоретически:,
где nчисло молекул в единице объёма (концентрация молекул),
n число молекул из общего их числа, скорости которых лежат в интервале скоростей:,
m0масса одной молекулы,
kпостоянная Больцмана,
Tтемпература газа.
Чем меньше по величине выбирается интервал скоростей, тем более точный результат даёт данная формула.
Nв единицу объёма, которые[,+]
Графическая иллюстрация данной формулы приведена на графике зависимости относительной концентрации молекул n/Vидеального однородного газа от скорости
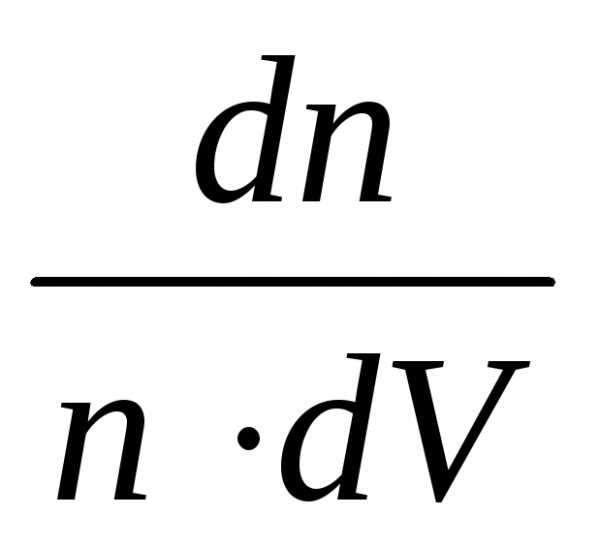





Функцией распределения молекул идеального газа по скоростям Максвелла называется выражение:
.
С помощью этой функции можно найти все статистически необходимые величины, характеризующие состояние идеального газа.
Вначале найдём наивероятнейшую скорость, т.е. значение скорости, соответствующее максимуму функции Максвелла. С точки зрения физики это такое значение скорости, к которому близки значения скорости большей части молекул. Воспользуемся методом нахождения экстремума функции, т.е. вначале возьмём производную от функции распределения Максвелла по скорости, а затем приравняем полученное выражение к нулю:
.
Последнее уравнение имеет три решения, т.к. необходимо равенство нулю каждого из множителей:
1. это не физический случай;
2. 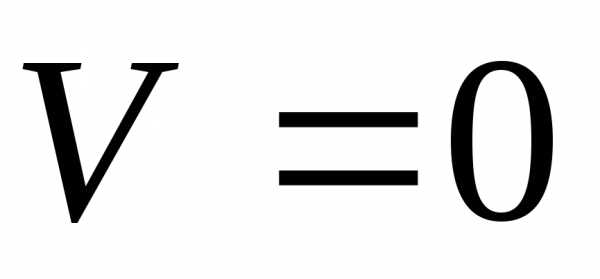 тривиальный случай;
тривиальный случай;
3.
Средне квадратичную и средне арифметическую скорости находятся интегрированием:
,.
studfiles.net
Уравнение состояния идеального газа в физике
Молекулы свободно движутся и лишь иногда сталкиваются между собой и со стенками сосуда, в котором находятся. Это значит, что в таком газе можно пренебречь потенциальной энергией его молекул в сравнении с кинетической. Газы можно считать идеальными с достаточной степенью точности в тех случаях, когда рассматриваются их состояния, далекие от областей фазовых превращений.
Уравнение состояния идеального газа
Параметры, с помощью которых описывают состояние идеального газа, как макросистемы это давление (p), объем (V), температура по шкале Кельвина (T). Очевидно, что уравнение, которое их связывает, является очень значимым с точки зрения теории и практики. Называется оно уравнением состояния идеального газа (иногда просто уравнением идеального газа):
где Дж/К – постоянная Больцмана,
n- число молекул в единице объема газа ( концентрация частиц вещества), N — число его молекул в заданном объеме.
Уравнению (1) можно придать известную форму уравнения Клапейрона (Надо отметить, что от изменения формы записи уравнения (2), (3) не перестают быть уравнениями состояния идеального газа):
или
где — количество молей газа, R=8,3 Дж/(моль•К) – молярная (универсальная) газовая постоянная, ( моль-1 (постоянная Авогадро)), – молярная масса газа, – плотность газа.
Уравнение состояния для смеси газов
Если газ представляет собой смесь газов, то уравнение (состояния) идеального газа принимает вид:
где число молей i-го компонента смеси.
Для произвольной массы газа (m) с молярной массой уравнение (состояния) идеального газа имеет вид:
Это уравнение называют уравнением Менделеева – Клапейрон и оно, опять таки, является уравнением идеального газа, точнее одной из форм записи этого уравнения.
Примеры решения задач
ru.solverbook.com
3.Уравнение состояния идеального газа.
В любом из равновесных состояний параметры Р, Т и Vтермодинамической системы (т.е. газа, жидкости или твердого тела), как показывает опыт, закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Функциональная связь между давлением, объемом и температурой
f(P,V,N) = 0 (1)
называется уравнением состояния вещества. Если разрешить (1) относительно какого-либо из параметров, например, Р, то уравнение состояния примет вид
Р = Р(V, Т). (2)
Опыт показывает, что для жидкости и твердых тел характер зависимости Р = Р(V, Т) крайне индивидуален. Иначе обстоит дело в случае разреженных газов. Все достаточно разреженные газы подчиняются одному и тому же уравнению состояния –уравнению Клапейрона-Менделеева, которое может быть установлено, как на основе известных опытных газовых законов Бойля-Мариотта (РV = constдля данной массы газа), Гей-Люсака [Vt = V0 (1 + t)для постоянных массы и давлении газа] и Авогадро (при одинаковых Т и Р в равных объемах любого газа содержится одинаковое число молекул), так и на основе молекулярно-кинетической теории строения вещества. Это уравнение имеет вид
PV=MRT/(3)
или P=MRT/V=RT/,
где М – масса газа, - молярная масса,R– газовая постоянная,R=8,31 Дж/мольК,- плотность газа.
Отношение Z= М/- число молей газа. Тогда
PV=ZRT(4)
В случае газовой смеси величина Zв уравнении (4) равна полному числу молей всех газов, входящих в смесь
Z = Z1 + Z2 +….+ Zn= М1/1+ М2/2+ …+ Мn/n(5)
где М1, М2, …,Мn– массы отдельных газов, а1,2, …n– молярные массы этих газов.
Реальные газы подчиняются уравнению Клапейрона-Менделеева лишь приближенно – при достаточно низких давлениях и высоких температурах. При больших же Р и низких Т у всех газов наблюдаются отклонения от этого уравнения. Газ, который вполне точно подчиняется уравнению Клапейрона-Менделеева, в термодинамике называют идеальным газом. Такого газа в действительности нет, он является некоторой абстракцией, носвойства всех реальных газов приближаются к свойствам идеального газа при малых давлениях. Любой газ в пределе при Р0 неотличим от идеального. Большинство газов уже при атмосферном давлении и комнатной Т близки к идеальному.
Преобразуем (3). Обозначив массу одной молекулы через m, будем иметь М =mNи=mNА, гдеN– общее число молекул газа, аNА– число Авогадро. Тогда (3) можно записать в виде
PV = NRT/NA,
но отношение k=R/NA=1,3810-23Дж/К – постоянная Больцмана. Тогда
PV=NkT(6)
В виде (6) уравнение состояния справедливо независимо от того имеем мы дело с химически однородным газом или с произвольной смесью, т.к. оно совершенно не зависит от химической природы газа.
Выражая из (6) Р, получим
Р = NkT/V, ноN/V=n– число молекул в единице объема газа, тогда
P=nkT(7)
т.е. давление газа зависит только от его температуры и числа молекул в единице объема газа.
4. Барометрическая формула и распределение больцмана.
Если на молекулы газа не действуют никакие внешние силы, то вследствие теплового движения они равномерно распределяются по всему объему сосуда, так что в каждой единице объема содержится в среднем одинаковое число молекул. При одинаковой во всех частях объема температуре в газе устанавливается всюду одинаковое давление Р = nkT = const (в соответствии с законом Паскаля).
Иначе обстоит дело, когда газ находится в некотором силовом поле, в котором на каждую частицу газа действует внешняя сила, толкающая ее в определенном направлении. Под действием такой силы молекулы будут собираться преимущественно в тех областях пространства, куда их заталкивают внешние силы, и там концентрация частиц, а значит, и давление газа будут возрастать. Т.е. действие внешних сил на молекулы газа противоположно тому действию, которое оказывает на них беспорядочное тепловое движение.
В результате одновременного действия внешних сил и теплового движения молекул в газе при заданной температуре устанавливается некоторое неравномерное распределение молекул в пространстве, не изменяемое во времени. Это значит, что при действии внешних сил плотность идеального газа, находящегося в равновесных условиях, будет различной в различных местах пространства, т.е. она будет некоторой функцией координат
n= n(X,Y,Z).
Примером внешних сил является поле силы тяжести, а примером газа в таком силовом поле является земная атмосфера. Молекулы газов, составляющие атмосферный воздух, под влиянием теплового движения рассеялись бы в мировом пространстве, если бы отсутствовала сила тяжести. Напротив, если бы отсутствовало тепловое движение молекул, то под действием силы тяжести все молекулы воздуха упали бы на землю, и весь воздух собрался бы тончайшим слоем у поверхности Земли. Таким образом, само существование атмосферы является результатом одновременного действия силы притяжения молекул к Земле и их теплового движения. При этом в атмосфере устанавливается некоторое неравномерное распределение молекул воздуха по высоте. Соответственно этому распределению молекул устанавливается и определенный закон изменения давления с высотой.
Если бы земная атмосфера находилась в состоянии теплового равновесия, т.е. температура атмосферы была бы одинаковой на всех высотах, то в ней бы установилось так называемое барометрическое распределение плотности и давления с высотой.
Для определения барометрического закона изменения давления и плотности идеального газа с высотой рассмотрим вертикальный столб газа с площадью поперечного сечения S= 1, находящийся при постоянной температуре, рис.1.
Z
dZ P-dP
Z P
0 P0
Х
Рис.1.
Обозначим давление газа на некотором нулевом уровне Z= 0 (уровне моря, поверхности земли, дне сосуда и т.д.) через Р0, а давление на высотеZнад нулувым уровнем через Р. При увеличении высоты наdZдавление газа уменьшится на некоторую величинуdР. Это уменьшение давления равно весу столба газа высотойdZс площадью основанияS= 1
dP = – g dZ, (1)
где – - плотность газа. На основании уравнения состояния идеального газа, его плотностьравна
= P/RT(2)
Следовательно,
dP = – (P/RT)g dZ,
откуда
dP/P = – (/RT)g dZ.
Интегрируя это выражение, находим
р z
dP/P = – /R g dZ/Т
p0 0
или z
ln P/P0 = – /R g dZ/Т (3)
0
На небольших высотах над поверхностью земли ускорение силы тяжести gможно считать постоянным, не зависящим от высотыZ, и вынести его за знак интеграла. Кроме тего, если газ находится в тепловом равновесии при постоянной, не зависящей от высотыZтемпературе Т, то и Т можно вынести за знак интеграла. В этом случае получим
ln P/P0 = – gZ/RT,
откуда
Р/Р0=е – gZ/RT
или
Р = Р0 е – gZ/RT. (4)
Формула (4) характеризует изменение давления газа с высотой и называетсябарометрической формулой. Она показывает, что давление газа с высотой убывает по экспоненциальному закону. Характер этого убывания графически можно представить следующим образом, рис.2. Р
Р0
Z
Рис.2.
Прибор для определения высоты над земной поверхностью называется высотомером (илиальтиметром). Принцип его действия основан на использовании формулы (4). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Принимая во внимание, что =mNAиR=kNA, мы можем переписать барометрическую формулу в виде
Р = Р0 е – mgZ/ kT.
Так как P=nkT, то эта барометрическая формула выражает такжезакон убывания плотности газа с высотой
n = n0 е – mgZ/ kT (5)
где nиn0– числа молекул в единице объема газа в точках, разность высот между которыми равнаZ. Ввиду чрезвычайно малой массы газовых молекул убывание плотности газа и его давления заметно только при значительных изменениях высоты. В случае небольшого изменения высоты изменение давления и плотности газа оказываются весьма малыми. Поэтому в случае газа, заключенного в сосуд небольшой высоты, действием силы тяжести на молекулы газа можно пренебречь. Поскольку температура атмосферы Земли не постоянна и изменяется с высотой, то для более точного описания изменений ее давления и плотности с высотой в формулы (4) и (5) необходимо вводить соответствующие поправки на изменение температуры.
Поскольку входящая в формулу (5) величина mgZпредставляет собой потенциальную энергию молекул в поле тяготения, то эту формулу можно переписать в виде
n = n0 е – U(Z) /kT (6)
т.е. она выражает закон распределения молекул идеального газа по величине их потенциальной энергии в поле тяготения. Причем величина n0имеет смысл числа частиц с потенциальной энергией равной нулю(n = n0 при U = 0).
В середине 19 века Больцман показал, что для идеального газа, находящегося влюбом силовом поле, число частиц, обладающих заданной потенциальной энергиейU, определяется формулой, имеющей тот же вид, что и формула (6). Поскольку, в произвольном силовом поле потенциальная энергия частицы может зависеть от всех трех координат, характеризующих ее положение в пространстве, а не только от одной, как это имело место в частном случае поля тяготения, т.е.n=n(X,Y,Z) и соответственно этомуU=U(X,Y,Z). Таким образом, в любом силовом поле распределение частиц в пространстве выражается законом
n(X,Y,Z) = n0 е – U(X,Y,Z) / kT – закон Больцмана (7)
где U(X,Y,Z) – потенциальная энергия частиц во внешнем силовом поле, зависящая от координат той точки, в которой находится частица;n(X,Y,Z) – концентрация частиц в точке с координатамиX,Y,Z;n0– число частиц в единице объема (концентрация) в том месте пространства, где их потенциальная энергия равна 0.
Больцман показал, что при постоянной Т концентрация частиц убывает с ростом Uи возрастает с убываниемU, т.е.частицы концентрируются преимущественно в местах с меньшей потенциальной энергией.
Закон Больцмана (8) является весьма общим законом, применимым не только к идеальному газу, но и ко многим другим системам невзаимодействующих частиц.
studfiles.net
