20 элементов таблицы менделеева – Список химических элементов — Википедия
- Комментариев к записи 20 элементов таблицы менделеева – Список химических элементов — Википедия нет
- Советы абитуриенту
То, что сейчас преподносят в школах и университетах под названием “Периодическая система химических элементов Д.И. Менделеева”,— откровенная ф а л ь ш и в к а . Последний раз в неискаженном виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник “Основы химии”, VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации настоящей диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева – сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован. Главное искажение Таблицы – перенос “нулевой группы” Таблицы в её конец, вправо, и введение т.н. “периодов”. Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент “Х” (по Менделееву — “Ньютоний”),— т.е. мировой эфир. Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент “Х” есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву. Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву. “… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород. Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через “y”. Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … “Короний”, плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром. Этот элемент “у”, однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу “х”, который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его “Ньютонием” — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом” (“Попытка химического понимания мирового эфира”. 1905 г., стр. 27). “Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше (!!! — В.Родионов) элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов. Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением. Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …” (“Основы химии”. VIII изд., 1906 г., стр. 613 и след.). http://www.glubinnaya.info/science/mendeleev/mendeleevtable.htm | |||||||||||
rekshino.com
Таблица Д.И. Менделеева – Презентации по физике
При решении задач по молекулярной физике, на сохранение зарядового и массового чисел в атомных реакциях без молярной массы не обойтись! Если у Вас в решении задач требуется молярная масса, загляните в таблицу Менделеева. Не забудьте, что молярная масса в решении физических задач должна быть выражена в кг/моль. Это значит, что к округленному числу молярной (атомной) массы необходимо добавить 10-3 и тогда значение физической величины будет соответствовать Системе Интернациональной (СИ).
Кликните мышью по таблице для открытия интерактивной таблицы Д.И. Менделеева
Ранее в 2011 году IUPAC признал за коллаборацией ОИЯИ с LLNL (США) приоритет в открытии 114 и 116 элементов, которые получили названия: 114 элемент ― Flerovium, Fl; 116 элемент ― Livermorium, Lv.
Флеровий ― в честь Лаборатории ядерных реакций им. Г.Н.Флерова ОИЯИ, являющейся признанным лидером в области синтеза сверхтяжелых элементов, и ее основателя выдающегося физика академика Г.Н.Флерова (1913−1990) ― автора открытия нового вида радиоактивности спонтанного деления тяжелых ядер, основоположника ряда новых научных направлений, основателя и первого директора ЛЯР ОИЯИ, которая сейчас носит его имя.
Ливерморий ― в честь Ливерморской национальной лаборатории им. Лоуренса и места ее расположения ― города Ливермор (штат Калифорния, США). Ученые Ливермора уже более 20-ти лет участвуют в проводимых в Дубне экспериментах по синтезу новых элементов.
В целом решение IUPAC является признанием выдающегося вклада ученых ОИЯИ в открытие «острова стабильности» сверхтяжелых элементов, что является одним из важнейших достижений современной ядерной физики.
История открытия таблицы Менделеева
В своей работе Д.И. Менделеев опирался на труды Роберта Бойле и Антуана Лавузье. Первый ученый ратовал за поиск неразложимых химических элементов. 15 из таковых Бойле перечислил еще в 1668-ом году.
Таблица периодических химических элементов стала одним из важнейших событий в истории науки и принесла своему создателю, российскому ученому Дмитрию Менделееву, мировую славу. Этот неординарный человек сумел объединить в единую концепцию все химические элементы, но как же ему удалось открыть свою знаменитую таблицу?
К середине 19 века ученым удалось открыть шестьдесят три химических элемента, однако выстроить из них стройную логическую цепочку никак не получалось. Элементы планировалось разместить по порядку возрастания атомной массы и разделить по сходству химических свойств на группы.Впервые свою теорию, схожую с будущей теорией Менделеева, предложил музыкант и химик Джон Александр Ньюленд – однако научное сообщество проигнорировало его достижение. Предложение Ньюленда не приняли всерьез из-за его поисков гармонии и связи между музыкой и химией.
Дмитрий Менделеев впервые опубликовал свою периодическую таблицу в 1869 году на страницах журнала Русского химического общества. Также ученый разослал извещения о своем открытии всем ведущим мировым химикам, после чего он неоднократно улучшал и дорабатывал таблицу, пока она не стала такой, какой ее знают сегодня. Суть открытия Дмитрия Менделеева заключалась в периодическом, а не монотонном изменении химических свойств элементов с ростом атомной массы. Окончательное объединение теории в периодический закон произошло в 1871 году.
Таблица Менделеева началась с книги «Соотношение свойств с атомным весом элементов». Труд выпущен в 1870-ых. Тогда же русский ученый выступил перед химическим обществом страны и разослал первый вариант таблицы коллегам из-за рубежа.
До Менделеева разными учеными были открыты 63 элемента. Наш соотечественник начал со сравнения их свойств. В первую очередь, работал с калием и хлором. Потом, взялся за группу металлов щелочной группы.
Химик обзавелся специальным столом и карточками элементов, чтобы раскладывать их, как пасьянс, ища нужные совпадения и комбинации. В итоге, пришло прозрение: — свойства компонентов зависят от массы их атомов. Так, элементы таблицы Менделеева выстроились в ряды.
Находкой маэстро химии стало решение оставить в этих рядах пустоты. Периодичность перепада между атомными массами заставила ученого предположить, что человечеству известны еще не все элементы. Промежутки в весе между некоторыми «соседями» были слишком велики.

Поэтому, периодическая таблица Менделеева стала похожа на шахматное поле, с обилием «белых» клеток. Время показало, что они, действительно, ждали своих «постояльцев». Ими, к примеру, стали инертные газы. Гелий, неон, аргон, криптон, радиоакт и ксенон открыты лишь в 30-ых годах 20-го века.
Теперь о мифах. Распространено мнение, что химическая таблица Менделеева явилась ему во сне. Это происки университетских педагогов, точнее, одного из них – Александра Иностранцева. Это русский геолог, читавший лекции в Петербургском университете горного дела. Иностранцев был знаком с Менделеевым, бывал у него в гостях. Однажды, изможденный поисками Дмитрий заснул прямо при Александе. Тот дождался, пока химик проснется и увидел, как Менделеев хватается за листок и записывает окончательный вариант таблицы. По сути, ученый просто не успел сделать это до того, как его захватил Морфей. Однако, Иностранцеву хотелось позабавить своих студентов. На основе виденного геолог придумал байку, которую благодарные слушатели быстро распространили в массы.
Особенности таблицы Менделеева
С момента первой версии 1969-го года порядковая таблица Менделеева не раз дорабатывалась. Так, с открытием в 1930-ых благородных газов удалось вывести новую зависимость элементов, — от их порядковых номеров, а не массы, как заявлял автор системы.
Понятие «атомный вес» заменили на «атомный номер». Удалось изучить число протонов в ядрах атомов. Эта цифра и есть порядковый номер элемента.
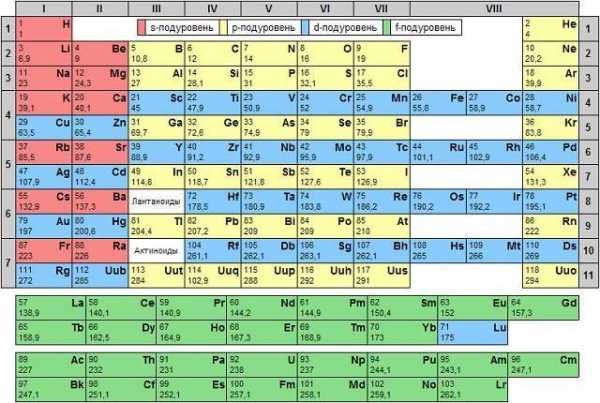
Ученые 20-го века изучили и электронное строение атомов. Оно тоже влияет на периодичность элементов и отражено в поздних редакциях таблицы Менделеева. Фото списка демонстрирует, что вещества в нем расставлены по мере роста атомного веса.
Первооснову менять не стали. Масса увеличивается слева направо. При этом, таблица не едина, а поделена на 7 периоды. Отсюда и название списка. Период – горизонтальный ряд. Его начало – типичные металлы, конец – элементы с неметаллическими свойствами. Убывание постепенное.
Есть большие и малые периоды. Первые находятся в начале таблицы, их 3. Открывает список период из 2-х элементов. Следом идут две колонки, в которых по 8 наименований. Оставшиеся 4 периода большие. Наиболее протяжен 6-ой, в нем 32 элемента. В 4-ом и 5-ом их по 18, а в 7-ом – 24.
Можно сосчитать, сколько элементов в таблице Менделеева. Всего 112 наименований. Именно наименований. Клеток же 118, а есть вариации списка и со 126-ю полями. Все еще остаются пустые клетки для неоткрытых элементов, не имеющих имен.
Не все периоды умещаются в одну строку. Большие периоды состоят из 2-х рядов. Количество металлов в них перевешивает. Поэтому, им полностью посвящены нижние строки. Постепенное убывание от металлов к инертным веществам соблюдается в верхних рядах.
Картинки таблицы Менделеева поделены и вертикально. Это группы в таблице Менделеева, их 8. Вертикально скомпонованы элементы, схожие по химическим свойствам. Они поделены на главную и побочную подгруппы. Последние начинаются только с 4-го периода. В главные подгруппы входят и элементы малых периодов.
Суть таблицы Менделеева
Названия элементов в таблице Менделеева – это 112 позиций. Суть их компоновки в единый список – систематизация первоэлементов. Над этим начали биться еще в античные времена.
Одним из первых понять, из чего составлено все сущее попытался Аристотель. Он взял за основу свойства веществ – холод и тепло. Эмпидокл выделил 4-ре первоосновы по стихиям: воду, землю, огонь и воздух.
Металлы в таблице Менделеева, как и другие элементы, — те самые первоосновы, но с современной точки зрения. Российскому химику удалось открыть большинство составляющих нашего мира и предположить существование еще неизвестных первоэлементов.
Получается, что произношение таблицы Менделеева – озвучивание некой модели нашей реальности, раскладывание ее на составляющие. Однако, выучить их не так-то просто. Попробуем облегчить задачу, описав пару эффективных методов.
Как выучить таблицу Менделеева
Начнем с современного метода. В сети Интернет можно найти ряд флеш-игр, помогающих запомнить список Менделеева. Участникам проекта предлагают находить элементы по разным опциям, например, названию, атомной массе, буквенному обозначению. Приведем для примера одну из них.
Кликните мышью по таблице для начала игры.
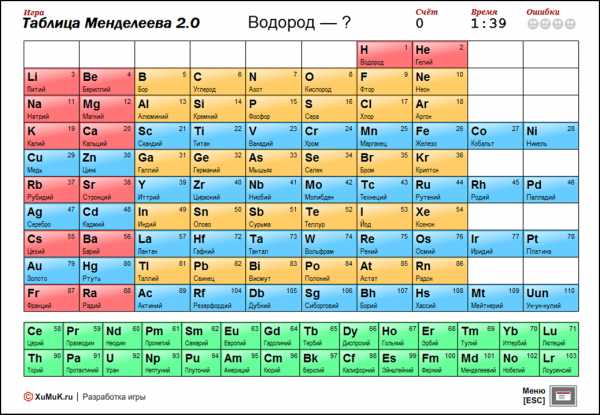
Игрок имеет право выбрать поле деятельности – лишь часть таблицы, или ее всю. В нашей воле, так же, исключить имена элементов, другие параметры. Это усложняет поиск. Для продвинутых предусмотрен и таймер, то есть тренировка ведется на скорость.
Игровые условия делают изучение номеров элементов в таблице Менделеева не нудным, а занятным. Просыпается азарт, и систематизировать знания в голове становится проще. Те же, кто не приемлет компьютерных флеш-проектов, предлагают более традиционный способ заучивания списка.
Его делят на 8 групп, или 18 (в соответствии с редакцией 1989-го года). Для удобства запоминания, лучше создать несколько отдельных таблиц, а не работать по цельному варианту. Помогают и зрительные образы, подобранные к каждому из элементов. Опираться следует на собственные ассоциации.
Так, железо в мозгу может соотноситься, к примеру, с гвоздем, а ртуть – с градусником. Название элемента незнакомо? Пользуемся методом наводящих ассоциаций. Иридий, например, составим из начал слов «ириска» и «динамик».
Характеристика таблицы Менделеева не учиться в один присест. Рекомендованы занятия по 10-20 минут в день. Начинать рекомендована с запоминания лишь основных характеристик: названия элемента, его обозначения, атомной массы и порядкового номера.
Школьники предпочитают вешать таблицу Менделеева над рабочим столом, или на стене, на которую часто смотрят. Метод хорош для людей с преобладанием зрительной памяти. Данные из списка невольно запоминаются даже без зубрежки.
Это учитывают и педагоги. Как правило, они не заставляют заучивать список, разрешают смотреть в него даже на контрольных. Постоянное заглядывание в таблицу равнозначно эффекту распечатки на стене, или написанию шпаргалок до экзаменов.
Приступая к изучению, вспомним, что и Менделеев не сразу запомнил свой список. Однажды, когда ученого спросили, как он открыл таблицу, последовал ответ: — «Я над ней, может, 20 лет думал, а вы считаете: сидел и, вдруг, готово». Периодическая система – кропотливый труд, который не осилить в сжатые сроки.
Наука не терпит спешки, ведь она приводит к заблуждениям и досадным ошибкам. Так, одновременно с Менделеевым таблицу составил и Лотар Мейер. Однако, немец немного недоработал список и не был убедителен при доказательстве своей точки зрения. Поэтому, общественность признала труд русского ученого, а не его коллеги-химика из Германии.
lslsm.ru
Таблица Менделеева была дополнена четырьмя новыми элементами
Автор: nlo-mir Чудеса науки

Сразу четыре новых элемента были добавлены в периодическую систему химических элементов по решению Международного союза теоретической и прикладной химии (IUPAC). Решение это было принято после того, как руководство союза признало соответствие открытых элементов всем необходимым критериям. Это первое дополнение таблицы Менделеева с 2011 года, а четыре новых элемента, наконец, полностью закрыли седьмой ряд периодической системы. Особенно приятно во всей этой истории то, что новые элементы были открыты российскими учёными или при их непосредственном участии.
Первым новым элементом стал Унунтрий (Uut) под номером 113. Он был открыт ещё в 2004 году русско-американской командой учёных. В том же году новый элемент удалось синтезировать и учёным из японского института RIKEN. В течение нескольких последующих лет японцам удалось повторить этот опыт дважды, поэтому руководство IUPAC приняло решение назвать элемент в честь них. Это будет первый элемент периодической системы, названный в честь азиатских исследователей. Вероятнее всего, его переименуют в «рикений».
«Для японских учёных это событие даже куда более важное, чем выиграть золото на Олимпийских играх», — поделился своим восторгом Риоджи Нойори, нобелевский лауреат в области химии и бывший президент института RIKEN.
Вторым элементом стал Унунпентий (Uup) под номером 115. Он был открыт всё той же командой исследователей в 2003 году. Руководство IUPAC сошлось во мнении, что приоритет в его открытии принадлежит учёным из Объединённого института ядерных исследований (г. Дубна, Россия) и Ливерморской национальной лаборатории (США).
Третий новый элемент – это Унунсептий (Uus) под номером 117. Учёные российского Объединённого института ядерных исследований сумели получить его в 2009 году. Для его синтеза была использована мишень из изотопа 97-го элемента, полученного в Окриджской национальной лаборатории (США).
И замыкает четвёрку Унуноктий (Uuo) под номером 118. Изначально его открытие было приписано американским учёным из Беркли, но позднее выяснилось, что их данные были ошибочны и даже фальсифицированы. Первое же настоящее событие распада 118-го элемента было зафиксировано российскими учёными из всё того же ОИЯИ в городе Дубны в 2002 году. Что ж, остаётся только поздравить российских, американских и японских исследователей со столь выдающимися достижениями.
Другие статьи:
nlo-mir.ru