Бром схема строения атома – Составьте схемы строения электоронных оболочек атомов хлора, брома и марганца. Что общего в атомах этих элементов? Как это отражается на их взаимном рас
- Комментариев к записи Бром схема строения атома – Составьте схемы строения электоронных оболочек атомов хлора, брома и марганца. Что общего в атомах этих элементов? Как это отражается на их взаимном рас нет
- Советы абитуриенту
Строение атома брома (Br), схема и примеры
Общие сведения о строении атома брома
Относится к элементам p-семейства. Неметалл. Обозначение – Br. Порядковый номер – 35. Относительная атомная масса – 79,904 а.е.м.
Электронное строение атома брома
Атом брома состоит из положительно заряженного ядра (+35), внутри которого есть 35 протонов и 45 нейтронов, а вокруг, по четырем орбитам движутся 35 электронов.
Рис.1. Схематическое строение атома брома.
Распределение электронов по орбиталям выглядит следующим образом:
+35Br)2)8)18)7;
1s22s22p63s23p63d104s24p5.
Внешний энергетический уровень атома брома содержит 7 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома брома можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
0 |
-1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие одного неспаренного электрона свидетельствует о том, что степень окисления брома может быть равна -1 или +1. Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома брома характерно наличие возбужденного состояния:
Именно поэтому для брома также характерна степень окисления +3. Известно, что в своих соединениях бром также способен проявлять степени окисления +5 и +7.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома бария (Ba), схема и примеры
Общие сведения о строении атома бария
Относится к семейству s-элементов. Металл. Обозначение – Ba. Порядковый номер – 56. Относительная атомная масса – 137,34 а.е.м.
Электронное строение атома бария
Атом бария состоит из положительно заряженного ядра (+56), внутри которого есть 56 протонов и 81 нейтрон, а вокруг, по шести орбитам движутся 56 электронов.
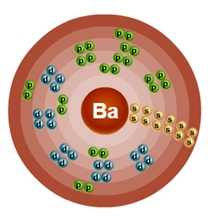
Рис.1. Схематическое строение атома бария.
Распределение электронов по орбиталям выглядит следующим образом:
+56Ba)2)8)18)18)8)2;
1s22s22p63s23p63d104s24p64d105s25p66s2.
Внешний энергетический уровень атома бария содержит 2 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Для атома бария характерно наличие возбужденного состояния. Электроны 6s-подуровня распариваются и один из них занимает вакантную орбиталь 6p-подуровня:
Наличие двух неспаренных электронов свидетельствует о том, что для бария характерна степень окисления +2.
Валентные электроны атома бария можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
|
s |
6 |
0 |
0 |
|
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома олова (Sn), схема и примеры
Общие сведения о строении атома олова
Относится к элементам p-семейства. Металл. Обозначение – Sn. Порядковый номер – 50. Относительная атомная масса – 118,69 а.е.м.
Электронное строение атома олова
Атом олова состоит из положительно заряженного ядра (+50), внутри которого есть 50 протонов и 69 нейтронов, а вокруг, по пяти орбитам движутся 50 электронов.
Рис.1. Схематическое строение атома олова.
Распределение электронов по орбиталям выглядит следующим образом:
+50Sn)2)8)18)18)4;
1s22s22p63s23p63d104s24p64d105s25p2.
Внешний энергетический уровень атома олова содержит 4 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие двух неспаренных электронов свидетельствует о том, что для олова характерна степень окисления +2. За счет наличия вакантных орбиталей 5d-подуровня для атома олова возможно возбужденное состояние (степень окисления +4):
Валентные электроны атома олова можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома фтора (F), схема и примеры
Общие сведения о строении атома фтора
Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес – 18,998 а.е.м. Это единственный стабильный нуклид фтора.
Электронное строение атома фтора
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы.
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитальногоl, магнитногоmlи спиновогоms. Определенные значения трех квантовых чисел (n, l,ml) описывают состояние электрона, называемое атомной орбиталью (АО).
Главное квантовое число nопределяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число lопределяет форму АО и энергетический подуровень, оно может принимать значения от нуля доn-1.Исторически атомным орбиталям со значениямиl, равным 0, 1, 2, 3 присвоены буквенные обозначенияs-,p-,d-,f-. В графических схемах электронного строения атомов каждая орбиталь обозначается символом .
Магнитное квантовое числоmlопределяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –lдо +l.
Спиновое квантовое число msхарактеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений lиnвыражается электронными или электронно-графическими формулами.
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому электроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным. Например, четыре валентныхp-электрона атома кислорода размещаются в квантовых ячейках следующим образом:
Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значениемnв этой сумме. Например,
1s2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f
(лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s-элементы – заполнение внешнегоs-подуровня (например, литий 1s22s1),р-элементы – заполнение внешнегоp-подуровня (например, фтор – 1s22s22p5),d-элементы – заполнение предвнешнегоd-подуровня (например, ванадий – 1s2 2s2 2p6 3s2 3p6 4s2 3d3), f-элементы–заполнение f-подуровня второго снаружи уровня (например, неодим– 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4).
Для d– и f-элементов возможны отклонения от описанного способа заполнения АО – так называемый провал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или наполовину заполненная АО, т.е. d10, d5, f14, f7. В ситуации, когда до достижения такого состояния не хватает одного электрона, он переходит («проваливается») с предыдущего уровня. Например, электронный паспорт серебра 1s22s22p63s23p64s23d104p65s24d9 с учетом провала электрона примет вид 1s22s22p63s23p64s23d104p65s14d10.
Если на валентных энергетических уровнях имеются вакантные АО, то при получении электронами порции энергии (возбуждении атома) становится возможным «разъединение» валентных электронов, т.е. их переходы с тех подуровней, где все АО заняты полностью () или частично (), на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
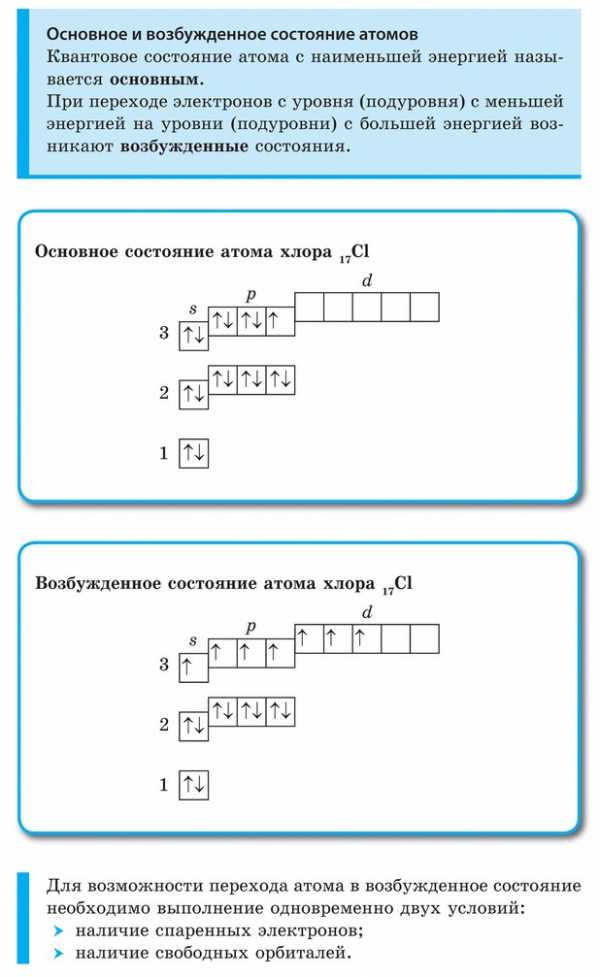
Пример 1.Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях.
Решение.1. Порядковый номер брома – 35, следовательно атом брома имеет 35 электронов. Бром находится вIVпериоде периодической системы, следовательно, АО сn, равным 1; 2 и 3 заполнены полностью. Бром относится кp-элементам, следовательно, заполнен 4s-подуровень. В ряду 4p-элементов бром – пятый элемент, следовательно, на 4p-подуровне – пять электронов. Таким образом, электронная формула брома имеет вид 1s22s22p63s23p64s23d104p5.
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т.е. 4s-, 4p– и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид
втаком состоянии бром имеет валентность 1, которой соответствуют степени окисления1 и +1.
3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь. В этом первом возбужденном состоянии
бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободнуюd-орбиталь. Во втором возбужденном состоянии
бром имеет валентность 5, которой соответствует степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь. Втретьем возбужденном состоянии
бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2.Составить электронные формулы атома селена в состоянияхSe2иSe+4и графические схемы заполнения электронами валентных орбиталей.
Решение. 1.Cоставим электронную формулу атома селена (см. пример 1): 1s22s22p63s23p64s23d104p4. Графическая схема заполнения электронами валентных орбиталей имеет вид
2. Для получения Se2необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского). Тогда графическая схема примет вид
Электронная формула Se2 – 1s22s22p63s23p64s23d104p6.
3. Для получения Se+4необходимо убрать четыре электрона с 4p-орбитали, атома селена:
Электронная формула Se+4 – 1s22s22p63s23p64s23d104p0.
Пример 3.Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
Решение.Согласно правилу Клечковского 3d-элементы находятся в четвертом периоде таблицы Д.И.Менделеева. На данной орбитали находится шесть электронов, значит, это шестой по счету среди 3d-элементов, т.е. железо, полная электронная формула которого 1s22s22p63s23p64s23d6.
Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
1. B, Al, Th. 2. Po, Ba, Lu. 3. Mg, Pm, Be. 4. Br, Co, Hf. 5. C, Tm, As. 6. Nd, Ca, V. 7. Ta, O, Ce. 8. Y, Rb, S. | 9. At, Xe, Lr. 10. Cs, U, H. 11. Cl, Cu, Bi. 12. Na, Ac, Fe. 13. Pb, Ra, Dy. 14. Ag, Re, In. 15. Cd, K, Pa. 16. P, Se, Li. | 17. Yb, Mn, Sn. 18. Mo, La, N. 19. Pu, Ni, Sb. 20. Au, Np, Rn. 21. Cr, Tl, Cm. 22. Si, I, Zr. 23. Tb, Sr, Bk. 24. Fr, Ti, W. | 25. He, Hg, Gd. 26. Pt, Ne, Sm. 27. Ga, Ru, Ho. 28. Sc, Pr, Os. 29. Ar, Ir, Eu. 30. Zn, Rh, Er. 31. Kr, Pd, Am. 32. Ge, Cf, F. |
Задание II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
33. Li+, C+2. 34. O2, F. 35. Na+, N3. 36. Ca+2, C+4. 37. Al+3, B3. 38. C4, Ba+2. 39. S+6, P3. 40. P+5, Cl1. | 41. I+5, Fe+3. 42. Be+2, Co+3. 43. Cr+6, Cu+2. 44. I, P+3. 45. Cr+3, Br+3. 46. Ag+, Sn+4. 47. Zn+2, S2. 48. K+, Fe+2. | 49. Zr+4, Pb+2. 50. N+5, Br. 51. Ni+2, Cl+5. 52. Se2, Cs+. 53. Te2, Sr+2. 54. Bi+3, Si4. 55. B+3, Sc+2. 56. Mg+2, Mn+7. | 57. Cd+2, Sn+2. 58. Nb+3, Hg+. 59. Tl+, V+3. 60. Ti+4, Mn+2. 61. Os+3, Au+3. 62. Rb+, Ce+3. 63. Fr+1, Y+3. 64. H+, Re+7. |
Задание III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
65. 4d1. 66. 3d10. 67. 4s13d10. 68. 5d2. 69. 6p2. 70. 6s14f145d10. 71. 4s23d5. 72. 4s13d5. | 73. 7s26d1. 74. 5d3. 75. 6s24f2. 76. 6p1. 77. 5s14d5. 78. 4f3. 79. 6d15f3. 80. 5s24d5. | 81. 5d8. 82. 5s14d10. 83. 5s24d10. 84. 5s2. 85. 5p3. 86. 6p4. 87. 4d6. 88. 5d6. | 89. 5f7. 90. 5d6. 91. 5f2. 92. 4d7. 93. 5d14f7. 94. 4f10. 95. 4d8. 96. 5p6. |
studfiles.net
Строение атома селена (Se), схема и примеры
Общие сведения о строении атома селена
Относится к элементам p-семейства. Неметалл. Обозначение – Se. Порядковый номер – 34. Относительная атомная масса – 78,96 а.е.м.
Электронное строение атома селена
Атом селена состоит из положительно заряженного ядра (+34), внутри которого есть 34 протона и 45 нейтронов, а вокруг, по трем орбитам движутся 34 электрона.
Рис.1. Схематическое строение атома селена.
Распределение электронов по орбиталям выглядит следующим образом:
+34Se)2)8)18)6;
1s22s22p63s23p63d104s24p4.
Внешний энергетический уровень атома селена содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома селена можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие двух неспаренных электронов свидетельствует о том, что степень окисления селена равна +2. Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома селена характерно наличие возбужденного состояния:
Именно поэтому для селена также характерна степень окисления +4.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Тема №1 «Строение атома» | CHEM-MIND.com
Оглавление
Электроны
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится. Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
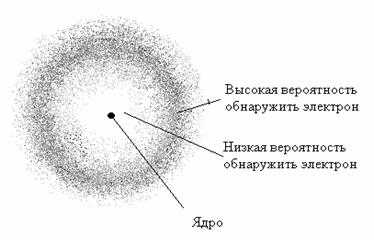 Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака, и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей, которые обозначаются латинскими буквами s, p, d и f. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
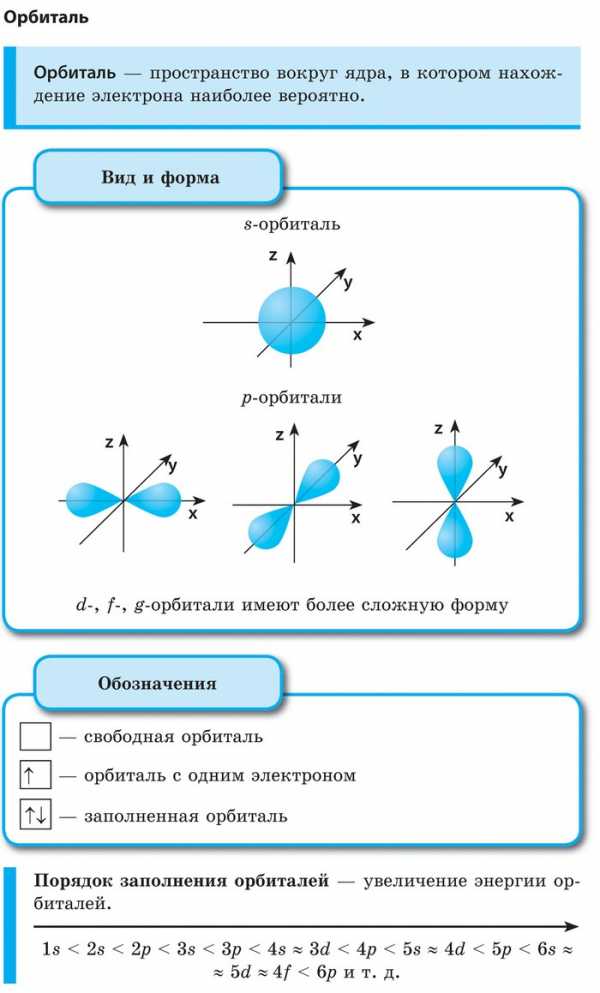
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, — 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
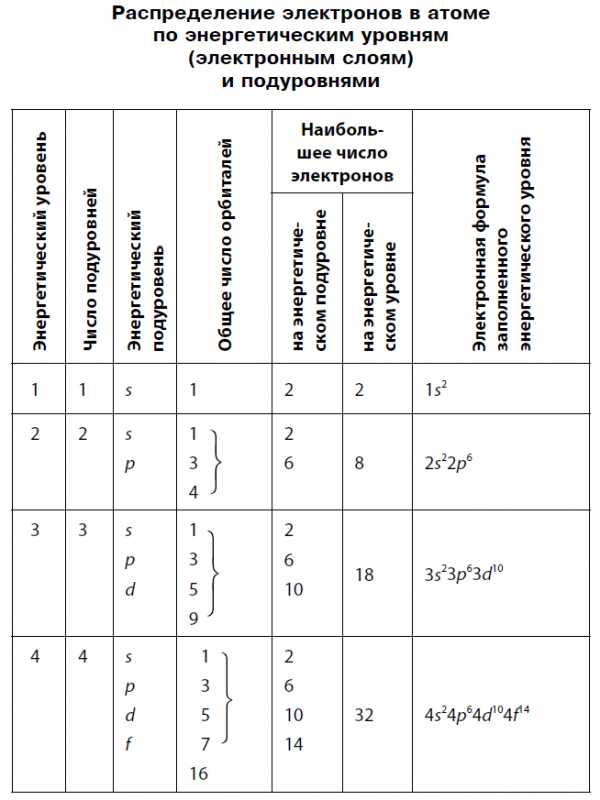
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n2,
где N — максимальное число электронов; n — номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более 8; на третьем — не более 18; на четвертом — не более 32.
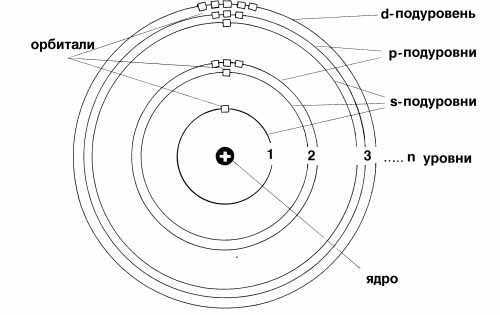
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня. Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроны
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
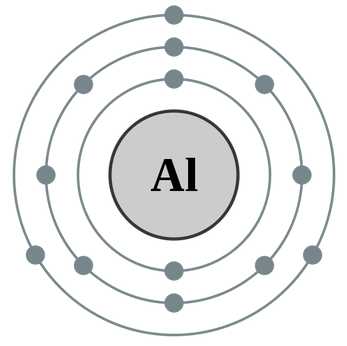
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e—.
Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:

N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.

Элементы первого периода
Схема электронного строения атома водорода:

Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
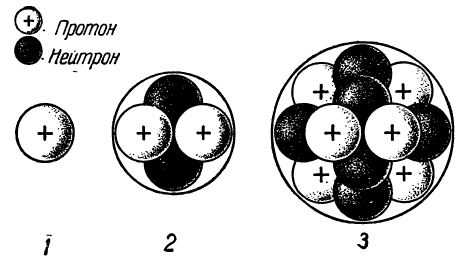
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем 2 электрона. Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем 8 электронов.
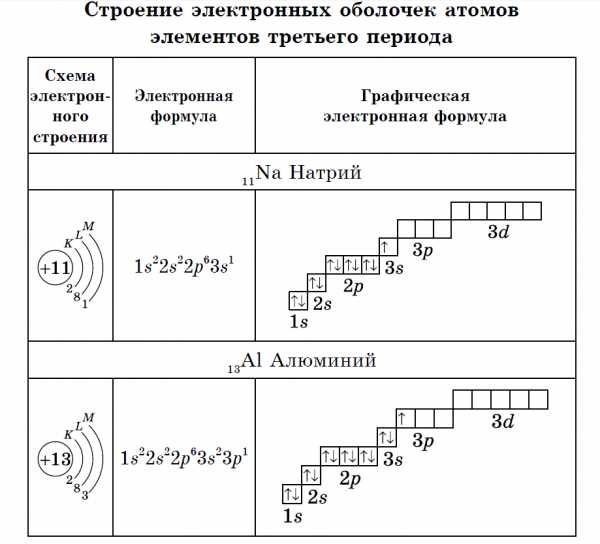
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg — s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar — р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr — р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42Мо, 44Ru, 45Rh, 46Pd, 47Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Cs и 56Ва — 6s-элементы; 57La … 6s25dx — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf — 80Hg — 5d-элементы; 81Т1 — 86Rn — 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf7и nf14. В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
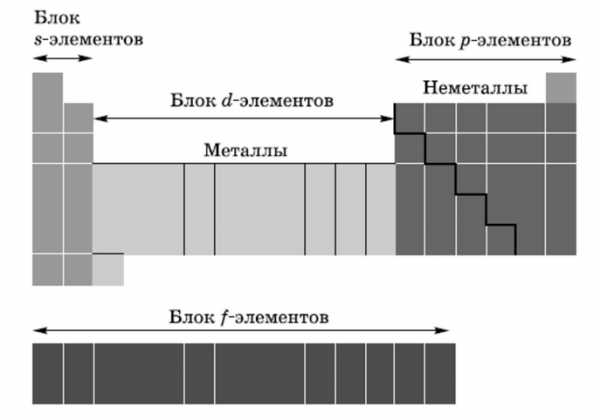
- s-элементы. Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы. Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III— VIII групп.
- d-элементы. Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы. Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Основное и возбужденное состояния
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули. Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
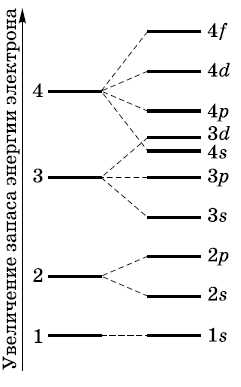

Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
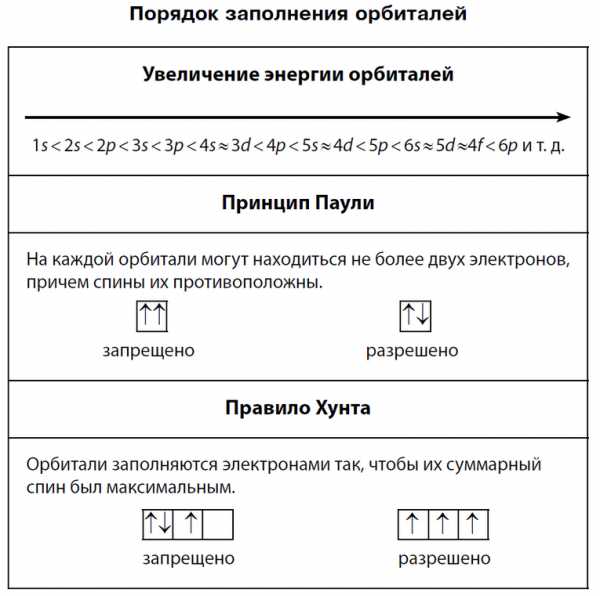
Правило Хунда и принцип Паули
Правило Хунда — правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина).
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частицы с полуцелым спином) не могут одновременно находиться в одном и том же квантовом состоянии.
 Правило Хунда и принцип Паули
Правило Хунда и принцип ПаулиПравило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d,а не 4f, и только затем происходит заселение четырнадцатью электронами 4f орбиталей, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и дляорбиталей 7s, 6d и 5f.
Распределение элекронов в атоме хрома — согласно правилам(сверху) и реальное(снизу), согласно исключениям из правила Клечковского:
www.chem-mind.com



