Чтение химических элементов – Как читаются элементы в таблице Менделеева?
- Комментариев к записи Чтение химических элементов – Как читаются элементы в таблице Менделеева? нет
- Советы абитуриенту
- Читать онлайн “Популярная библиотека химических элементов. Книга первая. Водород — палладий” автора Коллектив авторов – RuLit
- Названия элементов | Путешествие в мир химии
- Как научиться читать таблицу химических элементов ДИ Менделеева
- Cайт учителя химии Ващенко Н.Ю.
- Чтение химических формул – Справочник химика 21
- Читать книгу Химия. Периодическая система химических элементов Д.И. Менделеева и строение атомов Антонины Гуровой : онлайн чтение
- 2.4. Электронные орбитали
- 2.5. Электронные и электронно-графические формулы строения атома
- 2.6. Квантовые числа
- 2.7. Ионы
- Электронные формулы
- Электронно-графические формулы
- 3. Периодический закон. Периодическая система химических элементов Д.И. Менделеева в свете строения атома
- 4. Изменения свойств простых веществ и соединений элементов в периодах и подгруппах
Читать онлайн “Популярная библиотека химических элементов. Книга первая. Водород — палладий” автора Коллектив авторов – RuLit
ПОПУЛЯРНАЯ БИБЛИОТЕКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
ВОДОРОД — ПАЛЛАДИЙ
Ответственный редактор академик И.В. ПЕТРЯНОВ-СОКОЛОВ
Составители В.В. СТАНЦО, М.Б. ЧЕРНЕНКО
«Я знаю, люди состоят из атомов, частиц, как радуги из светящихся пылинок или фразы из букв. Стоит изменить порядок, и наш смысл меняется» (А. Вознесенский). С небольшой поправкой на поэтическую вольность этот тезис можно принять.
Элементы химические — совокупности атомов, обладающих одинаковым зарядом ядра; образуют все многообразие простых и сложных, веществ». Таково строгое энциклопедическое определение элементов.
Вероятно, почти о каждом из 107 известных ныне элементов написаны научные монографии. Не раз предпринимались попытки рассказать популярно обо всех элементах сразу, в одной книге, адресованной массовому читателю. В результате получались «ножницы»: с одной стороны — сугубо научные монографии, представляющие интерес и понятные лишь узкому кругу специалистов, а с другой — книги, построенные по принципу «путевых очерков». Авторы их, несомненно, руководствовались самыми добрыми намерениями, но физически не могли втиснуть в строго ограниченное издательствами количество печатных листов все самое интересное и самое важное обо всех, химических элементах. К тому же, вряд ли есть на земле человек, который хорошо знал бы все элементы.
В настоящее издание «Популярной библиотеки химических элементов» вошли материалы обо всех химических элементах, открытых до 1 января 1983 г.; здесь читатель найдет сведения об истории открытия, физических и химических свойствах, важнейших соединениях, методах получения, областях, применения и потенциальных возможностях каждого из элементов в эпоху научно-технической революции.
«Популярная библиотека химических элементов» предназначена прежде всего тем, кто учится, и тем, кто учит: школьникам-старшеклассникам и студентам, учителям, преподавателям вузов и техникумов. Это издание может быть также полезно широкому кругу химиков и инженерно-технических работников как средство предварительного ознакомления с каждым конкретным элементом. Прежде всего это касается редких., рассеянных и искусственно полученных элементов.
В книге помимо основных сведений о каждом элементе содержится информация о неожиданных, применениях элементов и соединений, минералах, изотопах, любопытных или курьезных фактах из истории элементов. В историческую часть многих разделов включены фрагменты документов, писем и высказываний выдающихся ученых, о роли того или иного элемента в жизни человечества. Особенно широко, что естественно для такой книги, представлены работы первооткрывателя периодической системы элементов гениального русского химика Дмитрия Ивановича Менделеева.
В основу «Популярной библиотеки химических элементов» — и первых изданий, и этого тоже — положены публикации научно-популярного журнала Академии наук СССР «Химия и жизнь».
Первое издание «Библиотеки» (1971—1974) было предпринято в связи со 100-летием периодического закона химических элементов.
Во втором (1977 г.) издании были обновлены практически все материалы. Включены были также материалы о вновь открытых элементах № 106 и 107.
Нынешнее — третье — издание в основном аналогично второму, внесены лишь частные уточнения и дополнения. Названия соединений, как и в предыдущих изданиях, даны в соответствии с русской номенклатурой неорганических соединений. Для молодых читателей, привыкших к оксидам, гидроксидам, пероксидам и прочим атрибутам международной номенклатуры, напомним, что закисью и окисью называются оксиды соответственно в низшей и высшей степенях окисления, а гидроокиси — то же самое, что гидроксиды, перекиси — пероксиды и т. д.
В издание впервые включен справочный аппарат: таблицы «Константы и свойства», таблицы перевода единиц измерения в интернациональную систему СИ, именной указатель. Эти материалы помещены в конце второй книги.
ЗАКОН МЕНДЕЛЕЕВА — ЗАКОН ПРИРОДЫ
1 марта 1969 г. исполнилось 100 лет со дня открытия одного из величайших законов современного естествознания — периодического закона химических, элементов.
В этот день в 1869 г., молодой, тогда мало известный русский ученый Дмитрий Иванович Менделеев разослал многим ученым-химикам разных, стран небольшой печатный листок, скромно озаглавленный: «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
Современники еще не подозревали, что в науке совершилось великое историческое событие: в необозримый хаос разрозненных сведений о природе и свойствах химических элементов и их соединений вошли ясность и порядок, преобразовав древнюю химию из эмпирического искусства в строгую и точную науку.
Названия элементов | Путешествие в мир химии
 Чтобы каждый раз не отвлекаться на то, как обозначают химики разные химические элементы и как читают (по-русски) их названия, в том числе в формулах, полезно привести некоторые из них в отдельной таблице. В ней в алфавитном порядке (латинском) расположены символы некоторых наиболее важных элементов, их произношение в химических формулах, а также русские и латинские названия элементов. Конечно, некоторые названия произнести не очень просто (например, «гидраргирум»), но такова традиция.
Чтобы каждый раз не отвлекаться на то, как обозначают химики разные химические элементы и как читают (по-русски) их названия, в том числе в формулах, полезно привести некоторые из них в отдельной таблице. В ней в алфавитном порядке (латинском) расположены символы некоторых наиболее важных элементов, их произношение в химических формулах, а также русские и латинские названия элементов. Конечно, некоторые названия произнести не очень просто (например, «гидраргирум»), но такова традиция.
Химики иногда позволяют себе читать символ кремния просто как «си». Видно, что символы многих элементов (в основном это металлы) произносятся в формулах так же, как они называются по-русски.
К слову, символ элемента Na химики читают «натрий» (но ни в коем случае не «на»!), символ С1 — «хлор», символ Вг — «бром» и т. д. Такие слова понятны и людям, никогда не изучавшим химию. Символы некоторых элементов (в основном это тоже металлы) произносятся на латыни.
Например, Аи читается «аурум», Sn читается «станнум».
Подобные названия непосвящённые, скорее всего, не поймут.
Некоторые элементы-неметаллы произносят только по первой букве их латинских названий.
Таких элементов немного.
Это Н (по традиции читается как французская буква h — «аш»), N, С, О, Р, S. И так совпало, что именно эти шесть элементов — одни из самых распространённых в живых организмах: на их долю приходится примерно 90 % массы тела человека. Не везде химики называют элементы и читают формулы так же, как у нас. Например, по-английски символы всех элементов читаются по буквам, так что олово — это не «станнум», а «эс-эн». Такое прочтение может приводить к забавным недоразумениям.
Вот как описывает американский химик Алан Хигер начало своей работы над новыми электропроводящими полимерами, за которые он вместе с Аланом Макдиармидом и Хидеки Сиракавой в 2000 году получил Нобелевскую премию по химии. «В 1975 году появилась первая статья, посвященная новому металлическому полимеру, полимерному нитриду серы (SN). Меня поразил этот необычный металл, и я захотел принять участие в игре.
Я выяснил, что Алан Макдиармид, профессор химического факультета Пенсильванского университета, знаком с химией нитрида серы.
Я договорился с ним о встрече с целью убедить его поработать совместно и синтезировать (SN)x. Вспоминаю, что мы встретились вечером осеннего дня. После довольно продолжительного обсуждения, в ходе которого я почти не приблизился к своей цели, мне наконец стало понятно, что, когда я произносил «(SN)x», он воспринимал это как «(Sn)x»! Нечего и говорить, что на него не произвёл никакого впечатления мой энтузиазм, поскольку «(Sn)х» — это металл.
Любой химик знает, что олово — металл и проводит ток! Как только Макдайармид и я справились с этой «лингвистической» проблемой, началось наше тесное сотрудничество». Принципы, по которому составлены символы элементов, были сформированы ещё в первой половине XIX века.
Берётся первая буква латинского названия, а если она у разных элементов одинаковая, то символ составляется из двух букв, причём другая буква необязательно вторая в названии.
Так, например, элемент кюрий (названный в честь супругов Марии и Пьера Кюри) имеет латинское название Curium. Но если взять первые две буквы этого названия (Си), то получится символ меди!
Поэтому для кюрия был выбран символ Сm. Довольно много элементов было названо в честь учёных.
Если у вас под рукой есть периодическая таблица Менделеева, можете попробовать их найти, почти все они расположены в её конце. Это гадолиний Gd (финский химик и минералог Юхан Гадолин), самарий Sm (горный инженер В. Е. Самарский-Быховец), эйнштейний Es (физик Альберт Эйнштейн), фермий Fm (итальянский физик Энрико Ферми), кюрий Cm (Мария и Пьер Кюри), менделевий Md (Д. И. Менделеев), нобелий No (Альфред Нобель), лоуренсий Lr (американский физик Эрнест Орландо Лоуренс), резерфордий Rf (английский физик Эрнест Резерфорд), сиборгий Sg (американский физик Гленн Сиборг), борий Bh (датский физик Нильс Бор), мейтнерий Mt (австрийский физик Лиза Мейтнер), рентгений Rg (немецкий физик Вильгельм Рентген), если ребенок еще не знает что это такое, в этом случае ему необходимо Детское внеклассное чтение.
Названия ряда элементов происходят от имён древних богов, героев и даже злых духов.
Вот эти «мифологические» элементы (кроме уже упоминавшихся ниобия и тантала): кадмий (Кадм — герой греческой мифологии, брат Европы, царь Кадмейской земли), кобальт и никель (злые духи в средневековой Германии), прометий (герой мифов Прометей), торий (древнескандинавский бог-громовержец Тор), титан (Титаны — гиганты в древнегреческой мифологии), ванадий (древнескандинавская богиня красоты Ванадис), уран, нептуний, плутоний (эти элементы были названы так же, как незадолго до них открытые планеты, а те, в свою очередь,- по именам героев древнегреческих мифов), гелий (древнегреческий бог солнца Гелиос), теллур (лат. tellus — планета Земля), селен (греч. selene — Луна), церий и палладий (названы по незадолго до этого открытым астероидам и так же, как и они, — в честь древнегреческой богини плодородия Цереры и богини мудрости Афины Паллады).
Многие элементы имеют «географические» названия.
Вот они: бериллий Be (город Белур (Веллуру) в Южной Индии), магний Mg и марганец Мп (от Магнесии в Греции), скандий Sc (в честь Скандинавии), медь Си (от лат. Cyprus — остров Кипр, где в древности добывалась медь — отсюда латинское название этого элемента cuprum), галлий Ga (Gallia — латинское название Франции), германий Ge, стронций Sr (шотландская деревня Строншиан), иттрий Y, иттербий Yb, тербий ТЬ, эрбий Ег (шведский посёлок Иттербю, от названия которого «отрезали» одну или две буквы), рутений Ru (Ruthenia — латинское название России), гафний Hf (Hafnia — латинское название Копенгагена), рений Re (Рейнская провинция в Германии), полоний Ро (на латыни Polonia — Польша), франций Fr, европий Ей, гольмий Но (Holmia — старинное латинское название Стокгольма), тулий Тт (лат. Thulium, в честь Скандинавии: так римляне называли северную часть Европы — Thule), лютеций Lu (от старинного латинского названия города, на месте которого расположен современный Париж,- Lutetia Parisoram), америций Am, берклий Bk (город Беркли в CIIIA), калифорний Cf (штат в СГЛА), дубний Db (город Дубна), хассий Hs (Hassia — латинское название старинного немецкого княжества Гессен), дармштадтий Ds (город в Германии Дармштадт).
Ряд элементов назван по их свойству. Например, хлор — от греч.
chloros — «жёлто-зелёный»; бром — от греч.
bromos — «зловонный», йод — от греч. iodes — «фиолетовый» и т. д. Бывали и многолетние споры о названии элементов.
В 1841 году английский химик Чарлз Хатчет выделил из неизвестного минерала, присланного из Канады, оксид нового элемента. Минерал он назвал по месту находки (Британская Колумбия) колумбитом, а элемент — колумбием (Сb). Через три года немецкий химик Генрих Розе выделил оксид какого-то неизвестного ему элемента из минерала, найденного в Баварии.
Этот оксид по своим химическим свойствам был очень похож на оксид другого элемента — тантала.
Читайте так же:
cgz.sumy.ua
Как научиться читать таблицу химических элементов ДИ Менделеева
Периодическая система химических элементов – это уникальный справочный материал, который нужно правильно «читать», а затем воспользоваться полученной информацией. Помимо этого таблица Д.И. Менделеева считается разрешенным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Вам понадобитсяПериодическая система химических элементов Д.И. Менделеева
Спонсор размещения P&G Статьи по теме “Как научиться читать таблицу химических элементов Д.И. Менделеева” Как читать таблицу Менделеева Почему в периодической системе изменяются металлические свойства Как составить формулу веществаИнструкция
1
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или химический элемент живет в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот. Кроме этих данных в каждой «квартире» или клетке указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
2
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя подгруппы. В зависимости от того, с какой стороны их больше, та подгруппа называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).3
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.4
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.5
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.6
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.7
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.8
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием. Как простоmasterotvetov.com
Погода в Ногинске Живой календарь Праздники | Язык химии. Знаки химических элементов. Химический язык и его части
Таблица 1.Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые ” буквы” , научитесь понимать смысл ” слов” и” предложений” . Вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться. Химические знаки (символы химические) – буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод – С (Carboeum), кальций – Ca (Calcium), кадмий – Cd…Символ химического элемента – условное обозначение химического элемента. Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца ( ☉ , золото), Луны ( ☽ , серебро), Юпитера ( ♃ , олово),Венеры (♀, медь), Сатурна ( ♄ , свинец), Меркурия ( ☿ , ртуть),Марса ( ♁ , железо). Металлы, открытые в XV—XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.  Попытки упорядочить старинные химические знаки продолжались до конца XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач И. Я. Зацепин. Ниже приведена таблица химических знаков некоторых элементов, их названия , относительные массы и произношение. 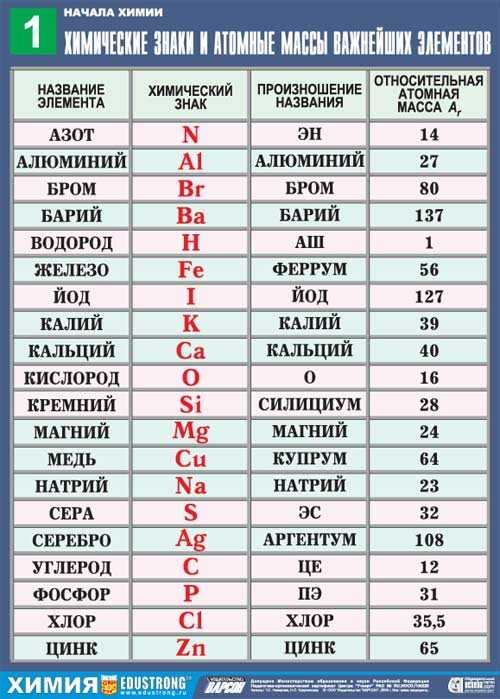 Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон». Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10–22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса. · Массы атомов очень малы. Абсолютные массы некоторых атомов: m(C) =1,99268 ∙ 10-23 г m(H) =1,67375 ∙ 10-24 г m(O) =2,656812 ∙ 10-23 г · В настоящее время в физике и химии принята единая система измерения. Введена атомная единица массы (а.е.м.) m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-24 г. · Ar(H) = m(атома) / m (а.е.м.) = = 1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м. · Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина. Относительная атомная масса – это 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная атомная масса безразмерная величина Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева). Ar(Cl) = 35,5. ·Связь между абсолютной и относительной массами атома представлена формулой: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг №1. Используя ПСХЭ составьте пары из знаков химических элементов и соответствующих русских названий: Используя ПСХЭ определите относительные атомные массы химических элементов с порядковыми номерами: 80, 23, 9, 2 №3. Дайте характеристикухимическому элементу – О по его положению в ПСХЭ согласно плану: Разгадайте новое слово,которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек. Например, •Cr , убираем из названия “хром” одну начальную букву и получаем “ром” а) : Na . б) Mg : . в) . F г) Ba : №5. Разгадайте новое слово,которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек. А) : . Pd : В ) : Co: Г ) : : C №6. Ваша задача при ответе на данный вопрос записать химические знаки (символы) элементов, русские названия которых будут приведены ниже (при написании ответа, записывайте символы через запятую и пробел, например, Ti, Co, Al): Сера Медь Углерод Калий Кальций Фосфор №7. Поработайте с тренажёром “Относительные атомные массы” | Новости сайта Поздравляем победителей и лауреатов Всероссийских дистанционных олимпиад по химии и биологии Полезные ссылки Архив записей |
himiknoginsk.ucoz.ru
Чтение химических формул – Справочник химика 21
ПРАВИЛА ЧТЕНИЯ ХИМИЧЕСКИХ ФОРМУЛ И УРАВНЕНИЙ [c.88]Запишите химическую формулу гипса и переходите к чтению рубрики 38. [c.219]
Чтение химических формул [c.226]
Для закрепления навыков пользования химической номенклатурой при чтении уравнений реакций и вообще при устном ответе следует произносить названия веществ по международной номенклатуре, а не читать символы элементов и индексы в фор.муле (напри.мер, купрум-эс-о-четыре ). Для выработки этого навыка в пособии широко используются названия веществ по. международной но.менклатуре в.место их формул, если последние очевидны. [c.4]
Запишите химические формулы этих соединений. Не в их число натриевые и кальциевые соли угольной кислот рядом с каждой формулой название соответствующего сое Переходите к чтению рубрики 9. [c.289]
Запишите название и химическую формулу этого соединения, а затем переходите к чтению рубрики 13. “ [c.395]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивает прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом способствует сосредоточенности внимания, помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный студентами на основе изучения учебника, передает не только содержание книги, но и отношение читающего к изучаемому материалу. Прежде чем записать мысль, необходимо обдумать ее формулировку и выразить ее своими словами. Однако наиболее важные положения и определения целесообразно приводить в виде выписок и цитат. Необходимо заносить в конспекты основные законы и понятия химии, формулы и уравнения реакций, математические зависимости, незнакомые термины и названия. Облегчает усвоение материала, составление графиков, схем и таблиц на основе прочитанного раздела книги. [c.4]
Изучение отдельных глав книги рекомендуется проводить в два этапа. При первом чтении создается общее представление о содержании и выясняются ее трудные места. При повторном изучении темы легче понять сущность вопроса, теоретические положения, их применение, математические зависимости, уравнения химических реакций. Подавляющее большинство людей легче усваивают прочитанное, если параллельно с чтением книги ведут конспект. Работа над конспектом помогает пониманию прочитанного и является средством самоконтроля. Лучшая форма конспектирования учебника — тезисная. Тезис, сформулированный самостоятельно при чтении учебника, передает не только содержание книги,- но и отношение к изучаемому материалу. Наиболее важные положения и определения целесообразно выписывать дословно. Рекомендуется заносить в конспекты основные законы и понятия, формулы и уравнения реакций, математические расчеты, незнакомые термины и названия. [c.4]
В учебнике крупными оранжевыми буквами выделены определения. Широкие белые поля на каждой странице гигиеничны, позволяют отдыхать глазам при чтении. Разнообразие шрифтов, а также наличие на многих страницах оранжевого и темносерого цветов снимают монотонность при чтении и устраняют скуку. В оранжевых рамках выделены алгоритмы (например, составления формул), образцы химических расчетов (например, расчет молекулярной массы вещества), а в темно-серых рамках приведены исторические факты, высказывания ученых и даже выдержки из детских сочинений о химии. Все это возбуждает интерес и желание вникнуть в содержание. Довольно крупный шрифт позволяет не перегружать страницу учебника. Все это имеет большую методическую ценность. [c.167]
Ознакомимся с важнейшими физико-химическими свойствами некоторых газов, исследование которых имеет большое значение для различных отраслей промышленности. Предварительно, для удобства и облегчения чтения, напомним вкратце содержание понятий, определений и формул, с которыми мы будем встречаться при дальнейшем изложении материала. [c.10]
Н. Н. Зинин начал свои работы, когда в органической химии господствовала теория радикалов, затем, в 50-е годы, он стал горячим приверженцем теории типов после становления теории химического строения в 60-х годах он долгое время избегал пользоваться структурными формулами, ограничиваясь выражением в своих формулах лишь эмпирического состава изучавшихся им соединений. В какой-то мере это было оправдано тем, что он занимался сложными соединениями бензойного ряда, тогда как структурная формула бензола была установлена в 1865 г., а нафталина лишь в 1869 г., причем далеко не все их признавали. Перевод формул Зинина на язык структурной теории читатель найдет в примечаниях. Основное назначение примечаний — облегчить современному читателю чтение работ Н. Н. Зинина, изобилующих уже вышедшей из употребления терминологией. В примечаниях также даны необходимые справки из истории химии и библиографические отсылки к работам химиков, о которых сам Н. Н. Зинин только упоминает. Примечания к статье А. П. Бородина и А. М. Бутлерова содержат уточнения биографических сведений о Зинине, которые стало возможным сделать в результате изучения литературных, а главным образом архивных источников. [c.8]
Хотя в этом случае уравнение, по-видимому, более точно отражает реально происходящие события, но по сравнению с уравнением (4.7) оно несет в себе ряд неудобств протон представлен формулой НзО , которую при беглом чтении трудно отличить от НгО, причем с химической точки зрения, быть может, правильнее было бы писать не Н3О+, а НэО или что-нибудь еще в этом роде. Вода в уравнении (4.11) выступает в роли одного из реагентов, однако из выражения для константы равновесия (и в частности для константы Ка) она неизбежно выпадает, так как концентрация воды остается постоянной. Если мы будем записывать диссоциацию НА в форме уравнения (4.11), то с тем же основанием мы должны написать уравнение диссоциации воды в виде [c.212]
Учебник включает 29 уроков раздел дополнительных текстов для чтения, тематика которых связана с тематикой текстов уроков раздел обзорных упражнений по основным грамматическим темам список слов, часто встречающийся в научно-технической литературе, и список сокращений, принятых в химической литературе правила чтения химических формул, а также список химических элементов с указанием их произношения. В учебнике имеется также краткий грамматический справочник, в котором представлен материал, изучаемый в уроках учебника. Справочник предназначается для самостоятельной работы над выделенными грамматическими темами. В конце учебнг ка даи англо-русский словарь, содержащий лексику учебника. [c.3]
Гипс имeet химическую формулу. … При обжиге гипс теряет. … Переходите к чтению рубрики 63. [c.221]
Как бы ни идеальна была формула, подсчет по ней может дать лишь приближенные результаты. Сложность и разнообразие химических соединений, составляющих органическую массу топлива, да еще разных его видов, не могут быть выражены или у,чтены никакой формулой. [c.213]
С течением времени такая система записи валового химического состава вещества, будучи формально вполпе корректной, привела к определенной терминологической путанице. Действительно, при чтении валовой формулы вещества содержание всех элементов читается как сумма окислов окись кальция, окись углерода, окись кремния и никогда СаО, Oj или SiO не читаются [c.8]
При вводе химических формул возникают такие же сложности, как и для математических формул, но, к счастью, необходимые символы имеются на клавиатуре. Из-за ограниченных возможностей первых компьютеров авторы программ представляли химические формулы в линейном формате. При этом студенты должны были усвоить определенный формализм для чтения таких химических формул. Большинство микрокомпьютеров достаточно гибки для вывода на дисплей подстрочных и надстрочных индексов, но проблема восприятия вводных команд от студента сохраняется. Если вводные команды включают подстрочные и надстрочные индексы, то для обозначения места индикации этих чисел на экране следует ввести некоторый формальный параметр. В одном из подходов к этой проблеме для индикации того, что данная цифра должна быть надстрочным индексом, с успехом применяли клавишу SHIFT. В противном случае эти числа воспринимаются как подстрочные индексы или коэффициенты, причем программа идентифицирует два последних варианта в соответствии с контекстом [16]. [c.99]
В конце своей книги М. Дьюар заметил, что те дни, когда химик-органик при теоретическом обсуждении интересующих его вопросов мог ограничиваться примитивной теорией резонанса или даже результатами расчетов по простому мётоду Хюккеля (МОХ), сочтены. Именно справедливость этого утверждения и является причиной, по которой мы рекомендуем самому широкому кругу химиков эту не очень легкую для них книгу. Правда, применение метода МОХ дало органической химии много интересных и важных выводов, а полная доступность такого подхода сделала его исключительно привлекательным. Не случайно книга Стрейтвизера Теория молекулярных орбит для химиков-органиков ), в которой изложен этот метод и его приложения, — одна из наиболее часто цитируемых книг в мировой химической литературе. Однако со времени выхода этой монографии прошло более 10 лет, причем это были годы чрезвычайно интенсивной работы химиков-теоретиков, в результате которой в круг их рассмотрения включались не только новые объекты, но и развивался йовый подход, основанный на более глубоком анализе самого метода молекулярных орбита-лей. Выводы, к которым привело это направление, оказались не особенно утешительными для сторонников примитивной теории. На основании детального анализа было продемонстрировано, что применение метода Хюккеля надежно обосновано только для ограниченного круга систем (альтернантных углеводородов), распространение же его на другие молекулы (не-альтернантные углеводороды, системы с гетероатомами и т. п.) является недопустимым произволом и может приводить (и уже приводило) к ошибочным заключениям. Поэтому оставаться на старых позициях оказалось невозможным. Настоящая книга и предназначена для того, чтобы служить трамплином для овладения более современным подходом, его идеями, методами и результатами. Правда, для этого необходимо преодоление некоторых трудностей. Химика могут насторожить первые главы книги, в которых нет ни одной химической формулы и на первый взгляд слишком много математических формул. Но это не должно служить препятствием для чтения этих глав. Дело [c.5]
При чтении работ А. М. Бутлерова необходимо иметь в виду, что в работах № 1—8 и диссертациях он пользуется эквивалентными весами для углерода и кислорода, т. е. в этих работах С = 6 и О = 8 во всех остальных работах он употребляет а гомные веса, однако, для отличия между собою знаков, соответствующих эквивалентным и атомным весам элементов, перечеркивает, как это было принято в конце 1850-х — начале 60-х годов, атомные знаки углерода, кислорода, серы, цинка и т. д., т. е. пишет = 12, -0- = 16, 2п = 65 и т. д. (работы № 9—24 и 28). Обычное для французских журналов написание в химических формулах индексов вверху в настоящем издании везде заменено на написание их внизу как из соображений единообразия, так и потому, что сам А. М. Бутлеров в своих статьях па французском языке в изданиях Петербургской Академии Наук всегда писал индексы внизу. [c.10]
Химическая номенклатура состоит из формул и названий при этом название должно адекватно описывать формулу (т. е. состав). В части, посвященной номенклатуре неорганических веществ (глава 2), авторы книги уделяют основное внимание изложению и иллюстрированию правил построения названий соединений, но почти не рассматривают правил построения формул. По нашему глубокому убеждению написание формул должно подчиняться таким же строгим правилам, как и построение их систематических названий. Тогда переход от формулы к названию неорганического соединения окажется весьма простым и будет заключаться в чтении формулы справа налево с заменой химических символов элементов (или групп симво-“ [c.10]
Сз ществующая номенклатура складывалась стихийно, и ее состояние нельзя считать отвечающим современным требованиям. Если способы написания ф о р -м у л, в основном, общеприняты и особых изменений не требуют, то значительно хуже обстоит дело с названиями соединений. Как известно, в настоящее время параллельно применяются две основные номенклатуры таких названий — старая русская (хлористый натрий и т. п.) и приближенная к международной латинизированная (хлорид натрия и т. п.). Обе они используют заимствованную в начале прошлого века из Франции неудобную систему обратного чтения формул (тогда еще писали С1Ыа, 80 Ыа и т. д.). Очевидно, что при совершенствовании номенклатуры разумно стремиться к минимализацин логических операций, необходимых для перехода от формул к названиям и обратно, т. е. строить названия по ходу формул . Это становится особенно актуальным в связи с уже намечающимися возможностями автоматизированной обработки химических данных при помощи электронных счетно-логических машин. [c.532]
А. Петренко, Т. И. Шушаиская, М. Я. Голобородько и др. Ими установлено, что сведения о фактах большинство учаидих-ся усваивают лучше в процессе чтения книги, чем при слушании речи учителя. Однако не имеет смысла заменять устное изложение работой с учебником, если делаются важные теоретические обобщения, научные прогнозы. Учащиеся могут самостоятельно по учебнику изучить инструкции к выполнению опытов, систематизировать в форме таблицы или схемы фактический материал, изучить несложные вопросы, например применение веществ, распространение и круговорот их в природе, общую характеристику естественных групп химических элементов. Учебник используют и как справочник для нахождения формул, цифровых данных. Учебники используют на уроке и тогда, когда надо изучить имеющиеся в нем рисунки, схемы, таблицы. [c.41]
В английском варианте Правил ШРАС названия веществ строятся по ходу формул (например, K l — калия хлорид, h3S — водорода сульфид), что не согласуется с правилами русского литературного языка. В соответствии с традицией, существующей в русском химическом языке, используется вариант номенклатуры с обратным чтением формул (например, Na l — хлорид натрия, aS — сульфид кальция). Порядок расположения элементов в формуле основывается на их положении в Периодической системе и электроотрицательности неметаллов (см. п. 1. ]. 4). [c.5]
За исключением отдельных, специальных случаев, вычисление изотермически-изохорной работы реакции мало интересует химиков. Это своеобразно отразилось в том, что не все авторы руководств по химической термодинамике считают нужным говорить о различии величин А и Л . Так, например, даже в таком фундаментальном курсе, как Химическая термодинамика Улиха [Е—И], величины Л и обозначены просто одним символом (К), и только при весьма внимательном чтении можно понять (из сводки формул п ед 10), что для реакций при р = onst и u = onst один и тот же символ К означает все же разные величины. [c.305]
При воспроизведении формул в нашей монографии допущено дна отступления от оригинала. Оба эти отступления, не меняя ничего ио существу, позволяют устранить излишний разнобой в написании формул. Во-первых, во всех случаях мы пишем, как обычно, цифровые индексы при знаках элементов справа внизу, хотя в прошлом, главным образом во французских изданиях, было принято писать индексы справа вверху. Во-вторых, мы не воспроизводим перечеркивапие знаков углерода, кислорода II серы, которое в 50-х и 60-х годах XIX в., во время перехода от знаков, отвечающих эквивалентам, к знакам, отвечающим атомным весам, применялось, хотя и не систематично, для отличия вторых от первых. Такое отступление от оригинала тем более оправданно, что иначе пришлось бы пользоваться перечеркнутыми и неперечеркнутыми знаками в одном и том же смысле, а неперечеркнутыми знаками в двух разных значениях, что затрудняло бы чтение книги. Таким образом, химические знаки в приводимых далее формулах имеют обычное, современное значение, если не сделано оговорки, что они отвечают эквивалентным весам. [c.5]
Отмеченная Гейнцем своеобразная манера, с которой Кекуле говорит о химическом строении, повидимому, применяется последним таь же в его учебнике п по отношению к современным теоретическим взглядам других химиков. По крайней мере, при чтении рассуждений Кеку. ю о рациональных формулах (Lehrb., ILS. 246) создается впечатление, что все возникшие за последние годы идеи о способе соединения атомов в молекулах высказаны впервые самим Кекуле. В статье такой прием, пожалуй, был бы безвреден. На основапип же учебника учащийся должен будет считать одного Кекуле создателем современных взглядов, относящихся к способу соединения атомов. Между тем этп взг,ляды не являются, подобно унитарной системе, созданием одного человека они стали нам ясны благодаря усилиям многих химиков и постепенно завоевали себе в науке почетное положе-пне, причем среди этих химиков Кекуле, несомненно, занимает одно из самых выдающихся мест. [c.133]
chem21.info
Читать книгу Химия. Периодическая система химических элементов Д.И. Менделеева и строение атомов Антонины Гуровой : онлайн чтение
2.4. Электронные орбитали
В зависимости от запаса энергии электрона каждый энергетический уровень делится на подуровни – место наиболее вероятного нахождения электрона.
Часть околоядерного пространства, в которой вероятность нахождения электрона достаточно велика, называется электронной орбиталью.
Различают 4 вида электронных орбиталей: s, p, d, f. Они отличаются формой и энергией: s-орбиталь имеет форму сферы и не имеет направления в пространстве, максимально на этой орбитали может находится два электрона;
p-орбитали имеют форму симметричной восьмерки и три направления в пространстве во взаимно перпендикулярных плоскостях (х, у, z). Различают рх-, ру-, рz-орбитали. Максимально на них может располагаться 6 электронов – по два на каждой;
d-орбитали имеют 5 направлений в пространстве, и максимально на них может располагаться 10 электронов;
f-орбитали имеют 7 направлений в пространстве, и максимально на них может располагаться 14 электронов.
Графически положение орбиталей в пространстве с учетом их количества можно изобразить следующим образом:
s-подуровень содержит одну электронную орбиталь
p-подуровень содержит три электронные орбитали
d-подуровень содержит пять электронных орбиталей
f-подуровень содержит семь электронных орбиталей
С увеличением энергии электрона и номера энергетического уровня размер электронного облака увеличивается.
Электроны заполняют орбитали энергетического уровня строго последовательно. Каждая следующая орбиталь заполняется электронами после полного завершения предыдущей орбитали.
Число орбиталей на каждом уровне совпадает с номером энергетического уровня.
1-й энергетический уровень – s-орбиталь,
2-й энергетический уровень – s-,р-орбитали,
3-й энергетический уровень – s-,р-,d-орбитали,
4-й энергетический уровень – s-,р-,d-, f-орбитали.
2.5. Электронные и электронно-графические формулы строения атома
Чтобы правильно изображать электронные конфигурации различных атомов, нужно знать:
1) число электронов в атоме (равно порядковому (атомному)) номеру элемента;
2) максимальное число электронов на энергетических уровнях, подуровнях;
3) порядок заполнения энергетических уровней и подуровней (орбиталей).
Задания
2.5.1 II. Запишите строение атома и составьте электронную формулу, электронно-графическую формулу элемента № 17.
Ответ. Элемент № 17 – хлор, заряд ядра атома +17, электронов в атоме 17. Элемент находится в 3-м большом периоде, следовательно, в атоме три энергетических уровня, в УПА группе, следовательно, семь электронов на внешнем энергетическом уровне.
2.5.2. Установите соответствие между элементом и его электронной формулой.
Определите принадлежность каждого элемента к группе металлов, неметаллов, благородных газов.
См. образец ответа к заданию 2.3.4.
2.5.3. По порядковому номеру следующих элементов определите количество электронов на внешнем энергетическом уровне их атомов: а) № 14; б) № 8; в) № 4; г) № 9; д) № 13.
2.5.4. По электронной формуле определите элемент 4-го периода, IА группы:
а) 1s22s22р63s1;
б) 1s22s22р63s23р64s2;
в) 1s22s22р63s23р2;
г) 1s22s22р63s23р64s1.
2.5.5. В химии используют запись в виде сокращенных электронных формул, в которых указываются только незавершенные энергетические уровни. Укажите элементы по сокращенным электронным формулам:
См. образец ответа к заданию 2.3.4 (II способ).
2.6. Квантовые числа
Состояние электрона в атоме определяется четырьмя квантовыми числами. Квантовые числа – это энергетическая характеристика электрона.
Главное квантовое число n численно совпадает с номером энергетического уровня. Это основная, но не единственная характеристика электрона.
Чем дальше расположен электрон от ядра, тем больше его главное квантовое число и больше запас энергии.
Максимальное число электронов, находящихся на энергетически устойчивом, заполненном уровне, равно 2n2.
Побочное квантовое число l – принимает значения от 0 до n – 1 и характеризует форму электронной орбитали (s, p, d, f).
Число значений l для каждого энергетического уровня численно равно главному квантовому числу этого энергетического уровня.
Энергия состояния электрона в атоме определяется суммой главного и побочного квантовых чисел (n + l). По этой формуле можно точно определить порядок распределения электронов в атоме. Первыми заполняются те энергетические уровни, которые имеют наименьшее значение главного квантового числа.
При равных суммах n + l первыми заполняются те орбитали, у которых значение главного квантового числа меньше.
Так как n = 3 меньше, чем n = 4, то электроны заполняют сначала 3р-орбиталь.
Магнитное квантовое число m – принимает целые значения от – l через 0 до +1 и определяет направление электронных орбита-лей в пространстве.
Графически орбиталь изображается в виде клетки (квантовой ячейки):
Спиновое квантовое число ms– характеризует два возможных направления вращения (спин) электронов вокруг собственной оси.
Оно имеет два значения: +½ и – ½. Электрон со спином +½ изображают ↑, а со спином – ½ ↓.
На одной орбитали может быть не более двух электронов с противоположными спинами ↑↓.
Принципы заполнения электронных орбиталей
1. Принцип наименьшей энергии (правило Клечковского) n + l.
Подуровни заполняются в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы – в порядке увеличения значения n (рис. 6).
2. Принцип Паули.
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковые.
При одинаковом наборе трех квантовых чисел спиновое квантовое число обязательно будет различным (+½, -½).
3. Правило Хунда.
Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
При заполнении подуровня, имеющего свободные орбитали, на каждой орбитали располагается по одному электрону с положительным спином. Затем происходит последовательное дозаполнение этих же орбиталей электронами с отрицательным спином.
Рис. 6. Порядок заполнения электронных орбиталей на энергетических уровнях и подуровнях
Все элементы разделяются на 4 электронных семейства: в-элементы, р-элементы, d-элементы, f-элементы, в зависимости от того, какой подуровень заполняется последним.
Рассмотрим заполнение энергетических орбиталей в атомах элементов главных и побочных подгрупп.
В атоме кальция последним заполняется s-подуровень внешнего энергетического уровня, поэтому кальций относится к s-элемен-там.
Элементы, в атомах которых заполняется последним в-подуровень внешнего энергетического уровня, называются в-эле-ментами.
В атоме кремния последним заполняется р-подуровень внешнего энергетического уровня, поэтому кремний относится к р-элементам.
Элементы, в атомах которых заполняется последним р-подуровень внешнего энергетического уровня называются р-эле-ментами.
В главных (А) подгруппах Периодической системы химических элементов Д.И. Менделеева находятся s– и р-элементы.
У скандия заполняется последним пред-внешний d-подуровень, поэтому скандий является d-элементом.
У d-элементов последним заполняется d-подуровень предвнешнего энергетического уровня.
У церия заполняется последним предпредвнешний f-подуровень, поэтому церий является f-элементом.
У f-элементов последним заполняется третий снаружи энергетический уровень – f-подуровень.
В побочных (В) подгруппах Периодической системы химических элементов Д.И. Менделеева находятся d– и f-элементы.
Чтобы избежать записи длинных электронных формул, используют их сокращенный вариант. В сокращенной электронной формуле в квадратных скобках записывают знак ближайшего химического элемента – благородного газа, у которого энергетические уровни полностью завершены.
20Са 1s2 2s22р6 3s23р64s2 [Ar] 4s2
14Si 1s2 2s22р6 3s23р2 [Ne] 3s23р2
21Sc 1s2 2s22р63s23р64s23d1 [Ar] 3s23р2
58Се 1s2 2s22р63s23р64s23d104р65s24d105р6 6s24f2 [Xe] 6s24f2
На внешнем энергетическом уровне для элементов А-подгрупп и предвнешнем и предпред-внешнем энергетических уровнях для элементов В-подгрупп находятся электроны, которые называются валентными. Сумма этих электронов равна номеру группы. В побочных (В) подгруппах у некоторых d-элементов наблюдается «провал» электрона. Для более устойчивого состояния атома электрон с внешнего в-подуровня переходит на d-орбиталь предвнешнего энергетического уровня, что объясняется наиболее устойчивым состоянием электронных форм d5и d10. «Провал» электрона наблюдается, например, в атомах хрома, меди.
Таблица. Масимальное оличество элетронов на энергетичесих уровнях и подуровнях
Задания
2.6.1 II. Записать электронные орбитали в порядке возрастания энергии: 4d 5s 5р.
Ответ. Запас энергии электронов на орбиталях рассчитывается по принципу наименьшей энергии (правило Клечковского) n + l.
2.6.2. Какой из подуровней заполняется электронами раньше:
Зd или 4s; 4р, 4f или 5s. Запишите их в порядке возрастания энергии?
2.6.3 II. Какой завершенный энергетический уровень характеризуют электронные формулы:
а) ns2;
б) ns2np6nd10nf14;
в) ns2np6.
Ответ. Максимальное количество электронов на энергетическом уровне рассчитывают по формуле 2n2. В примере а) максимальное количество электронов на энергетическом уровне 2, следовательно, 2n2 = 2, откуда n = 1.
2.6.4 II. Напишите электронные формулы элементов, атомы которых содержат:
а) на 3d-подуровне три электрона;
б) на 4р-подуровне один электрон;
в) на 2р-подуровне три электрона;
г) на 3d-подуровне пять электронов.
Так как последним завершается d-подуровень, это d-элемент. Он находится в побочной (В) подгруппе. У элементов побочных подгрупп валентные электроны располагаются на в-орбитали внешнего энергетического уровня и на d-орбитали предвнешнего энергетического уровня. Следовательно, валентные электроны 4s23d3, их сумма равна 5. Это элемент VB группы, побочной подгруппы, 4-го периода, т. к. 4 энергетических уровня. Это – ванадий V,элемент № 23.
2.6.5. Напишите электронные формулы атомов серы, магний, цинка, меди. Укажите, к каким семействам относятся данные элементы.
2.7. Ионы
Атомы химических элементов являются электронейтральными частицами. В атомах металлов и неметаллов внешний энергетический уровень не завершен. Электроны внешнего энергетического уровня, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав внешнего энергетического уровня последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, т. к. количество протонов в ядре атома превышает количество оставшихся отрицательно заряженных электронов. Атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Заряд иона численно совпадает с количеством отданных или принятых электронов.
Электронные формулы
Электронно-графические формулы
Следует знать, что одинаковую электронную формулу могут иметь и атомы, и ионы.
Например: электронная формула [Ne]3s23р6 соответствует строению атома аргона Аr0, отрицательным ионам С1–, s2-, положительным ионам К+, Са2+.
Потеря атомом электронов приводит к уменьшению его размеров, а присоединение избыточных электронов – к увеличению. Радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома.
Задания
2.7.1 II. В ядре 7 протонов и 7 нейтронов. Вокруг ядра движутся 6 электронов. Как называется эта частица?
Ответ. Протонов р+ = 7, электронов е– = 6, эначит положительно заряженный ион (катион). Число протонов соответствует порядковому (атомному) номеру элемента в Периодической системе химических элементов Д.И. Менделеева. Следовательно, это ион N+.
2.7.2. В ядре частицы 8 протонов. Вокруг ядра вращаются 10 электронов. Как называется такая частица?
2.7.3 II. Чем отличается строение атома аллюминия Al3+?
Ответ.
Ион А13+ не имеет электронов на третьем энергетическом уровне.
2.7.4. Чем отличается строение атома серы от строения иона серы S2-?
2.7.5. Напишите электронные формулы для ионов N3-, Zn2+. Атомам каких химических элементов соответствуют эти формулы?
3. Периодический закон. Периодическая система химических элементов Д.И. Менделеева в свете строения атома
После отрытия строения атома стало возможным дать более точную современную формулирову Периодического закона: свойства химических элементов и образованных им и соединений находятся в периодической зависимости от заряда ядра их атомов.
В Периодической системе химических элементов Д. И. Менделеева, графическом изображении Периодического закона, каждое обозначение: порядковый (атомный) номер элемента, номер периода, номер группы связано со строением атома.
Для элементов неметаллов по номеру группы можно определить низшую степень окисления и количество непарных электронов на внешнем энергетическом уровне атома. Для этого из номера группы, в которой находится элемент, надо вычесть максимальный номер группы 8.
Причина изменения свойств также объясняется строением атомов химических элементов.
Каждый период начинается элементом щелочным металлом (исключение – первый период), в атомах которых на внешнем энергетическом уровне имеются один я-электрон. Общая электронная формула строения внешнего энергетического уровня щелочных металлов ns10,где n – номер периода.
Каждый период заканчивается элементом благородным газом. В атомах элементов благородных газов на внешнем энергетическом уровне имеются два я– и шесть р-электронов. Общая электронная формула строения внешнего энергетического уровня благородных газов ms2np6, где n – номер периода (исключение: гелий Не – ns2).
Период – это горизонтальная последовательность элементов по возрастанию порядкового (атомного) номера элемента, атомы которых имеют одинаковое число энергетических уровней, численно равное номеру периода.
В периодах металлические свойства уменьшаются, а неметаллические свойства увеличиваются. В больших периодах изменения свойств происходят медленнее, что объясняется появлением десяти d-элементов (4-й, 5-й периоды) и четырнадцати f-элементов (6-й, 7-й периоды).
По группам (в главных подгруппах) металлические свойства увеличиваются, а неметаллические уменьшаются.
Группа – это вертикальная последовательность элементов по возрастанию порядкового (атомного) номера, обладающая схожими свойствами.
Главная подгруппа – это вертикальная последовательность в– и р-элементов с одинаковым числом электронов на внешнем энергетическом уровне, равным номеру группы.
Побочная подгруппа – это вертикальная последовательность d– и f-элементов, которые имеют одинаковое суммарное количество валентных электронов.
Следовательно, возможна третья формулировка Периодического закона, которая отражает причину периодического изменения свойств.
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от строения внешних энергетических уровней атомов.
Изменение свойств элементов по диагонали
Под диагональной периодичностью понимают повторяемость сходства химических свойств простых веществ и соединений элементов, расположенных по диагонали друг от друга. Диагональ из левого верхнего угла к нижнему правому объединяет отчасти сходные элементы. Это объясняется приблизительно одинаковым увеличением неметаллических свойств в периодах и металлических свойств в группах.
Литий Li и его соединения больше похожи на магний Mg и его соединения. Бор В больше напоминает кремний Si, чем алюминий Аl.
Если провести диагональ от бериллия 4Ве до астата 85Аt, то она условно разделит элементы на металлы и неметаллы. Вдоль этой диагонали будут расположены переходные элементы, соединения которых обладают ам-фотерными (двойственными) свойствами.
«Звездная периодичность» химических элементов
Под «звездной периодичностью» подразумевают изменение свойств элементов с учетом горизонтальной, вертикальной и диагональной периодичности.
«Звездная периодичность» наблюдается как у элементов главных, так и побочных подгрупп.
Рис. 8. «Звездность» Периодической системы
Свойства центрального элемента являются средними из свойств элементов, окружающих его.
Обобщение всех видов периодичности изменений свойств элементов позволяет предсказывать и открывать новые химические элементы.
Задания
3.1 II. Укажите, к какому электронному семейству относятся следующие элементы:
а) 56Ва б) 41Nb, в) 53I, г) 26Ре.
Ответ.
3.2 II. По электронной формуле внешнего энергетического уровня:
а) 4s24р6, б) 5s25р3, в) 6s26р2, г) 3s2,д) 3d64s2 – определите, какой это элемент. Укажите, к какому электронному семейству они относятся.
Ответ: а) 4s24р6 – это элемент 4-го большого периода, т. к. в атоме четыре энергетических уровня; VIII группы, т. к. сумма валентных электронов равна 8; главной (А) подгруппы, т. к. это р-элемент (последней электронами заполняется р-орбиталь). Следовательно, это криптон Кr.
3.3 II. По положению элемента в Периодической системе определите, какой элемент имеет больший радиус атома и большую электроотрицательность: а) 32Gе и 35Вr; б) 17Сl и 35Вr; в) 12Mg и 56Ва; г) 80Hg и 85At. Ответ поясните.
Ответ. Радиус атома по периоду уменьшается, а по группе возрастает.
(Ассоциация: «Снежная баба, смотрящая вдаль»)
Электроотрицательность (Э.О.), наоборот, по периоду возрастает, по группе уменьшается.
а) 32Gе и 35Вг – это элементы одного периода, следовательно, радиус атома германия Gе больше радиуса атома брома Вг, а электроотрицательность Gе меньше электроотрицательности брома Вг.
Rа(Gе) > Rа(Вr), Э.О.(Gе) < Э.О.(Bг).
3.4 II. 33Аs и 35Вг являются неметаллами. Какие свойства проявляет селен 34Sе?
Ответ. 33Аs, 34Sе, 35Вг.
Элемент селен находится между элементами мышьяком и бромом в одном периоде. Следовательно, он будет проявлять свойства средние между свойствами своих соседей (горизонтальное сходство). 33Аs – неметалл, 35Вг – очень активный неметалл, 34Sе – неметалл со средней химической активностью.
3.5 II. Сколько валентных электронов в атомах следующих элементов: а) 4Ве; б) 25Мn; в) 50Sn?
Ответ. а) 4Ве – элемент № 4, находится во 2-м малом периоде, во II группе, главной (А) подгруппе. Следовательно, он имеет на внешнем энергетическом уровне атома два валентных электрона (…2в2).
4. Изменения свойств простых веществ и соединений элементов в периодах и подгруппах
Малые периоды (второй, третий) Периодической системы химических элементов Д.И. Менделеева являются типичными, так как в них элементы расположены в один ряд и четко прослеживается изменение свойств элементов и их соединений от неметаллических к металлическим; хорошо видна причинно-следственная связь между строением атома и свойствами.
Первый период тоже считается малым, но в нем только два элемента, поэтому к типичным его не относят.
Характеристики и свойства атомов химических элементов, простых веществ и соединений элементов определяются: зарядом ядра, радиусом, числом электронов на внешнем энергетическом уровне атома.
Рассмотрим элементы третьего периода.
Большие периоды
В четных рядах больших периодов ослабление металлических свойств происходит медленнее, что объясняется присутствием d-элементов (в 4-м, 5-м периоде) и f-элементов (в 6-м, 7-м периодах), имеющих схожее строение. Сжатие их электронного облака происходит в меньшей степени, т. к. структура внешнего энергетического уровня остается неизменной. Это незначительно влияет на уменьшение радиуса атомов и всех других свойств этих элементов и их соединений.
В нечетных рядах больших периодов свойства элементов и их соединений изменяются аналогично изменению свойств элементов малых периодов.
Главные (А) подгруппы
В IА, IIА, IIIА (кроме бора 5В) группах Периодической системы химических элементов Д.И. Менделеева находятся элементы металлы, активность которых усиливается с увеличением порядкового (атомного) номера элемента.
Таблица. Элементы IА группы
Элементы VIIА группы
Особое двойственное положение в Периодической системе химических элементов Д.И. Менделеева занимает элемент 1Н. Это объясняется электронным строением его атома – 1s1.До завершения энергетического уровня атому водорода не хватает одного электрона, который он может принимать, проявляя окислительные свойства. В этом его сходство с элементами VII(А) группы.
Атом водорода может и отдать один электрон, проявляя при этом восстановительные свойства. В этом его сходство с элементами
I(А) группы – щелочными металлами.
Побочные (В) подгруппы
Атомы элементов побочных подгрупп в большинстве имеют на внешнем энергетическом уровне два s-электрона. Они отличаются по занятости внутренних d– и (или) f-орбиталей. Сходство между элементами главных и побочных подгрупп одной группы сильно увеличивается от первой группы к четвертой, потом быстро уменьшается от четвертой группы к седьмой. Химические свойства элементов побочных подгрупп меняются значительно меньше, чем в главных подгруппах. В различных соединениях элементы побочных подгрупп часто имеют разные степени окисления. В отличие от соединений элементов главных подгрупп внутри побочной подгруппы стабильность соединений элементов в высшей степени окисления увеличивается. Оксиды элементов побочных подгрупп в низшей положительной степени окисления проявляют основные свойства, в промежуточной – амфотерные, в высшей положительной степени окисления – кислотные свойства.
Например: элемент VIВ группы хром 24Сг образует следующие оксиды:
Периодическая повторяемость свойств элементов связана с повторяемостью числа электронов на внешнем энергетическом уровне, где располагаются электроны, участвующие в химических превращениях, поэтому многие элементы со сходными свойствами имеют исторически сложившиеся групповые названия.
Рассмотрев изменения свойств простых веществ и их соединений по периодам и группам, можно сделать вывод: свойства простого вещества и соединений химического элемента являются промежуточными между двумя соседними с ним элементами по периоду и подгруппе.
Физический смысл Периодического закона стал понятен после создания теории строения атома. Но сама эта теория развивалась на основе Периодического закона и Периодической системы Д. И. Менделеева. Периодический закон – один из основных законов природы и важнейший закон химии.
Задания
4.1 II. Какой из двух элементов обладает более выраженными неметаллическими свойствами: а) Р или Si, б) Сl или I, в) Аs или Sе?
Ответ. В Периодической системе химических элементов Д.И. Менделеева неметаллические свойства по периоду усиливаются, по группе ослабевают. С точки зрения строения атома на внешнем энергетическом уровне атомов неметаллов находятся от четырех до семи электронов, следовательно, чем больше электронов на внешнем энергетическом уровне, тем активнее неметалл.
а) P или Si – фосфор № 15 и кремний № 14 элементы одного периода. В Периодической системе химических элементов Д.И. Менделеева по периоду сначала стоит кремний, а затем фосфор. Кремний – элемент IVA группы, следовательно, в его атоме 4 электрона на внешнем энергетическом уровне. У фосфора 5 электронов на внешнем энергетическом уровне, т. к. это элемент VA группы. Вывод: фосфор обладает более ярко выраженными неметаллическими свойствами.
4.2. Какой из элементов 4-го периода обладает наиболее ярко выраженными металлическими свойствами: цинк, медь, хром, калий? Ответ объясните.
4.3 II. Как изменяется характер оксидов в ряду Li2O, ВеО, В2О3, CO2, N2O5?
Ответ. Данные оксиды образованы элементами 2-го малого периода. Свойства элементов по периоду с увеличением порядкового (атомного) номера изменяются от металлических через переходные элементы к неметаллическим. Переходным элементом в данном периоде является бериллий Ве, следовательно…
4.4. Выберите элемент: селен, барий, алюминий, оксид которого проявляет: а) основные свойства; б) кислотные свойства.
4.5. Выберите формулу амфотерного оксида: Сl207, Р205, Аl203, SОд, MgО.
4.6. Как изменяется радиус атома у элементов 2-го периода с возрастанием порядкового (атомного) номера элемента?
а) Уменьшается;
б) увеличивается;
в) не изменяется.
4.7. Сравните кислотные свойства растворов сероводорода Н2S и селеноводорода Н2Sе.
4.8. Укажите формулу оксида, образованного элементом IV группы: RО3, RО2, R2О7, R2О5 (R – обозначение элемента).
4.9. Используя Периодическую систему химических элементов Д. И. Менделеева, определите низшую степень окисления серы.
4.10. Выберите общую формулу водородного соединения, образованного элементом V группы: НR, Н2R, RН3, RН4.
iknigi.net



