Имин химия – Имины — Википедия
Имины — Википедия
Материал из Википедии — свободной энциклопедии
Структура иминов. Иминогруппа выделена синим.Имины — органические соединения общей формулы R1R2C=NR3, где R1, R2 — H, Alk, Ar и R3 — H, Alk, Ar, азотистые аналоги альдегидов (R2 — H, альдимины) и кетонов (R1, R2 — Alk, Ar, кетимины), содержащие фрагмент NR3, соединенный двойной связью с атомом углерода.
К иминам относятся также азометины (основания Шиффа).
В систематической номенклатуре IUPAC суффикс -имин используется для обозначения группы C=NH (без атома углерода)[1].
Имины – маслообразные или кристаллические вещества, обычно нерастворимые в воде и растворимые в органических растворителях.
Несопряженные имины бесцветны, при сопряжении аминогруппы с ароматической системой или системой двойных связей – окрашены и используются в качестве красителей (азометиновые красители) и индикаторов, например, мурексид:
Характеристическая полоса иминогруппы в ИК-спектрах алифатических иминов лежит в области 1690-1640 см−1, у ароматических (N-бензилиденанилинов) – в области 1631-1613 см−1.
Атом азота в иминах слабонуклеофилен, атом углерода – электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR1 + R2Hal →{\displaystyle \to } R2C=N+R1R2•Hal−
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы (азетидин-2-оны)
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов
ru.wikipedia.org
Имины
01 марта 2011Оглавление:
1. Имины
2. Синтез
Структура иминов. Иминогруппа выделена синим.
органические соединения общей формулы RRC=NR, где R, R H, Alk, Ar и R H, Alk, Ar, азотистые аналоги альдегидов и кетонов, содержащие фрагмент NR, соединенный двойной связью с атомом углерода.
К иминам относятся также азометины.
В систематической номенклатуре IUPAC суффикс -имин используется для обозначения группы C=NH.
Реакционная способность
Атом азота в иминах слабонуклеофилен, атом углерода – электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR + RHal R2C=NRR•Hal
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
- R2C=NR + H2O R2C=O + RNH2
Реакции иминов с аминами приводят к образованию аминалей:
- R2C=NR + RNH2 R2C2
Реакция иминов с цианистым водородом либо триметилсилилцианидом является вариантом реакции Штреккера и, в случае N-замещенных иминов, может служить методом синтеза N-замещенных α-аминокислот:
- R2C=NR + HCN R2CCN
- R2CCN + 2H2O R2CCOOH + NH3
Взаимодействие реактивов Гриньяра и литийорганических соединений с иминами ведет к C-алкилированию последних с образованием аминов:
- R2C=NR + RLi R2RCN R Li
- R2RCN R Li + H2O R2RCNHR + LiOH
Имины вступают в различные реакции циклоприсоединения, образуя с карбенами продукты-циклоприсоединения – азиридины, с кетенами идет-циклоприсоединение с образованием азетидин-2-оны:
С 1,3-диполярными соединениями образуются пятичленные гетероциклы – продукты-циклоприсоединения.
Имины также могут выступать в роли диенофилов в реакции Дильса-Альдера:
Под действием энергичных восстановителей имины восстанавливаются до вторичных аминов:
- R2C=NR + R2CH-NHR
Имины, образованные из енолизирующихся карбонильных соединений, способны к имин-енаминной таутомерии:
Просмотров: 3491
4108.ru
Имины – это… Что такое Имины?
Структура иминов. Иминогруппа выделена синим.Имины — органические соединения общей формулы R1R2C=NR3, где R1, R2 — H, Alk, Ar и R3 — H, Alk, Ar, азотистые аналоги альдегидов (R2 — H, альдимины) и кетонов (R1, R2 — Alk, Ar, кетимины), содержащие фрагмент NR3, соединенный двойной связью с атомом углерода.
К иминам относятся также азометины (основания Шиффа).
В систематической номенклатуре IUPAC суффикс -имин используется для обозначения группы C=NH (без атома углерода)[1].
Реакционная способность
Атом азота в иминах слабонуклеофилен, атом углерода – электрофилен.
Имины обладают слабоосновными свойствами и в отсутствие воды могут протонироваться и алкилироваться по атому азота с образованием иминиевых солей:
- R2C=NR1 + R2Hal R2C=N+R1R2•Hal−
Иминиевые соли также образуются при алкилировании и ацилировании иминов, продукты алкилирования могут быть выделены, в случае ацилирования промежуточно образующиеся ацилиминиевые соли циклизуются в β-лактамы (азетидин-2-оны)
Реакции иминов с нуклеофилами протекают по атому углерода, весьма разнообразны и широко используются в органическом синтезе.
Так, имины гидролизуются водой с образованием карбонильных соединений и аминов, эта реакция обратна реакции синтеза иминов:
- R2C=NR1 + H2O R2C=O + R1NH2
Реакции иминов с аминами приводят к образованию аминалей (гем-диаминов):
- R2C=NR1 + R
Реакция иминов с цианистым водородом либо триметилсилилцианидом является вариантом реакции Штреккера и, в случае N-замещенных иминов, может служить методом синтеза N-замещенных α-аминокислот:
- R2C=NR1 + HCN R2C(NHR1)CN
- R2C(NHR1)CN + 2H2O R2C(NHR1)COOH + NH3
Взаимодействие реактивов Гриньяра и литийорганических соединений с иминами ведет к C-алкилированию последних с образованием аминов:
- R2C=NR1 + R2Li R2R2CN− R1 Li+
- R2R2CN− R1 Li+ + H2O R2R2CNHR1 + LiOH
Имины вступают в различные реакции циклоприсоединения, образуя с карбенами продукты (2+1)-циклоприсоединения – азиридины, с кетенами идет (2+2)-циклоприсоединение с образованием азетидин-2-оны (синтез β-лактамов по Штаудингеру, формально – ацилирования иминов кетенами):
С 1,3-диполярными соединениями (диазометаном, нитрилоксидами) образуются пятичленные гетероциклы – продукты (2+3)-циклоприсоединения.
Имины также могут выступать в роли диенофилов в реакции Дильса-Альдера[2]:
Под действием энергичных восстановителей (алюмогидрид лития, борогидрид натрия, водород над никелем Ренея и т. п.) имины восстанавливаются до вторичных аминов:
- R2C=NR1 + [H] R2CH-NHR1
Имины, образованные из енолизирующихся карбонильных соединений, способны к имин-енаминной таутомерии:
Синтез
Традиционным методом синтеза иминов является конденсация альдегидов и кетонов с первичными аминами. На первой стадии происходит нуклеофильная атака аминогруппы по электрофильному карбонильному атому углерода с образованием неустойчивого
В случае альдегидов, несущих сильные электронакцепторные заместители при альдегидной группе (хлораль, гексафторацетон и т. п.), образуются стабильные гем-аминоспирты.
Имины также могут быть синтезированы окислением вторичных аминов надкислотами:
- R2CH-NHR1 + [O] R2C=NR1 + H2O
или через образование N-хлораминов с дальнейшим отщеплением от них хлороводорода:
- R2CH-NClR1 + OH− R2C=NR1 + H2O + Cl−
Примечания
dic.academic.ru
Имины – Справочник химика 21
Гетероциклические соединения [79, 81, 154] могут присутствовать и в группе соединений основного характера и в группе соединений остаточного азота. Для качественного определения азотных гетероциклов в инфракрасной области можно пользоваться табл. 68 [79, 207]. Гетероциклические соединения с атомом азота в кольце, как правило, имеют характер вторичных аминов или иминов (пирролы, пиридины, хинолины). В их спектрах поглощения присутствуют полосы поглощения вторичных аминов или иминов, отличающихся, как уже говорилось, повышенной интенсивностью. Кроме того, присутствуют интенсивные полосы поглощения, соответствующие скелетным колебаниям кольца, валентным колебаниям замещенных колец, валентным и деформационным колебаниям водородного атома кольца. [c.134]Внутреннее строение и физико-химические свойства полимеров. Свойства полимеров зависят от особенностей их внутреннего строения и в” первую очередь от вида структурной единицы полимера, степени полимеризации, строения цепей, а также от характера и интенсивности взаимодействия между ними. Структурные единицы, составляющие данный полимер, могут содержать полярные группировки атомов, что усиливает взаимное притяжение между цепями и, в частности, при наличии гидроксильных или имино-групп (ОН, МН) приводит к образованию между ними водородных связей. Структурные единицы могут содержать двойные связи, что облегчает образование химических связей между цепями. Наличие боковых ответвлений, их размеры и характер расположения вдоль цепи влияют на взаимодействие между цепями, а также на степень кристалличности и т. д.
Восстановлением нитропроизводных можно группу NO2 превратить в NHs н получить имины. [c.41]
При действии системы К02/18-краун-6 в эфире при комнатной температуре (перемешивание в течение 4—6 ч) вторичные Ы-хлорамины превращаются в имины и далее в карбонильные соединения [977] [c.397]
Имины = NH имино- -имин [c.82]
Кроме того, нитрилы образуются из альдегидов и аммиака через промежуточную стадию дегидрирования иминов [c.422]
Азотсодержащие органические соединения объединяют несколько классов, важнейшими из которых являются амины с функциональной группой —Nh3, имины с группой =NH, цианистые соединения или нитрилы с группой—N, нитросоедипения с группой —NO2, нитрозосоединепня с группой —NO. [c.152]
Наблюдающаяся высокая химическая активность )адикалов обусловлена незаполненностью их электронных оболочек. Характерна аналогия между химическими свойствами гидридов углерода, азота, кислорода и фтора и химическими свойствами атомов с тем же числом электронов. Так, радикал СН (метин) является химическим аналогом атома Н, радикалы СНа (метилен) и NH (имин) — аналогами атома О, радикалы СН3 (метил), НН2 (аминогруппа) и ОН (гидроксил) — аналогами атома К и, наконец, молекулы СН4, N1 3, Н2О и НГ в известном смысле (инертность) аналогичны атому N6. Благодаря химической ненасыщенности радикалов энергия активации нроцессов, протекающих с их участием, имеет порядок величины энергии активации атомных реакций. Поэтому такие процессы, как правило, идут приблизительно с такой же скоростью, с какой идут атомные процессы. [c.34]
Названия соединений, в которых двухвалентная группа >NH замыкает цепь атомов угле )ода, образуют, добавляя суффикс -имин к названию соответствующего углеводорода с тем же числом атомов углерода и водорода, что и в данном соединении [c.286]
Этиленимин. Действием тионилхлорида на мопоэтанола1 ипгид-рохлорид при 80—90° или действием газообразного хлористого водорода па моноэтаноламин при 160° [311 получают Р-хлорэтиламингидрохлорид, который под действием водных щелочей при 90—100° переходит в этилеп-имин [c.195]
Связь = N. В спектрах алифатических иминов полоса С = N-связи обычно расположена в области 1G70 см и смещена в сторону меньших частот в случае сопряженных и ароматических [c.133]
ПАВ, содержащие функциональные группы с положительным суммарным электронным эффектом (например, амины, амиды, имины и др.), несколько меньше, чем ПАВ первой группы, повышают диэлектрическую проницаемость бензола (табл. 6.5). В их присутствии увеличивается энергия выхода электрона из металла (ДКРП отрицательна) (см. рис. 6.13), в [c.300]
Для осуществления реакции между аммиаком и спиртами мож-1 0 применять н дегидрирующие катализаторы (медь, никель, кобальт, нанесенные, например, на оксид алюминия). В этом случае лгехагтзм реакции совершенно иной —вначале происходит дегидрирование спирта в альдегид, а затем конденсация альдегида с аммиаком и гидрирование образующегося имина [c.280]
Выбор температурного интервала окисления. Окисление будет протекат цепным путем (о и,) при небольшом и,. Из условия и = получаем для цепного режима условия и иманометрическая установка позволяет измерять достаточно надежно скорости поглощения кислорода и>Цмин. Следовательно, измерить а можно только в таких условиях, когда а2>и>и ин, т. е. Иминповышением температуры. Поэтому существует такая температура Гмин, ниже которой на данной установке параметр а определить уже нельзя, и опыты надо проводить при 7 >7 мнн. Если известен температурный ход а (lga=lgЛa— —Ед/2,ЗНТ), то можно вычислить Т МИН используя Н0рЭ.В6НСТВО [c.56]
Если реакция (2) протекает быстро, то скорость окислительного аммонолиза, как и наблюдалось на опыте, равна скорости образования акролеина. Пока еще не установлено, является реакция (2) гомогенной или гетерогенной. Ее можно представить как образование имина СН2=СН— H=NH с последующей окислительной дегидрогенизацией, но эти соединения весьма неустойчивы и легко полимеризуются. Известно, однако, что на катализаторе М0О3 в присутствии аммиака протекает превращение акролеина в нитрил. [c.161]
Для первичных и вторичных аминов (имеющих подвижный атом водорода в аминной группе) механизм ингибирующего действия заключается в линейном обрыве цепи в результате образования иминных радикалов [c.61]
Указанный механизм подтверждается присутствием иминных радикалов, а также структурой ожидаемых конечных продуктов окисления. Иминный радикал в свою очередь взаимодействует С пероксидным, в результате чего образуются алкоксильные и азо-токсидные радикалы [c.61]
Все эти катализаторы работают по рассмотренному ранее окислительно-восстановительному механизму, и скорость реакции зависит только от парциального давления пропилена (г = йЯсзНб )> свидетельствуя о лимитирующей стадии взаимодействия пропилена с окисленным активным центром катализатора, где образуется хе-мосорбированный аллильный радикал. В свою очередь, на другом активном центре сорбируется аммиак, вероятно, в виде иминного радикала NH. Взаимодействие их друг с другом с участием кислорода решетки и дает акрилонитрил. [c.424]
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.102 , c.120 , c.136 ]
Органикум. Практикум по органической химии. Т.2 (1979) — [ c.58 ]
Химический энциклопедический словарь (1983) — [ c.218 ]
Синтезы органических препаратов Сб.3 (1952) — [ c.0 ]
Углублённый курс органической химии книга2 (1981) — [ c.25 ]
Названия органических соединений (1980) — [ c.191 , c.195 , c.280 ]
Синтетические методы органической химии (1982) — [ c.90 , c.112 , c.215 , c.277 ]
Органическая химия (1974) — [ c.698 , c.699 ]
Общая органическая химия Т.7 (1984) — [ c.65 , c.71 ]
Количественный органический анализ по функциональным группам (1983) — [ c.0 ]
Биоорганическая химия (1991) — [ c.189 , c.190 , c.228 , c.333 ]
Органическая химия Часть 2 (1994) — [ c.225 , c.226 ]
Химия Краткий словарь (2002) — [ c.124 ]
Основы современной химии гетероциклических соединений (1971) — [ c.0 ]
Органическая химия Том1 (2004) — [ c.58 ]
Справочник Химия изд.2 (2000) — [ c.498 ]
Катализ в неорганической и органической химии книга вторая (1949) — [ c.40 , c.601 ]
Органическая химия (1964) — [ c.82 , c.83 ]
Алюмогидрид лития и его применение в органической химии (1957) — [ c.135 ]
Основы органической химии (1983) — [ c.153 , c.155 , c.166 , c.184 , c.323 ]
Механизмы реакций в органической химии (1991) — [ c.245 ]
Межфазный катализ в органическом синтезе (1980) — [ c.71 , c.309 ]
Электрохимический синтез органических веществ (1976) — [ c.170 ]
Методы эксперимента в органической химии Часть 2 (1950) — [ c.274 ]
Основы органической химии 1 Издание 2 (1978) — [ c.488 ]
Органикум Часть2 (1992) — [ c.2 , c.69 ]
Химия илидов (1969) — [ c.0 ]
Органическая химия (1972) — [ c.304 ]
Комплексные гидриды в органической химии (1971) — [ c.224 ]
Электрохимический синтез органических веществ (1976) — [ c.170 ]
Химия координационных соединений (1985) — [ c.354 , c.355 ]
Органическая химия (1972) — [ c.304 ]
Органическая химия Издание 2 (1976) — [ c.312 ]
Органическая химия Том 1 (1963) — [ c.537 , c.631 ]
Новые воззрения в органической химии (1960) — [ c.297 ]
Катализ в химии и энзимологии (1972) — [ c.152 , c.157 , c.192 ]
Органическая химия (1964) — [ c.82 , c.83 ]
Справочное руководство по эпоксидным смолам (1973) — [ c.87 ]
Акваметрия (1952) — [ c.397 ]
Органическая химия Том 1 (1962) — [ c.537 , c.631 ]
Курс физической органический химии (1972) — [ c.481 ]
Синтезы органических препаратов Сборник 3 (1952) — [ c.0 ]
Биохимия Издание 2 (1962) — [ c.360 ]
Определение строения органических соединений (2006) — [ c.12 , c.130 , c.217 , c.278 ]
Иммобилизованные ферменты (1987) — [ c.91 ]
chem21.info
Имины получение – Справочник химика 21
Его применяют при аллергиях (бронхиальной астме, сенной лихорадке и др.) так же, как и адреналин. Синтезируют рацемический эфедрин (псевдоэфедрин) действием метиламина на I-фенил-1,2-пропандион с последующим восстановлением промежуточного имина. Адренэргическим и сосудосуживающим действием обладает также и норэфедрин (7). Первая стадия его синтеза заключается в конденсации бензальдегида с нитроэтаном, которая проводится в присутствии водного карбоната калия при комнатной температуре в атмосфере азота. Полученный при этом нитроспирт затем восстанавливают в амин (7) в системе 2п/АсОН [c.57]При реакции аминов с альдегидами и кетонами образуются продукты присоединения, известные под названием иминов или оснований Шиффа (разд. 7.3,Г и 8.4,В). Имины, полученные из алифатических альдегидов и первичных аминов, обычно неустойчивы и полимеризуются или реагируют далее с амином с образованием более сложных продуктов. Однако имины, полученные из ароматических альдегидов, таких, как бензальдегид, часто стабильны, так же как и оксимы и гидразоны (разд. 7.3,Г). Образование иминов — процесс обратимый, и из них часто можно регенерировать альдегиды или кетоны гидролизом водной кислотой. [c.155]
Основания Шиффа легко алкилируются с образованием четвертичной соли имина, при гидролизе которой получается вторичный амин. Этот метод особенно часто используют для получения смешанных алифатических вторичных аминов. На первой стадии удовлетворительные результаты получаются только для иодистого метила [35]. Используя на первой стадии диалкилсульфат [36], удается успешно ввести как метилвную, так и этильную группы. Второй метод более прост, поскольку для его выполнения не требуется аппаратуры, способной выдерживать давление, но он дает более низкие выходы и более загрязненные продукты, чем метод с применением иодистого алкила [37]. Для ряда смешанных алифатических вторичных аминов, полученных алкилированием иодистым метилом, выходы составляли 52—93% [37]. [c.502]
Механизм реакции довольно сложен и не до конца выяснен [323]. На первой стадии субстрат атакуется частицей, содержащей нитрил и НС1 (и кислоту Льюиса, если таковая присутствует), давая соль имина (39). Атакующими частицами могут быть 37 или 38. На второй стадии полученная соль гидролизуется до продуктов [c.371]
Получение и реакции иминов [c.215]
В СВОЮ очередь вторичный амин может реагировать либо с альдегидом, либо с имином полученные продукты восставав вливаются в третичные амины [c.348]
Своеобразную пространственную структуру имеют имины, полученные из кетенов их кумулированные двойные связи создают условия для существования оптических антиподов (34а) и (346), напоминающих алленовые. Барьер рацемизации невелик (40—50 кДж/моль). [c.339]
Производное пятичленного гетероцикла, содержащее в цикле четыре атома азота, – 1,5-пентаметилентетразол (коразол, 172) применяют в качестве аналептика ( пробуждающего средства центрального действия) при угнетении сердечно-сосудистой системы и дыхания, а также при отравлениях наркотиками и снотворными. Синтезируют коразол действием избытка азотистоводородной кислоты на циклогексанон в присутствии хлорида цинка или пентаоксида фосфора. Полагают, что вначале образуется иминная форма капролактама, циклоконденсация которой со второй молекулой исходной кислоты приводит к получению сти.мулятора (172) [c.110]
Нитрилы гидрируются в амины на платиновых и родиевых катализаторах при температуре 25 °С и давлении 1-3 атм и на скелетном никеле при 25-150 °С и 1-270 атм. Применяются также бориды никеля, кобальтовые и поверхностные палладиевые катализаторы. Восстановление протекает ступенчато. Первичный амин, образующийся в результате присоединения к нитрилу 2 моль водорода, способен присоединяться к промежуточному имину, что в конечном счете приводит к получению смеси первичного, вторичного и даже третичного аминов реакции конденсации с повышением температуры интенсифицируются [c.62]
Принципиально новым и оригинальным направлением в области создания ингибиторов, пригодных для одновременной защиты черных и цветных металлов, является получение солей аминов, иминов и других органических оснований с нитро- и динитробензойными кислотами. Данное направление детально разработано Институтом физической химии АН СССР [93 144]. [c.124]
Несимметрично замещенные по атому углерода оксазиридины имеют асимметрический атом углерода, и частичное разделение 2-бутил-З-изобутил-З-метилоксазиридина на оптические изомеры при стереоселективном окислении его в присутствии бруцина является доказательством циклического строения этих соединений. Оксазиридины с хиральностью, обусловленной только асимметрией при трехковалентном атоме азота, были получены окислением иминов оптически активными пероксикислотами, например ( + )-пероксикамфорной кислотой. Окисление пероксикислотами иминов, полученных из оптически активных аминов, дало высокие оптические выходы диастереомеров, что свидетельствует о хиральности как при атоме азота, так и в углеродной цепи исходного амина. [c.675]
Для амидов или иминов, полученных при взаимодействии 2-арилэтиламинов с производными карбоновых кислот или альдегидами, возможно замыкание цикла, приводящее к 3,4-дигидро- или 1,2,3,4-тетрагидроизохинолинам соответственно. Последующее окисление позволяет получать таким образом ароматические производные изохинолина. [c.186]
Это объяснение, которое, возможно, и оправедливо для КО М- нлек сообразования с объемистым триметилбором, не в скрывает, однако, общих закономерностей изменения электронодонорных сво йств циклических иминов в зависимости от величины цикла. Соответствующие причины, скорее, следует искать в различном характере распределения электронов, присущем этим циклам. Эта наиболее общая и фундаментальная причина была вскрыта при исследовании [82] химических сдвигов в ЯМР-спектрах циклических иминов. Полученные результаты представляют прямое физическое доказательство распределения электронов у атома азота в зависимости от величины цикла и показывают, что минимальную электронную плотность имеет атом азота трехчленного цикла этиленимина. В силу этого для него следует ожидать минимальной способности к присоединению протона и, следовательно, минимальной основности. [c.65]
Используя менее активные производные, например НЬ1А1(ОС2Н5)з, можно задержать реакцию на первой стадии имин, полученный таким образом, гидролизуется до альдегида. [c.490]
В разд. 6-3.1. Другой пример обращения копфр1гурации при изменении природы растворителя найден при изучении гидрирования и гидрогенолиза имина, полученного из (В)- (+)-а-метилбензил-амина и а-кетоглутаровой кислоты [126]. В среде этанола образуется (5 )-(+)-глутаминовая кис.тота (13% и.э.), а в диоксане получается избыток i -(—)-энантиомера (19% и.э. ср. разд. 7-2.2). [c.54]
Харада и сотр. [33, 40], Хиски и Нортроп [30] изучили гидрирование оксимов и иминов, полученных из менти.лпирувата или из хиральных амидов пировиноградной кислоты. [c.370]
На первой стадии под действием сильно кислой среды (безводная фосфорная кислота) происходит отщепление иона гидроксила. Образовавшийся положительно заряженный атом азота присоединяет гидридион, отщепляющийся от соседнего атома углерода, а полученный при этом карбокатион V теряет протон и образует имин VI. В присутствии уксусного ангидрида образуется ацетильное производное а-комплекса VII, из которого при изомеризации получается 3,4-диалкилацетанилид. [c.134]
В синтезе азотсодержащих производных очень важны пеизогипсические трансформации азотсодержащих функций различных уровней окис.тения. Так, обычным путем получения аминов является восстановление производных кислот (нитри.тов или амидов) или карбопи, гьных соеди-пепий (иминов), [c.114]
Обычные первичные и вторичные галогениды дают главным образом продукты М-алкилирования, особенно в случае енаминов, полученных из альдегидов. Продукты алкилирования первичными и вторичными галогенидами можно получить с хорошими выходами другим методом, а именно алкилированием солей енаминов, которые получают [173] обработкой имина этил-магнийбромидом в тетрагидрофуране [174] [c.444]
Имины получают по реакции 16-14. Метод, основанный на реакции с солью енамина, был также успешно использован для моно-а-алкилирования а,р-ненасыщенных кетонов [175]. Енамины, полученные из альдегидов и бутилизобутиламина, можно алкилировать с хорошими выходами простыми первичными алкилгалогенидами [176]. В этом случае Ы-алкилированию, по-видимому, препятствуют стерические затруднения. [c.444]
Соединение состава N2F2 — дифтордиазин — образуется в качестве одного из продуктов при электролизе аммоний-гидродифторида (доп. 73) или действии фтора на натрийазид. Более прямым путем его получения является взаимодействие фто[> имина (доп. 81) с очень тщательно высушенным калийфторидом по уравнению [c.405]
Из электрохимических производств, основанных на использовании электролиза для проведения окислительных или восстановительных реакций, можно назвать электрохимическое окисление Na l в Na lOa производство перхлоратов окислением хлоратов электрохимическое получение хлорной кислоты при обессоливании морской и минерализованных вод электролизным методом получение диоксида хлора и т. д. В органической химии процессы электролиза используются в реакциях катодного восстановления нитросоединений, иминов, имидоэфиров, альдегидов и кетонов, карбоновых кислот, сложных эфиров, а также в реакциях анодного окисления жирных кислот и их солей, ненасыщенных кислот ароматического ряда, ацетилирова-ния, алкилирования и др. [c.357]
Иминный водородный атом амидной связи подвижен и может быть замещен на различные радикалы. На этом основаны многочисленные реакции полиамидов, например реакция оксиэтилирования, которая приводит к получению производных с ценными свойствами. [c.260]
Рассмотрены реакции олигомеров е-аминокапроновой кислоты для получения иминов с широким спектром медико-биологической активности. Так, оротовый альдегид образует имины с указанными олигомерами, обладающие высокой антивирусной и антитоксичной активностью. Установлено, что каталитическая реакция аллилового спирта и его сложных эфиров с е-капролактамом сопровождается аллильной перегруппировкой. что способствует олигомеризации аллиловым спиртом и получению Ы-ацилпроизводных аллилтовых эфиров е-аминокапроновой кислоты. [c.53]
С целью разработки методов получения молекулярно-организованных металлокомплексных систем с векторным фото- и элеюростимуллированным переносом заряда и энергии в настоящей работе на основе смешанно-лигандньпс циклометаллированных комплексов платиновых металлов 1ТЧ(11), Ргетероциклическими иминами – депротонированные формы 2- [c.51]
Более далекое расположение иминного фрагмента от фуранового цикла повышает антибактериальное действие нитрофуранов. Получен ряд препаратов, например фурагин (12), его водо- [c.89]
Оно также обладает ненаркотическим анальгетическим действием и ингибирует биосинтез простагландинов. В основе промышленного метода его синтеза лежит реакция Фишера. Необходимое для этого основание Шиффа получают конденсацией параметоксифенилгидразина (78) с метилатом 3-ацетилпропио-новой кислоты (79) в уксусной кислоте. Образовавшийся имин кипятят в смеси этанола с соляной кислогой, а полученный таким образом эфир индолилуксусной кислоты подвергают ше-лочному гидролизу до свободной кислоты (80). Затем индол (80) ацилируют п-хлорбензоилхлоридом в присутствии гидрида натрия до индометацина (81) [c.99]
Разработано несколько промышленных путей синтеза цикло-серина. Один из них основан на хлорировании акрилата (91) до дигалогенида (92), в котором региоселективно замещают атом хлора при С-3 на аминооксигруппу [действием О-натриевого производного оксима ацетона (93) с последующим гидролизом имина (94)[. Затем второй атом хлора в промежуточном монохлориде замещают на аминофуппу и полученный таким образом аминоэфир (95) циклизуют в щелочной среде в циклосерин (96) [c.102]
Общая схема получения барбитуратов (211) основана на циклоконденсации замещенных эфиров малоновой кислоты с мочевиной или гуанидином в присутствии этоксида натрия В первом случае образуется промежуточная натриевая соль (210), а во втором – промежуточный имин (212), которые затем переводят в уреиды (211) [c.148]
Триаминозамещенный птерин (315) используют в качестве диуретика под названием триамтерен. Его синтезируют из пиримидина (310) конденсацией с бензальдегидом. Основание Шиффа образуется региоселективно с наиболее основной из четырех присутствующих аминогрупп, а именно с той, которая находится в (З-положении к циклическим атомам азота и не может участвовать в образовании таутомерных иминов. Альди-минную фуппу затем цианируют и полученный продукт (314) конденсируют внутримолекулярно под действием щелочи [c.170]
chem21.info
2.1 Образование иминов и оксимов:
При реакции самого аммиака с карбонильными соединениями образуются неустойчивые и склонные к полимеризации имины. Имины, содержащие хотя бы один ароматический заместитель у карбонильного углерода (Аr–СН=N–R), являются устойчивыми продуктами. Они известны как основания Шиффа (часть 2, глава 2).
2.1.1 Гидролиз иминов. Имины легко гидролизуются в кислой или щелочной среде, что позволяет отделить карбонильные соединения от соединений других классов и выделить их в чистом виде:
2.1.2 Гидролиз оксимов. Оксимы, как и многие производные карбонильных соединений, в водных растворах кислот могут подвергаться гидролизу, регенерируя исходное карбонильное соединение и гидроксиламин. В присутствии сильных кислот альдоксимы могут подвергаться дегидратации:
2.2.3 Перегруппировка Бекмана (1886 г.). Оксимы кетонов под действием сильных кислот (концентрированной H2SO4, полифосфорной кислоты) или РОСl3, РСl5 претерпевают перегруппировку с образованием амидов кислот:
Следует отметить две характерные особенности механизма перегруппировки:
миграция углеводородного заместителя и разрыв связи N–О протекают как одновременный процесс, так что атом азота не получает в процессе реакции полного положительного заряда;
в протонированном оксиме обычно мигрирует R–группа, находящаяся в транс-положении к ОН-группе.
Оксимы, как и все другие продукты взаимодействия карбонильных соединений с N-нуклеофилами, благодаря π-связи могут существовать в виде цис–транс-изомеров, называемых в отличие от алкенов син– и анти-формами. Роль второго заместителя у атома азота выполняет электронная пара. Если ОН-группа и меньший заместитель находятся по одну сторону плоскости π-связи, этот изомер называют син-изомером, а если по разные стороны – анти-изомером.
Получающиеся амиды легко гидролизуются с образованием первичного амина и карбоновой кислоты, поэтому эта реакция дает возможность по структре установить строение исходного кетона, а также конфигурацию оксимов. Кроме того, перегруппировка Бекмана может быть использована в синтезе амидов, первичных аминов и кислот, в частности, нашла применение в промышленности перегруппировка оксима циклогексанона с целью получения капролактама – исходного соединения для производства полиамидного синтетического волокна капрон:
2.2 Образование гидразонов:
2.3 Реакция Кижнера–Вольфа (1911 г.). Гидразоны при нагревании со щелочами или алкоголятами расщепляются с выделением азота и образованием углеводорода:
3. Реакции с галогенцентрированными нуклеофилами. Альдегиды и кетоны при взаимодействии с РСl5 образуют геминальные дигалогенуглеводороды через внутримолекулярное нуклеофильное замещение:
4. Реакции восстановления альдегидов и кетонов. Альдегиды и кетоны могут быть восстановлены в зависимости от условий реакции до соответствующих спиртов либо углеводородов, если в молекуле имеются связи С=С, С≡С, C≡N, то они в присутствии катализаторов восстанавливаются легче, чем карбонильная группа. Каталитическое гидрирование альдегидов и кетонов приводит к соответствующим спиртам (катализаторы – Ni, Рt, Рd):
4.1
4.2
4.3 Метод Клеменсена (1913 г.). Восстановление карбонильной группы активными металлами (или амальгамами) в кислой среде приводит к образованию углеводородов:
4.4 Восстановление по Кижнеру-Вольфу (1911 г.). Прямое нагревание оксосоединения с гидразином и КОН в высококипящем полярном растворителе:
4.5 Восстановление комплексными гидридами металлов (NaBН4, LiAlН4). Реакции восстановления карбонильной группы гидридами металлов по механизму могут быть отнесены к типичным ANреакциям:
Атакующей частицей служит анион BН4– (или AlН4–), который и переносит гидрид-ион на карбонильный атом углерода. Главное достоинство этих реагентов по сравнению с другими заключается в том, что они содержат много активного водорода в малом количестве вещества. Так, в случае LiAlН4 для восстановления используются все четыре атома водорода.
4.5.1 Алюмогидрид лития – мощный и поэтому недостаточно селективный восстановитель. В его присутствии восстанавливаются параллельно с карбонильной группой и кратные связи, группы –NO2, –ON, сложно-эфирные группы –COOR, сопряженные с карбонильной группой:
4.5.2 Борогидрид натрия – более мягкий восстановитель, селективно восстанавливающий карбонильные группы, не затрагивающий сопряженные с ними двойные связи. Это позволяет получать дефицитные ненасыщенные спирты:
studfiles.net
16.3.1.Ж. Присоединение первичных и вторичных аминов. Получение иминов и енаминов
Классическим примером нуклеофильного присоединения по карбонильной группе являются реакции альдегидов и кетонов с первичными и вторичными аминами. Конечными продуктами реакции в случае первичных аминов являются имины (основания Шиффа), а для вторичных аминов – енамины (енамин – ненасыщенный амин). Если исходить только из строения продуктов, это совершенно разные реакции, поскольку в иминах двойная связь связывает азот и углерод, а в енаминах два атома углерода:
На самом деле обе реакции по существу совершенно аналогичны, так как механизм процесса в обоих случаях один и тот же. Имины и енамины образуются в результате обратимого кислотно-катализируемого процесса нуклеофильного присоединения по карбонильной группе. В первой стадии реакции присоединения первичного амина образуется диполярный тетраэдрический интермедиат, который стабилизируется в результате переноса протона от азота к кислороду с образованием нейтрального полу-аминаля (карбиноламина). Карбиноламин далее протонируется по атому кислорода. Отщепление воды от протонированной формы приводит к иминиевому катиону, который стабилизируется в результате отщепления протона в конечный продукт – альдимин или кетимин:
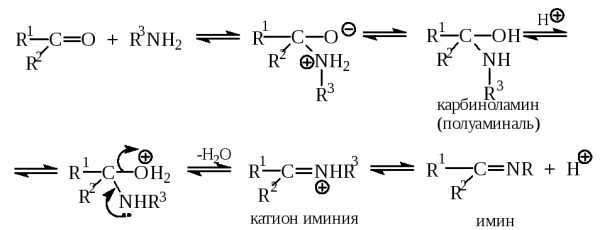
В качестве примеров приведем получение иминов уксусного альдегида и ацетона соответственно с бутиламином и циклогексиламином:
Некоторые производные 1,2-диаминоэтана являются качественными реагентами на альдегиды. N,N’-дифенил-1,2-диаминоэтан при взаимодействии с альдегидами образует имидазолины – циклические аминали, которые могут быть использованы для идентификации альдегидов:
Енамины получаются подобным же образом из вторичных аминов. Единственное различие заключается в том, что иминиевая соль в этом случае не может стабилизироваться отщеплением протона от атома азота. Вместо этого протон отщепляется от соседнего атома углерода с образованием нейтрального соединения – енамина:
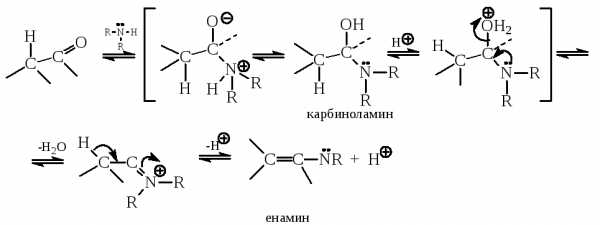
Енамины получаются из альдегидов или кетонов и вторичных аминов с удовлетворительными выходами только при азеотропной отгонке воды с бензолом или толуолом, что позволяет сместить равновесие в желаемую сторону. В качестве вторичных аминов всегда используют пяти- и шестичленные амины – пирролидин, пиперидин или морфолин:
В усовершенствованном методе получения енаминов исходят из триметилсилильного производного вторичного амина. Атом кремния обладает значительно большим сродством к кислороду, чем к азоту, что позволяет в мягких условиях поучать енамины из (СН3)3SiNR2 и кетонов.
Подробнoе изучение механизма процесса обнаружило сильную зависимость скорости образования имина от рН среды. Скорость реакции резко снижается в области высоких (рН > 9) и низких (рН < 1) значений рН, достигая максимума обычно в интервале рН ~3-5, т.е. в области слабой кислотности. Эту зависимость можно объяснить, если рассмотреть влияние рН на каждую стадию процесса. Кислота необходима для протонирования карбиноламина и дальнейшего его превращения в иминиевый катион. Поэтому эта стадия полностью подавляется в области высоких значений рН. С другой стороны, в области низких рН, меньших единицы, амин и некоторые другие азотистые нуклеофилы (NH2OH; NH2-NH2 и др.) протонируются с образованием соли аммония, которая не способна присоединяться по карбонильной группе, так как лишена свойств нуклеофильного агента. Интервал рН в диапазоне от 3 до 5 обычно является разумным компромиссом между этими двумя противоположными тенденциями, причем для каждого азотистого нуклеофила существует свой оптимальный диапазон значений рН, при котором скорость реакции максимальна. На рис. 16.3 в качестве иллюстрации представлена зависимость скорости реакции образования оксима ацетона из ацетона и гидроксиламина от рН среды:
Соединения, образующиеся в результате взаимодействия альдегида или кетона с гидроксиламином, гидразином, фенилгидразином, 2,4-динитрофенилгидразином, n-нитрофенилгидразином, семикарбазидом и тиосемикарбазидом, следует рассматривать как производные иминов. Большинство из них представляют собой кристаллические вещества, обладающие четкой температурой плавления. Эти производные используются для идентификации альдегидов и кетонов:
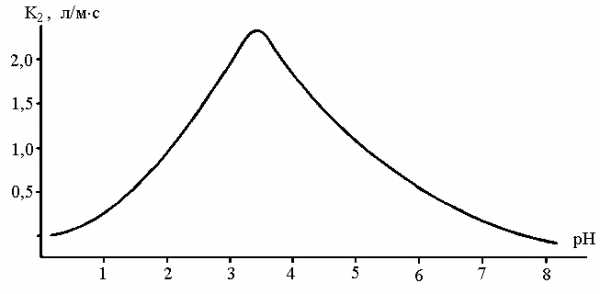
Рис. 16.3.Зависимость скорости образования оксима ацетона от рН
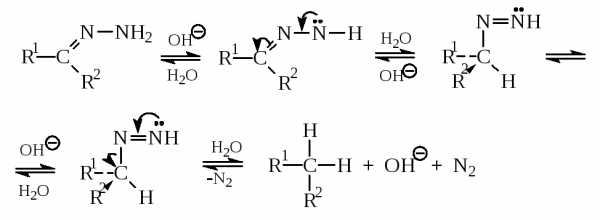
Гидразоны альдегидов и кетонов широко используются в органическом синтезе для превращения карбонильной группы С=O в метиленовую группу. Эта реакция была открыта независимо в 1911 г. Н.М.Кижнером в России и Л.Вольфом в Германии. Они обнаружили, что при нагревании с твердой КОН гидразоны разлагаются с выделением азота, образуя алканы. Метод Кижнера-Вольфа был модифицирован таким образом, что щелочное разложение гидразонов стали выполнять в высококипящих протонных растворителях – диэтиленгликоле (т.кип. = 245 °С) или триэтиленгликоле (т.кип. = 287 °С):
В реакции Кижнера-Вольфа первоначально образуется анион гидразона, который при протонировании превращается в азосоединение. Анион гидразона представляет собой азотистый аналог аллил-аниона и енолят-иона (см. гл.17, ч.3) и проявляет поэтому свойства типичного амбидентного аниона, который при протонировании водой образует азосоединение. Азосоединение далее подвергается депротонированию под действием гидроксид-иона с последующим одновременным отщеплением молекулы азота и протонированием по атому углерода:
studfiles.net



