Кратко термодинамика – Термодинамика — Википедия
- Основы термодинамики
- Термодинамика. Основные положения
- Законы термодинамики
- Основные понятия термодинамики – Электронный учебник K-tree
- Законы термодинамики | Наука | FANDOM powered by Wikia
- Химическая термодинамика, теория и примеры
- Основы термодинамики, теория и примеры задач
Основы термодинамики
Основы термодинамики
Молекулярная физика и термодинамика занимаются явлениями, обусловленными совокупным действием огромного числа непрерывно движущихся частиц. Несмотря на то, что каждая частица движется по законам механики, их совокупное движение не является механическим, а представляет собой качественно новый, более сложный вид движения – тепловое движение. Для его исследования применяют два метода:
– статистический (молекулярно-кинетический), когда свойства макроскопической системы определяют свойствами частиц системы, особенностями их движения и усредненными характеристиками этого движения;
– термодинамический метод, когда свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между ними описывают с помощью термодинамических параметров, характеризующих систему в целом – давление (
При изучении молекулярных явлений статистический и термодинамический методы взаимно дополняют друг друга.
Из трех состояний, в которых может находиться вещество, наиболее простым для изучения является газообразное, поэтому начинают изучение свойств веществ со свойств газов. Чтобы облегчить изучение свойств газов, реальные газы заменяют их упрощенной моделью, которая называется идеальным газом. Считают, что в идеальном газе:
а) отсутствуют силы межмолекулярного взаимодействия, т. е. молекулы не притягиваются и не отталкиваются друг от друга;
б) взаимодействие молекул происходит только при их соударениях и является упругим;
в) молекулы газа не имеют объема, т. е. представляют собой материальные точки.
Ближе всего эта модель газа соответствует свойствам одноатомных газов, находящихся при давлениях, близких к атмосферному, и температурах не ниже -2000С.
Когда газ находится в состоянии термодинамического равновесия, параметры, характеризующие его связаны так называемым уравнением состояния идеального газа – уравнением Клапейрона-Менделеева
pV=υRT,
где R=8,31 Дж/(моль·К) – универсальная газовая постоянная,
υ – количество вещества, которое измеряется в моль. 1 моль представляет собой количество вещества, в котором содержится число частиц, равное постоянной Авогадро NA=6,022∙1023 моль-1,
µ– молярная масса – масса одного моля. Она равна произведению массы одной молекулы на число Авогадро.
.
Зная число Авогадро, можно найти массу молекулы другим способом:
,
где 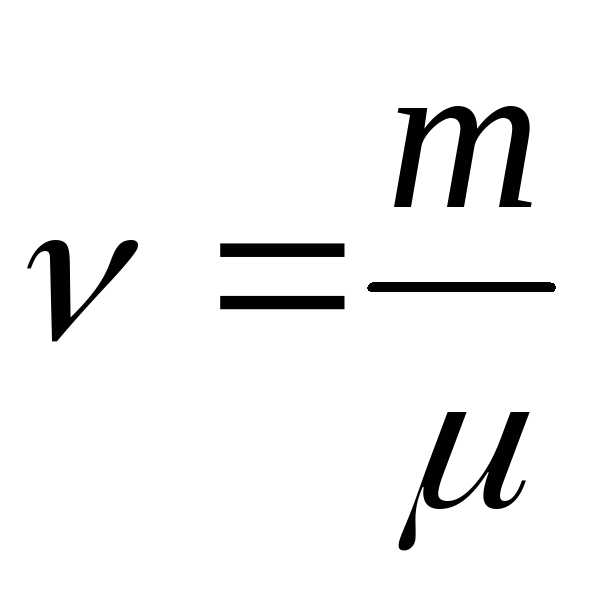 –
количество вещества;
–
количество вещества;
N – число частиц в массе m вещества.
Введем несколько физических понятий, описывающих термодинамическую систему (газ).
Температура (Т) – скалярная физическая величина, характеризующая интенсивность теплового движения молекул изолированной системы в условиях термодинамического равновесия, пропорциональная средней кинетической энергии поступательного движения молекул.
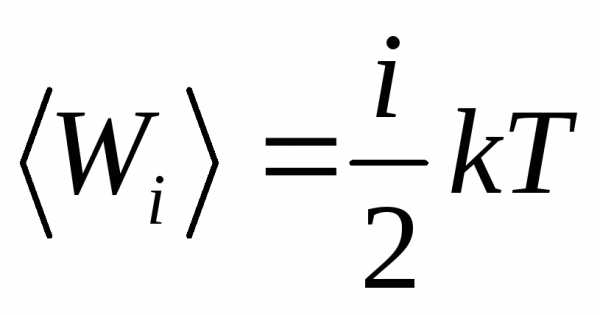 .
.
Средняя кинетическая энергия поступательного движения молекулы идеального газа прямо пропорциональна его абсолютной температуре (и не зависит от ее массы). В выражении i – число степеней свободы материального объекта (молекулы), равное числу независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта в пространстве относительно рассматриваемой системы отсчета. Например, положение материальной точки в пространстве определяется тремя координатами x, y, z следовательно, материальная точка обладает тремя степенями свободы.
Абсолютно твердое тело имеет 6 степеней свободы: координаты x, y, z определяют положение центра масс, углы θ, φ, ψ – ориентацию двух взаимно перпендикулярных, жестко связанных с телом осей ОО и О’О’ (рис.1)
x, y, z – поступательные степени свободы;
θ, φ, ψ – вращательные степени свободы абсолютно твердого тела.
Система из
Молекулы газов, состоящие из одного атома (Ar, Xe, He) обладают тремя степенями свободы i=3; молекулы газов, состоящие из двух атомов (О2, Н2, N2) обладают пятью степенями свободы i=5; молекулы газов, состоящие из трех и более атомов (CO2, CH4) обладают шестью степенями свободы i=6.
Согласно закону Максвелла-Больцмана, если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы равна kT/2. Тогда средняя энергия хаотического теплового движения одной молекулы
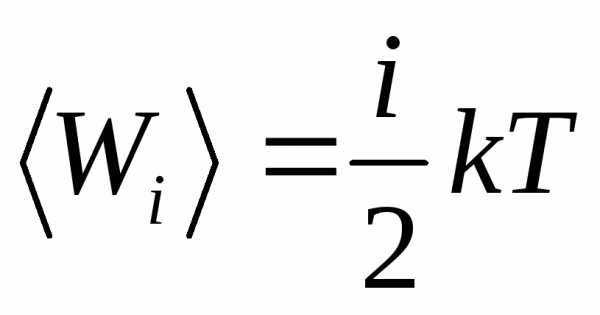
Молекулы идеального газа не взаимодействуют друг с другом на расстоянии, изменения состояния идеального газа сопровождается изменением только энергии хаотического движения его молекул. Вследствие этого под внутренней энергией идеального газа понимают энергию хаотического поступательного и вращательного движения его молекул.
Внутренняя энергия идеального газа равна средней энергии всех N молекул газа:
Существенно отметить, что внутренняя энергия идеального газа зависит только от температуры. Она определяется только состоянием газа и не зависит от того, каким способом газ привели к этому состоянию. Такие величины называются функциями состояния.
Изменить внутреннюю энергию термодинамической системы можно либо совершив работу, либо передав ей некоторое количество теплоты.
Необходимым условием совершения работы является перемещение взаимодействующих с системой тел или их макроскопических частей, а значит изменение объема системы.
Работа в термодинамике определяется соотношением
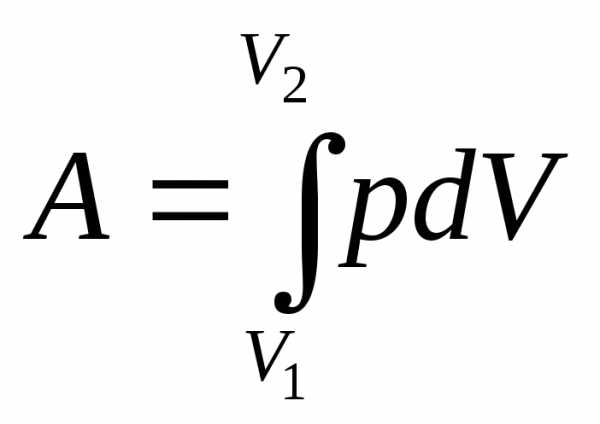
Приращение объема системы может быть как положительно, так и отрицательно. Если dV>0, то работа положительна, т.е. система совершает работу. Если dV<0, то работа отрицательна, т.е. она совершается над системой.
Графически работу можно представить, как площадь под кривой процесса в координатах p,V (рис.2) .
Численное значение работы зависит от пути перехода системы из одного состояния в другое. Поэтому работа, в отличие от внутренней энергии, является функцией процесса.
Теплопередача осуществляется либо путем непосредственного взаимодействия частиц системы с частицами среды при их случайных столкновениях (теплопроводность, конвекция), либо путем обмена электромагнитным излучением (лучеиспускание).
Энергия, получаемая или отдаваемая системой в процессе теплопередачи, называется количеством теплоты Q. Количество тепла также как и работа – функция процесса, поэтому говорить о «запасе тепла» в системе бессмысленно.
Термодинамика базируется на двух началах – фундаментальных законах, установленных в результате обобщения опытных данных. Первое начало термодинамики – частная формулировка закона сохранения и превращения энергии применительно к тепловым процессам. Оно состоит в том, что количество тепла, подведенное к системе, затрачивается на приращение внутренней энергии системы и на совершение системой работы над внешними телами
Теплоемкость – скалярная физическая величина, характеризующая связь между количеством сообщенного системе тепла и изменением ее температуры. Различают полную, удельную и молярную теплоемкости.
Полная теплоемкость С численно равна количеству тепла, которое надо сообщить газу, чтобы повысить его температуру на один градус вблизи рассматриваемой температуры

Удельная теплоемкость с численно равна количеству тепла, которое необходимо сообщить единице массы вещества, чтобы повысить его температуру на один градус вблизи рассматриваемой температуры
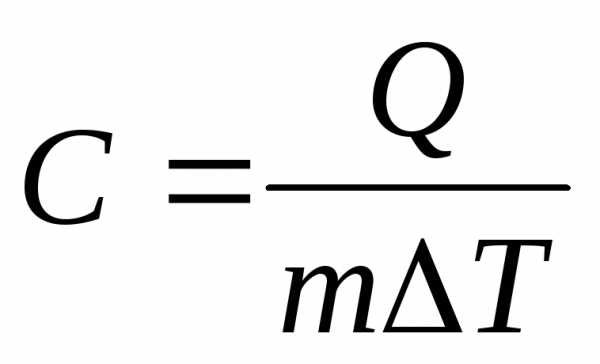
Молярная теплоемкость Сµ численно равна количеству тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на один градус вблизи рассматриваемой температуры
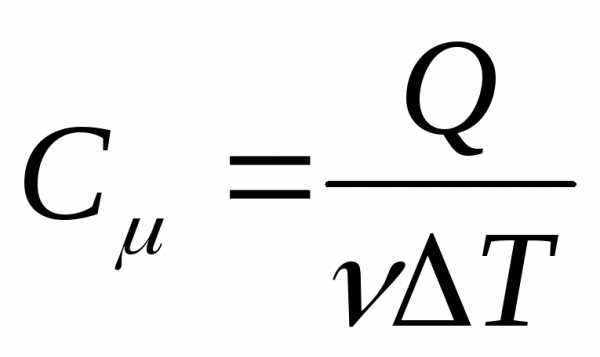 .
.А теперь перейдем к рассмотрению конкретных процессов и конкретизируем вышеуказанные параметры для них.
Изопроцессами называются такие термодинамические процессы, происходящие с неизменным количеством газа, во время которых не изменяется один из параметров газа – давление, объем, температура, энтропия.
Изохорический процесс, протекающий при постоянном объеме V=const.
Из первого начала термодинамики А=0 и Q=ΔU, т.е. обмен энергией между газом и внешней средой при изохорическом процессе происходит только в форме теплопередачи. Подводимое к газу тепло затрачивается только на приращение внутренней энергии газа.
Молярная теплоемкость зависит только от числа степеней свободы молекул.
Изохорный процесс в идеальном газе описывается законом Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре
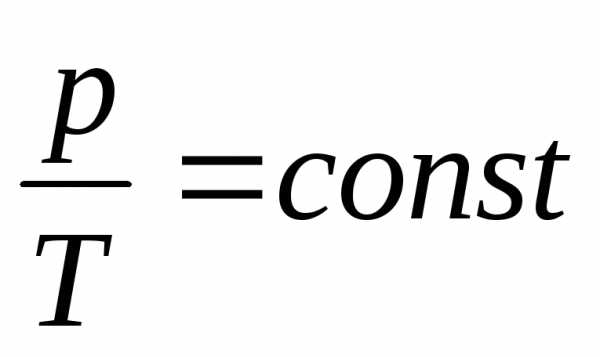 .
.
На диаграмме p, V изохорный процесс представлен кривой в (рис.3).
Рис. 3
Изобарический процесс – при постоянном давлении p=const.
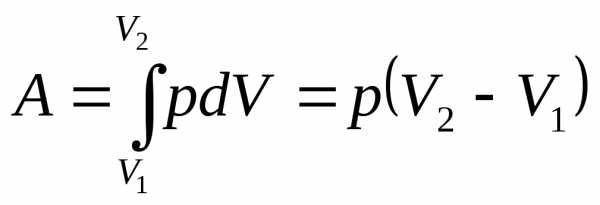
Обмен энергией происходит в форме работы и в форме теплопередачи. Подводимое к газу тепло затрачивается на приращение внутренней энергии газа и на совершение работы
Поскольку когда
сохраняется давление 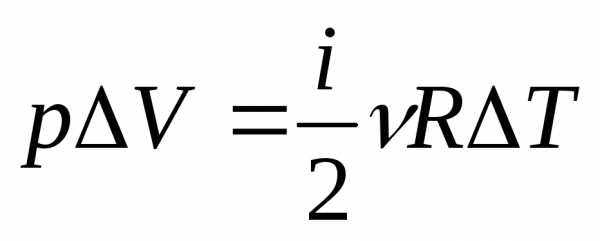 ,
то.
,
то.
Молярная теплоемкость .
Для изобарного процесса справедлив закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
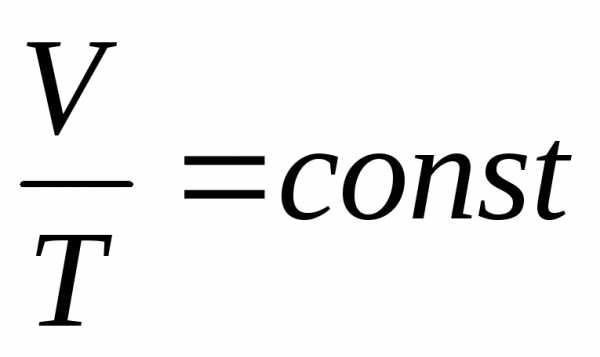 .
.
На диаграмме p, V ибарический процесс представлен кривой б (рис.3).
Изотермический процесс, при постоянной температуре T=const.
ΔU=0 , .
Газ обменивается энергией с внешней средой в форме теплопередачи и в форме работы. Подводимое к газу тепло затрачивается на совершение работы Q=A.
Молярная
теплоемкость 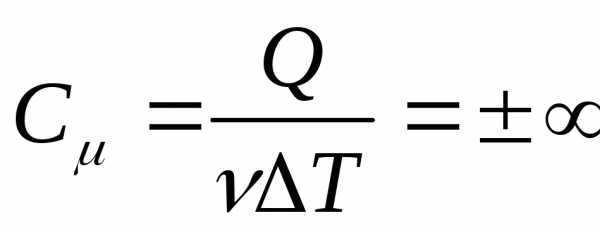 .
.
Изотермический процесс в идеальном газе подчиняется закону Бойля-Мариотта: для данной массы газа при неизменной температуре произведения числовых значений давления и объема есть величина постоянная .
На диаграмме p, V изотермический процесс представлен кривой a (рис.3).
4. Адиабатический процесс – протекает без теплообмена с внешней средой Q=0.
Газ совершает работу только за счет внутренней энергии А=-ΔU. Причем, если газ расширяется, то его температура уменьшается и наоборот.
Молярная теплоемкость  .
.
Уравнения процесса:
– уравнение Пуассона;
;
.
γ – показатель адиабаты, который равен отношению молярной теплоемкости газа при изобарном процессе к молярной теплоемкости при изохорном процессе
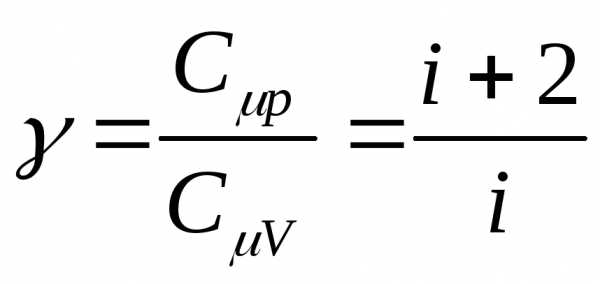 .
.
На диаграмме p, V адиабатный процесс весьма схож с изотермическим, но изображается более крутым (рис.4). Объясняется это тем, что при адиабатическом сжатии увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, то также еще и увеличения температуры. При адиабатическом расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении.
Рис.4
Если с газом происходят несколько следующих друг за другом процессов, то количество теплоты Q, полученное им, работу газа A и изменение его внутренней энергии ΔU можно найти как алгебраическую сумму соответствующих величин в ходе каждого изопроцесса.
studfiles.net
Термодинамика. Основные положения
Термодинамика — теория наиболее общих энергетических превращений макроскопических систем. Внутренняя энергия тела — сумма кинетической энергии хаотического движения его частиц (атомов, молекул) и потенциальной энергии их взаимодействия.
Внутренняя энергия идеального газа
где i — число степеней свободы молекул газа (i = 3 для одноатомного газа, i = 5 для двухатомного газа). Число степеней свободы — число возможных независимых направлений движения молекулы. Внутренняя энергия замкнутой теплоизолированной системы сохраняется.
Изменение внутренней энергии возможно в результате теплообмена, а также при совершении работы. Теплообмен — процесс передачи энергии от одного тела к другому без совершения работы. Количество теплоты, получаемое телом, — энергия, передаваемая телу извне в результате теплообмена. Работа, совершаемая газом,
где ΔV = V2 – V1 — изменение объема газа.
При расширении газа ΔV > 0, при его сжатии ΔV < 0.
Первый закон термодинамики:
количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы:
Первый закон термодинамики: 1) при изохорном процессе:
2) при изотермическом процессе:
3) при изобарном процессе
4) при адиабатном процессе
Адиабатный процесс — термодинамический процесс в теплоизолированной системе (Q = 0). Тепловые двигатели — устройства, преобразующие внутреннюю энергию топлива в механическую энергию.
Наличие нагревателя и холодильника — необходимое условие для непрерывной работы теплового двигателя.
Замкнутый цикл — совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние. Для циклического процесса требуется сжатие газа, которое не может происходить самопроизвольно. Необходимое уменьшение объема газа возможно при его охлаждении. Коэффициент полезного действия теплового двигателя — отношение работы, совершаемой двигателем за цикл, к количеству теплоты, полученному от нагревателя-
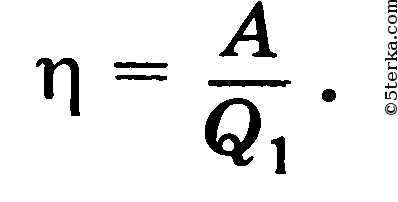
КПД теплового двигателя всегда меньше единицы.
Цикл Карно — цикл работы теплового двигателя, состоящий из двух изотермических и двух адиабатных процессов.
В цикле Карно исключена теплопередача без совершения работы, поэтому его КПД максимален.
где T1, T2 — температура нагревания и холодильника соответственно. Использование тепловых двигателей неблагоприятно влияет на окружающую среду.
Второй закон термодинамики:
в циклически действующем тепловом двигателе невозможно преобразовать все количество теплоты, полученное от нагревателя, в механическую работу.
Второй закон термодинамики — следствие необратимости тепловых процессов.
Необратимый процесс — процесс, обратный которому самопроизвольно не происходит.
Второй закон термодинамики определяет статистическую направленность изменения состояния системы, состоящей из большого числа частиц.
Статистическая формулировка второго закона термодинамики: замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное (или из менее вероятного в более вероятное).
5terka.com
Законы термодинамики
Термодинамика – раздел физики, в рамках которого изучается взаимное превращение теплоты в движение и наоборот. Являясь достаточно обширным разделом, данная часть прикладной физики делится на несколько различных подразделов, к которым относятся:
- Основные законы термодинамики.
- Фазовые переходы и термодинамические процессы.
- Термодинамические циклы и др.
Фактически законы термодинамики – не только ее подраздел, но также и постулаты, базис, лежащий в основе изучаемого раздела физики. Всего выделяют три термодинамических начала.
Рассмотрим их подробнее.
1. Первый закон или начало термодинамики. Сперва вспомним о том, что энергия постоянно переходит из одного вида в другой. Преобразуясь, в зависимости от условий, из кинетической в потенциальную и обратно, энергия из системы не уходит. Однако несложный пример с маятником, которому придали ускорение, ставит под сомнение эту теорию. Находясь в движении, маятник имеет кинетическую энергию, в крайних точках амплитуды – потенциальную. Теоретически такое движение не должно иметь конца и края, то есть быть бесконечным. На практике же мы видим, что движения постепенно угасают, маятник останавливает свой ход. Происходит это за счет сопротивления воздуха, которое обусловливает силу трения при движении. В результате та энергия, что должна была придавать маятнику ускорение, расходуется на преодоление воздушного препятствия. Как следствие, образуется теплота. Согласно опытам ученых, температура подвеса и окружающей среды повышается за счет хаотичного движения молекул вещества маятника и воздуха.
Собственно, первый закон термодинамики более известен как Закон сохранения энергии. Его суть в том, что энергия в системе не исчезает, а лишь преобразуется из одного вида в другой и переходит из одной формы в другую.
Впервые подобное наблюдение было описано в середине ХІХ в. К. Мором. Он отметил, что энергия может переходить в другие состояния: теплота, электричество, движение, магнетизм и т. д. Однако сформулирован Закон был только в 1847 Г. Гельмгольцем, а в ХХ в. ему была присвоена небезызвестная формула E=mc2, которая также включала в себя выводы А. Эйнштейна.
2. Второй закон или начало термодинамики. Сформированный в 1850 г. ученым Р. Клаузиусом, он заключается в следующем наблюдении: внутреннее распределение энергии в закрытой системе изменяется хаотично таким образом, что полезная энергия уменьшается, вследствие чего увеличивается энтропия.
3. Третий закон или начало термодинамики. Имея в виду представление о том, что теплота есть беспорядочное и хаотичное движение молекул, можно сделать вывод, что охлаждение системы влечет за собой снижение их двигательной активности. Энтропия равна нулю в том случае, когда всякое хаотичное движение молекул полностью остановлено.
Абсолютное значение энтропии вещества можно вычислить, зная его теплоемкость при абсолютном нуле. В. Нернстом путем долгих и многочисленных исследований было обнаружено, что все кристаллические вещества обладают одинаковой теплоемкостью: при абсолютном нуле и она равна нулю. Этот вывод представляет собой третий закон термодинамики. Зная этот факт, можно сравнивать энтропию различных материалов при изменениях температуры.
Существует также так называемый нулевой закон термодинамики, заключается он в следующем: теплота от нагретой части изолированной системы распространяется на все ее элементы. Таким образом, со временем температура в рамках одной системы выравнивается.
Законы термодинамики – это базовые составляющие науки о механике. Благодаря выводам, совершенным в разное время, современная наука и общество обогатились за счет изобретения большинства машин.
Законы термодинамики универсальны для всех разделов механики.
fb.ru
Основные понятия термодинамики – Электронный учебник K-tree
Данная статья предназначена для подготовки к изучению термодинамики, здесь даны общие сведения, которые не требуют запоминания, но обязательны для понимания
Термодинамика
В термодинамике всего три основных закона, на которых строится данная наука. Термодинамика это фундаментальный предмет, который изучает процессы преобразования энергии. В законах термодинамики нет исключений, как, например, в химии. Для того, что бы работать с термодинамикой, необходимо изучить базовые понятия, которые используются для исследования всего, что нас окружает. Термодинамика используется для изучения некоторого объекта, первое что необходимо сделать – это определиться, что мы будем изучать.
Термодинамическая система
Итак, первое понятие, термодинамическая система – это объект изучения, часть пространства, ограниченная физически или воображаемой границей, которая будет подвергнута изучению. Если мы берёмся изучать обмен энергией в человеке, то весь человек – это термодинамическая система. Если мы изучаем обмен теплом с солнцем, то солнце – это термодинамическая система. Если мы изучаем обмен тепла между печкой и домом, то и печка и дом – это термодинамическая система.
Границы системы
Важно обозначить, где заканчивается система, граница термодинамической системы – это физический или воображаемый объект, например, если мы изучаем кофе в термокружке как термодинамическую систему, то кофе – это система, а внутренние стенки кружки и нижняя часть крышки – это границы системы. Также мы можем изучать участок трубы, по которой течёт жидкость: внутренняя поверхность трубы и определённые нами (воображаемые) границы участка будут являться границей термодинамической системы.
Окружающая среда
Всё, что находится за пределами границы системы – это окружающая среда. Подразумевается, что окружающая среда не изменяется в течение времени, т.е. все её параметры постоянны независимо от того, что происходит в системе (например, система может отдавать или принимать тепло от окружающей среды, что никак не влияет на среду).
Типы термодинамической системы
Открытая система
Открытой называется такая система, которая обменивается с окружающей средой веществом и энергией. Это может быть, например, камера сгорания в двигателе или паровая турбина.
Закрытая система
В закрытой системе невозможно ни изменение массы вещества, ни обмен веществом с окружающей средой. Например, вакуумная упаковка – пока упаковка цела, масса продукта внутри постоянна (если, конечно, там не протекают сложные химические процессы, которые не имеют интерес в данной ситуации).
Адиабатическая система
Может быть открытой или закрытой, но в любом случае отсутствует обмен энергией в виде тепла.
Свойства термодинамической системы
Термодинамическая система описывается набором величин, которые не зависят от предыдущих состояний системы. Каждое состояние может быть описано термодинамическими величинами. Любая характеристика системы является интенсивной или аддитивной. Интенсивная характеристика (с латинского intensive – принадлежащий объекту) не зависит от размера системы, т.е. её величина одинакова для всей системы (или части системы) независимо от размеров, например температура или концентрация. Аддитивная характеристика (с латинского – возможность присоединяться) зависит от размера выбранного объекта и для всей системы будет являться суммой значений для всех её элементов, например, масса.
Удельный объем и плотность ν, ρ
ν = V/m удельный объём
ρm = m/V плотность
Давление P
P = F/A нормаль силы на единицу площади
Давление различают абсолютное и манометрическое. Манометрическое – это давление избыточное по отношению к атмосферному (для вакуума манометрическое давление отрицательно). Абсолютное давление – это давление относительно полного вакуума.
Единицы измерения давления:
Паскаль (Па) = 1 Н/м2
Бар (бар) = 105 Н/м2 = 105 Па
Атмосфера (атм) = 1,013 бар = 760 мм ртутного столба
Фунт на квадратный дюйм – lbs или psi ≈ 6894,8 Па
Термодинамический обмен каким он бывает?
Термодинамические системы обмениваются энергией изменяя свои свойства. Различают следующие формы энергии: механическая, электрическая, магнитная, термическая, химическая и ядерная.
Обмен энергией происходит двумя способами: работа (макроскопический обмен) и тепло (микроскопический обмен). С помощью работы изменяется аддитивные параметры системы. Посредством тепла изменяется внутренняя энергия системы.
Термодинамическое равновесие
Мы говорим, что система находится в темродинамическом равновесии, когда результирующая взаимодействия любого вида энергии или вещества между системой и окружающей средой равна нулю.
Уравнение состояния идеального газа
Под идеальным газом подразумеваются следующие допущения: молекулы представляются в виде точек, соударения между ними абсолютно упруги (т.е. при столкновении не выделяется тепло) и отсутствует силы притяжения и отталкивания между молекулами. Такая модель пригодна только для теоретических расчётов и для реального газа значительно усложняется.
Уравнение состояния идеального газа
P V = N R T
где P – давление [Па], V – объём газа [м3], N – количество молей газа, R – универсальная газовая постоянная (константа, равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К), T – абсолютная температура [К]
Общий вид уравнения состояния:
P = P (T,ν)
Процессы в термодинамике
Для упрощения расчётов, в термодинамике используются идеализированные системы и типы процессов.
Квазистатический процесс
Такой процесс, в котором каждое последующее состояние системы является равновесным, называется квазистатическим. Это означает, что все изменения в системе происходят достаточно медленно для того, что бы не возникало переходных процессов. Представьте, что Вы завариваете кофе во френч-прессе: если Вы будете нажимать медленно на поршень, то кофе осядет вниз, если Вы попробуете резко с большой силой нажать на поршень то, во-первых, суммарно Вам потребуется больше энергии, а во-вторых, весь кофе выльется, из-за резкого повышения давления и несжимаемости жидкости. Квазистатический процесс – это процесс медленный, в котором все части системы находятся в одинаковом состоянии.
Обратимый и необратимый процессы
Обратимым называется такой процесс, который может происходить в направлении обратном нормальному развитию, восстанавливая произошедшие обмены энергией. Такой процесс является квазистатическим и не может быть реальным. В обратимом процессе не существует неравновесных сил между системой и окружающей средой. Необратимым процессом – называется любой реальный процесс.
Политропный процесс
Ещё одна модель идеальной системы, отвечающая уравнению «Pvn = cte» (при n=cte). Используется для таких систем, поведение которых похоже на поведение идеального газа. Такой процесс достаточно хорошо описывает поведение газа и результат близок к реальности.
Нередко рассматриваются частные случаи политропного процесса: изобарный (постоянное давление), изотермический (постоянная температура), адиабатный (отсутствует теплообмен с окружающей средой) и изохорный (постоянный объём).
k-tree.ru
Законы термодинамики | Наука | FANDOM powered by Wikia
Законы термодинамики, начала термодинамики, в принципе, — физические законы, описывающие особенности передачи тепла и работы в термодинамических процессах; начиная с концепции стали одними из самых важных во всей физике и других ветвях науки, связанных с термодинамикой; часто связываются с понятиями, далекими от того, что непосредственно заявлено в их формулировке.
Первое установленное начало термодинамики, которое в конечном счете стало «Вторым законом», было сформулировано Сади Карно в 1824. К 1860, в результате открытий в работах Рудольфа Клаузиуса и Вильяма Томсона, было уже два установленных «начала» термодинамики, первое начало и второе начало. Спустя годы, эти начала превратились в «законы». В 1873, например, термодинамик Джозайя Уиллард Гиббс в своей работе «Графические методы в термодинамике жидкостей» ясно заявил о существовании двух абсолютных законов термодинамики: Первого закона и Второго закона.
Теперь, открыто в общей сложности пять законов. За последние 80 лет различные авторы иногда предлагали добавить ещё законы, но ни один из них не был широко признан.
| Если каждая из двух термодинамических систем находится в тепловом равновесии с некоторой третьей, то они находятся в тепловом равновесии друг с другом. |
| В любом процессе полная энергия вселенной остается той же самой. |
Он может также быть определен как:: количество подведенного тепла к изолированной системе расходуется на совершение работы и изменение внутренней энергии
| Для любого термодинамического цикла сумма чистого тепла, доставленного в систему, и чистой работы, совершённой системой, равна нулю. |
Короче говоря, постулируется, что энтропия — «температурный иждивенец» и приводит к формулировке идеи абсолютного нуля.
Четвёртый закон (предварительный) Править
Любая неравновесная система обладает такими свойствами, называемыми кинетическими, которые определяют особенности протекания неравновесных процессов в направлении, указываемым вторым началом термодинамики, и от которых не зависят термодинамические силы, движущие эти неравновесные процессы.
Расширенные интерпретации Править
Не существует системы объектов объектов-систем с нулевой информацией.
Энергия связи идет на образование новых структур а значит и информации.
ru.science.wikia.com
Химическая термодинамика, теория и примеры
Определение и общие понятия химической термодинамики
Термодинамика является макроскопической теорией.
Химическая термодинамики использует термодинамические методы для решения задач химии, например, исследования теории разных видов химических и фазовых равновесий и свойств веществ в растворах.
Основной физической величиной, которая подлежит рассмотрению в термодинамике, является энергия. Основным законом термодинамики является вариация закона сохранения энергии. Спецификой макроскопических систем, рассматриваемых в термодинамике, является то, нельзя провести непосредственное измерение энергии макроскопической системы. Разные методы в физике дают возможность определить изменение энергии отдельных частиц системы (атомов, молекул, ионов). Не существует способов прямого измерения энергии как единого целого. Изменение энергии макросистемы определяют как теплоту или работу. Существование внутренней энергии макросистемы (), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя которые описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул.
На основе первого начала термодинамики составляют уравнения теплового баланса. Второе и третье начала термодинамики служат для анализа фазового и химического равновесия.
Задачи химической термодинамики
Исследование законов химического и физического равновесия дают возможность решать следующие основные задачи:
- Определение условий реализации химических процессов. Вычисление тепловых эффектор химических реакций.
- Поиск пределов устойчивости исследуемых веществ при заданных условиях.
- Ликвидация (избегание) побочных реакций.
- Избрание оптимального режима проведения процесса.
Основные законы химической термодинамики
Первый закон термодинамики, которой отображает обмен энергией между системой и окружающей средой в форме работы и теплоты. Это одни из видов законов сохранения энергии. Формулировок первого начала термодинамики несколько, запишем один из них для закрытой системы:
где – количество теплоты, подведенное к системе; – работа системы; – изменение внутренней энергии системы.
Энтальпией () называют термодинамическую функцию, которая характеризует энергетическое состояние системы в изобарно — изотермических условиях ( то есть при ). Энтальпия отражает тепловые изменения в системе, а теплота в окружающей среде. Количество теплоты, которое поглощается или выделяется в ходе химической реакции при равно изменению энтальпии системы (энтальпия реакции).
Закон Гесса для химических реакций говорит о том, что: величина теплового эффекта изобарных или изохорных процессов зависит только от начального и конечного состояний системы и не зависит от хода процесса.
Закон Гесса применяют для вычисления тепловых эффектов химических реакций.
Закон Гесса имеет полезные следствия:
- Энтальпия химической реакции при стандартных условиях равна разности алгебраической суммы энтальпий возникновения продуктов реакции, и суммы энтальпий образования исходных веществ.
- Теплота, которая выделяется при горении вещества в кислороде в количестве 1 моль до образования высших оксидов при стандартных условиях, называется стандартной теплотой сгорания вещества. Энтальпия реакции горения равна разности суммы энтальпий (с учетом знаков) сгорания исходных веществ и суммы энтальпий горения продуктов реакции при учете их стехиометрических коэффициентов. По закону Гесса количество выделяемой теплоты при окислении не зависит от того как и где происходит процесс горения, если продукты реакции не изменяются.
- При разложении вещества расходуется (требуется) такое же по модулю количество теплоты как при образовании данного вещества. Это закон Лавуазье – Лапласа.
- Если повести две реакции, которые приводят из разных начальных состояний к одним конечным состояниям, то разница в тепловых эффектах составит количество теплоты перехода из первого начального состояния во второе.
- При проведении двух реакций из одних начальных состояний в различные конечные состояния разница в тепловых эффектах составит тепловой эффект перехода от первого конечного состояния во второе.
Второй закон термодинамики говорит о направлении протекания процессов. Все самопроизвольные процессы происходят так, что система стремится к минимуму энергии, при этом энтропия системы увеличивается.
Примеры решения задач
ru.solverbook.com
Основы термодинамики, теория и примеры задач
Основы термодинамики
Данная наука является разделом молекулярной физики. Термодинамика рассматривает макроскопические свойства тел и явлений, не занимаясь молекулярным строением вещества.
Для описания свойств систем в термодинамике используют термодинамические переменные, которые называют термодинамическими параметрами. Термодинамические параметры — это физические величины, используя их, описывают явления, которые связаны с превращениями теплоты и работы. Термодинамические параметры являются макроскопическими величинами, отражающими свойства больших совокупностей молекул, например, таковыми являются температура, плотность вещества и т.д.
Базу термодинамики составляют три основных закона, или как их называют начала термодинамики.
Первое начало термодинамики
Первое начало термодинамики говорит о том, что теплота, получаемая термодинамической системой (), расходуется ей на совершение работы () и изменение ее внутренней энергии ():
Выражение (1) носит название интегральной формы первого начала термодинамики. Работу в термодинамике находят как:
где – начальный объем системы; – конечный объем. если работу выполняет система (газ) над внешними силами.
В дифференциальном виде первый закон термодинамики записывают как:
или:
где – давление; – элементарное изменение объема; – теплоемкость тела.
Тело имеет внутреннюю энергию (). Для идеального газа внутренняя энергия вычисляется как:
где – число степеней свободы молекулы; – масса; – молярная масса; – универсальная газовая постоянная; T – температура по абсолютной шкале.
Существование внутренней энергии макросистемы (), как физической величины было установлено в середине XIX века, после открытия первого начала термодинамики. Позднее появилась необходимость применять и другие, не измеряемые величины такие как: энтропия, энтальпия, химический потенциал и т.п. Каждая подобная величина определена как функция измеряемых величин, поэтому все выводы термодинамики можно проверить экспериментально.
Энтропия () – это функция состояния термодинамической системы, в обратимом процессе:
В соответствии со вторым началом термодинамики в необратимом элементарном процессе изменение энтропии:
Для адиабатного процесса выражение (7) имеет вид:
где знак равно относится к обратимому процессу. Выражение (8) – математическая запись второго начала термодинамики (Следует помнить, что рассматривается замкнутая система).
При помощи третьего начала накладываются ограничения на процессы, утверждается неосуществимость процессов, которые бы вели к достижению термодинамического нуля температуры. Этот закон термодинамики называют теоремой Нернста. Ее можно сформулировать так: При температуре системы стремящейся к нулю энтропия стремится к нулю, и это не зависит от значений других параметров термодинамической системы.
Все термодинамические законы относятся к телам, количество молекул которых очень велико (макроскопические тела).
Примеры решения задач
ru.solverbook.com



