Ph таблица менделеева – Таблица Менделеева online – pH некоторых растворов
- Комментариев к записи Ph таблица менделеева – Таблица Менделеева online – pH некоторых растворов нет
- Советы абитуриенту
Таблица Менделеева online – О сайте
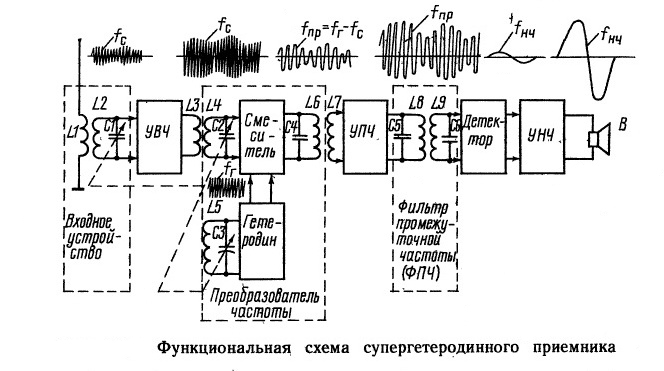
Таблица Менделеева, (или периодическая система химических элементов) – это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | |
| Температура плавления: | 1412°C |
| Температура кипения: | 2567°C |
| Теплопроводность: | 10 |
| Плотность: | 8,536 г/см3 |
| Открыт: | Пол Лекок де Буабодран |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Редкоземельный |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f105s25p65d05f06s2 |
| Электронная формула: |
Dy – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f10 6s2 Dy – [Xe] 4f10 6s2 |
| Валентность: | +3 |
| Степени окисления: | 0, + III |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 11,67 В 22,802 В |
| Электропроводность в тв. фазе: | 1,11*106 при 273K |
| Ковалентный радиус: | 1,59 Å |
| Атомный объем: | 19 см3/моль |
| Атомный радиус: | 2,49 Å |
| Теплота распада: | 11,06 Кдж/моль |
| Теплота парообразования: | 230 Кдж/моль |
| Кристаллическая структура: | Гексагональная. Радиус описанной вокруг основания окружности не равен высоте фигуры. Боковая сторона перпендикулярна основанию |
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | 1,01 |
| Температура плавления: | 97,81°C |
| Температура кипения: | 882,9°C |
| Теплопроводность: | 150 |
| Плотность: | 0,971 г/см3 |
| Открыт: | Гемфри Дэви |
| Цвет в твёрдом состоянии: | Серебристо-белый (в очень чистом виде – розовый) |
| Тип: | Щелочной металл |
| Орбитали: | 1s22s22p63s1 |
| Электронная формула: |
Na – 1s2 2s2 2p6 3s1 Na – [Ne] 3s1 |
| Валентность: | +1 |
| Степени окисления: | 0, +I |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 5,139 В 47,286 В 71,641 В |
| Электропроводность в тв. фазе: | 21,1*106 при 273K |
| Ковалентный радиус: | 1,54 Å |
| Атомный объем: | 23,7 см3/моль |
| Атомный радиус: | 2,32 Å |
| Теплота распада: | 2,598 Кдж/моль |
| Теплота парообразования: | 96,96 Кдж/моль |
| Кристаллическая структура: | Объемоцентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре куба |
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | |
| Температура плавления: | 1663°C |
| Температура кипения: | 3402°C |
| Теплопроводность: | 23 |
| Плотность: | 9,85 г/см3 |
| Открыт: | Г. Урбеин |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Редкоземельный |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d15f06s2 |
| Электронная формула: |
Lu – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d1 6s2 Lu – [Xe] 4f14 5d1 6s2 |
| Валентность: | +3 |
| Степени окисления: | 0, +III |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 13,888 В 20,957 В |
| Электропроводность в тв. фазе: | 1,47*106 при 298K |
| Ковалентный радиус: | 1,56 Å |
| Атомный объем: | 17,78 см3/моль |
| Атомный радиус: | 2,25 Å |
| Теплота распада: | 18,6 Кдж/моль |
| Теплота парообразования: | 355,9 Кдж/моль |
| Кристаллическая структура: | Гексагональная. Радиус описанной вокруг основания окружности не равен высоте фигуры. Боковая сторона перпендикулярна основанию |
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | 1,23 |
| Температура плавления: | 2227°C |
| Температура кипения: | 4602°C |
| Теплопроводность: | 22 |
| Плотность: | 13,2 г/см3 |
| Открыт: | Д. Костер, Г. Хевеши |
| Цвет в твёрдом состоянии: | Серо-стальной |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d25f06s2 |
| Электронная формула: |
Nb – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d4 5s1 Nb – [Kr] 4d4 5s1 |
| Валентность: | (+2), +3, (+4), +5 |
| Степени окисления: | 0, +IV, V |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 7,0 В 14,925 В 23,32 В |
| Электропроводность в тв. фазе: | 2,44*106 при 300K |
| Ковалентный радиус: | 1,44 Å |
| Атомный объем: | 13,6 см3/моль |
| Атомный радиус: | 2,16 Å |
| Теплота распада: | 24,06 Кдж/моль |
| Теплота парообразования: | 575 Кдж/моль |
| Кристаллическая структура: | Гексагональная. Радиус описанной вокруг основания окружности не равен высоте фигуры. Боковая сторона перпендикулярна основанию |
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | 1,49 |
| Температура плавления: | 156,61°C |
| Температура кипения: | 2080°C |
| Теплопроводность: | 87 |
| Плотность: | 7,31 г/см3 |
| Открыт: | Фердинанд Рейх, Т. Рихтер |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f05s25p1 |
| Электронная формула: |
In – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 In – [Kr] 5s2 4d10 5p1 |
| Валентность: | (+1), (+2), +3 |
| Степени окисления: | 0 , + III |
| Сверхпроводящее состояние при температуре: | 3,405 К |
| Потенциалы ионизации: | 5,785 В 18,869 В 28,03 В |
| Электропроводность в тв. фазе: | 11,9*106 при 293K |
| Ковалентный радиус: | 1,44 Å |
| Атомный объем: | 15,7 см3/моль |
| Атомный радиус: | 2 Å |
| Теплота распада: | 3,263 Кдж/моль |
| Теплота парообразования: | 231,5 Кдж/моль |
| Кристаллическая структура: | Тетрагональная. Ширина и длина равны. Высота отлична от длины и ширины. Все углы прямые. В каждой вершине имеется атом |
table-mendeleev.ru
| Относительная электроотрицательность (по Полингу): | 1,23 |
| Температура плавления: | 2227°C |
| Температура кипения: | 4602°C |
| Теплопроводность: | 22 |
| Плотность: | 13,2 г/см3 |
| Открыт: | Д. Костер, Г. Хевеши |
| Цвет в твёрдом состоянии: | Серо-стальной |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d25f06s2 |
| Электронная формула: |
Hf – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d2 6s2 Hf – [Xe] 4f14 5d2 6s2 |
| Валентность: | +4 |
| Степени окисления: | 0,+IV |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 7,0 В 14,925 В 23,32 В |
| Электропроводность в тв. фазе: | 2,44*106 при 300K |
| Ковалентный радиус: | 1,44 Å |
| Атомный объем: | 13,6 см3/моль |
| Атомный радиус: | 2,16 Å |
| Теплота распада: | 24,06 Кдж/моль |
| Теплота парообразования: | 575 Кдж/моль |
| Кристаллическая структура: | Гексагональная. Радиус описанной вокруг основания окружности не равен высоте фигуры. Боковая сторона перпендикулярна основанию |
table-mendeleev.ru