Пиран химия – XuMuK.ru – –
12.4.6. -Пиран и -пиран и их производные
Пираны — это ненасыщенные гетероциклические кислородосодержащие соединения. Возможно существование двух таких изомеров — -пирана и -пирана:
-пиран-пиран
Циклы пиранов содержат один насыщенный атом углерода (-атом в -пиране и, соответственно, -атом в -пиране), поэтому в их молекулах отсутствует полное циклическое сопряжение и эти соединения не могут относиться к ароматическим.
Пираны широкого распространения и практического использования не имеют. Однако более распространены соли катиона пирилия и оксопроизводные пиранов — пироны:
пирилий-катион -пирон-пирон
Строение катиона пирилия подобно строению катиона пиридиния (и молекулы пиридина). Здесь имеет место циклическая сопряжённая 6--электронная система. Отличие от молекулы пиридина — это присутствие в катионе пирилия сильно электроотрицательного атома кислорода в оксониевой форме. Это вызывает сильнейшую поляризацию связей и высокую реакционную способность по отношению к нуклеофилам. Реакции электрофильного замещения для них неизвестны.
Обычно местом нуклеофильной атаки в катионе пирилия является атом С2, но возможны реакции и по атомуС4. Присоединение нуклеофила в положение 2 влечёт за собой, как правило, раскрытие цикла, но возможно последующее его замыкание с образованием другой циклической системы:
-Пироны являются одновременно -лактонами и сопряжёнными диенами. Поэтому они проявляют свойства сложных эфиров и вступают, например, в реакцию диенового синтеза как сопряжённые диены.
-Пироны способны расщепляться под действием щёлочи, аммиака, аминов. Местом нуклеофильной атаки является положение 2. Механизм процесса аналогичен приведённому выше взаимодействию катиона пирилия с аммиаком.
12.4.7. Способы получения
Пиридин, хинолин, изохинолин и их метильные производные содержатся в каменноугольной смоле, откуда их выделяют при промышленном получении.
Пиридиновое кольцо входит в структуру многих природных соединений — витаминов, алкалоидов, нуклеиновых кислот, и поэтому некоторые производные пиридина могут быть получены путём превращений исходных природных соединений.
Для синтетического получения пиридина, хинолина, изохинолина, их производных, а также кислородосодержащих гетероциклических соединений используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Приведём некоторые примеры таких синтезов.
Частично гидрированные алкилпиридины могут быть получены конденсацией -дикарбонильных соединений с аммиаком.
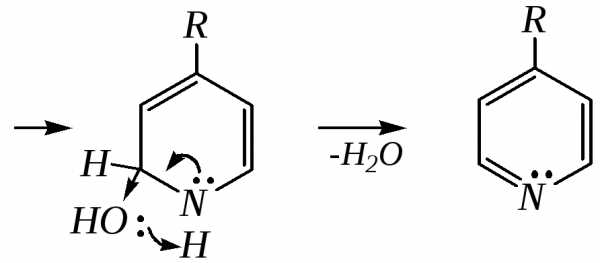
Синтез Ганча* представляет собой получение замещённых пиридинов конденсацией эфиров -оксокислот с альдегидами и аммиаком.
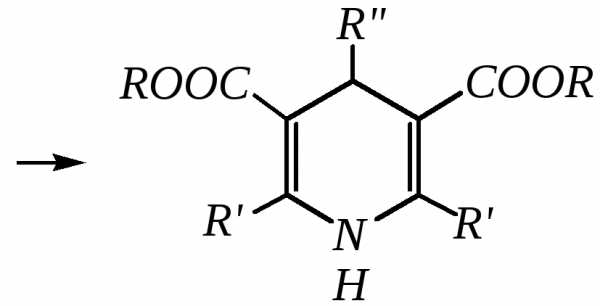
Образовавшийся по данной схеме цикл дигидропиридина может быть далее дегидрирован до пиридинового цикла. Вместо эфира -кетокислот здесь могут быть использованы другие-дикарбонильные соединения (малоновый эфир, ацетилацетон) и эфиры циануксусной кислоты.
Пиридин может быть получен циклизацией ацетилена с циановодородом:
studfiles.net
Пиран – Справочник химика 21
Полная номенклатура моносахаридов иллюстрируется на примере р-Д-глюкопиранозы (45). Слово -пираноза обозначает шестичленный цикл (пиран), слог оза обозначает сахар ГЛЮКО- характеризует относительную конфигурацию при С-2, С-3, С-4 и С-5 р — указывает на конфигурацию при аномерном атоме С-1 О — однозначно говорит об энантиомерной форме всей молекулы. [c.170]
Калибруют эти приборы известным методом с помощью вакуумметра Мак-Леода при использовании предварительно осушенного воздуха. Соответствующие калибровочные кривые представлены в технической документации на прибор. Точность измерения манометра Пирани составляет 5% в интервале давления от 1 до 5-10″ мм рт. ст., а ионизационного вакуумметра —3% в интервале давления от 10 до 10 мм рт. ст. Для подсоединения этих приборов к вакуумированной ректификационной установке они снабжаются штуцером со стандартным шлифом NS 14,5/28 или небольшим фланцем.
З-дигндро-1, 4-бенз-пиран см. а-Токоферол [c.1090]
Имеются также случаи, когда локанты суффиксов не могут быть перемещены влево, например когда другой локант на основании специального правила должен занять это место. Таковы, например, названия 5а-холестан-3-он, 2Н-пиран-3-ол или бицикло [3,3,0] окт-2-ен. [c.66]
Манометр Пирани, основанный на измерении теплопроводности Общее давление Зависят 10-1—10- [c.447]
Особую группу тепловых вакуумметров составляют термопарные вакуумметры (ВТ), отличающиеся от вакуумметров Пирани тем, что температуру нити измеряют термопарой. Им присущи те же недостатки, что и всем тепловым вакуумметрам и их применение в лабораторной практике в нефтепереработке вряд ли перспективно. [c.37]
ОКСИ-4-ОКСО-1, 4-пиран- [c.776]
I, 4-Пиран-2, В-дикарбоно-вая к-та, З-окси-4-оксо- [c.884]
Пиран-5-карбоновая к-та, 2-оксо- [c.884]
Пиразолон, 3-метил-1-фенил-Пираконитин Пиран, тетрагидро- [c.884]
Уббелоде получил измеримые количества продуктов, кипящих выше температур кипения карбонильных соединений от С до С4 при окислении н-пентана при атмосферном давлении. Он проводил окисление в системе с циркуляцией при температурах от 320 до 350° С, отделяя к-пентан и низкокипящие продукты от конденсата и возвращая их в реактор [63]. Во фракции конденсата 65—95° С он выделил 2-метилтетрагидрофуран и обнаружил несколько ненасыщенных соединений, вероятно, дигидро-пиранов. Предположение Уббелоде относительно образования циклической окиси путем внутренней дегидратаций гидроперекиси является, по-видимому, наиболее удовлетворительным объяснением из всех, которые могут быть предложены. [c.339]
Об автоматическом регулировании остаточного давления в областях среднего и высокого вакуума в литературе имеется сравнительно мало сведений. При использовании вакуумметров, основанных на принципе измерения теплопроводности газа, Лапорт [49] рекомендует подключить к мостовой схеме Пирани сигнальное устройство, которое дает звуковой сигнал при увеличении давления выше заданного предела. Нисбет [54 ] описал прибор, позволяющий поддерживать в сосуде, продуваемом воздухом, постоянное давление 10″ мм рт. ст. Мельпольдер [55] описал регулятор давления, обеспечивающий в интервале от 10″ до 10″ мм рт. ст. точность регулирования, равную 10″ мм рт. ст. Схема данного регулятора приведена на рис. 384. Принцип его работы заключается во введении в манометр Мак-Леода четырех впаянных контактов 9—12. С помощью устройства 13 в манометре Мак-Леода каждую минуту поднимают уровень ртути. Регулирование давления осуществляется с помощью контактов 9 и При уменьшешш-давления в системе ниже заданного контакт 10 замыкается, при этом он через реле 5 и 2 закрывает электромагнитный клапан 5. Этот клапан размещен на штуцере 4, соединяющем систему с ваку-умным насосом. Вакуумированный аппарат подсоединяют к шту-
Принцип действия тейповых вакуумметров (тер Л1сторных и термопарных) основан на методах косвенного измерения зависимости теплопередачи через раарежецный газ от давления этого газа. Впервые такой вакуумметр был предложен Пирани более 70 пет назад. [c.36]
Кроме ]- н а-пиронов, рассмотренных в предыдущей главе, производными гетероциклических систем и а-пиранов являются также [c.687]
Из, них пиран и тиопиран известны до сих пор лишь в виде производных. Важнейшие из этих производных — пироны, ксантоны и пирилиевые красители (антоцианы) — уже были рассмотрены в предыдущих разделах вследствие их тесной связи с чисто ароматическими соединениями. Поэтому здесь будут описаны главным образом пиридин и его многочисленные производные. Однако сначала мы рассмотрим еще некоторые простейшие нирановые соединения, так как это позволит прийти к интересным выводам о распределении валентностей в таких кольцевых системах.
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.267 ]
Общая химия в формулах, определениях, схемах (1996) — [ c.313 ]
Названия органических соединений (1980) — [ c.217 ]
Общая химия в формулах, определениях, схемах (0) — [ c.313 ]
Успехи органической химии Том 3 (1966) — [ c.53 ]
Органическая химия (1974) — [ c.958 ]
Общая химия в формулах, определениях, схемах (1985) — [ c.313 ]
Биохимия (2004) — [ c.226 ]
Общая химия в формулах, определениях, схемах (0) — [ c.313 ]
Органическая химия Том2 (2004) — [ c.475 ]
Справочник Химия изд.2 (2000) — [ c.539 , c.542 ]
Основы биохимии Т 1,2,3 (1985) — [ c.306 , c.308 ]
Органическая химия (1976) — [ c.195 ]
Курс органической химии (1967) — [ c.605 ]
Органическая химия 1965г (1965) — [ c.261 ]
Органическая химия 1969г (1969) — [ c.293 ]
Органическая химия 1973г (1973) — [ c.352 ]
Курс органической химии (1979) — [ c.340 ]
Органическая химия для студентов медицинских институтов (1963) — [ c.221 , c.223 ]
Основы биологической химии (1970) — [ c.258 ]
Органическая химия Издание 3 (1977) — [ c.212 , c.533 , c.589 ]
Основы органической химии 2 Издание 2 (1978) — [ c.425 , c.426 ]
Курс органической химии (1970) — [ c.224 ]
ЭПР Свободных радикалов в радиационной химии (1972) — [ c.252 ]
Органическая химия (1972) — [ c.371 , c.406 ]
Основные начала органической химии Том 2 1957 (1957) — [ c.512 , c.517 , c.575 , c.589 ]
Основные начала органической химии Том 2 1958 (1958) — [ c.512 , c.517 , c.575 , c.589 ]
Органическая химия Издание 3 (1963) — [ c.280 ]
Органическая химия (1956) — [ c.275 ]
Химия органических лекарственных препаратов (1949) — [ c.512 ]
Химия и технология ароматических соединений в задачах и упражнениях (1971) — [ c.24 ]
Органическая химия (1972) — [ c.371 , c.406 ]
Органическая химия Издание 2 (1976) — [ c.403 ]
Органическая химия Издание 3 (1980) — [ c.343 , c.366 ]
Курс органической и биологической химии (1952) — [ c.265 , c.281 , c.285 ]
Органическая химия (1964) — [ c.518 ]
Химия органических лекарственных веществ (1953) — [ c.19 ]
Основы органической химии Ч 2 (1968) — [ c.331 , c.332 ]
Курс органической химии _1966 (1966) — [ c.496 ]
Биохимия Издание 2 (1962) — [ c.60 ]
Химия Справочник (2000) — [ c.417 ]
chem21.info
Пиран, производные – Справочник химика 21
Пиран и его производные. В данном разделе рассмотрены отдельные представители шестичленных кислородсодержащих гетероциклов, дигидропиран, а- и у-пираны, а- и 7-пироны. [c.558]Пираны и тетрагидропиран. Важнейшими шестичленными гетероциклами с одним атомом кислорода и двумя двойными связями являются а-пиран и у-пиран. Как свободные вещества эти гетероциклы не получены и известны лишь их многочисленные производные. Тетрагидропроизводное называется тетрагидропираном. Оно получено в свободном виде содержит на четыре атома водорода больше, чем пираны, и не имеет двойных связей [c.427]
ПИ РАНЫ. а-Пиран (ф-ла I) известен только в виде производных. у Пиран (ф-ла II жидк., (кип 84 °С) быстро разлагается при комнатной температуре. П.— структурные фрагменты молекул мн. прир. соединений. [c.440]
Каталитическое превращение тетрагидрофурилового спирта в дигидро-пиран, впервые отмеченное Полем [151], происходит при пропусканий паров спирта над окисью алюминия при температурах выше 300 . Эта реакция делает доступными самые разнообразные производные дигидропирана (стр. 272). Течение реакции дегидратации может быть представлено как нормальная перегруппировка не выделенного первичного продукта дегидратации по Вагнеру—Меервейну . [c.130]
Правила валентности не допускают существования полных кислородных аналогов пиридина. Родоначальным максимально ненасыщенным соединением (т. е. с двумя двойными связями) является пиран. Следует указывать положение экстра -водородных атомов, чтобы различать два возможных изомера, т. е. 2Н-пиран (а-пиран, 51) и 4Н-пиран ( -пиран, 52). Возможно существование двух дигидропиранов А – (53) и ДЗ-дигидропирана (54) Д (дельта) обозначает положение сохраняющейся двойной связи. Полностью гидрированное производное — тетрагидропиран. [c.28]
Этот ион, как и его предшественник, может реагировать различным образом. Он может присоединить еще одну молекулу формальдегида с образованием диоксанового производного, которое будет находиться в равновесии с триолом (не представленным на схеме). За счет потери протона он образует непредельный диол, который при отщеплении молекулы воды образует внутренний эфир — пиран (IV) [c.47]
Изучены дгасс-спектры 4-алкенил-1,3-диоксанов, 5,6-дигидро-(2Н)-пиранов, производных тетрагидропирана и непредельных спиртов. Установлены признаки, позволяющие идентифицировать подобные соединения. [c.133]
Кроме ]- н а-пиронов, рассмотренных в предыдущей главе, производными гетероциклических систем и а-пиранов являются также [c.687]
Из, них пиран и тиопиран известны до сих пор лишь в виде производных. Важнейшие из этих производных — пироны, ксантоны и пирилиевые красители (антоцианы) — уже были рассмотрены в предыдущих разделах вследствие их тесной связи с чисто ароматическими соединениями. Поэтому здесь будут описаны главным образом пиридин и его многочисленные производные. Однако сначала мы рассмотрим еще некоторые простейшие нирановые соединения, так как это позволит прийти к интересным выводам о распределении валентностей в таких кольцевых системах. [c.1013]
Из шестичленных гетероциклов с одним атомом кислорода наиболее важными являются производные -пирана (1,4-пира-на). Сам 7-пиран до сих пор не получен. Его тетра гидропроизводное представляет собой внутренний эфир пентандиола-1,5, из которого он может быть получен нагреванием с 60%-ной серной кислотой [c.605]
По разработанной нами схеме 2-метил-5-н-бутилпиридин был синтезирован из метилвинилкетона и гексен-1-илэтилово-го эфира. Полученный из этих соединений конденсацией Дильса—Альдера 2-этокси-3-н-бутил-6-метил-3,4-дигидро-1,2-пиран омылялся в соответствующее 1,5-дикарбонильное производное, которое, без выделения из реакционной массы, вводилось в конденсацию с гидроксиламином с образованием [c.55]
Производные пирона-2, пиридина и индол в синтезе аннелированных пиранов [c.550]
Некоторые производные пиранов, в том числе и конденсированные 2-амино- [c.557]
Соединения, относящиеся к ряду дигидропиранов и их производных, обладают широким спектром полезных свойств. Несмотря на определенные успехи химии пиранов, этот класс соединений остается недостаточно изз енным. Целью данной работы является разработка новых методов синтеза пиранилариламинов. [c.42]
Предполагается, что в качестве промежуточных продуктов могут выступать производные 2-амино-4Н-пиранов [997]. [c.97]
Производные 2-амино-4Н-пиранов [1018, ИЗО], 3-циаио-2Н-пира-нонов [11311 и 3-циано-2Н-пирантионов [П32] в присутствии ацетата [c.118]
Диамино4-фенил-5-цианопиразоло [3,4-Ь] пиран [536]. Следовательно, промежуточный аддукт Михаэля циклизуется за счет атома кислорода, а не азота аминогруппы. В указанную реакцию вступают и другие гетероциклы, содержащие по соседству с карбонилом активную метиленовую группу, например производные пирана [535], пиримидиндиона [535, 537]. [c.86]
Простые методы получения производных 2-амиио-3-циан-4Н-пиранов / Ю.Т.Лб-рамсяко, Н.А.Борщев, Н.Б.Всеволожская и др. – В кн. Новые химические средства защиты растений. М. НИИТЭХИМ, 1979, с. 7-11. [c.167]
Заслуживают также упоминания два важных типа производных во-первых, дигидропроизводные — 2Я-пиран (9) и 4Я-пиран (10) соединения этого типа часто являются интермедиатами в реакциях пирилиевых соединений во-вторых, соответствующие карбонильные производные — а-пирон (11) и Y-пирон (12) (иногда называемые пиранонами). [c.16]
Трифтор-4-этокси-3-бутен-2-он и 3-трифторацетил-3,4-дигидро-2Н-пиран реагируют с фенилгидразином в этиловом спирте с образованием соответствующих трифторметильных производных пиразина [178а]. Строение [c.243]
В этой главе рассматриваются моноциклические пираны, пироны, пи-рилиевые соли и их частично или полностью гидрированные производные. Основным соединением рассматриваемого класса является пиран, содержащий дважды ненасыщенный шестичленный цикл с атомом кислорода в качестве гетероатома. Две двойные связи могут быть сопряженными, как в а- или 1,2-пиране, или изолированными, как в – – или 1,4-пиране [c.269]
Тетрагидро-4-метил-3-(Ы-метилкарбамоилоксимино)пиран предложен в качестве инсектицида [127]. Инсектицидным действием обладают некоторые производные хромена (31) [128], другие производные хромена предложены в качестве средств борьбы с обрастанием морских судов [129]. [c.509]
Шестичленные гетероциклы с атомом кислорода — а-пиран и у-пиран — не относятся к ароматическим соединениям, так как в каждом из них имеется атом углерода в состоянии л/ -гибридизации и поэтому отсутствует единая сопряженная система р-электронов двойных связей и атома кислорода. Эти соединения представляют собой ненасыщенные циклические эфиры, обладающие высокой реакционной способностью, вследствие чего они неустойчивы, а а-пиран вообще в свободном виде неизвестен. Стабильными являются производные пиранов, в частноеги тетрагидропиран и его гидрокси-производные, относящиеся к классу моносахаридов (см. 15.1). [c.370]
ПИРАНЫ. а-Пиран (ф-ла I) известен только в виде производных. -у-Пиран (ф-ла II жидк., (кяя 84 °С) быстрораэ-лагается при комнатной температуре. П.— структурные фрагменты мо- J лекул мн. прир. соединений. [c.440]
chem21.info
Пираны и восстановленные фураны / Химия гетероциклических соединений
27.1.2. Пираны и восстановленные фураны
3,4-Дигидро-2Н-пиран и 2,3-дигидрофуран ведут себя как эфиры енола. Первый из них широко используется для защиты спиртов [7], с которыми он быстро реагирует в условиях кислотного катализа с образованием ацеталей, устойчивых даже в сильноосновных условиях, но легко гидролизующихся до спиртов в мягких условиях в кислых растворах.
4Н-Пиран, по-видимому, несколько менее устойчив, чем дигидропиран, но в реакции вступает подобным же образом: например, он литиируется по положению 2 и вступает в реакции Дильса-Альдера как эфир енола [8].
Гидроксилированные тетрагидрофураны и тетрагидропираны изучены достаточно подробно, так как подобные циклические системы встречаются в различных сахарах и соединениях, содержащих остатки сахаров; в качестве примеров [9] можно привести сахарозу и РНК (разд. 24.1.).
Тетрагидропиран, так же как и пиперидин, принимает конформацию кресла. Один из интересных аспектов, возникающих при изучении алкоксизамещённых тетрагидропиранов, заключается в том, что 2-алкоксигруппа находится преимущественно в аксиальном положении (аномерный эффект [10]). Причина заключается в том, что с экваториальной ориентацией связаны невыгодные диполь-дипольные взаимодействия между свободными электронными парами двух атомов кислорода, и выигрыш энергии от аксиальной ориентации заместителя в положении 2 с избытком компенсирует возникающее при этом невыгодное 1,3-диаксиальное взаимодействие.
Глюкоза существует преимущественно в циклических полуацетальных формах, содержащих тетрагидропирановый цикл, хотя во многих химических реакциях она участвует в виде находящейся в малых концентрациях ациклической полигидроксиальдегидной формы. Преобладание циклической формы свидетельствует о стабильности, присущей насыщенным шестичленным циклам, находящимся в конформации кресла. Склонность к циклизации — общее свойство 5-гидроксиальдегидов, 5-гидроксикетонов и 5-гидроксикислот, поскольку все они легко образуют шестичленные кислородсодержащие циклы — лактолы и лактоны соответственно.
Сравнительно легко образуются и пятичленные циклы: в зависимости от условий производные глюкозы могут легко образовывать формы фураноз, то есть производные тетрагидрофурана
Циклические насыщенные эфиры инертны подобно ациклическим эфирам и для разрыва связи C-O необходимы жёсткие условия [11]. Эти их свойства противоположны свойствам гетероциклических систем с малыми циклами.
www.dyda.ru
Пиран и его производные
Шестичленные гетероциклические соединения, содержащие кислород, называются пиранами. Различают α- и γ-пираны, неизвестные в свободном виде. Отщепление гидрид-иона от α- или γ-пирана приводит к ароматическому пирилиевому катиону, существующему в пирилиевых солях:
Н Н
Н
–Н– –Н–
О Н О О
α –пиран пирилий γ-пиран
Кислородные производные пиранов – α- и γ-пироны – лежат в основе различных природных продуктов растительного происхождения:
О
О О О
α –пирон γ-пирон
α-Пирон является лактоном δ-оксикарбоновой кислоты алифатического ряда, который легко гидролизуется разбавленными растворами щелочей и полимеризуется на воздухе.
γ-Пирон не дает реакций на карбонильную группу (С=О) и двойную связь С=С, хотя и содержит их в соответствии с классической формулой строения. Он обладает основными свойствами и алкилируется, образуя О-алкильные замещенные. Это внешне противоречивое поведение γ-пирона легко объясняется сопряжением карбонильной группы с неподеленной парой электронов кислорода.
Хиноидная система кольца превращается в ароматическую, что может быть показано на примере 2,6-диметил- γ-пирона, легко получаемого из дегидроацетовой кислоты (продукта димеризации дикетена). Как показано ниже, основные свойства 2,6-диметил- γ-пирона проявляются в образовании кристаллической солянокислой соли 2,6-диметил-4-метоксипирилия:
О О О
Н С СООН С СООН
СОСН3 Н2С СН НС С
С С С С
Н3С О О Н3С О О СН3 Н3С СН3
НО ОН
дегидроацетовая кислота
OH
О О HCl Cl
Н3С О СН3
–СО2; –Н2О хлорид 2,6-диметил-4-оксипирилия
Н3С О СН3 Н3С О СН3
OCH3
2,6-диметил-γ-пирон
(СН3О)2SO2OSO2OCH3
H3C O CH3
метилсульфат 2,6-диметил-4-метоксипирилия
Бензо-α-пирон, или кумарин, является материнским веществом ряда биологически активных веществ. Один из вариантов его синтеза заключается в конденсации фенола в присутствии концентрированной серной кислоты с яблочной кислотой, которая превращается в формилуксусную кислоту, реагирующую с фенолом:
H2SO4 C6H5OH
HOOC – CH2 – CH – COOH HOOC – CH2 – CH = O
OH –CO2; –H2 –H2O
яблочная кислота формилуксусная кислота
O H HO H
C C
CH2 CH
C C –H2O
O O O O O O
фениловый эфир формилуксусной кислоты кумарин
3,3΄-Метилен-4,4΄-диоксидикумарин препятствует свертыванию крови (активный антикоагулянт):
ОН ОН
СН2
О О О О
3,3΄-метилен-4,4΄-диоксидикумарин
Похожие статьи:
poznayka.org
Пиран синтез – Справочник химика 21
Только недавно были впервые синтезированы 2Н- и 4Н-пира-ны — чрезвычайно реакционноспособные соединения, о которых пока известно сравнительно мало. 3,4-Дигидро-2Н-пиран и 2,3-дигидрофуран легко образуют циклические эфиры енолов. Дигид-ропиран нашел широкое применение в органическом синтезе в качестве защитной группировки для спиртов, так как он легко превращается в ацеталь при кислотном катализе. Ценность этих про- [c.372]Производные пирона-2, пиридина и индол в синтезе аннелированных пиранов [c.550]
В трехгорлую круглодонную колбу емкостью 250 мл, снабженную мешалкой, обратным холодильником и капельной воронкой, помещают 25,6 г (0,2 моля) 2,2-диметилтетрагидро-пиран-4-она (см. Синтезы гетероциклических соединений , [c.34]
Авторами [15] предложен оригинальный и простой подход к синтезу замещенных 6-арил-4Я-тиено[3,2-с]пиран-4-оиов 47 основанный на реакции циклоконденсации тиофена 45 с ацетофенонами АгСОСНз 46 [15] (схема 7). [c.340]
Аналогичные методы синтеза оптически активных 2-амиио-4Я-пиранов 27 (схема 7) изучены в работе [38]. [c.539]
Иные методы синтеза замещенных 2-амино-4И-пиранов [c.540]
Часто при синтезе 2-амино-4Н-пиранов хорошие результаты достигаются в случае трехкомпонентной конденсации альдегидов, карбонилсодержащих соединений и метиленактивных нитрилов [525, 530—532]. Вероятно, здесь первоначально происходит конденсация Кневенагеля ароматического альдегида с метиленактивным нитрилом с последующей реакцией карбонильного соединения с аддуктом Михаэля. Дальнейшая циклизация дает 2-амино-пиран. [c.89]
В работе [72] предложен удобный метод синтеза пиразоло[3,4-6]пиранов 70 (схема 23) трехкомпонентной конденсацией З-метил-5-пиразолона 71, МН и ароматических альдегидов в метиловом спирте под действием органических оснований (метод А). [c.548]
Соли пирилия получают циклизацией предшественников, имеющих цепи из пяти углеродных атомов и несущих подходящие функциональные группы [33]. Большое число синтезов основано на промежуточном образовании 1,5-дикетонов. Углерод-углеродные связи между карбонильными группами могут быть насыщенными, как, например, в соединении (51), которое является ключевым интермедиатом в схеме (24) [34]. В этом случае 1,5-дикетон циклизуется в 4Я-пиран, который быстро окисляется ш зИи с образованием пирилиевого соединения. В условиях, указанных на схеме, окислителем может служить Ре “, хотя было замечено, что окисление может происходить путем переноса гидрид-иона к иону аци-лия, образующемуся из уксусного ангидрида. Могут быть использованы и другие окислители, например РНзС+ или молекулярный кислород. Рассматриваемая реакция лучше всего идет в случае [c.26]
Хотя большинство синтезов пирилиевых солей так или иначе связано с циклизацией 1,5-дикетонов, широкое применение нашел и другой подход. Он основан на циклизации 2,4-диенонов Первоначально образуется 2Я-пиран, который легко окисляется in situ с образованием пирилиевой соли (схема 29) [39]. Необходимые диеноны можно получить конденсацией метилкетонов с ненасыщенными альдегидами. Указанный метод наиболее эффективен, когда заместителями являются арильные группы он особенно полезен для получения 2,6-дизамещенных пирилиевых соединений. [c.28]
Соединения, относящиеся к ряду дигидропиранов и их производных, обладают широким спектром полезных свойств. Несмотря на определенные успехи химии пиранов, этот класс соединений остается недостаточно изз енным. Целью данной работы является разработка новых методов синтеза пиранилариламинов. [c.42]
В этом разделе описаны только наиболее широко используемые пути синтеза а-пиронов. Более детально эти вопросы рассмотрены в обзорах Кавальери [26] н Фрида [27]. Обычные подходы к синтезу а-пиронов и синтезу пирилиевых соединений (см. разд. 18.1 2.3) очень сходны при синтезе пирилиевых соединений необходимо получить подходящий 1,5-дикетон, а в случае а-пиронов — 5-оксокис-лоту, которая далее циклизуется. В общей форме три основные направления синтезов а-пиранов показаны на схеме (24). [c.51]
Пособие к лабораторному практикуму по органической хи мии включает оригинальные методы синтеза 1,5-дикетонов, тио-пиранов, солей тиапирилия, пирролидонов, изоиндолов и некоторых других гетероциклических соединений. [c.2]
Циклизация моноенолов 1,5-дикетонов приводит к образованию циклического полуацеталя, который при дегидратации превращается в эфир диенола (4Н-пиран). Для превращения последнего в катион пирилия необходимо лишь удаление гидрид-иона. 1,5-Дикетоны обычно получают in situ либо конденсацией альдегида с двумя молекулами кетона (ср. с синтезом Ганча, разд. 5.15.1.2), либо взаимодействием кетона с предварительно синтезированным непредельным кетоном ( халконом , если он получен из арилалкилкетона и ароматического альдегида). В последнем случае избыток халкона используется в качестве акцептора гидрид-иона. [c.212]
С формальдегидом дивинил взаимодействует по схеме диенового синтеза в присутствии серной кислоты, образуя 3,6-дигидро-2Н-пиран, т., е. диенофильной связью, как оказалось, может быть не только углерод-углеродная или азот-кислородная, но и углерод-кислородная двойная связь. Также реагируют алкилбутадиены и с другими альдегидами жирного ряда (ароматические альдегиды ввести таким образом в диеновый синтез не удалось), но реакция часто осложняется побочными процессами [c.58]
Пиран-4-уксусную кислоту (XIV) — промежуточное вещество в синтезе карбинола VIII — получают из тетрагидро-7-пирона (XIII) тремя путями [20]. [c.296]
Так как пиран легко отщепляется в присутствии кислот, эта реакция можег служить методом синтеза 2,6-дихлор-8-замещенных пуринов, которые трудно получить другими способами. Таким образом, вводя или не вводя тетрагидро-пиранильную группу по Ыд-атому, можно направлять нуклеофильную реакцию по положению 6 или 8. Этим способом получен 2,6-дихлор-8-аминопурин (XX). Аналогичным образом в строго контролируемых условиях действием 1 экв этилата натрия, метилмеркаптида натрия, едкого натра и других реагентов на соединение XIX синтезированы соответствующие 8-замещенные пурины [85], в частности 2,6-дихлор-8-этоксипурин. [c.222]
Однако, если реакция окисления 4Я-пнрана 1 в катион 2 хорошо изучена и служит методом синтеза солей пирилия [1], то электрофильное замещение с образованием нового 4Я-пирана 3 практически не исследовано. Это произошло видимо потому, что считалось, что любой электрофил будет окислять 4Я-пиран 1 в термодинамически стабильную соль 2. [c.402]
Ранее в этой главе был описан синтез пиперидинов и пипиридо-нов из бутадиена и оснований Шиффа или изоцианатов в присутствии палладиевого катализатора [см. схемы (4.24), (4.25)]. Аналогичным образом в присутствии катализатора, полученного из я-аллилпалладийхлорида, трифенилфосфина и феноксида иатрия, бутадиен реагирует с бензальдегидом, давая соответствующий пиран [54], [схема (4.60)]. Реакция формальдегида с бутадиеном дает смесь пиранов в соотношении 2 1 [55] [схема (4.61)]. [c.163]
Тризамешошые соли пирилия служат удобными исходными соединениями для синтеза различных карбо- и гетероциклических соединений. Первоначальная атака нуклеофила по положению 2 приводит к 2Н-пирану, находящемуся в равновесии с ациклическим таутомером 64. Соединение типа 64 может быть выделено при взаимодействии соли 2,4,6-триметилпирилия с некоторыми нуклеофилами, такими, как фениллитий ( =РЬ), цианид натрия (Y= N) и боргидрид натрия (У=Н). [c.208]
chem21.info
Пирана группа – Справочник химика 21
Особую группу тепловых вакуумметров составляют термопарные вакуумметры (ВТ), отличающиеся от вакуумметров Пирани тем, что температуру нити измеряют термопарой. Им присущи те же недостатки, что и всем тепловым вакуумметрам и их применение в лабораторной практике в нефтепереработке вряд ли перспективно. [c.37]Альдегидная или кетонная группа гексоз и пентоз взаимодействует с гидроксильными группами у С-4 или С-5. В результате образуются пяти- или шестичленные циклы. Эти циклы структурно аналогичны кислородсодержащим гетероциклам пирану и фурану [c.609]
Дигидро-у-пиран представляет собой бесцветную жидкость (т. кип. 86 °С). Атом кислорода, соседний с двойной С=С-связью, при-дает ей высокую реакционную способность. В присутствии толу-ол-4-сульфокислоты к 2,3-дигидро- пирану количественно присоединяются спирты и фенолы. Образующиеся ацетали устойчивы к действию оснований, но быстро гидролизуются разбавленными кислотами. Этот метод можно использовать для защиты гидроксильной группы [c.585]
При замене в пиранах метиленовой группы карбонильной группой получают а- или 1,2- и 7- или 1,4-пироны, занимающие по важности первое место -среди рассматриваемых соединений. Вследствие сопряжения карбонильной группы с двойными связями цикла а- и в особенности 7-пироны проявляют свойства, не встречающиеся в аналогичных нециклических соединениях. [c.269]
При реакции реактива Гриньяра с 2,3-дигидропираном, 4-метил-3,4-дигидро-2Н-пираном, 2-метилфураном и 2,5-диметилфураном происходит разрыв цикла у эфирной группы и образуются непредельные спирты и альдегиды, или кетоны [88] [c.319]
Полуацетальная связь в глюкозе может образоваться между альдегидной группой и ОН-группой 4-го или 5-го атома углерода. Такие структуры родственны соответственно фурану и пирану и имеют, по Фишеру, следующие формулы [c.106]
Из аналогов прегнина, содержащего при С и Сц метильные группы, следует отметить полученный В. Петровым (Англия). Действием ацетиленида лития в жидком аммиаке на 3-ацетат дегидроэпиандростерона-17 (I) синтезирован 3,17-диол (И), гидроксильные группы которого защищались дигидро-пираном и дигидропиранилдиол (П1) обрабатывался последовательно бутил-литием и йодистым метилом, что после гидролиза привело к пропинилдиолу [c.613]
Гетероциклические соединения — класс органических циклических соединений, в циклах которых, кроме атомов углерода, имеются атомы других элементов — гетероатомы кислород (напр., фуран и пиран), азот (напр., пиррол и порфирины, индол, пиразол, пиридин, пиримидин, хинолин, изохинолин, пурин и др.), сера (напр., тиофен), селен (напр., селенофен) и т. д. Г, с. могут быть смешанные, содержащие два гетероатома, например тиазол и др. В природе широко распространены Г. с. группы пиррола (гемоглобин, хлорофилл), пирона (растительные пигменты), пиридина, хинолина и изохинолина (различные алколоиды), пурина (мочевая кислота, кофеин и др.), тиофена (нефть). Некоторые Г.с. получают из каменноугольного дегтя (пиридин, хииолии, акридин и пр.) и при переработке растительного сырья (фурфурол). Многие природные и синтетические Г. с.—ценные красители (индиго), лекарственные вещества (хинин, морфин, акрихин, пирамидон). Г. с. используют в производстве пластмасс как ускорители вулканизации каучука, в кииофотопромышлениости. [c.38]
Приведенные выше обобщения свидетельствуют о том, что 1,4-присоеди-нение ДКС, образующих стабилизированные карбаниоиы, к непредельным акцепторам по Михаэлю – один из эффективных методов образования связи С-С. Региоселективность реакции зависит от кето-енольного равновесия в карбонильном фрагменте аддукта Михаэля и дальнейшей внутримолекулярной циклизации енолята в пиран. Подходящими функциональными группами в непредельном акцепторе оказались циано-, эфирные, азидо-, сульфоксидные и сульфоновые группы. [c.536]
Вторым основным методом получения замещенных 2-амиио-4Я-пиранов является взаимодействие нитрилов, содержащих активную метиленовую группу, и а,Р-не-предельных моно- или дикарбонильных соединений. [c.536]
Конденсация 1,3-ДКС с нитрилами, содержащими активную метиленовую группу, не всегда ведет к образованию пиранов, так как ход процесса зависит от многих факторов. Например, реакция 2-формилдимедоиа 59 с МН (схема 19) приводит к смеси 2-аминопирана (60, 79%) и 2-(1Я)пиридона (61, 20%) [56]. По-видимому, сначала соединение 59 присоединяет молекулу МН, давая аддукт 62, [c.545]
Диамино4-фенил-5-цианопиразоло [3,4-Ь] пиран [536]. Следовательно, промежуточный аддукт Михаэля циклизуется за счет атома кислорода, а не азота аминогруппы. В указанную реакцию вступают и другие гетероциклы, содержащие по соседству с карбонилом активную метиленовую группу, например производные пирана [535], пиримидиндиона [535, 537]. [c.86]
Соли пирилия получают циклизацией предшественников, имеющих цепи из пяти углеродных атомов и несущих подходящие функциональные группы [33]. Большое число синтезов основано на промежуточном образовании 1,5-дикетонов. Углерод-углеродные связи между карбонильными группами могут быть насыщенными, как, например, в соединении (51), которое является ключевым интермедиатом в схеме (24) [34]. В этом случае 1,5-дикетон циклизуется в 4Я-пиран, который быстро окисляется ш зИи с образованием пирилиевого соединения. В условиях, указанных на схеме, окислителем может служить Ре “, хотя было замечено, что окисление может происходить путем переноса гидрид-иона к иону аци-лия, образующемуся из уксусного ангидрида. Могут быть использованы и другие окислители, например РНзС+ или молекулярный кислород. Рассматриваемая реакция лучше всего идет в случае [c.26]
Хотя большинство синтезов пирилиевых солей так или иначе связано с циклизацией 1,5-дикетонов, широкое применение нашел и другой подход. Он основан на циклизации 2,4-диенонов Первоначально образуется 2Я-пиран, который легко окисляется in situ с образованием пирилиевой соли (схема 29) [39]. Необходимые диеноны можно получить конденсацией метилкетонов с ненасыщенными альдегидами. Указанный метод наиболее эффективен, когда заместителями являются арильные группы он особенно полезен для получения 2,6-дизамещенных пирилиевых соединений. [c.28]
Интересный метод генерирования диполей связан с алкилированием [24] или силилированием [25] карбонильного атома кислорода З-гидрокси-4-пиро-нов. Внутримолекулярное диполярное циклоприсоединение с участием таких диполей возможно и к неактивированной двойной связи [25]. Ниже приведен пример использования аналога койевой кислоты [койевая кислота — 5-гидро-кси-2-(гидроксиметил)-4Н-пиран-4-он] для генерирования диполя в результате метилирования по карбонильному атому кислорода и депротонированию 3-гид-роксильной группы поддействием объемного основания. [c.206]
Присоединение реактивов Гриньяра к 4-пиронам также проходит по карбонильной группе, последующая дегидратация первоначально образующегося третичного спирта под действием минеральной кислоты обеспечивает удобный синтетический подход к 4-монозамещенным пирилиевым солям [39]. В более жестких условиях реакции 2- и 4-пиронов с металлоорганическими реагентами приводят к образованию соответственно 2,2-дизамещенных 2Н-пиранов и [c.208]
Приведенные выше методы вполне пригодны для получения дибромалкил-аминов (XVI), так как карбоксильная группа на любой стадии может быть превращена в аминогруппу по реакции Курциуса—Шмидта. Так, пиран-4-ук-сусная кислота (XIV) легко образует пиран-4-метиламин (XVII), из которого может быть получен бис-(бромэтил)метиламин (II). [c.297]
Так как пиран легко отщепляется в присутствии кислот, эта реакция можег служить методом синтеза 2,6-дихлор-8-замещенных пуринов, которые трудно получить другими способами. Таким образом, вводя или не вводя тетрагидро-пиранильную группу по Ыд-атому, можно направлять нуклеофильную реакцию по положению 6 или 8. Этим способом получен 2,6-дихлор-8-аминопурин (XX). Аналогичным образом в строго контролируемых условиях действием 1 экв этилата натрия, метилмеркаптида натрия, едкого натра и других реагентов на соединение XIX синтезированы соответствующие 8-замещенные пурины [85], в частности 2,6-дихлор-8-этоксипурин. [c.222]
Из 2,4,6-триарил-4Я-пиранов 12а наряду с альдегидом 13а получаются дикето-ны 14, соответствующие гидролизу солей пирилия 15 [6]. Из 4-этилзамещенных солей 12Ь в качестве побочных продуктов образуются альдегиды 16, соответствующие взаимодействию этильной группы с избытком ДМФА через интермедиат 17. Наконец, метильная группа пирана 12с дважды формилируется в условиях реакции. Гидролиз интермедиата 18 приводит к описанному диальдегиду 19 [7]. Необходимо отметить, что выход побочных продуктов 14, 16 и 19 не превышает в каждой реакции 10%, а выделение альдегидов 13 не представляет препаративных трудностей. Для получения аналитически чистых образцов достаточно двух перекристаллизаций. [c.405]
Бензо[Ь]пираны, имеющие ароматический заместитель в пирановом кольце, из-за их широкой распространенности и большой важности для растений выделяют в особый раздел классификации. Они носят общее название флавоноидов и подразделяются на несколько типов. Биогенетическими предщественниками арилбензо[Ь]пиранов служат халконы (см. разд. 3.4.5). Образование циклической системы флавоноидов происходит путем внутримолекулярной реакции Михаэля — присоединения фенольной гидроксильной группы по активированной двойной связи халкона (схема 92). [c.364]
В дальнейшем было установлено, что атомы Н и группы ОН располагаются определенным образом над и под плоскостью цикла из атомов углерода и атома кислорода. Более наглядно пространственное строение моносахаридов передает написание формул в виде пяти- или шестичленных колец. Углеводы с шестичленными циклами называются пиранозами, а углеводы с пятичленными цшлш — фураноаами (от наименования соответствующих гетероциклических систем — пиран и фуран, см. 39.1). [c.506]
Дигидро-2Н- пиран-2-карбокси- альдегид 3,4-Дигидро-2Н-ниран-2-метанол, тет-рагидропиран-2-мета-нол (I) Ni-Ренея оксиметильной группы I [1251] [c.662]
Тип симметрии точечной группы 2Л ,. Тип симметрии Тетрагидро-точечной группы пиран 1576, 164, 7261 1918, 1641 Пиперидин 1918] Тетрагидро- тиопиран [918] [c.545]
Такие ненасыщенные циклические простые эфиры, как 3,4-ди-гидро-2Н-пиран и 2,3-дигидрофуран, представляют собой виниловые эфиры и характеризуются ожидаемой для них способностью подвергаться присоединениям под действием электрофильных инициаторов. Катализируемое кислотой присоединение спирта к виниловому эфиру дает ацеталь, который может служить полезным производным для защиты гидроксильной группы, поскольку спирт можно регенерировать обработкой водной кислотой [129]. 3,4-Ди-гидро-2Н-пиран находит широкое применение в качестве защитной группы в синтезе олигонуклеотидов, однако он обладает тем недостатком, что в случае хиральных спиртов образуются диасте-реомерные ацетали. Этот недостаток может быть устранен [129] при использовании винилового эфира 4-метокси-5,6-дигидро-2Н-пи-рана присоединение спирта к этому соединению не приводит к образованию нового хирального центра. [c.407]
Однако синтетическим путем были получены алкилированные производные пиранов (СКа вместо группы СНа) [c.684]
В группе шестичленных гетероциклов мы встречаемся с кольцами VIII и IX, которые отличаются друг от друга опять-таки тем, что содержат разные гетероатомы пиран содержит кислород, пиридин—азот. Однако различие между последними двумя веществами этим не исчерпывается. Они отличаются друг от друга также и строением колец (количеством и расположением двойных связей). [c.219]
Примерами реагентов, используемых для такой защиты гидроксильных групп, служат 2,3-дигидро-4Н-пиран (88), 4-метокси-5,6-дигидро-2Н-пиран (89а), метилвиниловый эфир (90) и 2-метокси-пропен (9 ). Типичными катализаторами служат ТьОН, НС , Р0С1з и ВРз. В результате аналогичного присоединения к 1-алкок-сиалкинам и кетенацеталям, катализируемого кислотами Льюиса (ВРз, ЕпСЬ) или алкоксидами, образуются сложные эфиры орто-карбоновых кислот. [c.69]
Каталитическое карбонилирование С2Н2 и его гомологов протекает в жидкой фазе при 150—200° С и давлении 30 атм. В качестве катализаторов используют галогениды, сульфиды, карбонилы или комплексы металлов VIII группы периодической системы [212, 419—427], а в качестве растворителей — воду, ТГФ, ацетон, пиран, диоксан, кетоны, простые эфиры, гликоли, лактоны, лактамы [420, 421, 428—430. Наиболее подробно изучены [c.69]
chem21.info



