Положительный индуктивный эффект – Положительный индуктивный эффект – Большая Энциклопедия Нефти и Газа, статья, страница 3
- Комментариев к записи Положительный индуктивный эффект – Положительный индуктивный эффект – Большая Энциклопедия Нефти и Газа, статья, страница 3 нет
- Советы абитуриенту
Презентация на тему: Отрицательный индуктивный эффект (-I)
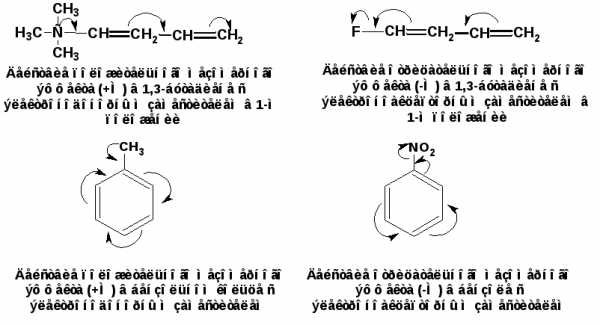
•-I эффект вызывают любые заместители, содержащие атомы с большей электроотрицательностью,
чем у атома углерода:
галогены (F, Cl, Br, I),OH- и ОR-
группы, Nh3-, NHR- и NR2-группы,
оксо-группа, карбоксильная группа, нитрогруппаи многие другие.

Положительный индуктивный эффект (+I)
•+I эффектом обладают: алкильныеR-группы,связанные с sp2 иsp-гибридизованнымиатомами углерода,алкоксид-анион,оксид-анионныецентры, атомы металлов.
δ-CH |
| δ+ | δ′′- | δ′- |
| δ- |
| − | ||
2 | = CH ← CH | СН3 | СН2 | СН2 |
| СН2 | О | |||
|
| |||||||||
|
| 3 |
|
|
|
|
| +I | ||
|
| +I |
|
|
|
|
| |||
δ′′- | δ′- | δ- | δ+ |
|
|
|
|
|
| |
Ch4 – Ch3 ← Ch3 | ← Ch3 | ← MgBr |
|
|
|
|
|
| ||
+I
23
Мезомерный эффект
• – это передача полярного влиянияатома или группы атомов по π-связямв сопряженной системе. Причем, атом, передающий эффект должен сам участвовать в сопряжении.
•Знак мезомерного эффекта
оценивается, исходя из графического обозначения, по тому же принципу, что и знак индуктивного эффекта.
•Поскольку π-связи(π-МО)легко поляризуются, томезомерный эффект, в отличие от индуктивного,не затухает по цепи связанных атомов.
Электронодоноры и электроноакцепторы
•Заместители, обладающие -I и-М-эффектами,называются электроноакцепторами.
•Заместители, обладающие +I и+М-эффектами,называются электронодонорами.
•Если электронные эффекты заместителя
разнонаправлены, например -I и+М, то
преобладающим, как правило, будет +М-
эффект. Такой заместитель является
электронодонором. | δ- |
..δ+ | |
δ- | Nh3 |
δ–I < +M ЭД
27
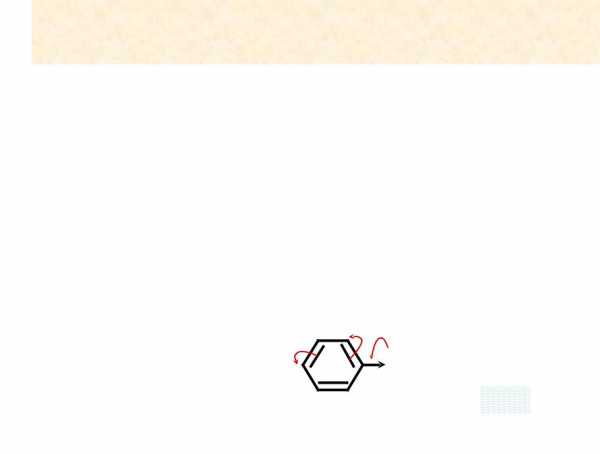
•Однако в хлорбензоле -I>+M, и атом хлора является электроноакцептором, понижающем электронную плотность на бензольном кольце.
.. | δ+ | ..δ- |
Cl | δ+ | Cl |
-I>+M ЭА | δ+ |
|
Результирующее влияние атома хлора как электроноакцептора
Факторы, определяющие реакционную способность
•Типы разрыва ковалентной связи
•Промежуточные частицы реакции
•Энергетический барьер реакции (энергия активаци)
•Температура, рН среды, соотношение реагентов, наличие кофакторов и катализаторов.
Типы разрыва ковалентной связи
• | Гомолиз |
|
А | В | А + В |
|
| атомы |
Атомные орбитали выходят из перекрывания и
каждая АО уносит с собой по одному электрону.
Образуются частицы с
неспаренными электронами. Это либо атомы, либо
радикалы
• Гетеролиз |
| |||
А |
|
| В | А+ + |
|
| |||
|
| |||
|
| |||
|
| |||
В | электрофил | |||
|
|
|
| нуклеофил |
Атомные орбитали выходят из перекрывания, и
пара электронов уносится АО частицы В, тогда как АО
частицы А остается вакантной
Образуются ионы.
Индуктивное влияние. Индукционный эффект — Мегаобучалка
Смещение электронов σ – связей обозначают как индуктивный эффект. Понятие индукционного эффекта предложено Дж. Льюисом.
Индуктивный эффект (I – эффект) – это смещение электронной плотности в молекулах по цепи σ – связей вследствие различной электроотрицательности атомов, участвующих в образовании этих связей.
Индукционный эффект состоит в передаче влияния путем последовательной поляризации σ – связей и распространяется вдоль цепи связанных атомов:
Подобные смещения электронных пар распространяются далее по цепи простых σ – связей.
В монохлоруксусной кислоте электронный сдвиг связи Cl H передается по цепочке простых связей до карбоксильной группы и связи О – Н, вызывая увеличение ее полярности, а следовательно, подвижности атома водорода и кислотных свойств:
Характерная особенность индуктивного механизма передачи влияния атомов в молекуле состоит в том, что все смещаемые электронные пары σ – связей остаются в своих первоначальных октетах. Изменения касаются лишь их положения относительно связанных атомов.
Силу индуктивного эффекта функциональных групп и атомов оценивают, сравнивая его с индуктивным эффектом группы, которую принимают за стандарт. В качественных оценках за стандарт часто принимают атом водорода. Количественно силу индуктивного эффекта различных групп оценивают по сравнению с метильной группой, которую принимают за стандарт.
Группы и атомы, оттягивающие электроны σ – связи от углерода, называют электроноакцепторными (ЭА). Их индуктивный эффект обозначается символом «–I» и называется отрицательным. – I-Эффект проявляют атомы, имеющие полный или частичный положительный заряд и более электроотрицательные, чем углерод. Например, в соединениях:
группы NO2 , CHO, F проявляют – I-эффект. Величина – I-эффекта зависит от электроотрицательности атомов, связанных с углеродом. Например, – I-эффект падает в ряду:
F > Cl > Br > I; F > OH > NH2
Атомы и группы атомов, вызывающие смещение электронов σ – связи к углероду, называются электронодонорными (ЭД). Индуктивный эффект таких групп обозначается символом «+I» и называется положительным. +I-Эффект проявляют атомы, несущие полный отрицательный заряд, металлы и алкильные группы. Например:
Mg в метилмагниййодиде и группа СН3 в пропене проявляют +I-эффект. +I-Эффект алкильных групп возрастает в ряду:
метил < этил < пропил < изопропил < трет-изобутил
то есть с накоплением метильных групп у атома углерода.
Наиболее сильное влияние индуктивный эффект оказывает на соседний атом и быстро затухает по цепи простых связей. Влияние заместителя с удалением на 3 – 4 С – С –связи становится малозаметным.
Сравнение кислотных свойств карбоновых кислот и их производных
| Соединение | Направление I-Эффекта | Константа диссоциации |
| +I | 1,76 * 10–5 | |
| I = 0 | 17,72 * 10–5 | |
| –I | 135,9 * 10–5 |
Сила индукционного эффекта зависит от природы заместителя, а именно, от его электроноакцепторных или электронодонорных свойств. Для электроноакцепторных заместителей – I-эффект возрастает с электроотрицательностью атома и увеличением числа электроотрицательных атомов.
Электроотрицательность атомов галогенов возрастает от йода к фтору. Это, как правило, усиливает вызываемый ими – I-эффект, и увеличиваются кислотные свойства галогенозамещенных карбоновых кислот.
Ненасыщенные группы обнаруживают слабый – I-эффект. Причина такой зависимости состоит в увеличении электроотрицательности атома углерода, связанного с изменением его гибридизации.
Насыщенные алкильные радикалы вызывают слабый +I-эффект. При этом +I-эффект алкильного радикала возрастает с увеличением длины цепи и ее разветвленности: уксусная кислота более сильная чем бутановая.
Кислотные свойства галогенозамещенных карбоновых кислот
megaobuchalka.ru
5.1.1. Индуктивный эффект.
10
ЛЕКЦИЯ 5
Схема лекции.
5.1. Электронные эффекты в органической химии.
5.1.1. Индуктивный эффект.
5.1.2. Эффекты сопряжения.
5.1.3. Резонанс.
5.2. Теория кислот и оснований в органической химии.
5.2.1. Кислоты Бренстеда.
5.2.2. Основания Бренстеда.
5.2.3. Кислоты и основания Льюиса.
5.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКОЙ ХИМИИ.
Химические свойства органических веществ различных рядов и классов определяются особенностями распределения электронной плотности в молекулах этих веществ, что в свою очередь определяется строением молекул и наличием функциональных групп. Строение функциональных групп и природа атомов, входящих в их состав находят свое отражение в так называемых электронных эффектах. К электронным эффектам относятся: индуктивный эффект, эффект поля (передача воздействия через пространство электростатическим путем), эффект сопряжения и эффект отталкивания орбиталей. Мы рассмотрим индуктивный эффект и эффект сопряжения.
Среди свойств ковалентной связи отмечалось свойство полярности, что выражается в смещении пары электронов, образующих связь в строну более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент. Дипольный момент связи оказывает воздействие на соседнюю связь. Эта связь в свою очередь оказывает воздействие на соседнюю связь и т.д. В итоге происходит смещение электронных облаков химических связей вдоль линии σ-связей, вызванное различием в значениях электроотрицательности атомов. Это явление смещения получило название индуктивного эффекта.
Определение: Индуктивным эффектом называется смещение электронной плотности σ-связей вдоль линии связи, вызванное различием в значениях электроотрицательности атомов.
Индуктивный эффект имеет электростатическую природу. Он передается по линии связи и ведет к появлению дробных электрических зарядов на атомах. Заряды обозначаются символами δ+ и δ–. Степень смещения электронной плотности зависит от разности электроотрицательности соответствующих атомов. Знак индуктивного эффекта определяется относительно атома или группы атомов, принятого за эталон. В качественных оценках его часто определяют относительно атома водорода. При количественном рассмотрении за стандарт принята группа СН3-. Индуктивный эффект изображают стрелкой вдоль σ-связи. Стрелка указывает направление смещения электронной плотности.
Индуктивный эффект передается по цепи σ-связей с затуханием. Наиболее подвержен действию индуктивного эффекта α-углеродный атом.
Заместители, притягивающие электроны, характеризуют отрицательным индуктивным эффектом. Их называют электроноакцепторными заместителями. Примерами электроноакцепторных заместителей, обладающих отрицательным индуктивным эффектом (-I-эффект). являются: F-; Cl-; Br-; -OH; -ОR; -COOH; -CHO; -COOR; -CN; -NO2; -NH2; СН2=СН-; С6Н5-; СНС- В состав данных функциональных групп входят атомы с электроотрицательность более высокой, чем электроотрицательность атома углерода в метильном радикале.
Заместители, отталкивающие электроны от себя проявляют положительный индуктивный эффект (+I-эффект). Такие заместители называются электронодонорными. Положительный индуктивный эффект также определяется относительно метильной группы. Положительным индуктивным эффектом обладают атомы металлов, а также разветвленные алкильные группы:
Заместители, в которых находится атом углерода в состояниях sp2-гибридизации и sp-гибридизации являются электроакцепторами по сравнению с атомом углерода в состоянии sp3-гибридизации и, соответственно, обладают отрицательным индуктивным эффектом.
Атомы с целым отрицательным зарядом обладают положительным индуктивным эффектом:
Атомы с целым положительным зарядом обладают отрицательным индуктивным эффектом.
5.1.2. Эффекты сопряжения.
Осуществление влияния природы атомов на распределение электронной плотности в молекуле возможно как по системе σ-связей посредством индуктивного эффекта, так и по системе π-связей. Способность π-электронов к смещению особенно ярко выражена в соединениях, в которых существует система чередующихся кратных и простых связей:
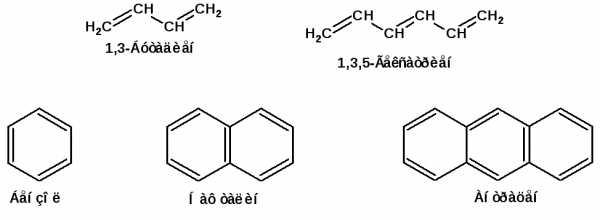
Такие соединения построены только из атомов в состоянии sp2-гибридизации. А сами такие системы называются сопряженными. Физической основой сопряжения является взаимодействие (перекрывание) р-орбиталей соседних двойных связей:
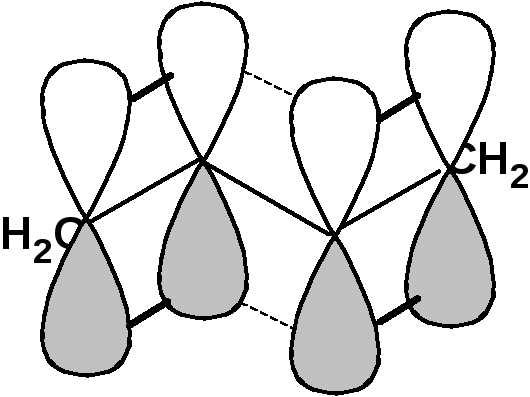
Сопряженная система представляет собой сплошную π-связь только электронная плотность концентрированна в большей степени на двойной связи и в меньшей степени на простой связи. Т.е. в случае сопряженной системы отсутствуют разрывы в цепочке связей как в случае σ-остова. Соответственно в случае появления в сопряженной системе атома, электроотрицательность которого отличается от электроотрицательности атома углерода в состоянии sp2-гибридизации, то в зависимости от того донором или акцептором является функциональная группа – произойдет смещение электронной плотности по всей цепи сопряжения. Эффект смещения электронной плотности по цепи сопряжения называется мезомерным эффектом (обозначается буквой «М»). В зависимости от направления смещения электронной плотности от заместителя или к нему различают положительный мезомерный эффект (+М) и отрицательный мезомерный эффект (-М). Графически мезомерные эффекты обозначается изогнутой стрелкой Часто термин «мезомерный эффект» заменяют термином «эффект сопряжения». Но сопряжение обозначает перекрывание орбиталей соседних связей, а мезомерия обозначает передачу влияния по цепи сопряженных связей:
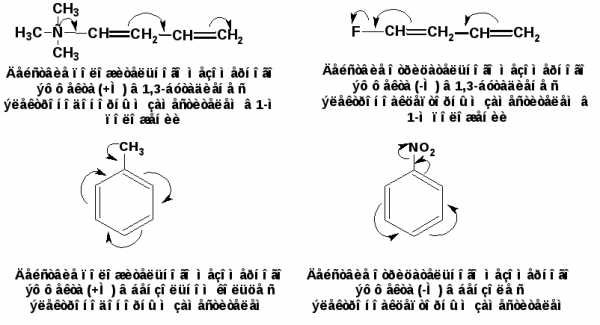
Комбинация изогнутых стрелок по структурной формуле отражает перераспределение электронной плотности в цепи сопряжения. Данное перераспределение называется делокализацией «размазыванием». Иногда делокализацию изображают графически пунктирной линией по структурной формуле:
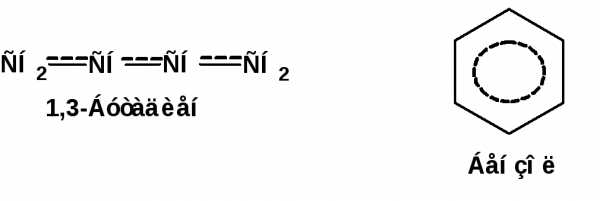
Такие формулы называют мезомерными формулами. Делокализация оказывает большое влияние на свойства сопряженных молекул. Чем выше степень делокализации тем выше термодинамическая стабильность сопряженной системы. Обратите внимание на порядок в своих комнатах. Чаще бывает беспорядок. Т.е. беспорядок более устойчивое состояние. Делокализация – то беспорядок в распределении электронов. Частным случаем делокализации является сверхсопряжение, которое способствует стабилизации неспаренных электронов алкильных радикалов.
Эффекты сопряжения характерны для соединений с кратными связями (двойные, тройные) независимо от природы атомов, соединенных кратными связями, а также для функциональных групп в состав которых входят гетероатомы с неподеленными электронными парами.
studfiles.net
5.1.1. Индуктивный эффект.
10
ЛЕКЦИЯ 5
Схема лекции.
5.1. Электронные эффекты в органической химии.
5.1.1. Индуктивный эффект.
5.1.2. Эффекты сопряжения.
5.1.3. Резонанс.
5.2. Теория кислот и оснований в органической химии.
5.2.1. Кислоты Бренстеда.
5.2.2. Основания Бренстеда.
5.2.3. Кислоты и основания Льюиса.
5.1. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКОЙ ХИМИИ.
Химические свойства органических веществ различных рядов и классов определяются особенностями распределения электронной плотности в молекулах этих веществ, что в свою очередь определяется строением молекул и наличием функциональных групп. Строение функциональных групп и природа атомов, входящих в их состав находят свое отражение в так называемых электронных эффектах. К электронным эффектам относятся: индуктивный эффект, эффект поля (передача воздействия через пространство электростатическим путем), эффект сопряжения и эффект отталкивания орбиталей. Мы рассмотрим индуктивный эффект и эффект сопряжения.
Среди свойств ковалентной связи отмечалось свойство полярности, что выражается в смещении пары электронов, образующих связь в строну более электроотрицательного атома. Мерой полярности ковалентной связи является дипольный момент. Дипольный момент связи оказывает воздействие на соседнюю связь. Эта связь в свою очередь оказывает воздействие на соседнюю связь и т.д. В итоге происходит смещение электронных облаков химических связей вдоль линии σ-связей, вызванное различием в значениях электроотрицательности атомов. Это явление смещения получило название индуктивного эффекта.
Определение: Индуктивным эффектом называется смещение электронной плотности σ-связей вдоль линии связи, вызванное различием в значениях электроотрицательности атомов.
Индуктивный эффект имеет электростатическую природу. Он передается по линии связи и ведет к появлению дробных электрических зарядов на атомах. Заряды обозначаются символами δ+ и δ–. Степень смещения электронной плотности зависит от разности электроотрицательности соответствующих атомов. Знак индуктивного эффекта определяется относительно атома или группы атомов, принятого за эталон. В качественных оценках его часто определяют относительно атома водорода. При количественном рассмотрении за стандарт принята группа СН3-. Индуктивный эффект изображают стрелкой вдоль σ-связи. Стрелка указывает направление смещения электронной плотности.
Индуктивный эффект передается по цепи σ-связей с затуханием. Наиболее подвержен действию индуктивного эффекта α-углеродный атом.
Заместители, притягивающие электроны, характеризуют отрицательным индуктивным эффектом. Их называют электроноакцепторными заместителями. Примерами электроноакцепторных заместителей, обладающих отрицательным индуктивным эффектом (-I-эффект). являются: F-; Cl-; Br-; -OH; -ОR; -COOH; -CHO; -COOR; -CN; -NO2; -NH2; СН2=СН-; С6Н5-; СНС- В состав данных функциональных групп входят атомы с электроотрицательность более высокой, чем электроотрицательность атома углерода в метильном радикале.
Заместители, отталкивающие электроны от себя проявляют положительный индуктивный эффект (+I-эффект). Такие заместители называются электронодонорными. Положительный индуктивный эффект также определяется относительно метильной группы. Положительным индуктивным эффектом обладают атомы металлов, а также разветвленные алкильные группы:
Заместители, в которых находится атом углерода в состояниях sp2-гибридизации и sp-гибридизации являются электроакцепторами по сравнению с атомом углерода в состоянии sp3-гибридизации и, соответственно, обладают отрицательным индуктивным эффектом.
Атомы с целым отрицательным зарядом обладают положительным индуктивным эффектом:
Атомы с целым положительным зарядом обладают отрицательным индуктивным эффектом.
5.1.2. Эффекты сопряжения.
Осуществление влияния природы атомов на распределение электронной плотности в молекуле возможно как по системе σ-связей посредством индуктивного эффекта, так и по системе π-связей. Способность π-электронов к смещению особенно ярко выражена в соединениях, в которых существует система чередующихся кратных и простых связей:
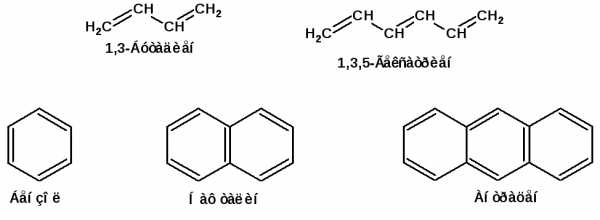
Такие соединения построены только из атомов в состоянии sp2-гибридизации. А сами такие системы называются сопряженными. Физической основой сопряжения является взаимодействие (перекрывание) р-орбиталей соседних двойных связей:
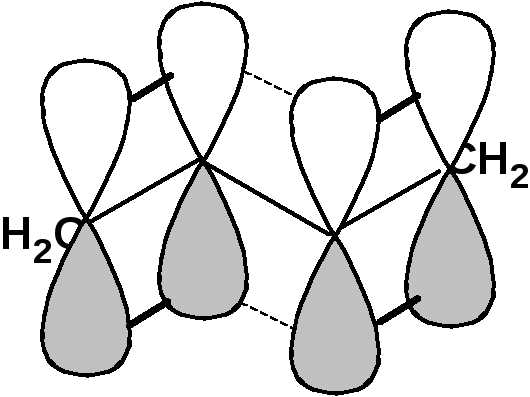
Сопряженная система представляет собой сплошную π-связь только электронная плотность концентрированна в большей степени на двойной связи и в меньшей степени на простой связи. Т.е. в случае сопряженной системы отсутствуют разрывы в цепочке связей как в случае σ-остова. Соответственно в случае появления в сопряженной системе атома, электроотрицательность которого отличается от электроотрицательности атома углерода в состоянии sp2-гибридизации, то в зависимости от того донором или акцептором является функциональная группа – произойдет смещение электронной плотности по всей цепи сопряжения. Эффект смещения электронной плотности по цепи сопряжения называется мезомерным эффектом (обозначается буквой «М»). В зависимости от направления смещения электронной плотности от заместителя или к нему различают положительный мезомерный эффект (+М) и отрицательный мезомерный эффект (-М). Графически мезомерные эффекты обозначается изогнутой стрелкой Часто термин «мезомерный эффект» заменяют термином «эффект сопряжения». Но сопряжение обозначает перекрывание орбиталей соседних связей, а мезомерия обозначает передачу влияния по цепи сопряженных связей:
Комбинация изогнутых стрелок по структурной формуле отражает перераспределение электронной плотности в цепи сопряжения. Данное перераспределение называется делокализацией «размазыванием». Иногда делокализацию изображают графически пунктирной линией по структурной формуле:
Такие формулы называют мезомерными формулами. Делокализация оказывает большое влияние на свойства сопряженных молекул. Чем выше степень делокализации тем выше термодинамическая стабильность сопряженной системы. Обратите внимание на порядок в своих комнатах. Чаще бывает беспорядок. Т.е. беспорядок более устойчивое состояние. Делокализация – то беспорядок в распределении электронов. Частным случаем делокализации является сверхсопряжение, которое способствует стабилизации неспаренных электронов алкильных радикалов.
Эффекты сопряжения характерны для соединений с кратными связями (двойные, тройные) независимо от природы атомов, соединенных кратными связями, а также для функциональных групп в состав которых входят гетероатомы с неподеленными электронными парами.
studfiles.net
Индуктивный эффект.
Связь между атомами может быть неполярной или полярной в зависимости от электроотрицательности атомов (ЭО).
ЭО – это способность атома притягивать валентные электроны. Существует шкала ЭО, разработанная американским ученым Л. Полингом на основе энергии связи.
F O N Cl Br I C H Li Na
4 3,5 3,0 3,0 2,8 2,6 2,5 2,2 1,0 0,9
Элементы, ЭО которых меньше, чем ЭО атома водорода (2,2), называются электроположительными, они увеличивают электронную плотность на атоме С.
–δ +δ
СNa
2,5 0,9
Элементы, ЭО которых больше, чем 2,2, называются электроотрицательными, они уменьшают электронную плотность на атоме С.
+δ –δ
СCl
2,5 3,0
Таким образом, при наличии в молекуле различных по своей ЭО атомов, происходит смещение электронной плотности в сторону более электроотрицательного. Влияние атома передается и на соседние связи, что приводит к перераспределению электронной плотности в молекуле.
Смещение электронной плотности в молекуле вдоль σ–связей под действием заместителя называется индуктивным эффектом. Обозначается буквой I, изображается стрелкой по σ–связи. По мере удаления заместителя влияние его ослабевает.
Например, при введении в молекулу пропана атома хлора вместо атома водорода, происходит смещение электронной плотности к атому хлора по всей цепи σ–связей. Это и есть индуктивный эффект.
+δ΄΄΄ +δ΄΄ +δ΄ –δ
СН3 СН2 СН2 Cl –I
2,5 3,0
δ΄΄΄ < δ΄΄ < δ΄
Если электронная плотность смещается к заместителю – это отрицательный индуктивный эффект (–I).
Если электронная плотность смещается от заместителя в молекулу – то положительный индуктивный эффект (+I).
+I проявляют: алкильные заместители (CH3,C2H5,C3H7 и т.д.), металлы, анионы (О–)
–I проявляют: Cl, Br, OH, NH2, NO2, –OCH3, –C = O , –C = O , – SO3H, –C≡N
H oh
Под действием заместителя электронная плотность в молекуле либо увеличивается, либо уменьшается, что определяет его реакционную способность.
I – это способ передачи взаимного влияния атомов.
Сопряженные системы. Сопряжение.
В соединении может быть несколько двойных связей и они могут быть расположены по разному относительно друг друга. Рассмотрим на примере пентадиена С5Н8.
1 2 3 4 5
С=С–С–С=С пентадиен –1,4
1 2 3 4 5
С=С=С–С–С пентадиен- 1,2
1 2 3 4 5
С=С–С=С–С пентадиен- 1,3
Соединения, в которых двойные связи чередуются с одинарными, называются сопряженными системами. Существуют открытые сопряженные системы (с.с) и замкнутые (циклические).
Открытые сопряженные системы.
Пример открытой с.с – бутадиен – 1,3.
1 2 3 4
СН2=СН–СН=СН2
|
Вследствие этого происходит делокализация (выравнивание) электронной плотности сопряженных π – связей и образуется единое π – электронное облако, охватывающее все четыре атома углерода.
Выравнивание электронной плотности π – связей сопряженной системы называется сопряжением.
Сопряжение подтверждается следующими фактами:
вследствие выравнивания электронной плотности происходит выравнивание длин связей (одинарные становятся короче, двойные – длиннее). Все связи в бутадиене имеют длину 0, 140 нм.
Сопряженные системы термодинамически более устойчивы.
Своеобразие химических свойств: в реакциях присоединения у бутадиена разрываются одновременно обе π – связи (так как это единая π – система), к 1и 4 атому углерода присоединяется реагент, а между 2 и 3 атомами углерода образуется новая π – связь.
1,2–присоединение
СН2=СН–СН=СН2 + Br2
1,4–присоединение
studfiles.net
Положительный индуктивный эффект – Большая Энциклопедия Нефти и Газа, статья, страница 1
Положительный индуктивный эффект
Cтраница 1
Положительный индуктивный эффект ( / – эффект) характерен и для алкильных групп, причем он усиливается с ростом разветвленное цепи алкила. [1]
Положительный индуктивный эффект ( 4 – / – эффект) метильной группы сообщает ядру бензола общую повышенную электронную плотность, причем за счет эффекта сопряжения наибольшую в о – и – положениях. Как известно, хлор обладает отрицательным индуктивным эффектом. [2]
Положительный индуктивный эффект ( / – эффект) метильной группы сообщает ядру бензола повышенную электронную плотность, причем наибольшую в орто – и пара-положениях. [3]
Положительный индуктивный эффект характерен для электро-нодонорных заместителей, какими являются алкильные, алкоксиль-ные и другие группы. [4]
Положительным индуктивным эффектом ( /) называют эффект, наблюдающийся при смещении электронов от электроотрицательного атома к атому углерода. [5]
За счет положительного индуктивного эффекта заместителя у атома азота устойчивость радикала будет тем больше, чем меньше нарушается сопряжение имидного цикла путем отдачи электронов заместителями. Следовательно, N-2, 4-диметилфенилмальимид должен был бы быть наиболее реакционноспособным мономером. [6]
Под влиянием положительного индуктивного эффекта алкильных групп ( /) в олефинах происходит поляризация двойной связи, сопровождающаяся появлением – б-заряда у наиболее гидрогенизированного атома углерода, который выступает в качестве акцептора протона. [7]
Группы с положительным индуктивным эффектом повышают электронную плотность в любом положении бензольного кольца, но преимущественно в орто – и шра-положениях – относительно группы Y. Напротив, группы с отрицательным индуктивным эффектом вызывают общее обеднение л-электронной плотности бензольного кольца, причем в наибольшей степени это влияние сказывается также в орто – и пара – положениях. [8]
Группы с положительным индуктивным эффектом повышают электронную плотность в любом положении бензольного кольца, но преимущественно в орто – и пара-положениях относительно группы Y. Напротив, группы с отрицательным индуктивным эффектом вызывают общее обеднение л-электронной плотности бензольного кольца, причем в наибольшей степени это влияние сказывается также в орто – и пара-положениях. [9]
Какие заместители проявляют положительный индуктивный эффект, а какие – отрицательный. [10]
Какие заместители проявляют положительный индуктивный эффект, а какие – отрицательный. [11]
Для незаряженных атомов положительный индуктивный эффект является функцией их электроотрицательности. Эффект металлов значительно больше, чем водорода. [12]
Атом кремния оказывает положительный индуктивный эффект на атом углерода, а углерод оказывает отрицательный индуктивный эффект на атом кремния. [13]
Метильная группа оказывает небольшой положительный индуктивный эффект, и можно ожидать, что введение такого заместителя в ароматическое кольцо вызовет небольшое повышение основности. Это и наблюдается в действительности для мета – и пара-заме-щенных анилинов, но не для орто-изомера. Этот аномальный орго-эффект не ограничивается только метильной группой, но наблюдается и для других заместителей. Причины этого явления понятны пока не полностью. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Индуктивный эффект
Электроника Индуктивный эффектпросмотров – 494
Одно из положений теории А.М. Бутлерова свидетельствует о взаимном влиянии атомов.Наиболее сильное взаимное влияние оказывают атомы непосредственно связанные друг с другом. Природу и механизм этого влияния можно объяснить с помощью теории электронных смещений. Существует два вида электронных смещений – 1)смещение электронной плотности в простых σ-связях и 2)смещение электронной плотности по сопряженной системе.
Индуктивный (индукционный) эффект – ϶ᴛᴏ смещение электронной плотности в простых или σ-связях, который возникает в силу различной электроотрицательности атомов. Обозначается индуктивный эффект буквой I.
Можно сказать, индуктивный эффект – ϶ᴛᴏ передача электронного влияния заместителя по цепи σ-связей
Индуктивный эффект по знаку может быть (+I) – положительный и (-I) –отрицательный в зависимости от того электронодонорные или электроноакцепторные свойства проявляют данный атом или атомная группа.
Электронодонорным принято называть такой заместитель, благодаря которому происходит повышение электронной плотности в цепи.
Электроноакцепторным принято называть такой заместитель, благодаря которому происходит понижение электронной плотности в цепи.
Для изображения такого смещения используют ( →) стрелку на σ-связи.
В молекулах углеводородов связь ковалентная неполярная ᴛ.ᴇ. электронная плотность в молекулах распределена равномерно. Рассмотрим индуктивный эффект на примере 1-хлорбутана в сравнении его с н-бутаном.
Н3С – СН2 – СН2 – СН3 Н3С – СН2 – СН2 – СН2 – Cl
Молекула н-бутана неполярна, т.к. электроотрицательность углерода и водорода приблизительно одинаковы, все атомы углерода находятся в sp3-гибридизации, ᴛ.ᴇ. и их электроотрицательность тоже одинакова, в связи с этим никакого смещения электронной плотности не происходит.
Введение в молекулу хлора приводит к тому, что молекула становится полярной, т.к. хлор более электроотрицательный элемент, чем углерод.
δ + δ+ δ+ δ+ δ-
Н3С→СН2→СН2 →СН2→– Cl
δ+ < δ+ < δ[D1] + < δ+
Уменьшение электронной плотности на атоме 1 приводит к тому что он проявляя электроакцепторные свойства «оттягивает» на себя электроны σ-связи от соседнего атома углерода, тот в свою очередь оттягивает электронную плотность на себя и т.д. Таким образом поляризация связи С-Cl вызывает элекронную асимметрию.
В основе оценки индуктивнго эффекта (+I, -I) лежит электроотрицательность элементов, в качестве стандарта служит атом водорода, индуктивный эффект которого равен 0.
Атомы и атомные группы, обладающие электроноакцепторными свойствами ᴛ.ᴇ. способные притягивать электроны, проявляют отрицательный индуктивный эффект (-I), а атомы или атомные группы, способные отталкивать от себя электронную плотность проявляют положительный индуктивный эффект (+I).
δ+ δ- δ- δ+
R – СН2 → Х R – СН2 – Н R – СН2 ← У
Х – акцепторная группа Стандарт У – донорная группа
(-I) (I = 0) (+I)
Отрицательным индуктивным эффектом обладают:
Х = -NO2 , -OH, – NH2 , -COH, -COR. –COOH, -SO3H, -OR, -SR, -SH, -Hal
Положительным индуктивным эффектом обладают:
У = алкильные группы (-CH3 , -C2H5 и т.д.)
Особенности индуктивного эффекта:
1) Индуктивный эффект заместителей распространяется всегда в одном направлении.
2) Индуктивный эффект постепенно затухает, вызывая поляризацию максимум 3-4 связей.
Отрицательный индуктивный эффект атомов и атомных групп определяется их электроотрицательностью, с увеличением электроотрицательности усиливается и индукционное влияние заместителей. Его удобно рассматривать в пределах одного периода в ПСЭ.
В ряду алкильных радикалов, наибольшей электроноотталкивающей способностью, ᴛ.ᴇ. наибольшим +I эффектом обладают третичные радикалы, затем вторичные, наименьший +I эффект проявляют первичные радикалы.
CH3 CH3
| |
H3C – C – > H3 C – CH2 – CH – > H3C – CH2 – CH2 – CH2 –
|
CH3
Увеличение +I эффекта наблюдается с увеличением углеродной цепи в ряду предельных углеводородов:
– СН3 < – C2H5 < – C3H7 < – C4H9
Все ненасыщенные и ароматические заместители оказывают –I эффект. Его относительная сила изменяется в следующем порядке:
– С ≡ СН > > -CH = CH2
Это связано с различной ЭО атомов углерода
Csp > Csp > Csp
уменьшение электроотрицательности
Относительную силу индуктивного влияния заместителей можно оценить, сравнивая некоторые свойства соединений лишь в ряду одного класса.
Хорошо иллюстрирует действие –I эффекта замещенные карбоновые кислоты:
O
║
HaL ← CH2 ← C ← O ← H
Чем более ЭО элементом является заместитель, тем сильнее должна стать кислота͵ ч то и наблюдается.
КИСЛОТА К 10-5
CH3 ← COOH 1,75
FCH2 ← COOH 260
ClCH2 ← COOH 155
BrCH2 ← COOH 138
ICH2 ← COOH 75
Накопление электроотрицательных заместителей приводит к возрастанию –I эффекта:
FCH2 ← COOH 260
F2CH ← COOH 5700
F3C ← COOH 58800
Удаление заместителя, вызывающего –I эффект, от карбоксильнай группы приводит к его снижению:
CH3 – CH2 – CH2 – COOH 1,5
CH3 – CH2 – CH – COOH 139
|
Читайте также
Поляризация связей: Индуктивным эффектом (I-эффект) заместителя называется передача электронного влияния заместителя по цепи &… [читать подробенее]
Ковалентные связи. Органическим соединениям характерны ковалентные связи. Ковалентной связью называется химическая связь, образованная за счет обобществления электронов связываемых атомов. Существует два типа ковалентной связи: &… [читать подробенее]
Индуктивный эффект (этот же эффект в различных учебниках называют еще электронным или полярным) – это способность заместителя передавать свое влияние по цепи ковалентно связанных атомов. При этом заместитель также испытывает на себе влияние остатка молекулы, к которому… [читать подробенее]
Одно из положений теории А.М. Бутлерова свидетельствует о взаимном влиянии атомов.Наиболее сильное взаимное влияние оказывают атомы непосредственно связанные друг с другом. Природу и механизм этого влияния можно объяснить с помощью теории электронных смещений…. [читать подробенее]
Ароматичность СН2 = СН – Сl Здесь происходит сопряжение p-электронов с р-электронами. Этот вид сопряжения наз-ся р, p-сопряжением. Закрытая система имеется в ароматических УВ. С6Н6 Сопряжение – процесс энергетически выгодный, энергия (Е) при этом… [читать подробенее]
oplib.ru



