Понятие органическая химия – Лекция №1 (II) семестр “Предмет органической химии. Органические вещества” – Лекции по химии – Студентам – Каталог файлов
- Комментариев к записи Понятие органическая химия – Лекция №1 (II) семестр “Предмет органической химии. Органические вещества” – Лекции по химии – Студентам – Каталог файлов нет
- Советы абитуриенту
- Основные понятия и законы органической химиии
- Органическая химия
- ОРГАНИЧЕСКАЯ ХИМИЯ — Большая Медицинская Энциклопедия
- Словарь терминов по органической химии амфотерность
- Основные понятия органической химии Органическая химия это
- Органическая химия — Традиция
- Понятие органическая химия – Справочник химика 21
Основные понятия и законы органической химиии
Трудно представить прогресс в какой бы то ни было области хозяйства без химии – в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией.
Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям).
Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных изучала вещества, входящие в состав животных организмов; растительная – вещества, входящие в состав растений; минеральная – вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция – в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов.
В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину – органическую химию.
Среди ученых в то время господствовало виталистическое мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной “жизненной силы”. Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом.
В 1828 г. немецкий химик Вёлер, работая с циановокислым аммонием, случайно получил мочевину
O
II
Nh3–C–Nh3.
В 1854 г. француз Бертло синтезировал вещества, относящиеся к жирам, а в 1861 г. русский ученый Бутлеров синтезировал вещества, относящиеся к классу сахаров. Это были тяжелые удары по виталистической теории, окончательно разбивающие убеждение о невозможности синтеза органических соединений.
Эти и другие достижения химиков требовали теоретического объяснения и обобщения возможных путей синтеза органических соединений и связи их свойств со строением.
Исторически первой теорией органической химии стала теория радикалов (Ж.Дюма, Ю.Либих, И.Берцелиус). По мнению авторов, многие превращения органических соединений протекают так, что некоторые группы атомов (радикалы), не изменяясь, переходят из одного органического соединения в другое. Однако, вскоре было установлено, что в органических радикалах атомы водорода могут замещаться даже на такие отличные от водорода по химической природе атомы, как атомы хлора, и при этом тип химического соединения сохраняется.
Теорию радикалов сменила более совершенная и охватывающая больший экспериментальный материал теория типов (О.Лоран, Ш.Жерар, Ж.Дюма). Теория типов классифицировала органические вещества по типам превращений. К типу водорода относили углеводороды, к типу хлороводорода – галогенопроизводные, к типу воды – спирты, эфиры, кислоты и их ангидриды, к типу аммиака – амины. Однако накапливающийся огромный экспериментальный материал уже не укладывался в известные типы и, кроме того, теория типов не могла предсказать существование и пути синтеза новых органических соединений. Развитие науки требовало создания новой, более прогрессивной теории, для рождения которой уже существовали некоторые предпосылки: установлена четырехвалентность углерода (А.Кекуле и А.Кольбе, 1857 год), показана способность атома углерода образовывать цепочки атомов (А.Кекуле и А.Купер, 1857 год).
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе “О химическом строении вещества”.
Основные положения теории химического строения А.М.Бутлерова можно свести к следующему.
1. Все атомы в молекуле органического соединения связаны друг с другом в определенной последовательности в соответствии с их валентностью. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3–О–СН3) и этиловый спирт (С2Н5ОН).
2. Свойства веществ зависят от их химического строения. Химическое строение – это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга – как соседних, так и через другие атомы. В результате каждое вещество имеет свои особые физические и химические свойства. Например, диметиловый эфир – это газ без запаха, нерастворимый в воде, t°пл. = -138°C, t°кип. = 23,6°C; этиловый спирт – жидкость с запахом, растворимая в воде, t°пл. = -114,5°C, t°кип. = 78,3°C.
3. Изучение свойств веществ позволяет определить их химическое строение, а химическое строение веществ определяет их физические и химические свойства.
4. Атомы углерода способны соединятся между собой, образовывая углеродные цепи различного вида. Они могут быть как открытыми, так и замкнутыми (циклическими), как прямыми, так и разветвленными. В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с одинарными связями) или ненасыщенными (с двойными и тройными связями).
5. Каждое органическое соединение имеет одну определенную формулу строения или структурную формулу, которую строят, основываясь на положении о четырехвалентном углероде и способности его атомов образовывать цепи и циклы. Строение молекулы как реального объекта можно изучить экспериментально химическими и физическими методами.
А.М.Бутлеров не ограничился теоретическими объяснениями своей теории строения органических соединений. Он провел ряд экспериментов, подтвердив предсказания теории получением изобутана, трет. бутилового спирта и т.д. Это дало возможность А.М.Бутлерову заявить в 1864 году, что имеющиеся факты позволяют ручаться за возможность синтетического получения любого органического вещества.
В дальнейшем развитии и обосновании теории строения органических соединений большую роль сыграли последователи Бутлерова – В.В.Марковников, Е.Е.Вагнер, Н.Д.Зелинский, А.Н.Несмеянов и др.
Современный период развития органической химии в области теории характеризуется все возрастающим проникновением методов квантовой механики в органическую химию. С их помощью решаются вопросы о причинах тех или иных проявлений взаимного влияния атомов в молекулах. В области развития органического синтеза современный период характеризуется значительными успехами в получении многочисленных органических соединений, в число которых входят природные вещества – антибиотики, разнообразные лекарственные соединения, многочисленные высокомолекулярные соединения. Органическая химия глубоко проникла в сферу физиологии. Так, с химической точки зрения изучена гормональная функция организма, механизм передачи нервных импульсов. Ученые вплотную подошли к разрешению вопроса о строении и синтезе белка.
Органическая химия как самостоятельная наука продолжает существовать и интенсивно развиваться. Это объясняется следующими причинами:
1. Многообразием органических соединений, обусловленным тем, что углерод в отличие от других элементов способен соединяться друг с другом, давая длинные цепочки (изомеры). В настоящее время известно около 6 млн. органических соединений, в то время как неорганических – только около 700 тысяч.
2. Сложностью молекул органических веществ, содержащих до 10 тысяч атомов (например, природные биополимеры – белки, углеводы).
3. Специфичностью свойств органических соединений по сравнению с неорганическими (неустойчивостью при сравнительно невысоких температурах, низкой – до 300°С – температурой плавления, горючестью).
4. Медленно идущими реакциями между органическими веществами по сравнению с реакциями, характерными для неорганических веществ, образованием побочных продуктов, спецификой выделения получающихся веществ и технологическим оборудованием.
5. Огромным практическим значением органических соединений. Они – наша пища и одежда, топливо, разнообразные лекарственные препараты, многочисленные полимерные материалы и т.д.
Классификация органических соединений
Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп.
На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
Органические соединения
¯
¯
Ациклические (алифатические)
(соединения с открытой цепью)
Циклические
(соединения с замкнутой цепью)
¯
¯
¯
¯
Насыщенные (предельные)
Ненасыщенные (непредельные)
Карбоциклические (цикл состоит только из атомов углерода)
Гетероциклические (цикл состоит из атомов углерода и других элементов)
¯
¯
Алициклические (алифатические циклические)
Ароматические
Простейшими представителями ациклических соединений являются алифатические углеводороды – соединения, содержащие только атомы углерода и водорода. Алифатические углеводороды могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Простейшим представителем алициклических углеводородов служит циклопропан, содержащий цикл из трех углеродных атомов.
Ароматический ряд объединяет ароматические углеводороды – бензол, нафталин, антрацен и т.д., а также их производные.
Гетероциклические соединения могут содержать в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов (кислород, азот, серу и др.).
В каждом представленном ряду органические соединения делятся на классы в зависимости от состава и строения. Наиболее простым классом органических соединений являются углеводороды. При замене атомов водорода в углеводородах на другие атомы или группы атомов (функциональные группы) образуются другие классы органических соединений данного ряда.
Функциональная группа – атом или группа атомов, устанавливающие принадлежность соединения к классам органических соединений и определяющие главнейшие направления его химических превращений.
Соединения с одной функциональной группой называются монофункциональными (метанол СН3–ОН), с несколькими одинаковыми функциональными группами – полифункциональными (глицерин
СН2–
I
OH СН–
I
OH СН2),
I
OH
с несколькими разными функциональными группами – гетерофункциональными (молочная кислота
СН3–
СН–СООН).
I
OH
Соединения каждого класса составляют гомологические ряды. Гомологический ряд – это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).
Основные классы органических соединений следующие:
I. Углеводороды (R–H).
II. Галогенопроизводные (R–Hlg).
III. Спирты (R–OH).
O
//
IV. Эфиры простые и сложные (R–O–R’, R–C ).
\
OR’
O
//
V. Карбонильные соединения (альдегиды и кетоны) (R–C
\
H
O
II
, R–C–R).
O
//
VI. Карбоновые кислоты R–C ).
\
OH
R
I
VII. Амины (R–Nh3, NH, R–N–R’).
I I
R’ R’’
VIII. Нитросоединения (R–NO2).
IX. Сульфокислоты (R–SO3H).
Число известных классов органических соединений не ограничивается перечисленными, оно велико и с развитием науки все время увеличивается.
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращений функциональных групп без изменения углеродного скелета.
Классификация реакций органических соединений по характеру химических превращений
Органические соединения способны к разнообразным химическим превращениям, которые могут проходить как без изменения углеродного скелета, так и с таковым. Большинство реакций проходит без изменения углеродного скелета.
I. Реакции без изменения углеродного скелета
К реакциям без изменения углеродного скелета относятся следующие:
1) замещения: RH + Br2 ® RBr + HBr,
2) присоединения: Ch3=Ch3 + Br2 ® Ch3Br – Ch3Br,
3) отщепления (элиминирования): Ch4–Ch3–Cl ® Ch3=Ch3 + HCl,
C2H5ONa
4) изомеризации: Ch4–Ch3–CєСH
––––––®
¬––––––
Ch4–CєС–Ch4
Na
Реакции замещения характерны для всех классов органических соединений. Замещаться могут атомы водорода или атомы любого другого элемента, кроме углерода.
Реакции присоединения характерны для соединений с кратными связями, которые могут быть между атомами углерода, углерода и кислорода, углерода и азота и т. д., а также для соединений, содержащих атомы со свободными электронными парами или вакантными орбиталями.
К реакциям элиминирования способны соединения, содержащие электроотрицательные группировки. Легко отщепляются такие вещества, как вода, галогеноводороды, аммиак.
К реакциям изомеризации без изменения углеродного скелета особенно склонны непредельные соединения и их производные.
II. Реакции с изменением углеродного скелета
К этому типу превращений органических соединений относятся следующие реакции:
1) удлинения цепи,
2) укорачивания цепи,
3) изомеризации цепи,
4) циклизации,
5) раскрытия цикла,
6) сжатия и расширения цикла.
Химические реакции проходят с образованием различных промежуточных продуктов. Путь, по которому осуществляется переход от исходных веществ к конечным продуктам, называется механизмом реакции. В зависимости от механизма реакции они делятся на радикальные и ионные. Ковалентные связи между атомами А и В могут разрываться таким образом, что электронная пара или делится между атомами А и В, или передается одному из атомов. В первом случае частицы А и В, получив по одному электрону, становятся свободными радикалами. Происходит гомолитическое расщепление:
А : В ® А• + •В
Во втором случае электронная пара переходит к одной из частиц и образуются два разноименных иона. Поскольку образующиеся ионы имеют различные электронные структуры, этот тип разрыва связи называется гетеролитическим расщеплением:
А : В ® А+ + :В-
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион – так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Изучение условий и методов проведения, а также механизмов реакций органических соединений составляет основное содержание данного курса органической химии.
Вопросы номенклатуры органических соединений, как правило, излагаются во всех учебниках органической химии, поэтому мы сознательно опускаем рассмотрение этого материала, обращая внимание на то, что во всех случаях написания уравнений реакций исходные и образующиеся соединения снабжаются соответствующими названиями. Эти названия со знанием основ номенклатуры позволят каждому самостоятельно решить вопросы, связанные с номенклатурой органических соединений.
Изучение органической химии начинают по обыкновению с алифатического ряда и с наиболее простого класса веществ – углеводородов.
www.examen.ru
Органическая химия
Органи́ческая хи́мия — раздел химии, изучающий структуру, свойства органических соединений и реакции между ними.
Понятие органической химии включает следующие цели, экспериментальные методы и теоретические представления:
- Выделение чистых веществ из растительного, животного или ископаемого сырья
- Синтез и очистка соединений
- Определение структуры веществ
- Определение механизмов химических реакций
- Выявление связей между структурой органических веществ и их свойствами
История
Способы получения различных органических веществ были известны еще с древности. Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах. Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путем перегонки некоторых растительных продуктов. В 1769—1785 г. Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая. В 1773 г. Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений. Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.). При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (NH4OCN).
Важным открытием стала разработка Купером, Кекуле и Бутлеровым теории строения органических соединений в 1860 г. В основе этой теории стоял факт, что практически во всех соединениях углерод является четырехвалентным. В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии. В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра. В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
В 1931 г. Хюккель применил квантовую теорию для объяснения свойств ароматических углеродов, чем основал новое направление в органической химии — квантовую химию. В 1933 г. Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства органических реакций.
Историю органической химии принято излагать в связи с открытиями сделанными в области строения органических соединений, однако такое изложение гораздо больше связано с историей химии вообще. Гораздо интереснее рассматривать историю органической химии с позиции материальной базы, т. е. собственно предмета изучения органической химии.
На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения. Именно этому факту органическая химия обязана своим названием. Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля. Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез. В 50-60 годах прошлого века произошел переход основного органического синтеза на новую базу — нефть. Таким образом появилась новая область химии — нефтехимия. Огромный потенциал, который был заложен в новом сырье вызвал бум в органичсекой химии и химии вообще. Появление и интенсивное развитие такой области как химии полимеров обязана прежде всего новой сырьевой базе.
Несмотря на то, что современная органическая химия в качестве материальной базы по прежнему использует сырье биологического происхождения и каменноугольную смолу, объем переработки этих видов химического сырья по сравнению с переработкой нефти мал. Смена материально-сырьевой базы органической химии была вызвана прежде всего возможностями наращивания объемов производства.
Классификация органических соединений
Подробно рассмотрена в статье «Органические соединения».
Правила и особенности классификации
В основе классификации лежит структура органических соединений. Основа описания структуры — структурная формула. Атомы элементов обозначаются латинскими символами, как они обозначены в периодической таблице химических элементов (таблице Менделеева). Ковалентные связи обозначаются прямой чертой, количество связей характеризуется валентностью элементов. Водородные и электронодефицитные связи обозначаются пунктирной линией, ионные связи обозначаются указанием зарядов частиц, входящих в состав молекулы. Поскольку в подавляющее большинство органических молекул входит водород, его обычно не обозначают при изображении структуры. Таким образом, если в структуре у одного из атомов изображена недостаточная валентность, значит, возле этого атома расположен один или несколько атомов водорода.
Атомы могут образовывать циклические и ароматические системы.
Основные классы органических соединений
- Углеводороды — соединения, состоящие только из атомов углерода и водорода. Они в свою очередь делятся на:
- Насыщенные — максимальное количество атомов водорода на один атом углерода.
- Ненасыщенные — имеют в своем составе хотя бы одну двойную связь.
- С открытой цепью
- С замкнутой цепью — содержат цикл
К ним относятся алканы, алкены, алкины, циклоалканы, арены.
- Соединения с гетероатомами в функциональных группах — соединения, в которых углеродный радикал R связан с функциональной группой. По характеру функциональных групп делятся на:
- Гетероциклические — содержат гетероатомы в составе кольца. Различаются по числу атомов в цикле, по виду гетероатома, по количеству гетероатомов в цикле.
- Органического происхождения — как правило соединения очень сложной структуры, зачастую принадлежат сразу к нескольким классам органических веществ, часто полимеры. Из-за этого их сложно классифицировать и их выделяют в отдельный класс веществ.
- Полимеры — вещества очень большой молекулярной массы, которые состоят из периодически повторяющихся фрагментов — мономеров.
Строение органических соединений
Органические соединения в основном образованы ковалентными неполярными связями C—C, или ковалентными полярными типа C—O, C—N, C—Hal. Согласно октетной теории Льюиса и Косселя молекула является устойчивой, если внешние орбитали всех атомов полностью заполнены. Для таких элементов как C, N, O, Галогены необходимо 8 электронов, чтобы заполнить внешние валентные орбитали, для водорода необходимо только 2 электрона. Полярность объясняется смещением электронной плотности в сторону более электроотрицательного атома.
Классическая теория валентных связей не в состоянии объяснить все типы связей, существующие в органических соединениях, поэтому современная теория использует методы молекулярных орбиталей и квантовохимические методы.
Особенности органических реакций
В неорганических реакциях обычно участвуют ионы, они проходят быстро и до конца при комнатной температуре. В органических реакциях часто происходят разрывы ковалентных связей с образованием новых. Эти процессы требуют большей температуры и длительного времени. Часто они требуют наличия катализатора. Обычно протекает не одна, а сразу несколько реакций, поэтому выход целевого вещества зачастую не превышает 50 %. Поэтому при изображении органических реакций используют не уравнения, а схемы без рассчета стехиометрии.
Реакции могут протекать очень сложным образом и в несколько стадий, не обязательно так, как реакция условно изображена на схеме. В качестве промежуточных соединений могут возникать карбкатионы R+, карбанионы R−, радикалы R·, карбены CX2, катион-радикалы, анион-радикалы, и другие нестабильные частицы, живущие доли секунды. Подробное описание всех превращений, происходящих на молекулярном уровне во время реакции, называется механизмом реакции.
Реакции классифицируются в зависимости от способов разрыва и образования связей, способов возбуждения реакции, ее молекулярности.
Определение структуры органических соединений
За все время существования органической химии как науки важной задачей было определить структуру органических соединений. Это значит узнать, какие атомы входят в состав соединения и в каком порядке эти атомы связаны между собой.
Существует несколько методов решения этой задачи.
- Элементный анализ. Заключается в том, что вещество разлагается на более простые молекулы, по количеству которых можно определить количество атомов, входящее в состав соединения. С помощью этого метода невозможно установить порядок связей между атомами. Часто используется лишь для подтверждения предположенной структуры.
- Инфракрасная спектроскопия (ИК-спектроскопия). Образец материала (должен быть прозрачным) просвечивается светом инфракрасного диапазона. Этот свет поглощается валентными электронами соединения и возбуждает их. Позволяет установить наличие определенных функциональных групп в молекуле. Часто используется для того чтобы подтвердить идентичность исследуемого вещества с некоторым уже известным веществом путем сравнения ИК-спектров.
- Метод ядерного магнитного резонанса (ЯМР). Основан на взаимодействии магнитного поля валентных электронов с внешним магнитным полем. Один из главных методов, который может быть использован для определения структуры. Дает информацию о расположении атомов с нечетной атомной массой. К этому методу относится:
- Метод протонного магнитного резонанса (ПМР). Позволяет определить положение атомов водорода 1H в молекуле.
- Метод магнитного резонанса атомов 13С. Определяет положение атомов углерода в молекуле. Позволяет определить форму углеродного скелета молекулы.
- Метод магнитного резонанса атомов 19F. Определяет наличие и положение атомов фтора в молекуле.
- Метод магнитного резонанса атомов 31P. Определяет наличие и положение атомов фосфора в молекуле.
В трех последних методах используются неосновные изотопы элементов, поскольку основной изотоп этих элементов имеет четную атомную массу.
- Метод ультрафиолетовой спектроскопии (УФ-спектроскопия). Используется для определения наличия и характеристик коньюгированных &pi-систем.
- Методы аналитической химии. Позволяют определить наличие некоторых функциональных групп по специфическим химическим реакциям, факт протекания которых можно фиксировать визуально или с помощью других методов.
Описанных выше методов как правило полностью хватает для определения структуры неизвестного вещества.
Масс-спектроскопия. Вещество при определенных условиях (электрический разряд, химическая ионизация и др.) разлагают на ионы, ускоряемые затем в магнитном или электрическом поле. Позволяет определить молекулярный вес и иногда позволяет установить наличие различных функциональных групп. Метод ядерного магнитного резонанса (ЯМР). Основан на взаимодействии магнитного поля атомных ядер с внешним магнитным полем. Один из главных методов, который может быть использован для определения структуры. Дает информацию о расположении атомов с нечетной атомной массой. К этому методу относится:
Метод протонного магнитного резонанса (ПМР). Позволяет определить положение атомов водорода 1H в молекуле. Метод магнитного резонанса атомов 19F. Определяет наличие и положение атомов фтора в молекуле. Метод магнитного резонанса атомов 31P. Определяет наличие и положение атомов фосфора в молекуле. В двух последних методах используются неосновные изотопы элементов, поскольку основной изотоп этих элементов имеет четную атомную массу. Метод ультрафиолетовой спектроскопии (УФ-спектроскопия). Используется для определения наличия и характеристик коньюгированных &pi-систем. Методы аналитической химии. Позволяют определить наличие некоторых функциональных групп по специфическим химическим реакциям, факт протекания которых можно фиксировать визуально или с помощью других методов. Рентгеноструктурный анализ. Описанных выше методов
Литература
- Гауптман З., Грефе Ю., Ремане Х., «Органическая химия», Москва, «Химия», 1979.
- Марч Дж., «Органическая химия: реакции, механизмы и структура», в 4-х томах, Москва, «Мир», 1987.
- Кери Ф., Сандберг Р., «Углубленный курс органической химии», в 2-х томах, Москва, «Химия», 1981.
- Химическая энциклопедия, п. ред. Кнунянц, т.3, Москва, «Большая Российская Энциклопедия», 1992.
Ссылки
http://chaos.dvo.ru/chem.htm — Библиотека сканированных книг по химии на русском и английском языках.
mediaknowledge.ru
ОРГАНИЧЕСКАЯ ХИМИЯ — Большая Медицинская Энциклопедия
ОРГАНИЧЕСКАЯ ХИМИЯ — раздел химии, естественнонаучная дисциплина, предметом изучения к-рой являются органические соединения, т. е. соединения углерода с другими элементами, а также законы превращения этих веществ; иногда органическую химию определяют как химию углеводородов и их производных.
Влияние О. х. на развитие биологии и медицины очень велико. Все живое построено в основном из органических соединений (см.), и обмен веществ, лежащий в основе жизненных процессов, представляет собой превращения гл. обр. органических соединений. О. х. лежит в основе биохимии (см.) — науки, являющейся одной из естественнонаучных основ медицины. Большинство лекарственных веществ представляет собой органические соединения; поэтому О. х. наряду с физиологией и биохимией является основой фармакологии (см.). Методы О. х. сыграли важную роль в установлении строения нуклеиновых к-т, многих белков и других сложных природных соединении; с их помощью были раскрыты механизмы и регуляция синтеза белков. Благодаря возросшим возможностям органического синтеза были искусственно получены такие сложные природные вещества, как полинуклеотиды с заданным чередованием нуклеотидных звеньев, цианокобаламин и др.
Успехом органич. химии, имеющим принципиальное значение, явилась разработка методов синтеза многих биологически активных полипептидов, в т. ч. ферментов и нек-рых гормонов или их фармакологически активных аналогов, а также многих лекарственных средств.
Кроме того, большое значение приобрели методы О. х. в совр, технологии производства каучуков, пластмасс, синтетических красителей, пестицидов, гербицидов, стимуляторов роста растений.
О. х. изучает тонкое строение органических веществ: порядок соединения атомов в их молекулах, взаимное пространственное расположение атомов в молекулах органических соединений, электронное строение атомов и их связей в органических соединениях. Кроме того, предметом О. х. является изучение органических реакций, в т. ч. их кинетики (см. Кинетика биологических процессов), энергетики и электронных механизмов, а также разработка новых методов синтеза органических веществ в лабораторных и производственных условиях.
Разделы О. х. посвящены изучению отдельных групп органических веществ в соответствии с их классификацией, напр, химия углеводородов, химия аминокислот и т. д., или общетеоретическим вопросам, напр, стереоизомерия органических соединений, механизмы органических реакций, а также практически важным аспектам О. х., напр, химия красителей, химия органических лекарственных средств и т. д.
Органические соединения и нек-рые их свойства были известны людям с древних времен; уже тогда знали о спиртовом и уксусном брожении, крашении индиго и ализарином и т. п.
Начиная с 16 века — периода ятрохимии (см.)— исследования были направлены в основном на выделение и использование различных органических лекарственных веществ: из растений были выделены эфирные масла, приготовлен диэтиловый эфир, сухой перегонкой древесины получены метиловый (древесный) спирт и уксусная к-та, перегонкой янтаря — янтарная к-та. Однако возникновение О. х. как самостоятельной научной дисциплины относится лишь к 19 в. Впервые понятие «органическая химия» было использовано И. Берцелиусом, к-рый называл так химию веществ, образующихся в организме животных и растений. Важными этапами становления О. х. было осуществление первых хим. синтезов органических веществ — щавелевой к-ты и мочевины, показавшее возможность получения органических соединений вне живого организма, без участия «жизненной силы» (см. Витализм). Эти синтезы, а также работы Ю. Либиха, доказавшего, что во всех образующихся в живом организме (органических) веществах содержится углерод, способствовали появлению определения О. х. как химии соединений углерода, предложенного Л. Гмелином. С первой четверти 19 в. начались попытки обобщить фактический материал, имеющийся в распоряжении О. х., в виде тех или иных теорий. Первой такой теорией можно считать теорию радикалов, сформулированную Ж. Гей-Люссаком, согласно к-рой молекулы органических веществ состоят из групп атомов — радикалов, постоянных и неизменных и способных переходить из одного соединения в другое. Такие радикалы, по мнению Ж. Гей-Люссака, могут длительное время существовать в свободном состоянии, а в молекуле они удерживаются благодаря своим разноименным зарядам. Представление о радикалах как группах атомов, способных переходить из одной молекулы в другую, сохранилось и поныне. Однако все остальные положения этой теории оказались ошибочными.
Вслед за теорией радикалов появилась теория типов Жерара (F. Gerard) и Лорана (A. Laurent). По этой теории все органические вещества представляют собой соединения, образованные путем замены определенных атомов в молекуле нек-рых неорганических веществ (напр., воды, аммиака и др.) на органические остатки. Т. о. могут быть получены органические соединения, относящиеся к типам воды (спирты, простые эфиры), типам аммиака (первичные, вторичные и третичные амины) и т. д. Теория типов в свое время сыграла положительную роль, т. к. она позволила создать первую классификацию органических веществ, нек-рые элементы к-рой сохранились и в позднейших классификациях. Однако по мере накопления фактов и знакомства с более сложными веществами теория типов все чаще оказывалась несостоятельной.
Важным этапом в развитии О. х. явилось создание теории строения органических соединений. Одной из предпосылок создания этой теории было установление Кекуле (F. A. Kekule) в 1857 г. постоянной четырехвалентности углерода и открытие Купером (A. Cooper) в 1858 г. способности атомов углерода соединяться друг с другом, образуя цепи. Создателем теории строения органических соединений явился А. М. Бутлеров (1861). Основные положения этой теории заключаются в следующем. Все атомы, образующие молекулу органического вещества, связаны в определенной последовательности; они могут быть связаны одинарной —С—С—, двойной >С=С< или тройной —С-С— связью. От строения молекул, т. е. от порядка соединения атомов и характера связей между ними, зависят свойства вещества; этими положениями объяснялось непонятное ранее явление изомерии (см.). Хим. свойства каждого атома и атомной группы не неизменны, они зависят от других атомов и атомных групп, присутствующих в молекуле. Это положение теории строения органических соединений о взаимном влиянии атомов было развито учеником А. М.Бутлерова — В. В. Марковниковым. Теория А. М. Бутлерова, глубоко материалистическая, дает возможность выбрать наилучшую схему синтеза и по формуле строения, как по чертежу, синтезировать разнообразные органические вещества.
С момента создания теории строения органических соединений начинается интенсивное развитие О. х. Многие разделы О. х. становятся теоретической основой для ряда отраслей промышленности (химия топлива, химия красителей, химия лекарственных средств и т. д.).
В развитии О. х. выдающуюся роль сыграли также H. Н. Зинин, С. В. Лебедев, А. Е. Фаворский, Н. Д. Зелинский, В. М. Родионов, А. Н. Несмеянов, А. П. Орехов и многие другие. Среди зарубежных ученых в области О. х. широко известны Л. Пастер, Э. Фишер, Бертло (Р. E. М. Berthelot), А. Байер, Р. Вилъштеттер, Вудворд (R. В. Woodward) и др.
Под влиянием бурного развития физики в теории О. х. стали широко использоваться принципы квантовой, или волновой механики (см. Квантовая теория). Возникли понятия об орбиталях электрона (пространствах атома, в к-рых вероятность пребывания электрона наиболее велика). Электронные представления в О. х. дали возможность понять и классифицировать разнообразные факты взаимного влияния атомов, в основе к-рого, как выяснилось, лежит перераспределение электронной плотности. Большое внимание в О. х. уделяется изучению электронногомеханизма органических реакций. Эти реакции протекают с образованием свободных радикалов, имеющих атом с неспаренным электроном, магнитно некомпенсированным, а потому активным, или же ионов, несущих положительный или отрицательный заряд (карбокатионов и карбоанионов).
Глубокая связь О. х. с физикой и физической химией (см.) проявляется не только в изучении электронной природы хим. связей, взаимного влияния атомов и электронных механизмов реакций, но и в широкой разработке проблем кинетики и энергетики хим. реакций.
Особенностью О. х. второй половины 20 в. являются ее успехи в расшифровке строения и в синтезе таких сложнейших природных веществ, как белки (см.), нуклеиновые кислоты (см.) и др. Залогом успеха в этой области явилось установление взаимного пространственного расположения атомов в молекулах, т. е. стереохимии (см.) и конформации органических молекул (см. Конформация). Параллельно была решена задача изучения причин оптической изомерии и синтеза оптически активных соединений.
К успехам О. х. следует отнести открытие и изучение новых классов органических соединений, среди к-рых первое место занимают небензольные ароматические соединения (циклопеитадиенильный анион и металлоцены, катион тропилия, азу-лены и др.), нек-рые группы элемент-органических соединений с очень ценными в практическом отношении свойствами.
Во второй половине 20 в. продолжается дальнейшее сближение О. х. с биохимией и биологией, в результате к-рого возник новый раздел химии — биоорганическая химия.
Успехи О. х. стали возможны благодаря широкому использованию наряду с химическими ряда физических методов, к к-рым прежде всего относятся дифракционные методы (рентгенография и электронография), оптическая спектроскопия (в видимой, ультрафиолетовой и инфракрасной областях спектра), магнитная радиоспектроскопия: электронный парамагнитный резонанс (ЭПР), ядерный магнитный резонанс (ЯМР), масс-спектрометрия, определение электрических моментов диполя. Среди названных методов наиболее эффективным по информативности является ядерный магнитный резонанс (см.), в т. ч. его разновидности — протонно-магннтный резонанс и находящий все большее применение метод 13С-ЯМР. Эти методы не только во много раз ускорили расшифровку строения молекул органических соединений, но и позволили создать условия для получения их полной геометрической и энергетической характеристики, а также раскрыть электронные механизмы реакций. В органической химии используют и биохим, методы, напр, строго специфичные ферментативные методы, иммунол, методы и т. п.
С развитием естествознания появились такие новые дисциплины, как молекулярная патология и молекулярная фармакология. Все большее число болезней удается объяснить появлением в тканях измененных молекул органических веществ. Бурно развивающаяся молекулярная фармакология позволяет найти в клетках и охарактеризовать большое число рецепторов, специфически связывающих изучаемое лекарственное вещество. Изучение рецепторов на молекулярном уровне открывает перспективы для поисков новых лекарственных средств. Проникновение О. х. в биологию и медицину позволило вскрыть сущность нек-рых процессов, считавшихся ранее чисто биологическими. Так, было установлено, что наследственные признаки организмов «записаны» в молекулах ДНК в виде определенной последовательности нуклеотидов. О. х. проникла и в самую сложную сферу — в сферу изучения психической деятельности человека. Оказалось возможным одними органическими веществами вызвать у здорового человека галлюцинации, подобные галлюцинациям у психически больных, другими веществами эти галлюцинации снять. Из мозга человека и животных были выделены пептиды, обладающие действием, подобным действию морфина и его аналогов (см. Опиаты эндогенные). Возможно, что нарушение биосинтеза или рецепции этих пептидов лежит в основе патогенеза психических заболеваний, а органический синтез их устойчивых к действию пептидаз крови аналогов будет иметь огромное значение для анестезиологии, психиатрии и т. д.
По-видпмому, самые эффективные достижения следует ожидать именно в тех областях О. х., к-рые граничат с биологией и медициной. Это раскрытие хим. основ злокачественного роста п борьбы со злокачественными опухолями, расшифровка хим. основ памяти, механизма динамики развития и дифференцировки тканей, раскрытие хим. основ иммунитета и т. д. В областях О. х., пограничных с физикой и физической химией, будут продолжаться исследования по более глубокому проникновению в природу хим. связи между атомами в органической молекуле, будут более точно установлены количественные соотношения между строением и реакционной способностью таких молекул, глубже изучены механизмы реакций, в к-рые вступают органические соединения. В СССР научную работу по О. х. проводят НИИ АН СССР: Ин-т органической химии им. Н. Д. Зелинского (ИОХ), Ин-т органической и физической химии им. А. Е. Арбузова (ИОФХ), Ин-т нефтехимического синтеза им. А. В. Топчиева (ИНХС), Ин-т элементоорганических соединений (ИНЭОС), Ин-т биоорганической химии им. М. М. Шемякина, H PI И Сибирского отделения АН СССР: Новосибирский ин-т органической химии (НИОХ), Иркутский ин-т органической химии (ИНОХ), Ин-т химии нефти, а также НИИ республиканских академий — ин-ты органической химии Армянской ССР, Киргизской ССР, УССР, Ин-т тонкой органической химии им. А. Л. Мгджаяна (Арм. ССР), Ин-т физикоорганической химии (БССР), Ин-т физической и органической химии им. П. Г. Меликишвили (Груз. ССР), Ин-т органического синтеза (Латв. ССР) и др.
Национальный комитет советских химиков является членом Международного союза чистой и прикладной химии — IUPAC (International Union of Pure and Applied Chemie), к-рый организует один раз в два года конгрессы, конференции и симпозиумы, в т. ч. и по органической химии.
В связи с общей тенденцией медицины приблизиться к молекулярному уровню медик должен ясно представлять себе строение и пространственную конфигурацию молекул веществ, принимающих участие в метаболизме (нуклеиновых к-т, белков, ферментов, коферментов, углеводов, липидов и т. д.) в норме и патологии, а также строение молекул лекарственных средств.
О. х. является основой для изучения в медвузах и средних мед. учебных заведениях биохимии, фармакологии, физиологии и других дисциплин. Ей посвящен самостоятельный курс или она читается в составе курса по общей химии. Многие данные, полученные в исследованиях по О. х., используются в физической и коллоидной химии, биологии, гистологии, патофизиологии, общей гигиене, курсе профзаболеваний и т. д.
Библиография: Ингольд К. Теоретические основы органической химии, пер. с англ., М., 1973; Крам Д. и X э м-м о н д Дж. Органическая химия, пер. с англ., М., 1964; Матье Ж.-П. и П а-н и ко Р. Курс теоретических основ органической химии, пер. с франц., М., 1975; M о p р и сон Р. и Б о й д Р. Органическая химия, пер. с англ., М., 1974; Несмеянов А. Н. и Несмеянов Н. А. Начала органической химии, т. 1—2, М., 1974; Пальм В. А. Введение в теоретическую органическую химию, М., 1974; Райд К. Курс физической органической химии, пер. с англ., М., 1972; P е-в о А. Я. и 3 e л e н к о в а В. В. Малый практикум по органической химии, М., 1980; Реутов О. А. Теоретические проблемы органической химии, М., 1964; Робертс Дж. и К а с е-р и о М. Основы органической химии, пер. с англ., т. 1—2, М., 1978; С тепа-ненко Б. Н. Курс органической химии, ч. 1—2, М., 1976; он же, Курс органической химии, М., 1979.
Периодические издания — Журнал общей химии, М.— Л., с 1931; Журнал органической химии, М.— Л., с 1965; Химия гетероциклических соединений, Рига, с 1965; Химия природных соединений, Ташкент, с 1965; Bulletin de la Societe chi-mique de France, P., с 1863; Journal of the Chemical Society, Perkin Transaction, I. Organic and Bio-organic Chemistry, II. Physical Organic Chemistry, L., с 1972; Journal of Heterocyclic Chemistry, L., с 1964; Journal of Organic Chemistry, Washington, с 1936; Journal of the Orgariometailic Chemistry, Lausanne, с 1964; Journal of the Society of Organic Synthetic Chemistry of Japan, Tokyo, с 1943; Justus Liebigs Anna-len der Chemie, Weinheim, с 1832; Organic Magnetic Resonance, L., с 1969; Organic Mass Spectrometry, L., с 1968; Organic Preparations and Procedures, N. Y., с 1969; Synthesis, Stuttgart, с 1969; Synthetic Communication, N. Y., с 1971; Tetrahedron, N. Y.— L., с 1957; Tetrahedron Letters, L., с 1959.
Б. H. Степаненко.
xn--90aw5c.xn--c1avg
Словарь терминов по органической химии амфотерность
Словарь терминов по органической химии амфотерность – страница №1/1
Словарь терминов по органической химии
АМФОТЕРНОСТЬ – способность некоторых химических соединений проявлять кислотные или основные свойства в зависимости от веществ, которые с ними реагируют. Амфотерные вещества (амфолиты) ведут себя как кислоты по отношению к основаниям и как основания – по отношению к кислотам.
ВАЛЕНТНОСТЬ – число электронных пар, с помощью которых атом данного элемента связан с другими атомами.
ВОДОРОДНАЯ СВЯЗЬ – один из видов межмолекулярных связей. Обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF. Например, молекулы HF связаны между собой водородными связями, которые на рисунке показаны пунктирными линиями:
Водородная связь приблизительно в 20 раз менее прочная, чем ковалентная. При её возникновении число связей, образуемых атомом Н, превышает его формальную валентность.
ГИБРИДИЗАЦИЯ. Теоретическое представление, с помощью которого удается связать между собой физическую картину строения атома и определяемую опытным путем геометрию молекул. Например, атом углерода имеет s- и p-орбитали, но в молекуле CH4 не удалось опытным путем обнаружить отдельных связей, образованных s-электронами и отдельных связей – образованных p-электронами (все связи в CH4 одинаковы). Поэтому принято, что одна s- и три p-орбитали “смешиваются” (гибридизуются), образуя 4 новые, совершенно одинаковые орбитали (четыре sp3-гибридные орбитали). Эти 4 гибридные орбитали перекрываются с электронными оболочками 4-х атомов Н. Геометрическую формулу образовавшейся молекулы предсказывают исходя из правила, что гибридные орбитали в молекуле стремятся расположиться на максимальном расстоянии друг от друга. Например, для 4-х гибридных орбиталей это тетраэдр. В тех случаях, когда одна или две p-орбитали не участвуют в гибридизации, они остаются в “первозданном” виде и либо не несут электронов, либо участвуют в связывании другого типа (двойные и тройные связи). Это соответственно sp2– и sp-гибридизации. НЕПОДЕЛЕННЫЕ электронные ПАРЫ тоже участвуют в гибридизации. Например, аммиак :NH3 – sp3-гибридизация атома N, молекула имеет форму тетраэдра, одна из вершин которого – неподеленная пара электронов, оставшиеся три – атомы Н.
ГИДРАТАЦИЯ – донорно-акцепторное связывание молекул (атомов, ионов вещества) с водой, не сопровождающееся разрушением молекул воды.
ГИДРАТЫ – соединения вещества с водой, имеющие постоянный или переменный состав и образующиеся в результате гидратации.
ГИДРОКСИ-ГРУППА – группа ОН.
ГОРЕНИЕ – быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и, как правило, света.
ИНГИБИТОРЫ – вещества, замедляющие химические реакции.
ИНДИКАТОРЫ (кислотно-основные) – вещества сложного строения, имеющие разную окраску в растворах кислот и оснований. Бывают индикаторы и для других веществ (не кислотно-основные). Например, крахмал – индикатор на появление в растворе иода (дает синюю окраску).
КАТАЛИЗАТОРЫ – вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
КИСЛОТА – сложное вещество, в молекуле которого имеется один или несколько атомов водорода, которые могут быть замещены атомами (ионами) металлов. Оставшаяся часть молекулы кислоты называется кислотным остатком. Еще одно определение: кислоты – вещество, распадающееся в растворе с образованием ионов водорода Н+.
КОВАЛЕНТНАЯ СВЯЗЬ – связывание атомов с помощью общих (поделенных между ними) электронных пар. Неполярная ковалентная связь образуется между атомами одного вида. Полярная ковалентная связь существует между двумя атомами в том случае, если их электроотрицательности не одинаковы.
ЛЬЮИСА ФОРМУЛЫ – то же, что и СТРУКТУРНЫЕ ФОРМУЛЫ молекул, но с изображением связей между атомами не черточками, а точками, каждая из которых обозначает 1 электрон. Например, :N:::N: – молекула азота N2. В отличие от структурных формул, возможны формулы Льюиса и для отдельных атомов. Например H. – атом водорода (H:H – молекула водорода H2).
МОЛЕКУЛЯРНАЯ ОРБИТАЛЬ – электронное облако, образующееся при слиянии внешних электронных оболочек атомов (атомных орбиталей) при образовании между ними химической связи. Молекулярные орбитали образуются при слиянии двух или нескольких атомных орбиталей. Число молекулярных орбиталей всегда равно числу взаимодействующих атомных орбиталей. Все валентные электроны связывающихся атомов располагаются на вновь образованных молекулярных орбиталях.
МОЛЕКУЛА – наименьшая частица какого-либо вещества, определяющая его химические свойства и способная к самостоятельному существованию. Молекулы состоят из атомов.
НЕЙТРАЛИЗАЦИИ – (важная разновидность реакций обмена): реакции обмена между кислотой и основанием, в результате которых образуется соль и вода;
НЕПОДЕЛЕННАЯ ПАРА электронов – внешняя электронная пара атома, не участвующая в образовании химической связи.
НОРМАЛЬНЫМИ УСЛОВИЯМИ (н.у.) называют температуру 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па). Не путать со СТАНДАРТНЫМИ УСЛОВИЯМИ!
ОКИСЛЕНИЕ (вещества) – химическая реакция, при которой электроны отбираются у данного вещества окислителем.
ОКИСЛИТЕЛЬ – вещество, способное отнимать электроны у другого вещества (восстановителя).
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ – реакции, в которых происходит изменение степени окисления каких-либо атомов в реагирующих молекулах.
ОРБИТАЛЬ – пространство около ядра, в котором можно обнаружить электрон. За пределами этого пространства вероятность встретить электрон достаточно мала (менее 5%).
ОРГАНИЧЕСКАЯ ХИМИЯ – это раздел химической науки, изучающая соединения углерода.
ПЕРЕГОНКА – способ очистки веществ (как правило, жидкостей) путем их испарения в одном сосуде и конденсации паров в другом сосуде. Перегонкой можно разделять жидкости, если их температуры кипения отличаются.
РАСТВОРИТЕЛЬ. Из двух или нескольких компонентов раствора растворителем называется тот, который взят в большем количестве и имеет то же агрегатное состояние, что и у раствора в целом.
РЕАГЕНТЫ – исходные вещества в химической реакции. Формулы реагентов записываются всегда в левой части уравнения химической реакции.
СЛОЖНОЕ ВЕЩЕСТВО – вещество, которое состоит из молекул, построенных из атомов разных элементов. Примеры: соль, сахар, диоксид углерода, бензин, вода и т.д.
СМЕСЬ – вещество, состоящее из молекул или атомов двух или нескольких веществ (неважно – простых или сложных). Вещества, из которых состоит смесь, могут быть разделены. Примеры: воздух, морская вода, сплав двух металлов, раствор сахара и т.д.
СТРУКТУРНЫЕ ФОРМУЛЫ – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками. Например, структурные формулы: Cl – Ca – Cl (молекула CaCl2), O = С = O (молекула СО2) и т.д. Рекомендуется в структурных формулах изображать также и НЕПОДЕЛЕННЫЕ ПАРЫ электронов.
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ, типичных для органических соединений:
– ПРИСОЕДИНЕНИЯ (СИНТЕЗ) – два (или более) вещества-реагента соединяются в одно, более сложное вещество, сопровождаются образованием новых σ (сигма)-связей и за счёт разрыва π(пи)-связей;
– РАЗЛОЖЕНИЯ – одно сложное исходное вещество разлагается на два или несколько более простых молекул;
– ЗАМЕЩЕНИЯ – сопровождается образованием новых ковалентных связей при замещении одного атома (или группы атомов) на другие атомы или группы;
ФИЗИЧЕСКИЕ ЯВЛЕНИЯ – явления, не сопровождающиеся превращением одних веществ в другие путем разрыва и образования связей в их молекулах.
ХИМИЧЕСКИЕ РЕАКЦИИ – см. “химические явления”.
ХИМИЧЕСКИЕ ЯВЛЕНИЯ – явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит. Химические явления называют иначе химическими реакциями.
ХИМИЯ – наука о веществах и законах, по которым происходят их превращения в другие вещества.
ЭКОЛОГИЯ (от греческого oikos – пребывание и logos – слово, понятие, учение) – наука, изучающая взаимоотношения живых организмов с окружающей средой.
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ – относительная способность атомных ядер притягивать к себе электроны, образующие химическую связь.
ИМЕННЫЕ РЕАКЦИИ В ОРГАНИЧЕСКОЙ ХИМИИ.
Реакция Вагнера (окисление по Вагнеру, перманганатная проба)
Окисление органических соединений, содержащих двойную связь, действием 1–3%-го раствора перманганата калия (1887) в цис-a-гликоли в щелочной среде (считается положительной, если раствор перманганата быстро обесцвечивается в кислой среде или буреет в щелочной и нейтральной):
Вагнер Егор Егорович (1849–1903), профессор (Россия).
Реакция Вёлера. Взаимодействие карбида кальция с водой (1862). Практическое значение реакция приобрела после того, как А.Муассан и Т.Вильсон разработали способ дешевого получения карбида кальция в электропечи в результате сплавления кокса и извести (1892).
Вёлер Фридрих (1800–1882), профессор (Германия). Ученик Й.Я.Берцелиуса. Осуществил синтез мочевины при упаривании раствора цианата аммония (1828), что считается первым в истории науки синтезом органического вещества из неорганического.
Реакция Вюрца (реакция Вюртца). Синтез алканов действием металлического натрия в инертном растворителе на алкилгалогениды (1855):
в общем виде:
Вюрц (Вюртц) Шарль-Адольф (1817–1884), академик (Франция). Работал в областях органической и неорганической химии. Синтезировал фенол, метиламин и этиламин.
Реакция Вюрца–Фиттига (реакция Вюртца–Фиттига). Получение алкилбензолов из смеси алифатических и ароматических галогенидов действием металлического натрия в инертном растворителе (1864):
Фиттиг Рудольф (1835–1910), профессор (Германия). Ученик Ф.Вёлера. Основные работы
Реакция Густавсона. Получение циклоалканов из дигалогенпроизводных (1887).
Густавсон Гавриил Гавриилович (1843–1908), член-корреспондент Санкт-Петербургской академии наук (Россия). Открыл (1877) непрочные комплексные соединения галогенидов алюминия с различными углеводородами, обладающие каталитическими свойствами (ферменты Густавсона). Предложил (1888) способ получения аллена (с Н.Я.Демьяновым).
О нем были сложены такие строки:
«…И что студенчество к учению готово,
Туда, где юношей умели так увлечь
И Густавсоново увесистое слово,
И Тимирязева порывистая речь…» (Фортунатов. О восьми наставниках. Вестник воспитания, 1917, № 8–9, с. 140–174.)
Правило Зайцева. Отщепление галогеноводородных кислот от алкилгалогенидов или воды от спиртов преимущественно происходит так, что с галогеном или гидроксилом уходит водород от наименее гидрогенизованного соседнего атома углерода (1875):
Зайцев Александр Михайлович (1841–1910), член-корреспондент Санкт-Петербургской академии наук (Россия). Ученик А.М.Бутлерова. Разработал цинкорганические методы синтеза спиртов различных классов («зайцевские спирты», 1870–1875 гг.). Создатель крупной школы химиков. Президент Российского физико-химического общества (1905, 1908, 1911).
Реакция Зелинского–Казанского (метод Зелинского–Казанского). Тримеризация ацетилена (полимеризация ацетилена) на активированном угле при нагревании (1924):
Зелинский Николай Дмитриевич (1861–1953), академик (Россия). Основные исследования относятся к химии циклических соединений, химии гетероциклов, органическому катализу, химии белка и аминокислот. Открыл явление дегидрогенизационного катализа (1910). Разработал конструкцию противогаза (1916). Создатель школы химиков-органиков.
Казанский Борис Александрович (1891–1973), академик (Россия). Исследования связаны с разработкой основ нефтехимии и каталитического превращения углеводородов. Открыл каталитическую реакцию селективного гидрогенолиза циклопентановых углеводородов (1934 г., совместно с Н.Д.Зелинским и А.Ф.Платэ), реакцию С6-дегидроциклизации (ароматизации) алканов (1936 г., совместно с А.Ф.Платэ), реакцию С5-дегидроциклизации (1954 г., совместно с сотрудниками).
Реакция Зинина. Восстановление ароматических нитросоединений (1842 ):
Зинин Николай Николаевич (1812–1880), академик (Россия). Открыл бензидиновую перегруппировку (перегруппировка гидразобензола под действием кислот) (1845). Синтезировал аллиловый спирт. Основатель школы русских химиков. Один из организаторов Русского химического общества и первый его президент (1868–1877).
Реакция Кирхгофа. Получение глюкозы гидролизом крахмала при его нагревании с катализатором – разбавленной серной кислотой (1811):
Кирхгоф Константин Сигизмундович (Готлиб Сигизмунд Константин) (1764–1833), академик (Россия). Один из основоположников учения о катализе.
Реакция Кольбе (электрохимическая). Получение алканов с четным числом атомов углерода электролизом растворов солей щелочных металлов и карбоновых кислот с неразветвленной углеродной цепью (1849):
Кольбе Адольф Вильгельм Герман (1818–1884), профессор (Германия). Получил уксусную кислоту из элементов (1845). Открыл общий метод получения карбоновых кислот из спиртов через нитрилы (1847 г., совместно с Э.Франклендом). Синтезировал муравьиную (1861) и салициловую (1860) кислоты.
Реакция Коновалова. Получение нитроалканов (1888):
Коновалов Михаил Иванович (1858–1906), профессор (Россия). Основные работы посвящены изучению действия азотной кислоты на органические соединения. Открыл (1888) нитрующее действие слабого раствора азотной кислоты на алканы, циклоалканы и жирно-ароматические углеводороды. Своей реакцией он, по словам Н.Д.Зелинского, «оживил химических мертвецов» (алканы).
Реакция Кучерова (гидратация по Кучерову). Каталитическая гидратация ацетиленовых углеводородов с образованием карбонилсодержащих соединений (1881):
Кучеров Михаил Григорьевич (1850–1911), профессор (Россия). Получил дифенил (1873) и некоторые его производные. Исследовал гидратацию ацетиленовых углеводородов и изучил механизм этой реакции.
Реакция Лебедева. Получение бутадиена пиролизом этанола (1926):
Лебедев Сергей Васильевич (1874–1934), академик (Россия). Исследовал кинетику и механизм термической полимеризации диеновых углеводородов ряда дивинила и аллена (1908–1913). Впервые получил (1910) образец синтетического бутадиенового каучука. Разработал (1926–1928) одностадийный способ получения бутадиена из этанола.
Правило Марковникова. В случае присоединения водородсодержащих соединений (протонных кислот или воды) к несимметричному алкену атом водорода преимущественно присоединяется к наиболее гидрогенизованному атому углерода, стоящему при двойной связи (1869):
Марковников Владимир Васильевич (1837–1904), профессор (Россия). Выдвинул учение о взаимном влиянии атомов в молекуле, являющееся основой теории химического строения. Сформулировал правила о направлении реакций замещения, отщепления и присоединения по двойной связи и изомеризации в зависимости от химического строения (правила Марковникова, 1869 г.). Один из основателей Русского химического общества (1868).
Реакция Сабатье–Сандерана. Жидкофазное гидрирование этилена до этана в присутствии мелкораздробленного никеля как катализатора (1899):
Сабатье Поль (1854–1941), академик, нобелевский лауреат (Франция). Провел каталитическое гидрирование алкенов, а также алкинов и ароматических углеводородов (1899). Синтезировал метан из монооксида углерода и водорода (1902).
Реакция Савича. Получение алкинов из дигалогенпроизводных алканов (1861):
Савич В., химик (Россия).
Проба Толленса (реакция «серебряного зеркала»). Взаимодействие формальдегида с аммиачным раствором оксида серебра (реактив Толленса):
Толленс Бернгард Христиан Готфрид (1841–1918), профессор (Германия). Основные исследования посвящены органической химии и биохимии. Реактив предложен Толленсом в 1881 г. Создал методику определения углеводов.
Синтез Фишера–Тропша. Получение алканов при каталитическом гидрировании (взаимодействие с водородом) монооксида углерода под давлением (1923).
Фишер Франц (1877–1947), профессор (Германия).Основные исследования – синтезы органических соединений на основе СО и Н2. Указал (1926) на возможность использования открытой им реакции для получения жидкого моторного топлива. Разработал (1925–1935) технологию производства синтетического бензина (процесс Фишера–Тропша).
Тропш Ганс (1899–1935), химик-технолог (Германия). Усовершенствовал (1928–1935) каталитические системы, технологические схемы и аппараты синтеза жидких углеводородов, применявшихся для моторных смазок.
Реакция Фокина. Гидрогенизация жиров (1902):
Фокин Сергей Алексеевич (1865–1917), химик-органик и технолог (Россия). Основное направление исследований – каталитическое гидрирование непредельных органических соединений, особенно жиров. Впервые установил (1906), что платиновая чернь является хорошим катализатором гидрогенизации этиленовой связи: реакция протекает быстро при комнатной температуре. Разработал (1908) метод определения «водородного числа» непредельных соединений, в частности жиров, заложив основу для изучения кинетики каталитического гидрирования. Изучал (с 1902 г.) гидрогенизацию жиров в присутствии никелевого катализатора.
Крекинг по Шухову. Высокотемпературная переработка нефтяного сырья для получения продуктов меньшей молекулярной массы – расщепление углеводородов нефти (1891).
Шухов Владимир Григорьевич (1853–1939), инженер, изобретатель, почетный академик (Россия). Произвел расчеты первого в России нефтепровода (1878), создал конструкции аппаратов дробной дистилляции нефти (1888), ввел в технологию переработки нефти использование давления (1891). Участвовал в проектировании уникальных башен, мостов, перекрытий и т. п.
umotnas.ru
Основные понятия органической химии Органическая химия это
 Основные понятия органической химии Органическая химия — это химия соединений углерода – органических соединений. Органическая химия — это химия углеводородов и их производных. Основой органической химии является структурная теория, или теория химического строения органических соединений, которая была разработана во второй половине XIX в.
Основные понятия органической химии Органическая химия — это химия соединений углерода – органических соединений. Органическая химия — это химия углеводородов и их производных. Основой органической химии является структурная теория, или теория химического строения органических соединений, которая была разработана во второй половине XIX в.
 Основой органической химии является Структурная теория, Или Теория химического строения органических соединений, которая была разработана во второй половине XIX в. русским химиком А. М. Бутлеровым
Основой органической химии является Структурная теория, Или Теория химического строения органических соединений, которая была разработана во второй половине XIX в. русским химиком А. М. Бутлеровым
 Основные положения структурной теории: 1) Атомы в органических молекулах соединены между собой в определенном порядке химическими связями в соответствии с их валентностью. Этот порядок называется химическим строением. Углерод во всех органических соединениях четырехвалентен. 2) Химическое строение можно выразить структурной формулой, в которой химические связи между атомами изображаются черточками. Общее число черточек, отходящих от каждого атома, равно его валентности.
Основные положения структурной теории: 1) Атомы в органических молекулах соединены между собой в определенном порядке химическими связями в соответствии с их валентностью. Этот порядок называется химическим строением. Углерод во всех органических соединениях четырехвалентен. 2) Химическое строение можно выразить структурной формулой, в которой химические связи между атомами изображаются черточками. Общее число черточек, отходящих от каждого атома, равно его валентности.
 3) Физические и химические свойства веществ зависят не только от их качественного и количественного состава, но и от строения молекул. Вещества, описываемые одинаковой молекулярной формулой (изомеры), могут иметь совершенно разные физические и химические свойства. 4) Атомы в молекуле оказывают друг на друга взаимное влияние. Свойства каждого атома зависят не только от его природы, но и от его окружения.
3) Физические и химические свойства веществ зависят не только от их качественного и количественного состава, но и от строения молекул. Вещества, описываемые одинаковой молекулярной формулой (изомеры), могут иметь совершенно разные физические и химические свойства. 4) Атомы в молекуле оказывают друг на друга взаимное влияние. Свойства каждого атома зависят не только от его природы, но и от его окружения.
 Для классификация органических соединений используют понятия «углеродный скелет» и «функциональная группа» . Углеродный скелет — это каркас органической молекулы; он представляет собой последовательность химически связанных между собой атомов углерода. Во многих органических реакциях углеродный скелет остается неизменным. Углеродные скелеты бывают алифатические, в которых углеродная цепь не замкнута, и циклические, в которых углеродная цепь замкнута в цикл.
Для классификация органических соединений используют понятия «углеродный скелет» и «функциональная группа» . Углеродный скелет — это каркас органической молекулы; он представляет собой последовательность химически связанных между собой атомов углерода. Во многих органических реакциях углеродный скелет остается неизменным. Углеродные скелеты бывают алифатические, в которых углеродная цепь не замкнута, и циклические, в которых углеродная цепь замкнута в цикл.
 Углеродные скелеты бывают неразветвленные (линейные, нормальные) и разветвленные: в неразветвленных скелетах каждый атом углерода связан с одним или двумя атомами углерода, в разветвленных скелетах хотя бы один атом углерода связан с тремя или четырьмя атомами углерода.
Углеродные скелеты бывают неразветвленные (линейные, нормальные) и разветвленные: в неразветвленных скелетах каждый атом углерода связан с одним или двумя атомами углерода, в разветвленных скелетах хотя бы один атом углерода связан с тремя или четырьмя атомами углерода.
 Атомы углерода в скелетах различают по числу химически связанных с ними других атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя — третичным и четырьмя — четвертичным.
Атомы углерода в скелетах различают по числу химически связанных с ними других атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя — третичным и четырьмя — четвертичным.
 Органические соединения классифицируют также по кратности связи углерод-углерод. Соединения, содержащие только одинарные связи углерод-углерод, называют насыщенными, или предельными. Соединения со связями С=С или называют ненасыщенными, непредельными. С≡С или Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами.
Органические соединения классифицируют также по кратности связи углерод-углерод. Соединения, содержащие только одинарные связи углерод-углерод, называют насыщенными, или предельными. Соединения со связями С=С или называют ненасыщенными, непредельными. С≡С или Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами.
 Функциональные группы образуют все атомы, кроме водорода, или группы атомов, связанные с атомом углерода. Функциональные группы — это активные центры органических молекул. Именно они чаще всего определяют многие химические и физические свойства органических соединений и испытывают химические превращения.
Функциональные группы образуют все атомы, кроме водорода, или группы атомов, связанные с атомом углерода. Функциональные группы — это активные центры органических молекул. Именно они чаще всего определяют многие химические и физические свойства органических соединений и испытывают химические превращения.
 Соединения, имеющие одинаковые функциональные группы, но отличающиеся числом атомов углерода, обладают весьма похожими физическими и химическими свойствами. Такие соединения называют гомологами. Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СН 2—. Совокупность всех гомологов образует гомологический ряд.
Соединения, имеющие одинаковые функциональные группы, но отличающиеся числом атомов углерода, обладают весьма похожими физическими и химическими свойствами. Такие соединения называют гомологами. Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СН 2—. Совокупность всех гомологов образует гомологический ряд.
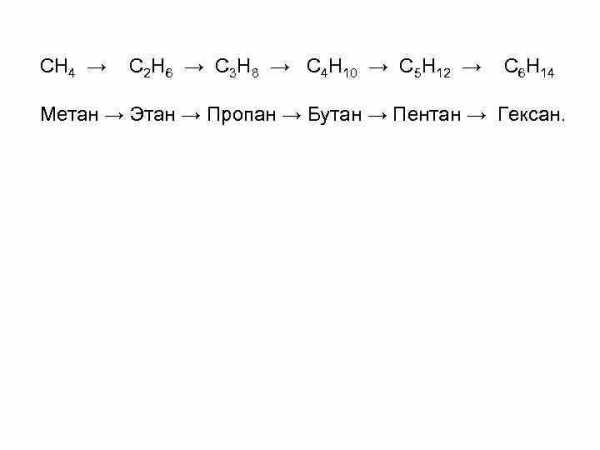 СН 4 → С 2 Н 6 → С 3 Н 8 → С 4 Н 10 → C 5 H 12 → С 6 Н 14 Метан → Этан → Пропан → Бутан → Пентан → Гексан.
СН 4 → С 2 Н 6 → С 3 Н 8 → С 4 Н 10 → C 5 H 12 → С 6 Н 14 Метан → Этан → Пропан → Бутан → Пентан → Гексан.
 Изомеры это вещества имеющие одинаковый качественный и количественный состав (молекулярную формулу), но разное строение молекул. Различают два вида изомерии — структурную и пространственную. Структурные изомеры отличаются друг от друга порядком соединения атомов. В пространственных изомерах порядок соединения атомов один и тот же, однако некоторые атомы благодаря электронным или геометрическим особенностям отличаются положением в пространстве относительно других атомов.
Изомеры это вещества имеющие одинаковый качественный и количественный состав (молекулярную формулу), но разное строение молекул. Различают два вида изомерии — структурную и пространственную. Структурные изомеры отличаются друг от друга порядком соединения атомов. В пространственных изомерах порядок соединения атомов один и тот же, однако некоторые атомы благодаря электронным или геометрическим особенностям отличаются положением в пространстве относительно других атомов.
 Структурные изомеры могут отличаться : 1) 2) 3) 4) строением углеродных скелетов; положением функциональной группы; положением кратной связи; по классам органических соединений.
Структурные изомеры могут отличаться : 1) 2) 3) 4) строением углеродных скелетов; положением функциональной группы; положением кратной связи; по классам органических соединений.
 Пространственные изомеры (стереоизомеры) можно разделить на два класса: 1) цис-транс-изомеры; 2) оптические изомеры. Цис транс изомерия связана с разным положением заместителей относительно двойной связи С=С или одинарной связи С—С в циклах. Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным отображением. Таким свойством обладают любые молекулы, имеющие хотя бы один атом углерода, связанный с четырьмя различными заместителями.
Пространственные изомеры (стереоизомеры) можно разделить на два класса: 1) цис-транс-изомеры; 2) оптические изомеры. Цис транс изомерия связана с разным положением заместителей относительно двойной связи С=С или одинарной связи С—С в циклах. Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным отображением. Таким свойством обладают любые молекулы, имеющие хотя бы один атом углерода, связанный с четырьмя различными заместителями.
 Составление названия органического соединения по номенклатуре IUPAC (заместительная номенклатура) 1. Определите функциональную (характеристическую) группу, если она имеется, суффикс которой используют при составлении названия. При составлении названия используется суффикс только одной функциональной группы, называемой главной ( исключение: суффиксы двойной или тройной связи). Все заместители, в том числе и другие младшие функциональные группы, указываются префиксами.
Составление названия органического соединения по номенклатуре IUPAC (заместительная номенклатура) 1. Определите функциональную (характеристическую) группу, если она имеется, суффикс которой используют при составлении названия. При составлении названия используется суффикс только одной функциональной группы, называемой главной ( исключение: суффиксы двойной или тройной связи). Все заместители, в том числе и другие младшие функциональные группы, указываются префиксами.
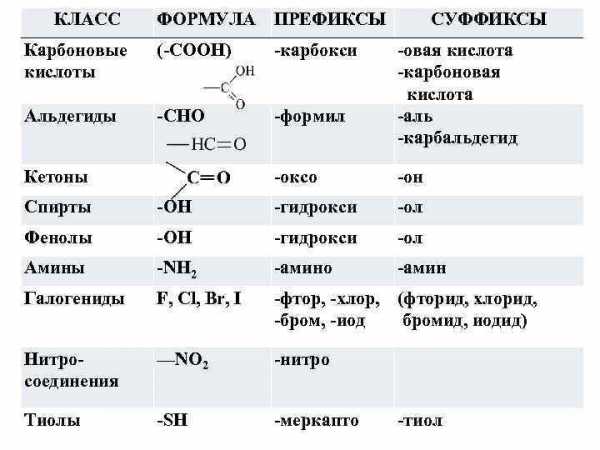 КЛАСС ФОРМУЛА ПРЕФИКСЫ Карбоновые кислоты (-СООН) -карбокси Альдегиды -CHO -формил Кетоны СУФФИКСЫ -овая кислота -карбоновая кислота -аль -карбальдегид -оксо -он Спирты -ОН -гидрокси -ол Фенолы -ОН -гидрокси -ол Амины -NH 2 -амино -амин Галогениды F, Cl, Br, I -фтор, -хлор, (фторид, хлорид, -бром, -иод бромид, иодид) Нитросоединения —NO 2 -нитро Тиолы -SH -меркапто -тиол
КЛАСС ФОРМУЛА ПРЕФИКСЫ Карбоновые кислоты (-СООН) -карбокси Альдегиды -CHO -формил Кетоны СУФФИКСЫ -овая кислота -карбоновая кислота -аль -карбальдегид -оксо -он Спирты -ОН -гидрокси -ол Фенолы -ОН -гидрокси -ол Амины -NH 2 -амино -амин Галогениды F, Cl, Br, I -фтор, -хлор, (фторид, хлорид, -бром, -иод бромид, иодид) Нитросоединения —NO 2 -нитро Тиолы -SH -меркапто -тиол
 Некоторые распространенные радикалы
Некоторые распространенные радикалы
 Все атомы в органических молекулах находятся во взаимосвязи и испытывают взаимное влияние. Смещение электронных облаков (электронной плотности) в молекуле под влиянием заместителей называют электронными эффектами. Если атом или группа атомов смещают электронную плотность на себя, то говорят, что они обладают электроноакцепторными свойствами и проявляют отрицательный электронный эффект. В противном случае они обладают электронодонорными свойствами и проявляют положительный эффект.
Все атомы в органических молекулах находятся во взаимосвязи и испытывают взаимное влияние. Смещение электронных облаков (электронной плотности) в молекуле под влиянием заместителей называют электронными эффектами. Если атом или группа атомов смещают электронную плотность на себя, то говорят, что они обладают электроноакцепторными свойствами и проявляют отрицательный электронный эффект. В противном случае они обладают электронодонорными свойствами и проявляют положительный эффект.
 • Смещение электронной плотности по цепи одинарных связей называют индуктивным эффектом: +I-эффект в случае повышения заместителем электронной плотности; –I-эффект в случае понижения заместителем электронной плотности
• Смещение электронной плотности по цепи одинарных связей называют индуктивным эффектом: +I-эффект в случае повышения заместителем электронной плотности; –I-эффект в случае понижения заместителем электронной плотности
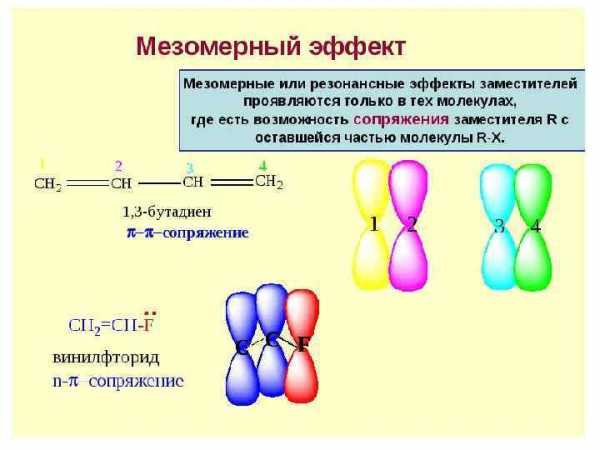
 Смещение электронной плотности, передаваемое по цепи кратных связей, называют мезомерным эффектом, +М или – М. Мезомерный эффект (эффект сопряжения, резонансный эффект) — смещение электронной плотности химической связи по πсвязям. Мезомерный эффект объясняется теорией химического резонанса.
Смещение электронной плотности, передаваемое по цепи кратных связей, называют мезомерным эффектом, +М или – М. Мезомерный эффект (эффект сопряжения, резонансный эффект) — смещение электронной плотности химической связи по πсвязям. Мезомерный эффект объясняется теорией химического резонанса.
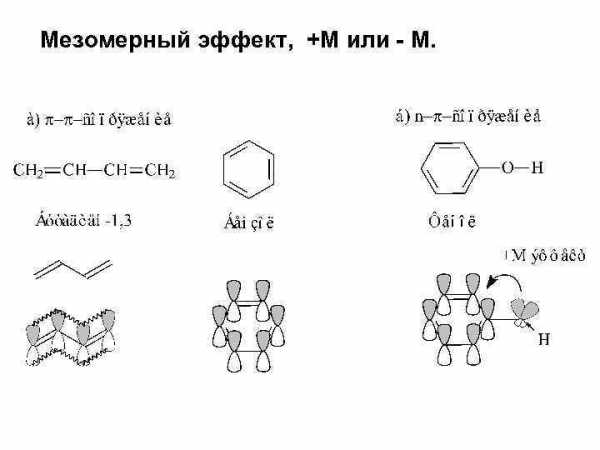 Мезомерный эффект, +М или – М.
Мезомерный эффект, +М или – М.
present5.com
Органическая химия — Традиция
Органи́ческая хи́мия — раздел химии, изучающий структуру, свойства органических соединений и реакции между ними.
Понятие органической химии включает следующие цели, экспериментальные методы и теоретические представления:
- Выделение чистых веществ из растительного, животного или ископаемого сырья
- Синтез и очистка соединений
- Определение структуры веществ
- Определение механизмов химических реакций
- Выявление связей между структурой органических веществ и их свойствами
Способы получения различных органических веществ были известны еще с древности. Египтяне и римляне использовали красители индиго и ализарин, содержащиеся в растительных веществах. Многие народы знали секреты производства спиртных напитков и уксуса из сахар- и крахмалсодержащего сырья.
Во времена средневековья к этим знаниям ничего не прибавилось, некоторый прогресс начался только в 16-17 в: были получены некоторые продукты, в основном путем перегонки некоторых растительных продуктов. В 1769—1785 г. Шееле выделил несколько органических кислот, таких как яблочная, винная, лимонная, галловая, молочная и щавелевая. В 1773 г. Руэль выделил из человеческой мочи мочевину.
Выделенные из животного или растительного сырья продукты имели между собой много общего, но отличались от неорганических соединений. Так возник термин «Органическая химия» — раздел химии, изучающий вещества, выделенные из организмов (определение Берцелиуса, 1807 г.). При этом полагали, что эти вещества могут быть получены только в живых организмах благодаря «жизненной силе».
Как принято считать, органическая химия как наука появилась в 1828 году когда Фридрих Вёлер впервые получил органическое вещество — мочевину — в результате упаривания водного раствора цианата аммония (NH4OCN).
Важным открытием стала разработка Купером, Кекуле и Бутлеровым теории строения органических соединений в 1860 г. В основе этой теории стоял факт, что практически во всех соединениях углерод является четырехвалентным. В 1865 году Кекуле предложил структурную формулу бензола, что стало одним из важнейших открытий в органической химии. В 1875 г. Вант-Гофф и Ле Бель предложили тетраэдрическую модель атома углерода, по которой валентности углерода направлены к вершинам тетраэдра, если атом углерода поместить в центр этого тетраэдра. В 1917 году Льюис предложил рассматривать химическую связь с помощью электронных пар.
В 1931 г. Хюккель применил квантовую теорию для объяснения свойств ароматических углеродов, чем основал новое направление в органической химии — квантовую химию. В 1933 г. Ингольд провел изучение кинетики реакции замещения у насыщенного атома углерода, что привело к масштабному изучению кинетики большинства органических реакций.
Историю органической химии принято излагать в связи с открытиями сделанными в области строения органических соединений, однако такое изложение гораздо больше связано с историей химии вообще. Гораздо интереснее рассматривать историю органической химии с позиции материальной базы, т. е. собственно предмета изучения органической химии.
На заре органической химии предметом изучения были преимущественно субстанции биологического происхождения. Именно этому факту органическая химия обязана своим названием. Научно-технический прогресс не стоял на месте, и со временем основной материальной базой органической химии стала каменноугольная смола, выделяемая при получении кокса прокаливанием каменного угля. Именно на основе переработки каменноугольной смолы в конце 19 века возник основной органический синтез. В 50-60 годах прошлого века произошел переход основного органического синтеза на новую базу — нефть. Таким образом появилась новая область химии — нефтехимия. Огромный потенциал, который был заложен в новом сырье вызвал бум в органичсекой химии и химии вообще. Появление и интенсивное развитие такой области как химии полимеров обязана прежде всего новой сырьевой базе.
Несмотря на то, что современная органическая химия в качестве материальной базы по прежнему использует сырье биологического происхождения и каменноугольную смолу, объем переработки этих видов химического сырья по сравнению с переработкой нефти мал. Смена материально-сырьевой базы органической химии была вызвана прежде всего возможностями наращивания объемов производства.
Классификация органических соединений[править]
Подробно рассмотрена в статье «Органические соединения».
Правила и особенности классификации[править]
В основе классификации лежит структура органических соединений. Основа описания структуры — структурная формула. Атомы элементов обозначаются латинскими символами, как они обозначены в периодической таблице химических элементов (таблице Менделеева). Ковалентные связи обозначаются прямой чертой, количество связей характеризуется валентностью элементов. Водородные и электронодефицитные связи обозначаются пунктирной линией, ионные связи обозначаются указанием зарядов частиц, входящих в состав молекулы. Поскольку в подавляющее большинство органических молекул входит водород, его обычно не обозначают при изображении структуры. Таким образом, если в структуре у одного из атомов изображена недостаточная валентность, значит, возле этого атома расположен один или несколько атомов водорода.
Атомы могут образовывать циклические и ароматические системы.
Основные классы органических соединений[править]
- Углеводороды — соединения, состоящие только из атомов углерода и водорода. Они в свою очередь делятся на:
- Насыщенные — максимальное количество атомов водорода на один атом углерода.
- Ненасыщенные — имеют в своем составе хотя бы одну двойную связь.
- С открытой цепью
- С замкнутой цепью — содержат цикл
К ним относятся алканы, алкены, алкины, циклоалканы, арены.
- Соединения с гетероатомами в функциональных группах — соединения, в которых углеродный радикал R связан с функциональной группой. По характеру функциональных групп делятся на:
- Гетероциклические — содержат гетероатомы в составе кольца. Различаются по числу атомов в цикле, по виду гетероатома, по количеству гетероатомов в цикле.
- Органического происхождения — как правило соединения очень сложной структуры, зачастую принадлежат сразу к нескольким классам органических веществ, часто полимеры. Из-за этого их сложно классифицировать и их выделяют в отдельный класс веществ.
- Полимеры — вещества очень большой молекулярной массы, которые состоят из периодически повторяющихся фрагментов — мономеров.
Строение органических соединений[править]
Органические соединения в основном образованы ковалентными неполярными связями C—C, или ковалентными полярными типа C—O, C—N, C—Hal. Согласно октетной теории Льюиса и Косселя молекула является устойчивой, если внешние орбитали всех атомов полностью заполнены. Для таких элементов как C, N, O, Галогены необходимо 8 электронов, чтобы заполнить внешние валентные орбитали, для водорода необходимо только 2 электрона. Полярность объясняется смещением электронной плотности в сторону более электроотрицательного атома.
Классическая теория валентных связей не в состоянии объяснить все типы связей, существующие в органических соединениях, поэтому современная теория использует методы молекулярных орбиталей и квантовохимические методы.
Особенности органических реакций[править]
В неорганических реакциях обычно участвуют ионы, они проходят быстро и до конца при комнатной температуре. В органических реакциях часто происходят разрывы ковалентных связей с образованием новых. Эти процессы требуют большей температуры и длительного времени. Часто они требуют наличия катализатора. Обычно протекает не одна, а сразу несколько реакций, поэтому выход целевого вещества зачастую не превышает 50 %. Поэтому при изображении органических реакций используют не уравнения, а схемы без расчета стехиометрии.
Реакции могут протекать очень сложным образом и в несколько стадий, не обязательно так, как реакция условно изображена на схеме. В качестве промежуточных соединений могут возникать карбкатионы R+, карбанионы R−, радикалы R·, карбены CX2, катион-радикалы, анион-радикалы, и другие нестабильные частицы, живущие доли секунды. Подробное описание всех превращений, происходящих на молекулярном уровне во время реакции, называется механизмом реакции.
Реакции классифицируются в зависимости от способов разрыва и образования связей, способов возбуждения реакции, ее молекулярности.
Определение структуры органических соединений[править]
За все время существования органической химии как науки важной задачей было определить структуру органических соединений. Это значит узнать, какие атомы входят в состав соединения и в каком порядке эти атомы связаны между собой.
Существует несколько методов решения этой задачи.
- Элементный анализ. Заключается в том, что вещество разлагается на более простые молекулы, по количеству которых можно определить количество атомов, входящее в состав соединения. С помощью этого метода невозможно установить порядок связей между атомами. Часто используется лишь для подтверждения предположенной структуры.
- Инфракрасная спектроскопия (ИК-спектроскопия). Образец материала (должен быть прозрачным) просвечивается светом инфракрасного диапазона. Этот свет поглощается валентными электронами соединения и возбуждает их. Позволяет установить наличие определенных функциональных групп в молекуле. Часто используется для того чтобы подтвердить идентичность исследуемого вещества с некоторым уже известным веществом путем сравнения ИК-спектров.
- Метод ядерного магнитного резонанса (ЯМР). Основан на взаимодействии магнитного поля валентных электронов с внешним магнитным полем. Один из главных методов, который может быть использован для определения структуры. Дает информацию о расположении атомов с нечетной атомной массой. К этому методу относится:
В трех последних методах используются неосновные изотопы элементов, поскольку основной изотоп этих элементов имеет четную атомную массу.
- Методы аналитической химии. Позволяют определить наличие некоторых функциональных групп по специфическим химическим реакциям, факт протекания которых можно фиксировать визуально или с помощью других методов.
Описанных выше методов как правило полностью хватает для определения структуры неизвестного вещества.
Масс-спектроскопия. Вещество при определенных условиях (электрический разряд, химическая ионизация и др.) разлагают на ионы, ускоряемые затем в магнитном или электрическом поле. Позволяет определить молекулярный вес и иногда позволяет установить наличие различных функциональных групп. Метод ядерного магнитного резонанса (ЯМР). Основан на взаимодействии магнитного поля атомных ядер с внешним магнитным полем. Один из главных методов, который может быть использован для определения структуры. Дает информацию о расположении атомов с нечетной атомной массой. К этому методу относится:
Метод протонного магнитного резонанса (ПМР). Позволяет определить положение атомов водорода 1H в молекуле. Метод магнитного резонанса атомов 19F. Определяет наличие и положение атомов фтора в молекуле. Метод магнитного резонанса атомов 31P. Определяет наличие и положение атомов фосфора в молекуле. В двух последних методах используются неосновные изотопы элементов, поскольку основной изотоп этих элементов имеет четную атомную массу. Метод ультрафиолетовой спектроскопии (УФ-спектроскопия). Используется для определения наличия и характеристик коньюгированных &pi-систем. Методы аналитической химии. Позволяют определить наличие некоторых функциональных групп по специфическим химическим реакциям, факт протекания которых можно фиксировать визуально или с помощью других методов. Рентгеноструктурный анализ. Описанных выше методов
- Гауптман З., Грефе Ю., Ремане Х., «Органическая химия», Москва, «Химия», 1979.
- Марч Дж., «Органическая химия: реакции, механизмы и структура», в 4-х томах, Москва, «Мир», 1987.
- Кери Ф., Сандберг Р., «Углубленный курс органической химии», в 2-х томах, Москва, «Химия», 1981.
- Химическая энциклопедия, п. ред. Кнунянц, т.3, Москва, «Большая Российская Энциклопедия», 1992.
traditio.wiki
Понятие органическая химия – Справочник химика 21
Далее даны определения основных понятий органической химии. [c.177]Соображения того же порядка побудили меня ввести коротенькую главу об основных понятиях органической химии, чтобы книга могла читаться лицами, даже не знакомыми с основами этой научной дисциплины. [c.9]
Углеводороды с открытой цепью. Карбоциклические соединения. Органические галогениды. Глоссарий терминов и понятий органической химии. Символика органических реакций [c.1]
Изд-во УГНТУ, 2001. – 4.1. Углеводороды с открытой цепью. Карбоциклические соединения. Органические галогениды Глоссарий терминов и понятий органической химии. Символика органических реакций. 288 с. [c.2]
Глава 21. Основные понятия органической химии [c.269]
Органическая химия, как и все естественные науки, переживает сейчас непрерывный и быстрый подъем во всех своих областях — идет ли речь о теоретической органической химии, об органическом синтезе, о нефтехимических процессах или о достижениях органической химии в целях удовлетворения повседневных нужд общества. Объем наших знаний возрастает с невероятной скоростью, и авторы учебников органической химии во всем мире стремятся втиснуть в приемлемые объемы хотя бы основные темы. Но, несмотря на все их старания, часто появляются учебники объемом свыше 1000 страниц в таких учебниках студентам очень трудно быстро ориентироваться и еще труднее — обучаться по ним. Поэтому, основываясь на собственном опыте, я решил написать небольшую по объему книгу, в которой хотел так объяснить студентам наиболее важные понятия органической химии и так скомпоновать материал, чтобы после его изучения они смогли с минимальными затратами времени штудировать гораздо более объемистые учебники. Таким образом, материал этой книги представляет как бы первый этап двухступенчатого изучения органической химии. Этой цели отвечает не только название, но и содержание, и способ его изложения. Многие студенты-химики в моей стране именно так и использовали эту книгу, и, кажется, с успехом. Кроме того, она полезна школьникам, которые из любознательности хотят расширить свои знания за пределы учебной программы или готовятся к сдаче вступительных экзаменов в вуз. Студенты некоторых вузов, где химия не входит в группу основных предметов, также успешно пользуются ею. [c.6]
Основные понятия органической химии [c.7]
В 1806 г. для студентов-медиков Я. Берцелиус написал руководство Животная химия . В нем впервые было введено понятие органическая химия . К середине XIX в. органическая химия становится химией углеродных соединений . [c.154]
В вводных главах в сжатой форме даны основные понятия органической химии, необходимые для дальнейшего изучения механизмов реакций. Особое внимание уделено описанию сте-реохимических закономерностей, играющих значительную роль в биологических системах. В книге дается не только представление об основных принципах стереохимии — оптической, геометрической изомерии и конформации, но и специально рассматриваются стереохимические аспекты органических и некоторых прохиральных ферментативных реакций. [c.5]
Действительно, в органической xимиli почти отсутствует канонический антураж строгой науки в виде математического аппарата, описывающего ее основные закономерности. По такому признаку органическая химия определенно не тянет на точную наутсу, Однако такое рассуждение носит явно поверхностный, дилетантский характер. Дело в том, что органическая химия оперирует весьма специфическими и очень сложными объектами, для которых количественные характеристики носят скорее второстепенный характер (самое кардинальное понятие органической химии — молекулярная структура — принципиально качественное описание объекта). Можно поэтому утверждать, что органическая (да и, наверное, вся фундаментальная) химия — наука, по природе своей качественная. Напомним в связи с этим, что самый футщамен-тальный закон химии — Периодический закон — всего лишь качественное обобщение. [c.548]
В целом система понятий органической химии может быть выражена схемой 3.5. В ней дана классификация по важнейшим научным теориям. Все понятия органической химии сгруппированы в пять групп на основе современной теории строения понятия химического строения, электронной теории и стереохимические, связанные между собой в единую современную теорию строения органических веществ, понятия высокомолекулярной химии, а также понятия о закономерностях химических реакций. [c.243]
ОСНОВНЫЕ ПОНЯТИЯ ОРГАНИЧЕСКОЙ ХИМИИ [c.315]
Если же читатель уже знаком с основными теоретическими понятиями органической химии, он может пропустить главу 1 и приступить к изучению основных глав учебника. [c.7]
В первой (вводной) главе изложены теория химического строения и основные современные электронные представления и понятия органической химии. Рассмотрен ряд современных физико-химических методов исследования органических веществ в приложениях приведены полученные этими методами цифровые данные, чтобы читатель имел и сведения справочного характера. [c.3]
Хотя принцип химического строения уже давно лежит в основе мышления химика, тем не менее многие основные понятия органической химии традиционно определяются, исх )дя не из строения, а из состава орга,нических соединений. Это в первую очередь относится к гомологии. Распространено определение, согласно которому два соединения гомологичны, если они сходны по свойствам и отличаются по составу на гомологическую разницу СНа, взятую п раз. Понятие сходства произвольно, в некоторых отношениях гомологи могут обладать разными свойствами (например, физиологическое действие метилоиого и этилового спирта) на группу СНа могут отличаться по составу соединения, которые никак не назовешь гомологами, например, ароматический бензол и непредельный циклогептатриен. Совершенно ясно также, что накоплением групп СНа не исчерпываются способы регулярного усложнения органических соединений, поскольку органическая химия знает и другие закономерно построенные ряды с иной гомологической разни- [c.13]
Проблема элеетронного и пространственного строения молекулы бензола хорошо известна. Особая термическая устойчивость бензола и его производных, стремление молекул этих соединений сохранять в различного рода химических превращениях неизменной свою главную структурную единицу — шестичленное сопряженное кольцо — привели к выделению этих соединений в самостоятельный, широко разветвленный класс ароматических соединений. Сопряженные циклические углеводороды и гетероциклические соединения, характеризующиеся свойствами, подобными бензолу (термодинамической стабильностью и склонностью к реакциям замещения, но не присоединения или расщепления), названы бензоидными, а соединения, не обладающие этими свойствами, — небензоидными. Наконец, еще более общее и концептуально важное понятие органической химии — ароматичность — также выведено из анализа свойств бензола и его аналогов. [c.265]
Именно это открытие проломило брешь в стене предубеждений, разделявших органическую и минеральную химию, и убедило химиков, что и органические вещества могут быть получены искусственно, без участия гипотетической жизненной силы. Насколько прочно все же держалось это предубеждение, следует из высказывания французского химика Жерара, установившего некоторые основные понятия органической химии, например понятие гомологии, и являющегося одним из авторов закона Авогадро — Жерара. Жерар в 1842 г., когда многие простые органические соединения были уже получены искусственным путем,. ысказал мнение, что синтез столь сложного вещества, как сахар, никогда не сможет быть осуществлен. Это скептическое предсказание было опровергнуто в 1861 г., когда А. М. Бутлеров впервые получил синтетически сахаристые вещества (из формалина). Наряду с этим быстро росло число синтезированных углеродсодержащих веществ, не встречающихся в природе. Так, в 1825 г. Фарадей получил бензол, еще ранее стали известны этилен, бромистый этилен, а также ряд производных бензола. В 1842 г. Зинин из нитробензола получил анилин, а в 50-х годах того же столетия из анилина были синтезированы первые анилиновые красители — мовеин Перкина и фуксин. [c.12]
Процесс изменения значений слов происходит непрерывно, неизбежно и незаметно. Когда в начале 19 века Берцелиус впервые использовал прилагательное органическая для определения специфической области химии, оно совершенно очевидно подчеркивало изучение соединений, сущ,ествуюп1,их в природе как составная часть живой материи. К концу века термин органический , используемый в химическом контексте, давно перестал обозначать Еещ,ества, которые образуются только в живых системах, и когда возник вопрос об определении понятия органическая химия Роско (1871 г.) определил ее как химия углеродных соединений , а Шорлеммер (1894 г.)—как химия углеводородов и нх производных — определения, применимые сегодня, как и тогда, когда они были впервые сформулированы. Это изменение отразило огромные достижения, происшедшие в течение 19 века в нашем понимании химии такого элемента как углерод. Кроме того, это было признанием явно неограниченной широты предмета. С тех пор измененне содержания, вкладываемого в выражение природный продукт , иллюстрировало изменение взглядов химиков на роль изучения таких вещ,еств в развитии органической химии. Эти исследования продолжались несмотря ни на что, с неослабевающей энергией как в прошлом веке, так и в первой половине этого. Для большинства, если не для всех, они являются основной частью всего предмета и подчеркивают внутреннюю взаимосвязь органической химии и биологии. [c.13]
С 1769 по 1785 гг. Шееле удалось выделить целый ряд кислот, таких как винная, лимонная, яблочная, галловая, молочная, мочевая и щавелевая. В 1773 г. Роуэлл получил из человеческой мочи мочевину. Выделенные из растительных и животных организмов соединения имели между собой много общего, но резко отличались от неорганических веществ. Так появилось понятие органическая химия — раздел науки, изучающий соединения, выделенные из организмов (Берцелиус, 1807 г.). При этом полагали, что органические вещества могут образовываться только в живых организмах благодаря присущей только им жизненной силе vis ultalis). [c.17]
После того как было установлено, что органические соединения могут быть синтезированы и вне лживого организма, появилась иеобход -мость дать новое определение понятию органическая химия . В середине прошлого века Гмелии, Кольбе и Кекуле иод этим ионятисм подразумевали химию соединений углерода . Такое определение действительно и в настояи ее время, хотя надо иметь в виду, что сам углерод, карбиды, оксид углерода и карбонилы металлов, диоксид углерода и карбонаты, сероуглерод и циановая кислота, синильная кислота и роданистоводородная кислота, а таклнеорганическим соединениям. Понятие органическая химия включает следующий комплекс экспериментальных методов и теоретических представлений. [c.18]
Большое влияние на курс органической химии оказывают межпредметные связи, особенно с биологией. Развитие биологии как науки и как учебного предмета оказало влияние на формирование школьного курса органической химии, в который в 1985 г. были введены гетероциклы и нуклеиновые кислоты. Они необходимы для понимания проблем молекулярной биологии, генетики, так как органическая химия формирует для биологии опорные понятия. Органическая химия широко пользуется понятиями физики представления об электрических явлениях в макромире способствуют пониманию микромира органических веществ. Межпредметные связи с историей позволяют ознакомить учащихся с историей органической химии как науки, показать успехи органического синтеза, раскрыть перспективы развития химической промышленности в нашей стране. Межпредметные связи органической химии с другими предметами школьного учебного плана четко определяют ее место в учебно-воспитательном процессе средней школы. [c.241]
Впервые понятие органическая химия использовал в 1807 г. Берцелиус, сравнивая растительный или животный организм с химической лабораторией лишь природа способна производить органические соединения. Эта концепция была опровергнута Вёлером, который синтезировал щавелевую кислоту (1824 г.) и мочевину (1828 г.) из неорганических веществ. В середине XIX в. Гмелин, Кольбе, Кекуле и другие ученые определили органическую химию как учение о химии углерода. [c.193]
В настоящее время особое значение приобретают понятия органической химии, отражающие ее специфику как иаукрг об углероде, углеродистых соединениях и их превращениях. В связи с вскрытой порочностью теории электронного резонанса, покоящейся на враждебной нам основе — идеализме-махизме, особое значение приобретают понятия теории химического строения органической химии, основоположником которой является А. М. Бутлеров. [c.404]
chem21.info