Примеры решения задач по химии – Как решать задачи по химии, готовые решения
- Комментариев к записи Примеры решения задач по химии – Как решать задачи по химии, готовые решения нет
- Советы абитуриенту
- Примеры решения типовых задач на понятие “количество вещества”
- Примеры решения задач по теме «Основные понятия и законы химии» — Студопедия.Нет
- Примеры решения задач по химии
- Примеры решения олимпиадных задач по химии
- Примеры решения типовых задач на массовую долю растворённого вещества в растворе
- Алгоритм решения задачи 35 (С5). Подготовка к ЕГЭ по химии. Задача №35
- Примеры решенных задач по химии.
Примеры решения типовых задач на понятие “количество вещества”
Важно знать! Как научиться решать задачи по химии.
Задача 1.1. Имеется 0,4 моль железа. Определите массу железа и число имеющихся атомов железа.
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину M(Fe) = 56 г/моль, имеем:
m = v • M = 0,4 моль • 56 г/моль = 22,4 г
N(Fe) = V • Na = 0,4 моль • 6,02 • 1023 атомов/моль = 2,41 • 1023 атомов железа.
Задача 1.2. Имеется 26,4 г оксида углерода (IV). Определите количество вещества оксида углерода (IV), его объем (н.у.), а также число имеющихся молекул оксида углерода (IV).
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину М(С02) = 44 г/моль, имеем:
v = m/М = 26,4 г / (44 г/моль) = 0,6 моль
V = VM • v = 22,4 л/моль • 0,6 моль = 13,44 л
Задача 1.3. Имеется 39,2 л сероводорода (н.у.). Определите количество вещества сероводорода, его массу и число имеющихся молекул сероводорода.
Решение. Используя формулу: v = m/M = V/VM = N/NA и величину M(H2S) = 34 г/моль, имеем:
v = V/VM = 39,2 л / (22,4 л/моль) = 1,75 моль
m = M • v = 34 г/моль • 1,75 моль = 59,5 г
N(H2S) = NA • v = 6,02 • 1023 молекул/моль • 1,75 моль = 10,5 • 1023 молекул = 1,05 • 1024 молекул H2S.
Задача 1.4. Имеется 7,826 • 1024 молекул хлора. Определите количество вещества хлора, его массу и объем (н.у.).
Решение. Используя формулу: v = m/M = V/V M = N/NA и величину М(Сl2) = 71 г/моль, имеем:
v = V/VM = 7,826 • 1024 молекул / (6,02 • 1023 молекул/моль) = 13,0 моль
m = M • v = 71 г/моль • 13 моль = 923 г
V = VM • v = 22,4 л/моль • 13 моль = 291 л.
Задача 1.5. Определите молярную массу газа, если его плотность равна 2,59 г/л при н.у.
Решение. Используя формулу: m/M = V/VM и величину ρ(газа) = m/V = 2,59 г/л, имеем:
М = VM • m/V = VM • ρ = 22,4 л/моль • 2,59 г/л = 58 г/моль.
[Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Решаем задачи по химии включающие: моль, молярная масса, химическое уравнение, молярный объем газов.
Видео ютуб канала “День знаний”
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Примеры решения задач по теме «Основные понятия и законы химии» — Студопедия.Нет
Пример 1 Определите молекулярную массу газа, если 5 г его при нормальных условиях занимают объем 4 л.
Решение:
На основании следствия из закона Авогадро находим массу 22,4 л газа:
4 л газа – 5 г
22,4 л газа – х г
Молярная масса газа составляет г/моль
Пример 2В каком количестве вещества Na2SO4 содержится: а) натрия массой 24 г; б) серы массой 96 г; в) кислорода массой 128 г.
Решение:
а) В одном моле вещества Na2SO4 содержится натрия 46 г, тогда:
1 моль – 46 г
х – 24 г моль
б) В одном моле вещества Na2SO4 содержится серы 32 г, тогда:
1 моль – 32 г
х моль – 96 г моль
в) В одном моле вещества Na2SO4 содержится 64 г кислорода, тогда:
1 моль – 64 г
х моль – 128 г моль
Пример 3. Вычислите число атомов азота в 100 г карбоната аммония, содержащего 10% неазотистых примесей.
Решение:
Большинство расчетных задач лучше решать в молях. Масса чистого карбоната аммония равна m((NН4)2СО3) = 100-0,9 = 90 г. Число молей карбоната аммония составляет v((NH4)2CO3) = m/М = 90/96 = 0,938 моль. Согласно химической формуле (NН4)2СО3 в одном его моле содержится два моль N, поэтому v(N) = 2v((NН4)2СО3) = 1,876. Число атомов азота получается умножением числа молей азота на постоянную Авогадро: N(N) = v-N
Ответ. 1,13·1024 атомов азота.
Примеры решения задач по теме «Строение атома»
Пример. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22.
Решение.
Электронные формулы изображают распределение электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nl*, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответсвующеебуквенное обозначение – s, p, d. f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он будет обладать наименьшей энергией – меньшая сумма n+l . Заполнение энергетических уровней и подуровней идет в такой последовательности: 1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®
®(5d1) ®4f®5d®6p®7s®(6d1-2) ®5f®6d®7p
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов №16 (сера) и №22 (титан) электронные формулы имеют вид:
16S 1s22s22p63s23p4
22Ti 1s22s22p63s23p63d24s2
Классы неорганических соединений и периодическая система элементов.
К числу наиболее распространенных классов неорганических соединений относятся оксиды, кислоты и соли.
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Оксиды подразделяются на солеобразующие (NO, CO,S2O).
Солеобразующие оксиды по способностям к взаимодействию с веществами кислотного или основного характера могут быть соответственно основными (Na
ZnO + 2HCE → ZnCE2 + H2O
ZnO + 2NaOH → Na2ZnO2 + H2O
Неметаллические элементы образуют преимущественно кислотные оксиды, металлические – способны давать оксиды всех видов. При этом по мере увеличения степени окисления металла, характер его оксидов меняется от основного до кислотного: MnO (основной) MnO2, (атмосферный) MnO3, Mn2O7 (кислотный). При высокой степени окисления (5, + 6, +7) металлы, как правило, образуют только кислотные оксиды. В периодах слева направо характер оксидов меняется от основного до кислотного.
В главных подгруппах кислотный характер оксидов ослабевает сверху вниз. Так, P2O5 более кислотен, чем Sb2O5. Кислотный или основный характер оксидов определяется природой их внутренних химических связей. В кислотных оксидах элемент соединен с кислородом ковалентными связями; в основных – ионными, в амфотерных – связи частично ионные, частично ковалентные.Основания и кислородные кислоты являются гидроксидами, поскольку их можно рассматривать как вещества, получившиеся в результате взаимодействия оксидов с водой. Однако, гидроксидами обычно называют только основания и амфотерные гидроксиды. Подвергаясь в растворах электролитической диссоциации, кислоты образуют ионы водорода и ионы кислотного остатка, основания – ионы металла и гидроксильные ионы.
HCL = H+ + CL–
NaOH = Na+ + OH–
Амфотерным оксидами соответствуют амфотерные гидроксиды, способные к взаимодействию и с кислотами, и с основаниями.
Zn(OH)2 + H2SO4 → ZnSO4+ 2H2O
Zn(OH)2 + 2NaOH → NaZnO2 + 2H2O
Предполагается, что эта способность основана на том, что амфотерные гидроксиды в состоянии диссоциировать и по основному типу, образуя ионы OH– , и по кислотному, образуя ионы H+ .
В первом случае имеет место
Zn(OH)2 = Zn2+ + 2OH–
Во втором
Zn(OH)2 = 2H+ + ZnO22-
Диссоциация по кислотному типу происходит в щелочной среде, по щелочному – в кислотной. Существует и другая теория, дающая объяснение своеобразным свойствам амфотерных электролитов – теория комплексных соединений. Амфотерность гидроксидов объясняется их способностью к образованию комплексов.
Типичные амфотерные гидроксиды образованны элементами второй группы – Be (OH)2, Zn (OH)2, третьей – Al(OH)3, Ga(OH)3, In(OH)3. Характерна амфотерность и для гидроксидов элементов четвертой группы – Sn(OH)2, Sn(OH)4, Pb(OH)2, Pb(OH)4.
Выяснить причину основности или кислотности того или другого гидроксида можно оценив характер химической связи между центральным атомом и группами ОН.
Если это ковалентные связи, как H2SO4 , то гидроксид оказывается кислотой, если же ионные как в NaOH, то-основанием. Объясняется это тем, что при наличии в гидроксиде ковалентной связи (в нашем примере связи между серой и кислородом) молекулы растворителя не будут действовать на нее достаточно интенсивно, а подействуют вместо этого на более полярную связь О – Н. Это и повлечет за собой появление в растворе ионов Н
Так как неметаллы соединяется с кислородом ковалентными связями, то их гидроксиды могут диссоциировать в водных растворах только по кислотному типу. Связи же атомов металлов с кислородом значительно разнообразней по степени своей ионности (или ковалентности) и поэтому среди гидроксидов металлов встречаются как кислоты, так и основания и амфотерные соединения. Например Cr(OH)2 – основание, Cr(OH)3 – амфотерное соединение, H2CrO4 – кислота. Основный характер Cr(OH)2 вызван тем, что связь хрома со степенью окисления +2 с кислородом более ионна, чем связь кислорода с водородом. Амфотерность Cr(OH)3 обусловлена примерно одинаковой степенью ионности связи Cr со степенью окисления +3 с кислородом и связей кислорода с водородом. Кислотность H2CrO4 объясняет высокой положительной валентностью хрома (+6) обеспечивающей самостоятельное существование ионов CrO42- в растворе.
Связи между атомами хрома и кислорода в CrO42- ковалентны, поэтому в растворе разрываются не они, а более полярные связи О – Н, т.е. вещество диссоциирует по кислотному типу.
Рост положительной степени окисления слева направо в периодах, а также уменьшение радиусов атомов элементов в периодах способствует усилению ковалентного характера в химических связях между атомами этих элементов и атомами кислорода, и тем самым приводит к усилению кислотности оксидов и гидроксидов элементов.
Соль представляет собой продукт замещения водорода кислоты металлом или группой атомов, способной образовать положительные ионы (например NH4+ – ион аммония). Если водород кислоты полностью замещен на металл (Na2SO4 сульфат натрия) соль называют средней; при частичном замещении – кислой (NaHSO4– гидросульфат натрия). Соли металлов, гидроксиды которых малорастворимы, могут содержать группы ОН или атомы кислорода. Такие соли называются основными, например, CuOHCl –хлорид гидроксимеди, FeOCl – хлорид оксожелеза(III). Если при одном кислотном остатке находятся два металла, то такие соли называются двойными, например, NaKCO3 – карбонат натрия – калия.
Примеры диссоциации солей
Na2SO4 = 2Na+ + SO42-
KNaCO3 = K+ + Na+ + CO32-
Кислые и основные соли диссоциируют по стадиям.
NaHSO4 = Na+ + HSO4–
HSO4– = H+ + SO42-
CuOHCl = CuOH+ + Cl–
CuOH+ = Cu2+ + OH–
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции
2NO + О2 → 2NO2
закон действия масс может быть записан
υ=κС2NOCO2,
где υ — скорость химической реакции; κ — константа скорости; СNO и CO2 — концентрации реагирующих веществ.
Реакция в гетерогенной системе [например, С(к) + О2(г) → СО2(г)] осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции
С(к) + О2(г) → СО2(г)
закон действия масс имеет вид
υ=κCO2S,
где κ — константа скорости; CO2 — концентрация кислорода; S — площадь поверхности раздела между фазами.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
,
где и — скорости реакций при Т2 и Т1; γ — температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10°.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т. е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
studopedia.net
Примеры решения задач по химии
Примеры решения практических заданий и задач
1. Вычислите растворимость поваренной соли в воде при 20°С, массовую долю соли (w), молярную концентрацию соли (С) в насыщенном растворе, если при выпаривании досуха насыщенного при 20°С раствора объёмом 217,4 мл (rр–ра = 1,15 г/мл) масса сухого остатка составила 66,2 г.
Решение – обратимся к определениям:
Мс = 23 + 35,5 = 58,5 г/моль,
где: mс – масса соли (г), Мс – молярная масса соли, nс – количество соли (моль).
Набор известных простых формул позволит быстро получить результат.
Итак, количество соли в растворе:
2. Коэффициент растворимости хлорида калия при 90°С равен 54, а при 20°С – соответственно 34. Вычислите массу кристаллов соли, образовавшихся при охлаждении горячего насыщенного раствора массой 300 г от 90°С до 20°С.
Решение – учтём, что коэффициент растворимости показывает отношение массы растворённого вещества (г) к массе растворителя (100 г) в насыщенном при данной температуре растворе. Надо понимать, что при нагревании растворитель как бы принимает всё больше и больше вещества и раствор становится всё крепче и крепче. Наоборот, при охлаждении растворитель уже не держит столько растворённого вещества – растворимость-то уменьшается. Избыток выпадает в осадок.
В нашем случае из условия следует, что массовая доля соли в насыщенном при 90°С растворе равна:
Если масса раствора 300 г, то очевидно, что масса соли в насыщенном горячем растворе
а масса воды
Именно эта вода при охлаждении раствора с учётом коэффициента растворимости удержит в растворе только:
–столько соли может быть в нашем растворе при 20°С.
Разница ( ) выпадает в осадок:
mкрист = 105,3 – 66,2 = 39,1 г
3. Определите состав мирабилита, содержащего в основном гидратированный сульфат натрия с небольшой долей нелетучих примесей (3,4 масс.%), если при прокаливании до постоянной массы образца минерала (10 г) потеря массы составила 5,4 г.
Решение – во-первых, ясно, что в образце масса собственно кристаллогидрата с учётом примесей составляет 10(1 – 0,034) = 9,66 г.
Во-вторых, прокаливание до постоянной массы означает полную дегидратацию по уравнению:
Далее – как обычно:
-по уравнению реакции
-по условию задачи
9,66 г крист.-гидр. – 5,4 г h3O
Откуда (142 + 18х)5,4 = 18х9,66 и х = 10.
Значит, мирабилит – это десятиводный сульфат натрия с небольшой долей примесей.
4. Определите массу этиленгликоля (НОСН2СН2ОН), который нужно растворить в воде объёмом 1 литр для приготовления антифриза с температурой замерзания –35°С. Криоскопическая константа воды 1,86.
Решение. По 2 закону Рауля: , где Kk – криоскопическая постоянная растворителя (воды), Cm – моляльность раствора, моль/кг.
Моляльность раствора (моль/кг):
Поэтому:
Молярная масса этиленгликоля: = 62 г/моль,
C учётом плотности воды r = 1 кг/л, =rV = 1 кг, получаем ответ:
5. Вычислите объём (м3, н. у.) водорода, выделившегося при электролизе слегка подсоленной (для лучшей проводимости) воды массой 1 т.
Решение – проще некуда:
= 18 г/моль, Vo = 22,4 л/моль – мольный объём (объём одного моля любого газа при нормальных условиях).
-по уравнению реакции
-по условию задачи
6. Вычислите минимальный расход (м3) воды для гашения извести после прокаливания известняка массой 10 т с заметной долей (20 %) инородных примесей.
Решение – сущий пустяк:
С учётом примесей масса карбоната кальция в известняке 8 т = 8106 г.
Глядя на уравнения обжига и гашения, видим, что мольное соотношение разлагающегося карбоната CaCO3, оксида кальция CaO и воды h3O равно 1 : 1 : 1, т. е. моль на моль. И опять:
-по уравнению реакции
-по условию задачи
7. В стакане с водой объёмом 250 мл растворили сульфат магния массой 30 г. Вычислите массовую долю соли в растворе, плотность раствора (г/мл), молярную концентрацию соли.
Решение. Основные данные для решения:
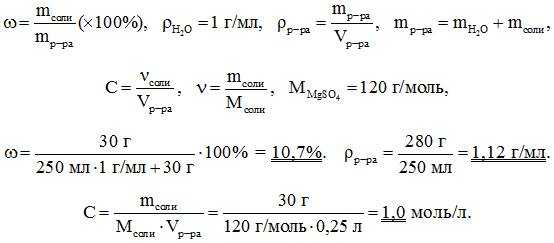
8. Вычислите количество (моль) гидроксида калия в растворе объёмом 6 л, в котором массовая доля основания равна 12,2 %. Плотность раствора 1,15 г/мл.
Решение.
9. Вычислите количество (моль) кристаллогидрата , который смешали с водой (100 моль) и получили раствор MgCl2 с массовой долей соли, равной 16,9 %.
Решение. В данном случае необходимо понимать, что растворяем кристаллогидрат, а массовая доля рассчитана на безводную соль. Учтём, что
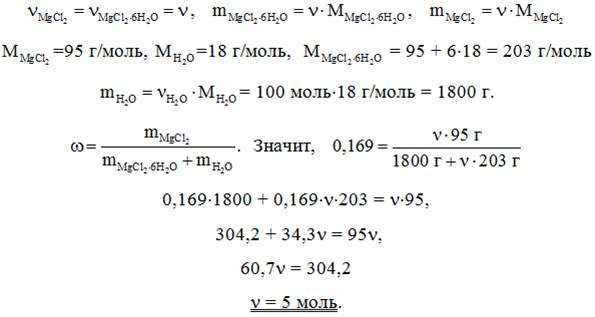
10. Вычислите массовую долю гидроксида натрия в растворе (плотность 1,2), в котором молярная концентрация основания равна 6 моль/л.
Решение. Возьмём банку с раствором, к примеру, объёмом 3 л. Тогда, если , то n = СV = 6 моль/л3л = 18 моль. MNaOH = 40 г/моль
m = n M = 18 моль40 г/моль = 720 г – такова масса NaOH в растворе.
Масса раствора при известной плотности:
mр–ра = r*V = 1,2 г/мл*3000 мл = 3600 г.
11. Вычислите молярную концентрацию серной кислоты в растворе, получившемся при смешении крепкого раствора кислоты (V= 44 мл, w = 49 %, r = 1,137) с водой. Объём разбавленного раствора 2,5 л.
Определим количество серной кислоты , воспользовавшись параметрами крепкого раствора: mр–ра = rV = 1,137 г/мл44 мл = 50 г.
Следовательно, mк = wmр-ра = 0,49*50 = 24,5 г. При получаем
12. Вычислите объём (л) раствора соли с молярной концентрацией 3 моль/л, необходимого для приготовления разбавленного раствора этой соли объёмом 5 л и концентрацией соли 0,3 моль/л.
Решение. Сообразим, что в разбавленном растворе количество соли должно составлять
13. Вычислите массу (г) раствора серной кислоты (массовая доля кислоты 80 %), который необходимо смешать с другим раствором серной кислоты массой 0,75 кг (массовая доля кислоты 10 %) для получения раствора с массовой долей кислоты 30 %.
Решение. Сконструируем результат:

14. Вычислите объём (мл) раствора серной кислоты (w = 19,6 %, r = 1,136) для приготовления разбавленного раствора объёмом 500 мл, в котором эквивалентная концентрация кислоты равна 0,2 экв/л (r = 1).
Решение. В разбавленном растворе количество (экв) кислоты составляет
n = СV = 0,2 экв/л0,5 л = 0,1 экв, а масса кислоты (М = 98 г/моль, Э = 98 / 2 = 49 г/экв) mк= 0,1 экв49 г/экв = 4,9 г.
15. В воде содержатся катионы и анионы, концентрации (мэкв/л) которых составляют: Ca2+ – 2,5; Na+ – 1,8; Mg2+ – 0,7; HCO3– – 2,9; Cl– – 1,5; SO42– – 0,6. Определите величины общей, временной и постоянной жёсткости воды.
Решение. Содержание ионов натрия не влияет на величину жёсткости воды. Общая жёсткость определяется суммарным содержанием (мэкв/л) ионов жёсткости:
Временная жёсткость – часть общей, определяемая содержанием (мэкв/л) HCO3– – ионов, но, заметим, Жвр < Жобщ. В нашем случае
Жвр = 2,9 мэкв/л
Так как общая жёсткость есть сумма временной и постоянной жёсткости, то постоянную жёсткость можно рассчитать по разности общей и временной жёсткости:
Жпост = Жобщ – Жвр = 3,2 – 2,9 = 0,3 мэкв/л.
Если в условии этой же задачи концентрация ионов HCO3– составляла бы, к примеру, не 2,9, а 3,9 мэкв/л, то временная жёсткость была бы равна общей жёсткости: Ж`вр = 3,2 мэкв/л, а вот на долю постоянной жёсткости не осталось бы ничего: Ж`пост = Жобщ – Ж`вр = 3,2 – 3,2 = 0 мэкв/л.
16. Вычислите временную, постоянную и общую жёсткость воды, в образце которой объёмом 125 мл обнаружили гидрокарбонат кальция массой 40,5 мг, хлорид натрия массой 115 мг, хлорид кальция массой 11,1 мг, сульфат магния массой 33 мг.
Решение. Хлорид натрия не является солью жёсткости. Временная жёсткость определяется концентрацией гидрокарбоната кальция, а постоянная – концентрацией хлорида кальция и сульфата магния. Рассчитаем эквивалентные массы солей жёсткости

17. Временная (кальциевая) жёсткость в образце воды равна 8 мэкв/л. Вычислите массу (г) накипи после кипячения такой воды объёмом 1,5 м3.
Решение. При кипячении происходит разложение гидрокарбоната кальция по уравнению:
Масса накипи равна массе образовавшегося карбоната кальция. По закону эквивалентов число эквивалентов (n) CaCO3равно числу эквивалентов Ca(HCO3)2:
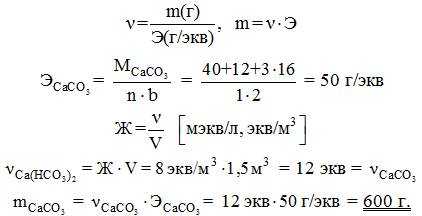
18. В большую бочку (300 л) с жёсткой водой для её умягчения высыпали и растворили ортофосфат натрия массой 131,2 г. Умягчили, но остаточная жёсткость, как показал анализ, составила 2 мэкв/л. Какова была первоначальная жёсткость воды в бочке?
Решение. Понижение жёсткости объясняется осаждением катионов жёсткости в виде осадков нерастворимых фосфатов. По закону эквивалентов число эквивалентов израсходованного фосфата натрия должно быть равно числу эквивалентов солей жёсткости, бывших в бочке.
Достаточно разделить это число на объём воды в бочке, и мы получим величину понижения жёсткости:
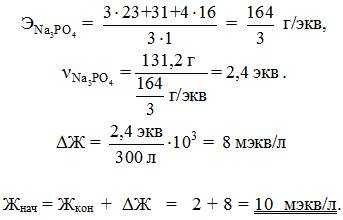
zadachi-ru.com.ua
Примеры решения олимпиадных задач по химии
Классификация задач
Задачи на смеси
Задача 1
Вычислите относительную плотность по азоту смеси газов, состоящих из пентена и углекислого газа, если в этой смеси на три атома углерода приходится один атом кислорода.
Пусть х моль пентена и у моль углекислого газа.
Тогда (5х + у) – 3
2у – 1; 5х + у = 6у; 5х = 5у; х = у
Допустим, 1 моль пентена и 1 моль углекислого газа. М(C5H10) = 70 г/моль; М(СО2) = 44 г/моль; 2 моль смеси – 114 г
1 моль смеси – М; М(смеси) = 57 г/моль Относительная плотность смеси по азоту 57 : 28 = 2, 04
Задача 2
18 г смеси оксида углерода (II) и оксида углерода (IV) занимает объём 11,2 л. Определите объём оксида углерода (II) после пропускания исходной смеси над раскалённым углем.
Пусть х моль угарного газа и у моль углекислого газа. Переведём объём смеси в количество вещества, что составит 0,5 моль.
Тогда получим, что х + у = 0,5
М(СО) = 28 г/моль; М(СО2) = 44 г/моль; 28х + 44у = 18
х + у = 0,5
Решая систему уравнений получим, что у = 0,25 моль; х = 0,25 моль;
0,25 моль 0,5 моль
CO2 + C = 2CO
1 моль 2 моль
После этой реакции угарного газа будет:
0,25 моль + 0,5 моль = 0,75 моль
Следовательно, объём угарного газа составит 0,75* 22,4 = 16,8 л
Задача 3
Для хлорирования смеси железа и меди массой 6г затрачен газообразный хлор объёмом 2,8л (н. у.). Определите массовые доли металлов в исходной смеси.
у моль 1,5у моль х моль х моль
2Fe + 3Cl2 = 2FeCl3 Cu +Cl2 = CuCl2
2 моль 3 моль 1 моль 1 моль
Пусть в реакции участвует х моль меди и у моль железа. Получим систему уравнений: 64 х +56 у = 6
х + 1,5 у = 0,125
Решая систему, получим, что х=у=0,5 моль; m(Fe) =2.8 г; m(Cu) =3.2 г.
Задача 4
Определите количественный состав смеси оксида железа (III ) и оксида меди (II ), если при восстановлении 32 г её водородом образовалось 9 г воды. Сколько грамм железа можно получить из этого количества смеси?
Уравнения протекающих реакций:
Fe2O3 + 3 H2 = 2 Fe + 3 H2O
CuO + H2 = Cu + H2O
Введём переменные обозначения: пусть x моль Fe2O3 и y моль CuO.
Тогда по уравнению перейдём к количеству вещества воды: 3 x и y моль.
Составим уравнение для воды: v(H2O) = 9 г : 18 г/моль = 0,5 моль 3 x + y = 0,5 моль
Рассчитаем молярные массы оксидов:
М(Fe2O3) = 160 г/моль; М(CuO) = 80 г/моль;
Составим уравнение для оксидов:
160 x + 80 y = 32
Решая систему уравнений получаем: 80 x = 8, x = 0,1 моль
Тогда найдём массу железа: m (Fe) = 0,2 моль * 56 г/моль = 11,2 г
Задание 5
0,39 г смеси алюминия и магния обработали 50 г 5% раствора соляной кислоты. При этом выделилось 448 мл газа. Каков состав смеси и состав раствора после реакции?
Составим уравнения реакций:
2x 3x 2x 3x
2Al + 6HCl = 2AlCl3 +3H2↑
y 2y y y
Mg + 2HCl = MgCl2 + H2↑
Пусть 2x моль алюминия, y моль магния, тогда составим уравнение для сплава 54x + 24y = 0,39
Рассчитаем количество вещества водорода 0,448 л: 22,4 л/моль = 0,02 моль.
Составим уравнение для выделившегося водорода:
3x + y = 0,02
Решаем систему уравнений и получаем, что
2x = 0,01моль Al, y = 0,005 моль Mg
Следовательно, m(Al) = 0,27 г, m(Mg) = 0,12 г
Найдём массовые доли металлов: ᾠ(Al) = 69, 2%, ᾠ(Mg) = 30,8%
Найдём массу выделившегося водорода: , m(H2) = 0,04 г
Установим массу раствора после реакции:
m(раствора) = 50 г + 0,39 г – 0,04г = 50,35 г
По уравнению реакции образовалось 0,005 моль MgCl2 , что составляет
0, 475 г MgCl2 и 0,01 моль AlCl3, что составляет 1, 335 г AlCl3
Рассчитаем массу растворимого вещества соляной кислоты:
m(HCl) = 50 г * 0,05 = 2,5 г
при этом прореагировало
2* 0,005моль + 3* 0,01 моль = 0,04 моль, тогда масса оставшейся кислоты:
m(HCl) = 2,5 г – (0,04* 36,5) г= 1,04 г
Рассчитаем массовые доли веществ, оставшихся в растворе:
ᾠ(MgCl2) = 0,475*100% : 50,35 = 0,94%
ᾠ(AlCl3) = 13,35 г *100% : 50,35 = 2,65%
ᾠ(HCl) = 1,04 *100% :50,35 = 2,07%
Задачи на выведение формулы вещества
Задача 1
Неорганическое вещество состоит из трёх элементов, один из которых кислород, а два других – неизвестны (обозначим их Х и У). Известно, что массовая доля кислорода в этом соединении равна 0,653, а элемента Х – 0,031. Определите формулу вещества, зная, что атом элемента Х в 31 раз легче атома У, а атом элемента У в 1,93 раза тяжелее атома кислорода.
Переведём массовые доли элементов в проценты, найдем массовую долю элемента У. Она равна 31,6%.
Найдём относительную атомную массу элемента У, она равна 31, значит этот элемент фосфор.
Найдём элемент Х, который в 31 раз легче У. Установим элемент водород.
Учтём массовые доли элементов:
O H P
65, 3 : 16 3,1 : 1 31,6 : 31
Получим соотношения элементов 4 : 3 : 1
Выведем формулу H3PO4 – ортофосфорная кислота
Задача 2
При взаимодействии 3,42 г щелочного металла с водой образовалось 448 мл водорода (н. у.). Какой металл вступил в реакцию?
Уравнение протекающей реакции: 2 Me + 2 HOH = 2 MeOH + H2↑
Переведём объём водорода в литры: 448 мл – 0,448 л
Найдём количество вещества водорода:
v(H2) = 0,448 л : 22,4 л/моль = 0,02 моль
По уравнению реакции найдём количество вещества щелочного металла:
v(Ме) = 0, 04 моль
Установим молярную массу металла:
М(Ме) = m : v = 3,42 г: 0,04 моль = 85,5 г/моль
По таблице Менделеева установим щелочной металл.
Это рубидий – Rb.
Mr (Rb) = 85,5 г/моль
Задание 3
При действии брома на неизвестный углеводород выделено одно единственное галогенопроизводное, плотность паров которого в 5,207 раза больше плотности воздуха. Определите структурную формулу исследуемого углеводорода.
CnH2n+2 + Br2 = CnH2n+1Br + HBr
Найдём молярную массу галогенпроизводного, она равна 151 г/моль.
Зная массу брома, найдём молярную массу радикала 151 – 80 = 71 г/моль.
14 n +1 = 71; 14n = 70; n = 5
Значит галогеналкан C5H11Br, а алкан C5H12
Так как образуется только одно галогенпроизводное, то алкан
2,2-диметилпропан CH3
CH3 – C – CH3
CH3
Задачи на растворы
Задание 1
Сколько миллилитров воды надо взять для растворения 27,8г железного купороса FeSO4 * 7H2O, чтобы приготовить 8% (по массе) раствор сульфата железа (II)?
Рассчитаем молярную массу кристаллогидрата, она равна 278 г/моль.
Найдем массовую долю сульфата железа (II) в железном купоросе –
(152 : 278) * 100% = 54,68%
Произведём расчет по квадрату Пирсона:
54,68% 8 весовых частей
8%
0% 46,68 весовых частей
Найдём массу воды: 27,8 г – 8 весовых частей
m(воды) – 46,68 весовых частей; m(воды) = 162,2 г
Масса воды равна объёму – 162,2 мл воды
Задание 2
Сколько г глауберовой соли Na2SO4 * 10 H2O и воды нужно взять, чтобы получить 71 г 20% раствора сульфата натрия.
Рассчитаем массовую долю сульфата натрия в глауберовой соли:
ᾠ = 142 * 100% =44,1%
322
Для решения можно использовать квадрат Пирсона:
44,1% 5 весовых частей
20%
0% 6,025 весовых частей
Тогда весь полученный раствор составит 11,025 весовых частей, а глауберовой соли в нём 5 весовых частей. Масса глауберовой соли составит:
71 г – 11,025 весовых частей
m(соли) – 5 весовых частей, m(глауберовой соли) = 32,2 г
Рассчитаем массу воды m(H2O) = 71 г – 32,2 г = 38,8 г
Задание 3
Некоторое количество металлического цинка полностью растворилось в концентрированной азотной кислоте. После осторожного выпаривания раствора и его высушивания масса полученного твёрдого вещества составила 41,8 г. Сухой остаток прокалили, а выделившийся газ собрали в газометр с водой объёмом 3,5 см3
а) Рассчитайте массу цинка, вступившего в реакцию.
б) Какие газы и в каком количестве содержатся в газометре.
в) Приведите все перечисленные уравнения реакций.
0,22 моль 0,22 моль
Zn +4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
1 моль 1 моль
М(Zn(NO3)2) = 189 г/моль; v(Zn(NO3)2) = 0,22 моль
0,22 моль 0,44 моль 0,11 моль
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2 моль 4 моль 1 моль
Масса цинка, вступившего в реакцию равна соответственно 14,4 г.
Газы оксид азота (IV) и кислород находятся в мольном отношении 1:4
Эти газы вступают в реакцию с водой, образуя азотную кислоту:
0,194 моль 0,388 моль 0,097 моль
2H2O + 4NO2 + O2 = 4HNO3
2 моль 4 моль 1 моль
Переведём воду в моли, получим 0,194 моль, на реакцию с ней потребуется 0,388 моль оксида азота (IV) и 0,097 моль кислорода.
Останется оксид азота (IV) в количестве 0,44 – 0,388 = 0,0521 моль
и кислород в количестве 0,11 моль – 0,097 моль = 0,013 моль
При переводе в литры получим 1,16 л NO2 и 0,29 л O2
Задание 4
При обжиге 19,4 г сульфида двухвалентного металла израсходовалось 6,72 л кислорода ( при н. у.). Полученный газ окислен далее в присутствии катализатора, а продукт реакции растворён в воде. Сульфид, какого металла подвергся обжигу и сколько граммов 33,6% раствора гидроксида калия потребуется для полной нейтрализации образующейся кислоты?
х моль 0,3 моль 0,2 моль
2MeS + 3O2 = 2MeO +2SO2
2 моль 3 моль 2 моль
6,72 л кислорода составляют 0,3 моль, подставим моли в уравнение, получим 0,2 моль сульфида металла.
19,4 г – 0,2 моль
М – 1 моль М(MeS) = 97 г/моль
М(Ме) = 65 г/моль, металл цинк, сульфид цинка.
0,2 моль 0,2 моль
2SO2 + O2 = 2SO3
2 моль 2 моль
0,2 моль 0,2 моль
SO3 +H2O = H2SO4
1 моль 1 моль
0,2 моль 0,4 моль
H2SO4 + 2KOH = K2SO4 + 2H2O
1 моль 2 моль
Рассчитаем массу растворимого вещества гидроксида калия, она равна 22,4 г
Найдём массу раствора гидроксида калия 100 г раствора – 33,6 г р. в.
х г раствора – 22,4 г р. в.
Масса раствора равна 66,67 г, объём раствора – отношение массы раствора к его плотности ( если считать, что плотность равна единице), объём раствора равен 66,67 мл.
Литература для учителя:
Адамович, Т.П. Сборник олимпиадных задач по химии [Текст] / Адамович Т.П., Васильева Г.И., Мечковский С.А., Станишевский Л.С. – Минск: Народная асвета, 1980. – 111 с.
Будруджак, П. М.Задачи по химии [Текст]:Мир, 1989-343 с.
Ерохин, Ю.М. Сборник задач и упражнений по химии [Текст] : с дидактическим материалом: Учеб. пособие для сред. спец. заведений /Ерохин Ю.М., Фролов В.И. – 2-е изд., перераб. и доп. – М. : Высшая школа, 1998. – 304с.
Хомченко, И.Г. Сборник задач и упражнений по химии для нехимических
техникумов [Текст] /: Учебное пособие для нехимических техникумов / И. Г. Хомченко. – М. : Высшая школа, 1989. – 256 с.
Задачи всероссийских олимпиад по химии [Текст]: под общ. ред. В.В. Сухова. – М.: Экзамен, 2003. – 480 с.
Литература для учащихся:
Абкин, Г.Л. Задачи и упражнения по химии [Текст]/: Учебное пособие для вузов/ Г.Л. Абкин. – М. : Высш. школа, 1971. – 264 с.
Габриелян, О.С. Химия в тестах, задачах, упражнениях 8 – 9 классы [Текст] Пособие для учащихся, родителей, учителей / О.С. Габриелян. – М. : Дрофа, 2005. – 350 с.
Гаврусейко, Н.П. Проверочные работы по неорганической химии 8 класс [Текст]/: Книга для учителя / Н.П. Гаврусейко. – М.: Просвещение, 1992. – 64 с.
Савинкина, Е.В. Сборник задач и упражнений по химии [Текст]/: Учебно-методический комплект УМК / Е.В. Савинкина, Н.Д. Свердлова. – М.: Экзамен , 2006.- 192 с.
Суровцева, Р.П. Задания для самостоятельной работы по химии в 8классе [Текст]/: Методическое пособие / Р.П.Суровцева, С.В.Софронов. – М, «Просвещение», 1993. – 96 с.
Хомченко, И.Г. Сборник задач и упражнений по химии для средней школы [Текст]/: Книга для преподавателей / И.Г. Хомченко. – М. Новая Волна, 2009. – 224 с.
Кузнецова, Н.Е. Задачник по химии 8 класс [Текст] / Н.Е. Кузнецова, А.Н. Лёвкин. – М. :Вентана-Граф, 2002. – 128 с.
Кузнецова, Н.Е. Задачник по химии 9 класс [Текст] / Н.Е. Кузнецова, А.Н. Лёвкин. – М. :Вентана-Граф, 2006. – 128 с.
Кузьменко, Н.Е. Химия для школьников старших классов и поступающих в ВУЗы [Текст] / Н.Е. Кузьменко, В.В. Ерёмин, В.А. Попков. – М.:Дрофа, 1999. – 544 с.
Радецкий, А.М. Дидактический материал по химии 8-9 [Текст] / А.М. Радецкий, В.П. Горшкова. – М.: Просвещение, 2000. – 78 с.
infourok.ru
Примеры решения типовых задач на массовую долю растворённого вещества в растворе
Важно знать! Как научиться решать задачи по химии.
Задача 3.1. Определите массу воды в 250 г 10%-ного раствора хлорида натрия.
Решение. Из w = mв-ва / mр-ра находим массу хлорида натрия:
mв-ва = w • mр-ра = 0,1 • 250 г = 25 г NaCl
Поскольку mр-ра = mв-ва + mр-ля, то получаем:
m(Н20) = mр-ра — mв-ва = 250 г — 25 г = 225 г Н20.
Задача 3.2. Определите массу хлороводорода в 400 мл раствора соляной кислоты с массовой долей 0,262 и плотностью 1,13 г/мл.
Решение. Поскольку w = mв-ва / (V • ρ), то получаем:
mв-ва = w • V • ρ = 0,262 • 400 мл • 1,13 г/мл = 118 г
Задача 3.3. К 200 г 14%-ного раствора соли добавили 80 г воды. Определите массовую долю соли в полученном растворе.
Решение. Находим массу соли в исходном растворе:
mсоли = w • mр-ра = 0,14 • 200 г = 28 г.
Эта же масса соли осталась и в новом растворе. Находим массу нового раствора:
mр-ра = 200 г + 80 г = 280 г.
Находим массовую долю соли в полученном растворе:
w = mсоли / mр-ра = 28 г / 280 г = 0,100.
Задача 3.4. Какой объем 78%-ного раствора серной кислоты с плотностью 1,70 г/мл надо взять для приготовления 500 мл 12%-ного раствора серной кислоты с плотностью 1,08 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,78 и ρ1 = 1,70 г/мл.
Для второго раствора имеем:
V2 = 500 мл, w2 = 0,12 и ρ2 = 1,08 г/мл.
Поскольку второй раствор готовим из первого добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,12 • 500 мл • 1,08 г/мл = 64,8 г.
Масса вещества в первом растворе также равна m2 = 64,8 г. Находим
объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 64,8 г / (0,78 • 1,70 г/мл) = 48,9 мл.
Задача 3.5. Какой объем 4,65%-ного раствора гидроксида натрия с плотностью 1,05 г/мл можно приготовить из 50 мл 30%-ного раствора гидроксида натрия с плотностью 1,33 г/мл?
Решение. Для первого раствора имеем:
w1 = 0,0465 и ρ1 = 1,05 г/мл.
Для второго раствора имеем:
V2 = 50 мл, w2 = 0,30 и ρ2 = 1,33 г/мл.
Поскольку первый раствор готовим из второго добавлением воды, то массы вещества в обоих растворах одинаковы. Находим массу вещества во втором растворе. Из w2 = m2 / (V2 • ρ2) имеем:
m2 = w2 • V2 • ρ2 = 0,30 • 50 мл • 1,33 г/мл = 19,95 г.
Масса вещества в первом растворе также равна m2 = 19,95 г.
Находим объем первого раствора. Из w1 = m1 / (V1 • ρ1) имеем:
V1= m1 / (w1 • ρ1) = 19,95 г / (0,0465 • 1,05 г/мл) = 409 мл.
Коэффициент растворимости (растворимость) — максимальная масса вещества, растворимая в 100 г воды при данной температуре. Насыщенный раствор — это раствор вещества, который находится в равновесии с имеющимся осадком этого вещества.
Задача 3.6. Коэффициент растворимости хлората калия при 25 °С равен 8,6 г. Определите массовую долю этой соли в насыщенном растворе при 25 °С.
Решение. В 100 г воды растворилось 8,6 г соли.
Масса раствора равна:
mр-ра = mводы + mсоли = 100 г + 8,6 г = 108,6 г,
а массовая доля соли в растворе равна:
w = mсоли / mр-ра = 8,6 г / 108,6 г = 0,0792.
Задача 3.7. Массовая доля соли в насыщенном при 20 °С растворе хлорида калия равна 0,256. Определите растворимость этой соли в 100 г воды.
Решение. Пусть растворимость соли равна х г в 100 г воды.
Тогда масса раствора равна:
mр-ра = mводы + mсоли = (х + 100) г,
а массовая доля равна:
w = mсоли / mр-ра = х / (100 + х) = 0,256.
Отсюда
х = 25,6 + 0,256х; 0,744х = 25,6; х = 34,4 г на 100 г воды.
Молярная концентрация с — отношение количества растворенного вещества v (моль) к объему раствора V (в литрах), с = v(моль) / V(л), с = mв-ва / (М • V(л)).
Молярная концентрация показывает число моль вещества в 1 л раствора: если раствор децимолярный (с = 0,1 М = 0,1 моль/л) значит, что в 1 л раствора содержится 0,1 моль вещества.
Задача 3.8. Определите массу КОН, необходимую для приготовления 4 л 2 М раствора.
Решение. Для растворов с молярной концентрацией имеем:
с = m / (М • V),
где с — молярная концентрация,
m — масса вещества,
М — молярная масса вещества,
V — объем раствора в литрах.
Отсюда
m = с • М • V(л) = 2 моль/л • 56 г/моль • 4 л = 448 г КОН.
Задача 3.9. Сколько мл 98%-ного раствора Н2SO4 (ρ = 1,84 г/мл) необходимо взять для приготовления 1500 мл 0,25 М раствора?
Решение. Задача на разбавление раствора. Для концентрированного раствора имеем:
w1 = m1 / (V1(мл) • ρ1).
Необходимо найти объем этого раствора V1(мл) = m1 / (w1 • ρ1).
Поскольку разбавленный раствор готовится из концентрированного смешиванием последнего с водой, то масса вещества в этих двух растворах будет одинакова.
Для разбавленного раствора имеем:
с2 = m2 / (М • V2(л)) и m2 = с2 • М • V2(л).
Найденное значение массы подставляем в выражение для объема концентрированного раствора и проводим необходимые вычисления:
V1(мл) = m / (w1 • ρ1) = (с2 • М • V2) / (w1 • ρ1) = (0,25 моль/л • 98 г/моль • 1,5 л) / (0,98 • 1,84 г/мл) = 20,4 мл.
[Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия: 11 класс» / М.А. Рябов]
Решение задач на растворы (массовая доля). Массовая доля. Расчеты по химическим формулам. Задачи по химии.
Видео ютуб канала “День знаний”
Поделитесь с друзьями:
zadachi-po-ximii.megapetroleum.ru
Алгоритм решения задачи 35 (С5). Подготовка к ЕГЭ по химии. Задача №35
В настоящее время на Едином госэкзамене по химии во второй (более сложной) предлагается шесть заданий. Первые четыре не связаны с количественными расчетами, последние два – это достаточно стандартные задачи.
Этот урок целиком посвящен разбору задачи №35 (С5). Кстати, ее полное решение оценивается в три балла (из 60).
Начнем с несложного примера.
Пример 1. 10,5 г некоторого алкена способны присоединить 40 г брома. Определите неизвестный алкен.
Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением:
CnH2n + Br2 = CnH2nBr2.
Рассчитаем количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2) = m/M = 40/160 = 0,25 моль.
Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n) = n(Br2) = 0,25 моль.
Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль).
Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение:
12n + 2n = 42.
Решением этого уравнения является n = 3. Формула алкена: C3H6.
Ответ: C3H6.
Приведенная задача – типичный пример задания №35. 90% реальных примеров на ЕГЭ строятся по аналогичной схеме: есть некоторое органическое соединение X, известен класс, к которому оно относится; определенная масса X способна прореагировать с известной массой реагента Y. Другой вариант: известна масса Y и масса продукта реакции Z. Конечная цель: идентифицировать Х.
Алгоритм решения подобных заданий также достаточно очевиден.
- 1) Определяем общую формулу гомологического ряда, к которому относится соединение Х.
- 2) Записываем реакцию исследуемого вещества Х с реагентом Y.
- 3) По массе Y (или конечного вещества Z) находим его количество.
- 4) По количеству Y или Z делаем вывод о количестве Х.
- 5) Зная массу Х и его кол-во, рассчитываем молярную массу исследуемого вещества.
- 6) По молярной массе X и общей формуле гомологического ряда можно определить молекулярную формулу Х.
- 7) Осталось записать ответ.
Рассмотрим этот алгоритм подробнее, по пунктам.
1. Общая формула гомологического ряда
Наиболее часто используемые формулы сведены в таблицу:
| Гомологический ряд | Общая формула |
| Алканы | CnH2n+2 |
| Алкены | CnH2n |
| Алкины | CnH2n-2 |
| Диены | CnH2n-2 |
| Арены | CnH2n-6 |
| Предельные одноатомные спирты | CnH2n+1ОН |
| Предельные альдегиды | CnH2n+1СОН |
| Предельные монокарбоновые кислоты | CnH2n+1СОOН |
Кстати, нет необходимости механически запоминать формулы всевозможных гомологических рядов. Это не только невозможно, но и не имеет ни малейшего смысла! Гораздо проще научиться самостоятельно выводить эти формулы. Как это сделать, я, возможно, расскажу в одной из следующих публикаций.
2. Уравнение реакции
Нет надежды, что мне удастся перечислить ВСЕ реакции, которые могут встретиться в задаче 35. Напомню лишь наиболее важные:
1) ВСЕ органические вещества горят в кислороде с образованием углекислого газа, воды, азота (если в соединении присутствует N) и HCl (если есть хлор):
CnHmOqNxCly + O2 = CO2 + H2O + N2 + HCl (без коэффициентов!)
2) Алкены, алкины, диены склонны к реакциям присоединения (р-ции с галогенами, водородом, галогенводородами, водой):
CnH2n + Cl2 = CnH2nCl2
CnH2n + H2 = CnH2n+2
CnH2n + HBr = CnH2n+1Br
CnH2n + H2O = CnH2n+1OH
Алкины и диены, в отличие от алкенов, присоединяют до 2 моль водорода, хлора или галогенводорода на 1 моль углеводорода:
CnH2n-2 + 2Cl2 = CnH2n-2Cl4
CnH2n-2 + 2H2 = CnH2n+2
При присоединении воды к алкинам образуются карбонильные соединения, а не спирты!
3) Для спиртов характерны реакции дегидратации (внутримолекулярной и межмолекулярной), окисления (до карбонильных соединений и, возможно, далее до карбоновых кислот). Спирты (в т.ч., многоатомные) реагируют с щелочными металлами с выделением водорода:
CnH2n+1OH = CnH2n + H2O
2CnH2n+1OH = CnH2n+1OCnH2n+1 + H2O
2CnH2n+1OH + 2Na = 2CnH2n+1ONa + H2
4) Химические свойства альдегидов весьма разнообразны, однако здесь мы вспомним лишь об окислительно – восстановительных реакциях:
CnH2n+1COH + H2 = CnH2n+1CH2OH (восстановление карбонильных соединений в прис. Ni),
CnH2n+1COH + [O] = CnH2n+1COOH
Для последней реакции записана лишь схема, поскольку в качестве окислителей могут выступать разные соединения.
Обращаю внимание на весьма важный момент: окисление формальдегида (НСОН) не останавливается на стадии муравьиной кислоты, НСООН окисляется далее до СО2 и Н2О.
5) Карбоновые кислоты проявляют все свойства “обычных” неорганических кислот: взаимодействуют с основаниями и основными оксидами, реагируют с активными металлами и солями слабых кислот (напр., с карбонатами и гидрокарбонатами). Весьма важной является реакция этерификации – образование сложных эфиров при взаимодействии со спиртами.
CnH2n+1COOH + KOH = CnH2n+1COOK + H2O
2CnH2n+1COOH + CaO = (CnH2n+1COO)2Ca + H2O
2CnH2n+1COOH + Mg = (CnH2n+1COO)2Mg + H2
CnH2n+1COOH + NaHCO3 = CnH2n+1COONa + H2O + CO2
CnH2n+1COOH + C2H5OH = CnH2n+1COOC2H5 + H2O
Ну, кажется, пора остановиться – я же не собирался писать учебник по органической химии. В заключение этого раздела хотелось бы еще раз напомнить о коэффициентах в уравнениях реакций. Если вы забудете их расставить (а такое, к сожалению, встречается слишком часто!) все дальнейшие количественные расчеты, естественно, становятся бессмысленными!
3. Нахождение количества вещества по его массе (объему)
Здесь все очень просто! Любому школьнику знакома формула, связывающая массу вещества (m), его количество (n) и молярную массу (M):
m = n*M или n = m/M.
Например, 710 г хлора (Cl2) соответствует 710/71 = 10 моль этого вещества, поскольку молярная масса хлора = 71 г/моль.
Для газообразных веществ удобнее работать с объемами, а не с массами. Напомню, что количество вещества и его объем связаны следующей формулой: V = Vm*n, где Vm – молярный объем газа (22,4 л/моль при нормальных условиях).
4. Расчеты по уравнениям реакций
Это, наверное, главный тип расчетов в химии. Если вы не чувствуете уверенности при решении подобных задач, необходимо тренироваться.
Основная идея заключается в следующем: количества реагирующих веществ и образующихся продуктов относятся так же, как соответствующие коэффициенты в уравнении реакции (вот почему так важно правильно их расставить!)
Рассмотрим, например, следующую реакцию: А + 3B = 2C + 5D. Уравнение показывает, что 1 моль А и 3 моль B при взаимодействии образуют 2 моль C и 5 моль D. Количество В в три раза превосходит количество вещества А, количество D – в 2,5 раза больше количества С и т. д. Если в реакцию вступит не 1 моль А, а, скажем, 10, то и количества всех остальных участников реакции увеличатся ровно в 10 раз: 30 моль В, 20 моль С, 50 моль D. Если нам известно, что образовалось 15 моль D (в три раза больше, чем указано в уравнении), то и количества всех остальных соединений будут в 3 раза больше.
5. Вычисление молярной массы исследуемого вещества
Масса Х обычно дается в условии задачи, количество Х мы нашли в п. 4. Осталось еще раз использовать формулу М = m/n.
6. Определение молекулярной формулы Х.
Финальный этап. Зная молярную массу Х и общую формулу соответствующего гомологического ряда, можно найти молекулярную формулу неизвестного вещества.
Пусть, например, относительная молекулярная масса предельного одноатомного спирта равна 46. Общая формула гомологического ряда: CnH2n+1ОН. Относительная молекулярная масса складывается из массы n атомов углерода, 2n+2 атомов водорода и одного атома кислорода. Получаем уравнение: 12n + 2n + 2 + 16 = 46. Решая уравнение, получаем, что n = 2. Молекулярная формула спирта: C2H5ОН.
Задача решена. Не забудьте записать ответ!
Конечно, не все задачи С 5 полностью соответствуют приведенной схеме. Никто не может дать гарантии, что на реальном ЕГЭ по химии вам попадется что-либо, дословно повторяющее приведенные примеры. Возможны незначительные вариации и даже сильные изменения. Все это, однако, не слишком важно! Не следует механически запоминать приведенный алгоритм, важно понять СМЫСЛ всех пунктов. Если будет понимание смысла, никакие изменения вам не страшны!
В следующей части мы рассмотрим несколько типичных примеров.
Решение задачи С5 (35) на экзамене по химии. Часть II. →
www.repetitor2000.ru
Примеры решенных задач по химии.
Ниже приведены условия задач. Закачка решений(в формате doc) начнется автоматически через 10 секунд. Если закачка не началась, кликните по этой ссылке. Еще примеры задач по химии здесь.
№389
Написать уравнение реакции взаимодействия 2,2,4-триметилпентана с азотной кислотой. Оценить различную подвижность атомов водорода у первичного, вторичного и третичного атомов углерода. В чем заключается пожарная опасность нитросоединений?
№416
Перечислить возможные направления процесса окисления алкенов кислородом воздуха и другими окислителями. Написать уравнения соответствующих реакций.
№459
К каким реакциям замещения способны галогеналкилы? Написать уравнения соответствующих реакций для бромистого этила.
№491
Написать уравнения реакций получения 1,2-этандиола и 1,2,3-пропантриола, а также уравнения реакций их взаимодействия с азотной кислотой. К какому классу относятся полученные продукты? Указать их практическое применение и пожарную опасность.
№523
Написать структурные формулы:
Акрилонитрил
α-бромпропановая кислота
триглицерид линолевой кислоты
Трихлоруксусной кислоты
Стеариновокислого натрия
Ангидрида масляной кислоты
Бензоат натрия
№544
При определенных условиях надуксусная кислота разлагается, превращаясь в уксусную кислоту и кислород. Как изменяется степень окисления всех атомов кислорода надуксусной кислоты?
№500
При окислении каких спиртов получается бензальдегид, дифенилкетон, пентаналь? Написать уравнения реакций.
№ 545
Основная масса фенола в производственных условиях получается из гидроперекиси кумола, которая получается из изопропилбензола. составить схему превращения изопропилбензола в фенол. Какое вещество получается вместе с фенолом?
Скачать решения задач:
Имя файла: him1.doc
Размер файла: 132.5 Kb
Если закачивание файла не начнется через 10 сек, кликните по этой ссылке
easyhelp.su



