Строение атома rb – Строение атома рубидия | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
- Комментариев к записи Строение атома rb – Строение атома рубидия | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями нет
- Советы абитуриенту
Строение атома рубидия (Rb), схема и примеры
Общие сведения о строении атома рубидия
Относится к элементам s-семейства. Металл. Обозначение – Rb. Порядковый номер – 37. Относительная атомная масса – 85,468 а.е.м.
Электронное строение атома рубидия
Атом рубидия состоит из положительно заряженного ядра (+37), внутри которого есть 37 протонов и 48 нейтронов, а вокруг, по пяти орбитам движутся 37 электронов.
Рис.1. Схематическое строение атома рубидия.
Распределение электронов по орбиталям выглядит следующим образом:
+37Rb)2)8)18)8)1;
1s22s22p63s23p63d104s24p65s1.
Внешний энергетический уровень атома рубидия содержит 1 электрон, который является валентным. Энергетическая диаграмма основного состояния принимает следующий вид:
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
Наличие одного неспаренного электрона свидетельствует о том, что степень окисления рубидия равна +1.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение атома бора (B), схема и примеры
Общие сведения о строении атома бора
Порядковый номер равен 5. Заряд ядра равен +5. Атомный вес – 10,811 а.е.м. У бора имеется два изотопа, с массовым числом 10 и 11. Доля их распределения в природе такова: 10В (19,8 %) и 11В (80,2 %).

Рис. 1. Внешний вид бора.
Электронное строение атома бора
Бор расположен во втором периоде, значит, он имеет две оболочки, одна из которых внешняя, содержащая валентные электроны. Атом бора имеет положительно заряженное ядро (+5), в котором имеется 5 протонов и 5 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 5 электронов.
Электронную конфигурация атома бора записывается следующим образом: можно записать двояко:
+5B)2)3;
1s22s22p1.
Бор относится к семейству p-элементов. Энергетическая диаграмма атома бора (на ней изображаются только валентные электроны) имеет вид:
Поскольку в атоме бора есть ещё две свободные p-орбитали, то он способен переходить в возбужденное состояние, т.е. внешние электроны s-орбитали расспариваются и один из них переходит на вакантную p-орбиталь.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Строение ядра атома, схема и примеры
Общие сведения о строении ядра атома
По величине заряда ядра атома определяют химический элемент, к которому этот атом относится.
Существование атомного ядра было доказано в 1911 году Э. Резерфордом и описано в труде под названием «Рассеяние α и β-лучей и строение атома». После этого разными учеными выдвигались многочисленные теории строения атомного ядра (капельная (Н. Бор), оболочечная, кластерная, оптическая и т.д.).
Электронное строение ядра атома
Согласно современным представлениям атомное ядро состоит из положительно заряженных протонов и нейтральных нейтронов, которые вместе называют нуклонами. Они удерживаются в ядре за счет сильного взаимодействия.
Число протонов в ядре называют зарядовым числом (Z). Его можно определить при помощи Периодической таблицы Д. И. Менделеева – оно равно порядковому номеру химического элемента, к которому относится атом.
Число нейтронов в ядре называют изотопическим числом (N). Суммарное количество нуклонов в ядре называют массовым числом (M) и оно равно относительной атомной массе атома химического элемента, указанной в Периодической таблице Д. И. Менделеева.
Ядра с одинаковым числом нейтронов, но разным числом протонов называют изотонами. Если же в ядре одинаковое число протонов, но различное нейтронов – изотопами. В случае, когда равны массовые числа, но различный состав нуклонов – изобарами.
Ядро атома может находиться в стабильном (основном) состоянии и в возбужденном.
Рассмотрим строение ядра атома на примере химического элемента кислорода. Кислород имеет порядковый номер 8 в Периодической таблице Д. И. Менделеева и относительную атомную массу 16 а.е.м. Это означает, что ядро атома кислорода имеет заряд равный (+8). В ядре содержится 8 протонов и 8 нейтронов (Z=8, N=8, M=16), а по 2-м орбитам вокруг ядра движутся 8 электронов (рис. 1).
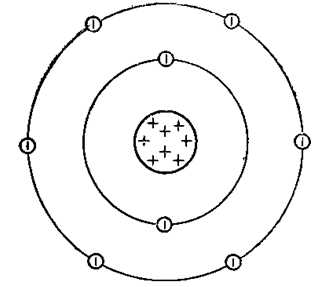
Рис. 1. Схематичное изображение строения атома кислорода.
Примеры решения задач
ru.solverbook.com
Строение атома — Викиверситет
Строение атома
Атом (от греческого atomos – неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойств вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из
| элементарная частица | заряд (условные единицы) | заряд (Кл) | масса (а.е.м.) | масса (г) |
|---|---|---|---|---|
| протон | +1 | 1,6·10×10-19 | 1 | 1,7·10×10-24 |
| нейтрон | 0 | 0 | 1 | 1,7·10×10-24 |
| электрон | -1 | -1,6·10×10-19 | 0 | 9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объёмом атома, то ядро условно принимается материальной точкой, покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Свойства электрона
Перед изучением свойств электрона и правил формирования электронных уровней необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее “верных” представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества предположили еще древнегреческие философы (если какое-либо тело начать делить пополам, половинку ещё пополам и так далее, то этот процесс не сможет происходить до бесконечности; мы остановимся на частичке, котору
ru.wikiversity.org
Электронное строение атома, схема и примеры
Понятие «атом»
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Электронное строение атома
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
|
Значение l |
1 |
2 |
3 |
4 |
5 |
|
Обозначение |
s |
p |
d |
f |
h |
|
Форма |
шар |
объемная восьмерка |
более сложная форма |
||
Магнитное квантовое число показывает ориентацию орбитали в пространстве. Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2). Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э. Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
Примеры решения задач
ru.solverbook.com
Строение атома
1. Ядро и электроны
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращений существует целый ряд процессов, в которых атомы выступают как сложные объекты, состоящие из положительно заряженной части – ядра и отрицательно заряженных электронов, суммарный заряд которых в точности компенсирует заряд ядра. В результате работ английского физика Дж. Дж. Томсона и американского физика Р.С. Малликена было установлено, что электрон имеет массу 9,1•1031 кг, или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основная масса атома сосредоточена в ядре, которое занимает очень малую часть его объема: диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4 диаметра атома. Наглядно это соотношение размеров можно представить себе, если увеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместится внутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят из положительно заряженных частиц – протонов и незаряженных частиц – нейтронов. Протон имеет заряд, равный заряду электрона, но со знаком плюс, его масса практически равна массе нейтрона. Отметим, что в химии принято выражать заряды ионов в единицах заряда электрона с соответствующим знаком, например Н+ , Mg2+ , СГ.
Таким образом, число протонов в ядре определяет его заряд и порядковый номер, а сумма чисел протонов и нейтронов – округленную общую массу ядра в атомных единицах, или массовое число атома. Очевидно, что в электронейтральном атоме число протонов в атомном ядре равно числу электронов в электронной оболочке атома.
2. Атомный номер элемента. изотопы
Порядковый номер элемента принято называть его атомным номером и обозначать буквой Z. Атомный номер лежит в основе систематизации химических элементов и определяет их положение в периодической системе.
При определенном атомном номере, т.е. при определенном числе протонов, в ядре могут находиться разные числа нейтронов, поэтому могут существовать отличающиеся по массе разновидности атомов одного и того же элемента – изотопы.
Например, природный водород представляет собой смесь изотопов с массовыми числами 1 и 2, а.
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке – 92 электрона
В периодической таблице, элементы расположены в порядке увеличения заряда ядра, а в отдельных клеточках таблицы принято приводить средневзвешенные атомные массы, поэтому они часто сильно отличаются от целочисленных.
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электронной пушки (2). Заряженные пластины (3) и (4) разгоняют поток полученных положительных ионов, который проходит через щель в пластине (4) и попадает в поле магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд: масса. За второй щелью (в) расположен детектор (7), который регистрирует число частиц, прошедших через щель. Меняя напряженность магнитного поля, можно последовательно регистрировать относительное количество ионов с различной массой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показана часть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2 . Отдельные полосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений масс атомов и разделение изотопов стало возможным в результате создания масс-спектрометрии – метода, основанного на воздействии магнитного поля на направленные пучки заряженных частиц.
3. Ядерная модель атома
Первая модель атома была предложена в начале XX века Э. Резерфордом, новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся с большой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношению к Солнцу. По представлениям классической электромагнитной теории в таком атоме электрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Через короткое время электрон неизбежно должен упасть на ядро. Это очевидное несоответствие фактам было не единственным недостатком модели Резерфорда: плавное изменение энергии электронов в атоме не согласовывалось с появившимися наблюдениями над спектрами атомов. Одним из достижений второй половины XIX века была разработка атомного спектрального анализа – точного и чувствительного метода, сыгравшего важнейшую роль в открытии новых элементов и послужившего экспериментальной основой изучения строения атомов. Метод основан на испускании света свободными атомами, получающимися при сильном нагреваний вещества; при этом атомы переходят из основного состояния с минимальной энергией в возбужденные состояния с более высокими энергиями.
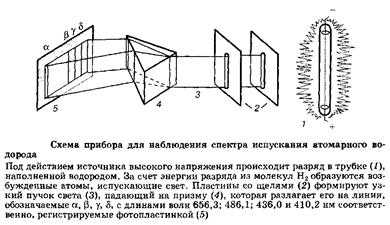
Возвращаясь в основное состояние, атомы излучают свет. Оказалось, что атомные спектры излучения состоят из отдельных линий, отвечающих только определенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров и устойчивость атомов, знаменитый датский физик Нильс Бор предложил два постулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зрения классической механики, допустимы лишь определенные орбиты, по которым электрон движется не излучая.
Частота поглощаемого или испускаемого атомом излучения при переходе из одного разрешенного состояния в другое определяется разностью энергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантовании энергии. Планк установил, что, хотя свет, испускаемый раскаленным телом, кажется сплошным, световая энергия поглощается или излучается отдельными порциями – квантами Е = hv, пропорциональными частоте светового электромагнитного колебания. Коэффициент пропорциональности h = 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образом в науку было введено понятие кванта света, или некоторого светового пакета – фотона, отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергии атома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснения наблюдаемых энергетических характеристик атомов с двумя и более электронами; главный же ее недостаток заключался в том, что она не давала логического обоснования природы квантования и устойчивости не меняющихся во времени состояний атома. Однако, несмотря на эти недостатки, сами идеи Бора о квантовании и стационарных состояниях легли в основу современного описания строения атома с позиций квантовой механики.
4. Волновые свойства электрона
Вскоре после 1920 г. был сделан следующий важный шаг в познании микромира: было установлено, что не только световые кванты, но и любые микрочастицы, в том числе электроны, обладают двойственной природой – частицы как таковой и волны.
Например, электрону при скорости 3 • 10е м/с отвечает длина волны
В частности, удалось обнаружить дифракцию электронов на периодической решетке кристаллов и на молекулах газов. Частице с массой покоя т, движущейся со скоростью v, соответствует длина волны X, которая может быть найдена из уравнения де Бройля: сопоставимая с размерами атома. В то же время можно говорить и об импульсе и даже о массе движущегося фотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельство существенным образом влияет на характер информации, которую дает спектроскопия. При столкновении фотона с электроном меняются импульс фотона и частота света, тем самым давая экспериментатору информацию об импульсе электрона. Однако, поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульс электрона, который надо определить. Ситуация в какой-то степени подобна попытке измерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи с разбега. Математически эти соображения описываются принципом неопределенности Гейзенберга, согласно которому возможность одновременного определения положения микрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, в частности, означает, что если мы хотим определить с большой точностью энергию электрона в атоме, то мы не сможем столь же точно определить его положение по отношению к ядру.
5. Квантово-механическая модель атома
Представления о стационарных состояниях атома и двойственной природе электрона, а также требования принципа неопределенности были использованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложил модель, описывающую электрон в атоме как своего рода стоячую волну, причем вместо точного положения электрона в пространстве рассматривалась вероятность его пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмерной стоячей волны, остановимся сначала на более простой одномерной модели стоячей волны, в качестве которой можно взять струну, закрепленную на концах. Струна способна издавать звуки только определенных частот, так как на ее длине может уложиться лишь целое число полуволн – это и есть квантование энергии колебаний струны. Для описания характера стоячих волн одномерной системы достаточно одного числа п, которое однозначно определяет длину волны и число узловых точек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарные колебания, может служить круглая мембрана, закрепленная по периметру, например, в телефонной трубке. Здесь также возможны лишь определенные, квантованные колебания, для описания которых необходимы уже два числа.
mirznanii.com
Тема 2 Строение вещества. Строение атома — Мегаобучалка
Практическое занятие
Цели: Дать представление о корпускулярно-волновом дуализме явлений микромира, волновой функции, атомной орбитали. Изучить квантовые числа: главное, орбитальное, магнитное и спиновое, энергетические уровни и подуровни, правила заполнения электронных орбиталей атома в основном состоянии, принцип Паули, правило Клечковского и Хунда, электронные емкости орбиталей, подуровней и уровней атома, способы записи электронных формул атома.
Формировать у студента диалектико-материалистическое мировоззрение о единстве природы.
Изучение строения вещества приводит к открытию все более тонких деталей его структуры, постоянно углубляет и уточняет ваши знания.
План
1 Элементарные частицы и атомное ядро
2 Корпускулярно-волновой дуализм
3 Квантовые числа. Принцип Паули
4 Правила заполнения электронных уровней и подуровней. Электронные формулы, Электронно-структурные формулы. Правило Хунда
5 Значение теории строения атома в химии и биологии
6 Сколько s, p, d, f элементов в периодической системе Д.И.Менделеева? Напишите электронную формулу атомов рубидия и цезия. Подсчитайте суммы спиновых квантовых чисел в этих атомах
7 Сформулируйте правило Хунда. Изобразите электронно-структурную формулу атома азота
8 Какие электроны называют валентными? Как изображают электронный остов атома рубидия?
9 Сколько электронов находится на d-подуровне атома с порядковым номером 43?
10 Охарактеризуйте квантовые числа следующих электронов:4s¹, 5p³, 4d²,4f¹.
Методические рекомендации
Квантово-механическая модель атома
Как известно, атомы состоят из ядра и электронов, а ядро – из протонов и нейтронов. Электроны, протоны и нейтроны являются элементарными частицами, т.е. мельчайшими частицами материи. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют чрезвычайно малые массы и геометрические размеры и поэтому обладают специфическими свойствами, отличающими их от объектов привычного нам мира-макромира, и образуют свой мир-микромир. В микромире проявля ются действия законов квантовой механики, которые не ощущаются в повседневной жизни. Квантовая механика – это наука о строении и свойст- вах элементарных частиц, ядер, атомных и молекулярных объектов, об их превращениях и о явлениях, сопровождающих эти превращения. Состояние электрона в атоме изучает квантовая механика. Главный тезис квантовой механики – микрочастицы имеют волновую природу, а волна – свойства частиц.
Частица- ( корпускула)- это сосредоточение вещества в малой части пространства . Движение частицы характеризуется траекторией, т.е. координа- тами и скоростью в каждый момент времени. Волна-это процесс, занимаю- щий значительный объем трехмерного пространства и развивающийся во времени, чаще всего как периодический процесс. Характеристиками волны являются ее длина, частота и скорость движения, амплитуда и знак амплитуды.
Луи де Бройль в 1924 году предложил, что все тела в природе обладают одновременно и волновыми и корпускулярными свойствами. Уравнение де Бройля отражает этот дуализм (двойственность).
λ=h / mv (1)
Оно объединяет характеристику волнового процесса – длину волны λ и характеристику корпускулярного движения – импульс mv.,
где m-масса частицы,
V –ее скорость.
Быстро движущийся электрон, обладающий свойствами волны, может находиться в любой части пространства вокруг ядра, и в различных положениях. Его можно рассматривать как электронное облако с определен ной плотностью отрицательного заряда. Электронное облако- это квантово-механическая модель движения электрона в атоме. Наиболее вероятное нахождение электрона на расстоянии 0,53 Ấ (наибольшая плотность). Ту сферу, где чаще бывает электрон, называют атомной орбиталью.
Квантовые числа
Состояние электрона в атоме описывают четыре квантовых числа:
1) Главное квантовое число (n) – характеризует энергетический уровень или запас энергии электрона, а также размеры электронного облака. Главное квантовое число имеет значения: n=1,2,3,4 и т.д. К,L,M,N-…буквенное обозначение уровня.
2) Орбитальное или побочное квантовое число (l) – характеризует энергетическое состояние электрона в подуровне и форму электронного облака. При данном (n) главного квантового числа орбитальное квантовое число(l) может принимать все неотрицательные целочисленные значения от 0 до n=1 . Это значит, что число возможных значений l при данном n также равно n . Например, если n =1, то l=0, при n=2 , l= 0,1, т.е. два значения. Числовые значения l имеют буквенные обозначения, которые удобнее в употреблении l =0,1,2,3 обозначение: s ,p, d ,f
Соответственно говорят о s -, р-, d-, f- состояниях электрона.
s- , p- , d- , f- орбиталях : S- O сфера имеет (шаровую форму), Р- (гантелевид-
ную форму), d- (форма четырехлепестковой розетки), f- (сложную форму).
Подуровни принято обозначать двумя символами: цифровым и буквенным, означающими главное и орбитальное квантовые числа.
| n | l | Число подуровней | Буквенное обозна- чение подуровней |
| 1S | |||
| 0,1 | 2S ,2p | ||
| 0,1,2 | 3S, 3p ,3d | ||
| 0,1,2,3 | 4S, 4p, 4d ,4f |
3) Магнитное квантовое число (m) –характеризует ориентацию орбиталей в пространстве. Им определяется число орбиталей на каждом подуровне. Величина m может принимать целые отрицательные и положительные значения от – l до +l включая ноль. Это означает, что каждому значению l соответствует свой набор магнитных квантовых чисел m . На подуровне l независимо от главного квантового числа n , всегда имеется 2l+1 атомных орбиталей. Для S-подуровня l=0 и поэтому m=0. Таким образом, на S-подуров- не всегда существует единственная S-орбиталь. Графически обозначают одной квантовой ячейкой. Для p-электронов или p-подуровня l=1 и m =-1,0,+1, т.е. p-подуровень всегда имеет три p-орбитали, т.е. квантовые ячейки
S-орбиталь Px-орбиталь Py-орбиталь Pz-орбиталь
Соответственно d-подуровень l=2, m= -2,-1,0,+1,+2, т.е. пять квантовых ячеек, таким образом, 5 орбиталей т.е. 2l + 1, l=2→ 2 2+1=5
f –подуровень l=3, m = -3,-2,-1,0 +1,+2,+3
f –орбиталей семь Nl = 2 * 3 +1 =7 квантовых ячеек.
4) Спин- это собственный момент количества движения электрона. В атоме этот момент количества движения квантуется и определяется спиновым квантовым числом. Спиновое квантовое число характеризует собственное вращение электрона вокруг своей оси. Спиновое квантовое число (ms) может принимать только два численных значения: – 1/2 и + 1/2
Оно определяет число электронов, которое может находиться на орбитали . В соответствии с принципом Паули на одной орбитали может находиться не более двух электронов. Этот принцип сформулирован В. Паули (1925).
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет, прежде всего, максимальную емкость по электронам одной орбитали Nm , т.е. в одной ячейке может быть два электрона с противоположными спинами ↓ ↑ – обозначение.
Максимальная емкость уровня по электронам определяется по формуле
Nl=2(2*l+1), l=0, m=0, s=1/2 , s=-1/2 S-подуровень N S =2(2*0+1)=2
l=1, m=-1 , 0 , +1, m=-1, s = + 1/2 , -1/2,
m=0, s = + 1/2 , – 1/2, p-подуровень Np = 2(2*1 +1 )=6
m=+1, s = 1/2 , -1/2,
n=1, N=2n2, N = 2* 12 =2 т.е. на I уровне максимально может быть два электрона.
n=2, N2= 2*22 =8
n=3, N3= 2*32 =18
n=4, N4= 2*42 =32
Например: на d-подуровне (l=2) количество электронов равно
N d = 2 (2* 2+1)=10
megaobuchalka.ru



