Строение атома рисунок – фото и картинки строение атома, скачать изображение на Depositphotos®
- Комментариев к записи Строение атома рисунок – фото и картинки строение атома, скачать изображение на Depositphotos® нет
- Советы абитуриенту
Электронное строение атома – Основы электроники
Любое вещество состоит из очень маленьких частиц, называемых атомами. Атом—это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное. Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим
ОПРЕДЕЛЕНИЕ:Электрон — это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов, по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны — положительными, а нейтроны — нейтральными (рисунок 1.1).
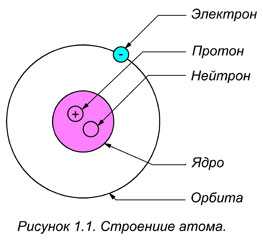
ОПРЕДЕЛЕНИЕ: Протон — мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1.2).
Теперь разберем строение электронных оболочек атомов. Самая внешняя оболочка называется валентной, а число электронов, содержащееся в ней, называется валентностью. Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра. Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.
Изоляторы, есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Промежуточное положение между изоляторами и проводниками занимают полупроводники , но о них мы поговорим позже
Рассмотрим свойства атома. Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион. Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Похожие материалы:
Добавить комментарий
www.sxemotehnika.ru
Урок 1. Схема строения атомов – HIMI4KA
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.

Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×1023 а.е.м и наоборот 1 а.е.м. = 1,66×10-24 г. Число 6,022×1023 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10-19 | 1,67·10-24 | 1,00728 |
| Нейтрон | 0 | 1,67·10-24 | 1,00866 |
| Электрон | -1,6·10-19 | 9,10·10-28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Как нарисовать атом: простые советы
Атом – это частица. В свою очередь, он состоит из еще более мелких элементов, таких как электрон и протон. Их количество может быть разным, в зависимости от вещества, которое берется. Как нарисовать атом? В общем виде берется круг с более мелкими кругами внутри него. Однако есть и свои нюансы, с которыми лучше ознакомиться. В первую очередь нужно понять, как выглядит атом.
Первые шаги в рисовании атома
Как нарисовать атом поэтапно? Для этого необходимо в первую очередь нарисовать ровный круг. Это будет само тело нашего атома, выбранного в качестве модели для рисунка.
Затем данный круг делят на части. Однако они будут заведомо неравными. То есть горизонтальная линия должна пролегать выше центра нарисованного круга. Затем рисуются и линии, которые пересекают первую изображенную черту. Это своего рода наводящие черты атома. Их можно нарисовать без нажима, так как в дальнейшем их придется стереть.
Рисуем центр фигуры
Как нарисовать атом? Это достаточно просто даже для новичка в рисовании. Внутри круга, который уже изображен, необходимо расположить небольшие круги. Это протоны. Они могут располагаться кучно, при этом находясь друг за другом, а не в ряд. Это придаст рисунку объем.
Затем наступает черед электронов. Это более мелкие частицы. Их рисуют также в виде шаров, но гораздо меньшего размера. Они располагаются вне главного и крупного шара, нарисованного в самом начале. Как нарисовать атом? Получается, что это просто совокупность шаров. Однако на этом рисование не заканчивается.
А что есть вокруг атома?
Чтобы понять, как нарисовать атом, следует определить, каков его внешний вид. Электроны, то есть мелкие шары, которые были нарисованы в предыдущем пункте, движутся вокруг протонов, то есть более крупных кругов. Поэтому у них есть своя траектория или путь. Он изображается в виде эллипсов, которые проходят через электроны. Эллипсы – это маршрут мелких частиц.
Эти вытянутые овалы располагают через основной круг, перекрещивая между собой. В среднем могут получиться около трех таких кругов. Если нарисовать окружности так, чтобы они пересекали электроны, сложно, то можно сначала нарисовать эти пути, а уже на них расположить электроны.
Теперь можно подтереть все карандашные наброски, выделить четкой линией то, что должно остаться, а сам атом раскрасить.
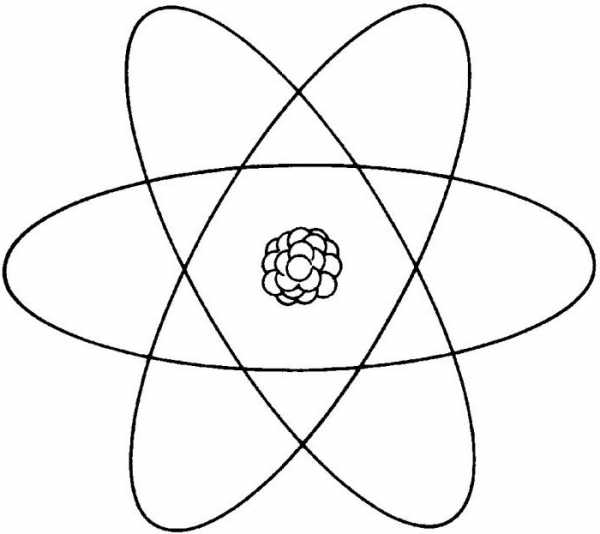
В общем смысле рисунок атома – это сборище маленьких кругов, кружащих вокруг центра из более крупных шаров. Это и есть наш атом, и теперь все знают, как нарисовать его. Раскрасить его можно так, как душе угодно!
fb.ru
Строение атомов | Физика
Удивительный малыш
Каждый человек, каждое живое существо, а также любой неодушевленный предмет вокруг нас состоит из атомов. Атомы — это “кирпичики”, из которых строится вся материя. Термин “атом” происходит от греческого слова “атомос”, означающего “неделимый”, – то есть неделимое первовещество.

Услышав “атомная физика”, многие приходят в ужас и трепет. В действительности же это бесконечно увлекательная область, которая может надолго захватить воображение. Первые исследователи атомов шли трудным, а иногда и ложным путем. Лучшим физикам того времени приходилось решать сложнейшие проблемы, поскольку атомы чрезвычайно малы. Сегодня наши познания значительно расширились: например, известно, что сами атомы тоже состоят из “кирпичиков”, еще более мелких, и поэтому не являются неделимыми в строгом смысле слова.
К этому вопросу мы еще вернемся, а сейчас зададим себе другой вопрос:
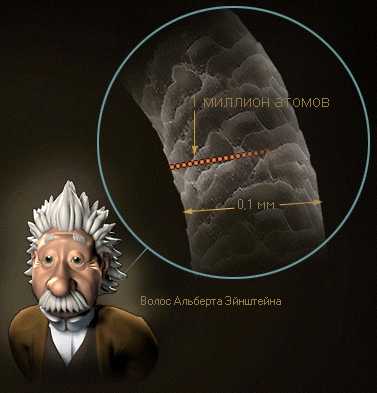
Насколько мал атом? Чтобы составить представление о его невероятно малых размерах, посмотрим на человеческий волос, скажем, Альберта Эйнштейна. Его толщина — около 0,1 мм. Если разделить эту величину на десять, получится одна сотая миллиметра — невооруженным глазом мы уже ничего не различим. Если поделить толщину волоса на миллион, получим диаметр одного атома. Выходит, толщине человеческого волоса соответствует цепочка из одного миллиона атомов.
Эту величину — 10 в минус десятой степени метра — называют ангстремом в честь шведского физика Андерса Ангстрема.
Ядро и оболочка
Каждый атом имеет оболочку из электронов. Они вращаются вокруг атомного ядра, которое находится в центре. Невероятно, но ядра, в зависимости от атома, бывают в 10000 и даже в 100000 раз меньше электронных оболочек. Если бы атом увеличился до размеров футбольного стадиона, ядро выглядело бы как горошина. Самое поразительное — что в этом ядре сосредоточена почти вся масса атома, а пространство между ядром и оболочкой ничем не заполнено.

Если плотно заполнить игральный кубик атомными ядрами, без оболочек, то он весил бы невероятно много — как полмиллиона авиалайнеров, по 350 000 кг каждый.

В природе существует более 100 химических элементов. Их атомы имеют различные массы и самые разные свойства, однако все они построены по одному принципу. Ядро состоит их так называемых нуклонов, которые представлены положительно заряженными протонами и электрически нейтральными нейтронами. Как мы уже знаем, оболочка образована электронами. Они имеют отрицательный заряд. Их количество всегда соответствует количеству протонов в ядре. Поскольку заряды протонов и электронов уравновешивают друг друга, в целом атом является электрически нейтральным.
Простейший атом — атом водорода, ядро которого состоит из единственного протона, а оболочка, соответственно, из единственного электрона.
Дальше идет атом гелия: в нем два протона и, следовательно, два электрона; к тому же ядро содержит еще два нейтрона.
Атом лития состоит из трех протонов, трех электронов и, кроме того, четырех нейтронов.
Атом кислорода имеет восемь протонов, восемь электронов и восемь нейтронов.

Уран — весьма тяжелый элемент: его ядро состоит из 235 нуклонов, из которых 143 являются нейтронами, а 92 — протонами. Электронов, естественно, тоже 92. Они располагаются на разных уровнях, образуя строгую систему.
phscs.ru



