Схема строения атома 3 периода – , . . . / /
- ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода
- 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
- Строение электронных оболочек атомов элементов первых четырех периодов периодической системы Д. И. Менделеева – ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ – ХИМИЯ – УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
- ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
- ядро, электронная оболочка. Схемы строения атома на примере трех химических элементов первых трех периодов.
- Строение атома | 8 класс
ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода
скачать Билет № 17-
Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода. -
Опыт. Проведение реакций, подтверждающих качественный состав выданной кислоты (серной или хлороводородной).
1. ПЛАН ОТВЕТА
-
Строение атома: ядро, электронная оболочка. -
Понятие о химическом элементе. -
Схемы строения атомов на примере химических элементов третьего периода.
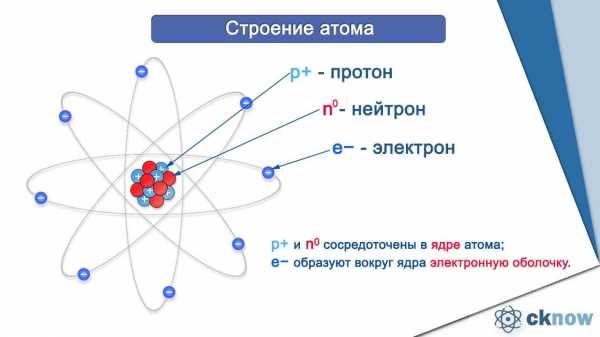
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки.
Ядро образовано протонами и нейтронами.
Протон — это частица, имеющая положительный заряд (+1).
Нейтрон — это нейтральная частица, заряд ее равен 0.
Из определений следует, что величина заряда ядра атома равна числу протонов и имеет положительное значение.
Электронная оболочка образована электронами, заряд у которых отрицательный. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица).
Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
Практически вся масса атома сосредоточена в ядре. Это связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают).
Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
На каждом электронном слое может располагаться определенное число электронов:
на первом — не больше двух,
на втором — не больше восьми,
на третьем — не больше восемнадцати.
Число электронных слоев определяется по номеру периода, в котором расположен химический элемент.
Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента.
Так, например, кислород расположен во втором периоде VI группы. Из этого следует, что у него два электронных слоя и на внешнем (втором) расположено шесть электронов.
Электронные слои заполняются у атомов постепенно, по мере увеличения общего числа электронов, которое соответствует порядковому номеру химического элемента. В сумме на первых двух электронных слоях может располагаться не более 10 электронов, т. е. элементом, завершающим второй период, является неон (Ne).
У атомов третьего периода в атоме находится три электронных слоя. Первый и второй электронные слои заполнены электронами до предела. Для первого представителя элементов третьего периода натрия схема расположения электронов в атоме выглядит так:
Na
2 8 1
Из схемы видно, что атом натрия имеет заряд ядра + 11. Электронную оболочку атома составляют 11 электронов. На первом электронном слое находится два электрона, на втором — восемь, а на третьем — один электрон. У магния, как элемента II группы этого периода, на внешнем электронном слое находится уже два электрона:
Mg
2 8 2
Для остальных элементов периода изменение строения атома происходит аналогично. У каждого последующего элемента, в отличие от предыдущего, заряд ядра больше на одну единицу и на внешнем электронном слое расположено на один электрон больше. Число электронов, располагающихся на внешнем электронном слое, равно номеру группы.
Завершает период аргон. Заряд его ядра +18. Это элемент VIII группы, поэтому на внешнем электронном слое его атома находится восемь электронов:
Ar
2 8 8
Далее можно сделать выводы и об изменении свойств элементов в периоде.
Любой период (кроме первого) начинается типичным металлом. В третьем периоде это натрий Na. Далее следует магний Mg, также обладающий ярко выраженными металлическими свойствами. Следующий элемент в периоде — алюминий А1. Это ам-фотерный элемент, проявляющий двойственные свойства (и металлов и неметаллов). Остальные элементы в периоде — неметаллы: кремний Si, фосфор Р, хлор С1. И заканчивается период инертным газом аргоном Аг.
Таким образом, в периоде происходит постепенное ослабление металлических свойств и возрастание свойств неметаллов. Такое изменение свойств объясняется увеличением числа электронов на внешнем электронном слое: от 1—2, характерных для металлов, и заканчивая 5—8 электронами, соответствующими элементам-неметаллам.
2. ОПЫТ
Серная и хлороводородная кислоты при диссоциации в водном растворе образуют ионы Н+, Сl–, SO42-
НС1 Н+ + Сl–
H2S04 2Н+ + SO4
-
Реактивом на ион Н+ служит раствор индикатора: лакмус краснеет, а метиловый оранжевый — розовеет. -
Реактивом на сульфат-ион SO42- является ион Ва2+ . Если к серной кислоте добавить раствор хлорида бария, то выпадет белый осадок сульфата бария:
ВаС12 + H2SO4 = BaSO4↓ + 2НС1
Ва2+ + SO42-= BaSO4↓
3. Реактив на хлорид-ион Сl– — растворимые соли серебра, например нитрат AgN03. При их взаимодействии образуется белый осадок хлорида серебра:
AgNO3 + НС1 = AgCl↓ + HNO3
Ag+ + Сl– = AgCl↓
nenuda.ru
1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Видеоурок: Строение атома: Строение электронных оболочек
Лекция: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Строение атома
 XX столетие является временем изобретения “модели строения атома”. Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
XX столетие является временем изобретения “модели строения атома”. Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) – 15.
Итак, атом состоит из протонов (p+), нейтронов (n0) и электронов (e–). Протоны и нейтроны образуют ядро атома, оно имеет положительный заряд. А электроны, совершающие перемещения вокруг ядра, «конструируют» электронную оболочку атома, имеющую отрицательный заряд.
Сколько электронов в атоме? Это легко узнать. Достаточно посмотреть порядковый номер элемента в таблице.
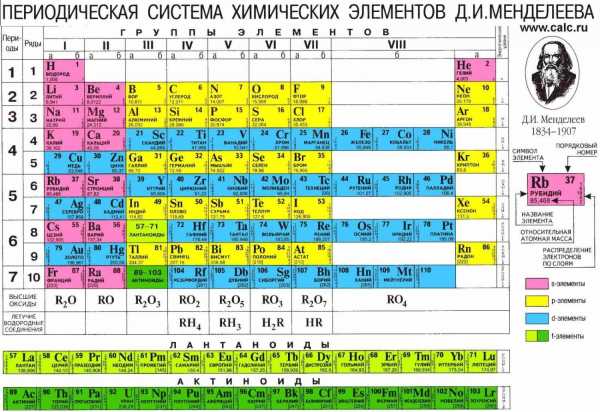
Так, число электронов фосфора равно 15. Количество электронов, содержащихся в оболочке атома, строго равно числу протонов, содержащихся в ядре. Значит и протонов в ядре атома фосфора 15.
Масса протонов и нейтронов, составляющих массу ядра атома, одинакова. А электроны меньше в 2000 раз. Это означает что вся масса атома сосредоточена в ядре, массой электронов пренебрегают. Массу ядра атома мы также можем узнать из таблицы. Посмотрите изображение фосфора в таблице. Внизу мы видим обозначение 30, 974 – это и есть масса ядра фосфора, его атомная масса. При записи мы округляем эту цифру. Исходя из сказанного, запишем строение атома фосфора следующим образом:
(внизу слева написали заряд ядра – 15, вверху слева округленное значение массы атома – 31).
Ядро атома фосфора:
(внизу слева пишем заряд: протоны имеют заряд равный +1, а нейтроны не заряжены, то есть заряд 0; вверху слева масса протона и нейтрона, равная 1 – условная единица массы атома; заряд ядра атома равен числу протонов в ядре, значит р=15, а число нейтронов нужно посчитать: из атомной массы вычесть заряд, т.е. 31 – 15 = 16).
Электронная оболочка атома фосфора включает в себя 15 отрицательно заряженных электронов, уравновешивающих положительно заряженные протоны. Поэтому, атом – электронейтральная частица.
Энергетические уровниРис.1
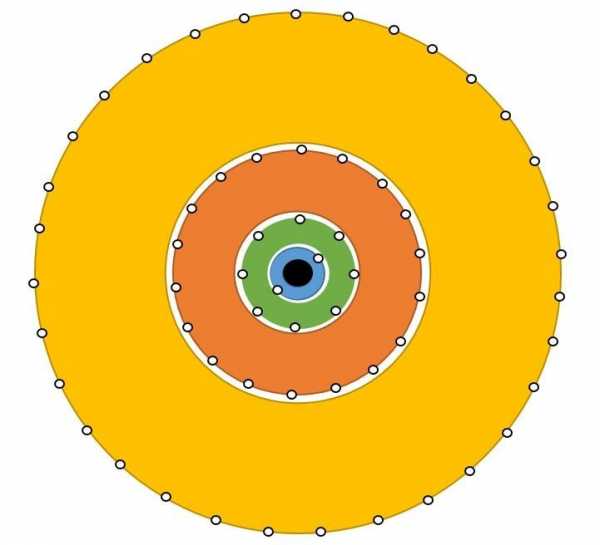 Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие – то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие – то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Вы можете заметить, как по мере удаления от ядра увеличивается объем слоя. Следовательно, чем дальше слой от ядра, тем больше в нем электронов.
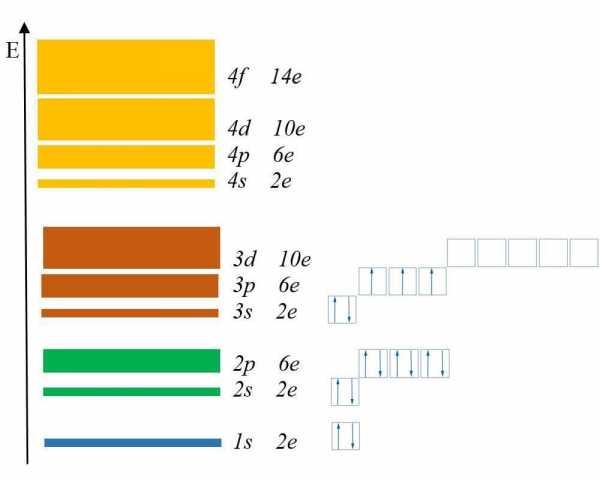
Электронный слой, содержит в себе электроны, сходные по показателям энергии. Из – за этого, такие слои нередко именуют энергетическими уровнями. Сколько же уровней может содержать атом? Количество энергетических уровней равно номеру периода в таблице Менделеева Д.И. в котором находится элемент. К примеру, фосфор (Р) находится в третьем периоде, значит атом фосфора имеет три энергетических уровня. Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня.
Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня. Получим, что первый уровень содержит всего 2 электрона, второй – 8, третий – 18, четвертый – 32.
Каждый энергетический уровень содержит в себе подуровни. Их буквенные обозначения: s-, p-, d- и f-. Посмотрите на рис. 2:Здесь изображены подуровни. Е – это энергия (вспомните, что она возрастает по мере удаления электрона от ядра).
Разным цветом обозначены энергетические уровни, а полосками разной толщины подуровни.
Самый тонкий подуровень обозначается буквой s. 1s – это s-подуровень первого уровня, 2s – это s-подуровень второго уровня и так далее.
На втором энергетическом уровне появился p-подуровень, на третьем – d-подуровень, а на четвертом f-подуровень.
Запомните увиденную закономерность: первый энергетический уровень включает одну s-подуровень, второй два s- и p- подуровня, третий три s-, p- и d-подуровня, а четвертый уровень четыре s-, p-, d- и f-подуровня.
На s-подуровне могут находится только 2 электрона, на p-подуровне- максимум 6 электронов, на d-подуровне – 10 электронов, а на f-подуровне до 14 электронов.
Электронные орбитали
Область (место) где может находится электрон называется электронным облаком или орбиталью. Имейте ввиду, что говорится о вероятной области нахождении электрона, поскольку скорость его движения в сотни тысяч раз больше скорости движения иглы швейной машинки. Графически эта область изображается в виде ячейки:
В одной ячейке может находится два электрона. Судя по рисунку 2 можно сделать вывод о том, что s-подуровень, включающий не более двух электронов может содержать только одну s-орбиталь, обозначается одной ячейкой; p-подуровень имеет три р-орбитали (3 ячейки), d-подуровень пять d-орбиталей (5 ячеек), а f-подуровень семь f-орбиталей (7 ячеек).
Форма орбитали зависит от орбитального квантового числа (l – эль) атома. Атомный энергетический уровень, берет начало с s – орбитали, имеющей l = 0. Представленная орбиталь имеет сферическую форму. На уровнях, идущих после s – орбитали, образуются p – орбитали с l = 1. P – орбитали напоминают форму гантели. Орбиталей, имеющих данную форму, всего три. Каждая возможная орбиталь содержит в себе не больше 2 – ух электронов. Далее располагаются более сложного строения d-орбитали (l = 2), а за ними f-орбитали (l = 3).
Рис. 3 Форма орбиталей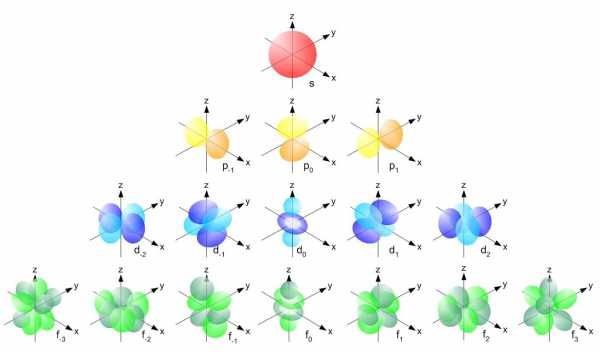 Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:Если же в орбитали два электрона, то они имеют два направления: стрелкой вверх и стрелкой вниз, т.е. электроны разнонаправленны:
Такое строение электронов называется валентным.
Существуют три условия наполнения атомных орбиталей электронами:
1 условие: Принцип минимального количества энергии. Заполнение орбиталей начинается с подуровня, имеющего минимальную энергию. Согласно данному принципу подуровни заполняются в таком порядке: 1s22s22p63s23p6 4s23d104p65s24d105р66s25d14f14… Как мы видим, в некоторых случаях электрону энергетически выгоднее занять место в подуровне вышележащего уровня, хотя подуровень нижележащего уровня не заполнен. Например, валентная конфигурация атома фосфора выглядит так:
Рис. 4
2 условие: Принцип Паули. Одна орбиталь включает 2 электрона (электронную пару) и не больше. Но возможно и содержание всего одного электрона. Его именуют неспаренным.
3 условие: Правило Хунда. Каждую орбиталь одного подуровня сначала заполняют по одному электрону, затем в них добавляются по второму электрону. В жизни мы видели аналогичную ситуацию, когда незнакомые пассажиры автобуса сначала занимают по одному все свободные сидения, а потом рассаживаются по два.
Электронная конфигурация атома в основном и возбужденном состоянии
Энергия атома, находящегося в основном состоянии, наименьшая. Если атомы начинают получать энергию из вне, к примеру, когда вещество нагревается, то они из основного состояния переходят в возбужденное. Этот переход возможен при наличии свободных орбиталей, на которые могут переместиться электроны. Но это временно, отдавая энергию, возбужденный атом возвращается в своё основное состояние.
Закрепим полученные знания на примере. Рассмотрим электронную конфигурацию, т.е. сосредоточение электронов по орбиталям атома фосфора в основном (невозбужденном состоянии). Еще раз обратимся к рис. 4. Итак, вспомним, что атом фосфора имеет три энергетических уровня, которые изображаются полудугами: +15)))
Распределим, имеющиеся 15 электронов на эти три энергетических уровня:Такие формулы называются электронными конфигурациями. Есть еще электронно – графические, они иллюстрируют размещение электронов внутри энергетических уровней. Электронно – графическая конфигурация фосфора выглядит так: 1s2 2s2 2p6 3s2 3p3 (здесь большие цифры – это номера энергетических уровней, буквы – это подуровни, а маленькие цифры – количество электронов подуровня, если их сложить, получится число 15).
В возбужденном состоянии атома фосфора 1 электрон переходит с 3s-орбитали на 3d-орбиталь, а конфигурация выглядит так: 1s2 2s2 2p6 3s1 3p33d1.cknow.ru
Строение электронных оболочек атомов элементов первых четырех периодов периодической системы Д. И. Менделеева – ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ – ХИМИЯ – УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Строение электронных оболочек атомов элементов первых четырех периодов периодической системы Д. И. Менделеева
Элементы первого периода
Схема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронная формула атома водорода (читается: один-эс-один):
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем 2 электрона.
Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь.
Элементы второго периода
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем 8 электронов.
Элементы третьего периода
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-подуровни (табл. 1).
Таблица 1
Строение электронных оболочек атомов элементов третьего периода
Схема электронного строения | Электронная формула | Графическая электронная формула |
11Na Натрий | ||
13Al Алюминий | ||
У атома магния достраивается 3s-электронная орбиталь. Na и Mg — s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar — р-элементы. s- и p-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са — s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr — р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: 5s → 4d → 5р. И также встречаются исключения, связанные с «провалом» электронов, у 41Nb, 42Мо, 44Ru,45Rh, 46Pd, 47Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55Cs и 56Ва — 6s-элементы; 57La … 6s25d1 — 5d-элемент; 58Се — 71Lu — 4f-элементы; 72Hf – 80Hg — 5d-элементы; 81Тl – 86Rn — 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf7 и nf14.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока (рис. 4):
1. s-элементы. Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
2. p-элементы. Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
3. d-элементы. Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
4. f-элементы. Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Рис. 4. Блоки химических элементов
Электронная конфигурация атома. Основное и возбужденное состояния
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки. Этот принцип носит название принципа Паули. Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами.
На рис. 5 показана схема подразделения энергетических уровней на подуровни.
Рис. 5. Схема подразделения энергетических уровней
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины при этом по принципу Паули будут уже противоположно направленными.
compendium.su
| Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки. – Посмотреть другие материалы » |
geum.ru
ядро, электронная оболочка. Схемы строения атома на примере трех химических элементов первых трех периодов.
Билет 15. 1. Строение атома: ядро, электронная оболочка. Схемы строения атома на примере трех химических элементов первых трех периодов.
Ответы:
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки. Ядро образовано протонами и нейтронами. Протон — это частица, имеющая положительный заряд (+1). Нейтрон — это нейтральная частица, заряд ее равен 0. Из определений следует, что величина заряда ядра атома равна числу протонов и имеет положительное значение. Электронная оболочка образована электронами, заряд у которых отрицательный. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица). Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента. Далее следует отметить, что практически вся масса атома сосредоточена в ядре. Это связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают). Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой. На каждом электронном слое может располагаться определенное число электронов: на первом — не больше двух, на втором — не больше восьми, на третьем — не больше восемнадцати. Число электронных слоев определяется по номеру периода, в котором расположен химический элемент. Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента. Так, например, кислород расположен во втором периоде VI группы. Из этого следует, что у него два электронных слоя и на внешнем (втором) расположено шесть электронов. Электронные слои заполняются у атомов постепенно, по мере увеличения общего числа электронов, которое соответствует порядковому номеру химического элемента. В сумме на первых двух электронных слоях может располагаться не более 10 электронов, т. е. элементом, завершающим второй период, является неон (Ne). У атомов третьего периода в атоме находится три электронных слоя. Первый и второй электронные слои заполнены электронами до предела. Для первого представителя элементов третьего периода натрия схема расположения электронов в атоме выглядит так: Из схемы видно, что атом натрия имеет заряд ядра +11. Электронную оболочку атома составляют 11 электронов. На первом электронном слое находится два электрона, на втором — восемь, а на третьем — один электрон. У магния, как элемента II группы этого периода, на внешнем электронном слое находится уже два электрона: Для остальных элементов периода изменение строения атома происходит аналогично. У каждого последующего элемента, в отличие от предыдущего, заряд ядра больше на одну единицу и на внешнем электронном слое расположено на один электрон больше. Число электронов, располагающихся на внешнем электронном слое, равно номеру группы. Завершает период аргон. Заряд его ядра +18. Это элемент VIII группы, поэтому на внешнем электронном слое его атома находится восемь электронов: Далее можно сделать выводы и об изменении свойств элементов в периоде. Любой период (кроме первого) начинается типичным металлом. В третьем периоде это натрий Na. Далее следует магний Mg, также обладающий ярко выраженными металлическими свойствами. Следующий элемент в периоде — алюминий А1. Это ам-фотерный элемент, проявляющий двойственные свойства (и металлов и неметаллов). Остальные элементы в периоде — неметаллы: кремний Si, фосфор Р, хлор С1. И заканчивается период инертным газом аргоном Аг. Таким образом, в периоде происходит постепенное ослабление металлических свойств и возрастание свойств неметаллов. Такое изменение свойств объясняется увеличением числа электронов на внешнем электронном слое: от 1 — 2, характерных для металлов, и заканчивая 5 — 8 электронами, соответствующими элементам-неметаллам.
cwetochki.ru
Строение атома | 8 класс
Вариант 1
1. Какое строение имеют атомы химических элементов?
В центре атома находится положительно-заряженное ядро, которое состоит из протонов и нейтронов, а вокруг ядра перемещаются электроны в соответствии с определенными законами.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах бора (массовое число 11), меди (массовое число 63) и олова (массовое число 118).
3. Напишите электронные формулы атомов азота и алюминия.
4. Напишите не менее трех символов химических элементов, у которых не внешнем энергетическом уровне находится четыре электрона. Изобразите схему строения атома и электронную формулу одного из них.
Вариант 2
1. Укажите различия в строении атомов типичных металлов и типичных неметаллов.
Атомы типичных металлов имеют на валентном уровне 1-2 электрона (элементы I и II А групп, кроме H и He), а типичных неметаллов – более 4 электронов.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах кальция (массовое число 40), кислорода (массовое число 16) и серебра (массовое число 107).
3. Напишите электронные формулы атомов фтора и кремния.
4. Электронная формула атома элемента 1s2 2s2 2p6 3s1. Какой это элемент? Напишите формулы оксида и гидроксида данного элемента.
Na. Na2O – оксид натрия, NaOH – гидроксид натрия.
Вариант 3
1. Что общего в строении атомов химических элементов, расположенных в одной А-группе?
Одинаковое количество электронов на внешнем энергетическом уровне.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах углерода (массовое число 12), цинка (массовое число 64) и брома (массовое число 79).
3. Напишите электронные формулы атомов лития и хлора.
4. Напишите не менее трех символов химических элементов, у которых на внешнем энергетическом уровне находятся пять электронов. Изобразите схему строения атома и электронную формулу одного из них.
Вариант 4
1. Что общего в строении атомов химических элементов, расположенных в одном периоде?
У атомов, расположенных в одном периоде одинаковое число энергетических уровней.
2. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах фтора (массовое число 19), калия (массовое число 39) и золота (массовое число 197).
3. Напишите электронные формулы атомов магния и кислорода.
4. Электронная формула атома элемента 1s2 2s2 2p6 3s2 3p4. Какой это элемент? Напишите для данного элементы формулы высшего оксида и летучего соединения с водородом.
S. SO3 – оксид серы (VI), H₂S – сероводород.
superhimik.ru



