Температура физика формула – Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко
- Комментариев к записи Температура физика формула – Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко нет
- Советы абитуриенту
- Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Абсолютная температура – понятия и формулы
- Температура и теплота | Физика
- Тепловое движение. Температура
- Измерение температуры | Физика
- Температура и ее измерение | Физика
- Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
Температура – это просто!
Температура
Температура – это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры – термометр.
Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах – это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
– используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
– точность измерения от 0,003 oС до 0,02oС
– интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях.
Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k – постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
– введена английским физиком У. Кельвином
– нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы – это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура – 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа – основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Заметьте, здесь концентрация молекул также одинакова!
Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. – Взаимодействие молекул. Строение твердых тел, жидкостей и газов. – Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
Абсолютная температура – понятия и формулы
Очень часто в повседневной жизни мы пользуемся такими понятиями как тепло, горячо, холодно, характеризуя степень нагретости тел. Это субъективный подход, который зависит от наших ощущений. Количественно выразить степень нагретости тел можно с помощью физической величины называемой температурой. А как точно определить температуру? Для этого существуют приборы называемые термометрами, в основу положена зависимость температуры от какой-либо величины, например давления, объема и состояния теплового равновесия.
Термодинамическое равновесие
Температура характеризует состояние теплового равновесия системы тел. Если привести в соприкосновение два тела разной температуры, то тела начнут обмениваться энергией. Тела с большей кинетической энергией будут передавать свою энергию телам с меньшей кинетической энергией. Через какое-то время этот обмен энергией прекратиться, наступит термодинамическое (тепловое) равновесие, в котором тела могут находиться сколь угодно долго. В этом состоянии температура тел одинакова.
Галилео Галилей, итальянский ученый высказал мысль о механической природе тепла, в 1597 году он построил первый термометр. Термометр состоял из стеклянного шара с трубкой, выходящей из него. Трубка опускалась в воду, которая поднималась по ней вверх. При нагревании или охлаждении воздуха в шаре столбик воды или опускался или поднимался вверх. Этот термометр был несовершенным, так как высота столбика воды зависела не только от температуры, но и от давления воздуха.
Во всех других созданных позднее термометрах использовалась жидкости. Но, было замечено, что в отличие от жидкостей, разряженные газы расширяются и меняют давление в зависимости от температуры одинаково. Опытным путем для разряженных газов, находящихся в состоянии теплового равновесия было определено, что
Где T – абсолютная температура
k = 1,38*10-23Дж/К – постоянная Больцмана. Названа так в честь австралийского физика, одного из основателей МКТ теории газов, Людвига Больцмана.
Благодаря данной зависимости возникла возможность создать температурную шкалу, не зависящую от рода вещества и использовать ее для измерения температуры. Ввел ее английский физик Уильям Томсон, титулованный в 1892 г. за работы в области физики лорд Кельвин.
Эту шкалу называют абсолютной (термодинамической) шкалой температур или шкалой Кельвина. За нулевую точку (абсолютный нуль температуры) по этой шкале принята точка соответствующая самой низкой теоретически возможной температуре, «наименьшая или последняя степень холода». Ее существование было предсказано Ломоносовым. Температуре Т=0 по шкале Кельвина, соответствует по шкале Цельсия
Для перехода от шкалы Кельвина к шкале Цельсия применяют соотношение Т = t + 273,15. Разности температур по шкале Кельвина и Цельсия равны.
fizikatyt.ru
Температура и теплота | Физика
В старину на Руси сведения о погоде записывали так: «1657 год, Генваря, 30-го дня, пяток. День был до обеда холоден и ведрен, а после обеда оттепелен, в ночи было ветрено». В то время еще не было термометров. Если требовалось отметить температуру воздуха в зимний день, то записывали так: «Мороз мал» или «Мороз лютый».
Первые термометры появились лишь в начале XVII века. Как не похожи они были на наши, современные! Это можно видеть на рисунке 107, на котором изображен первый термометр Галилея, и рисунке 108, на котором изображен первый медицинский термометр. Но и после появления первых термометров еще не было введено понятие о градусе, не установлена начальная точка отсчета температуры.
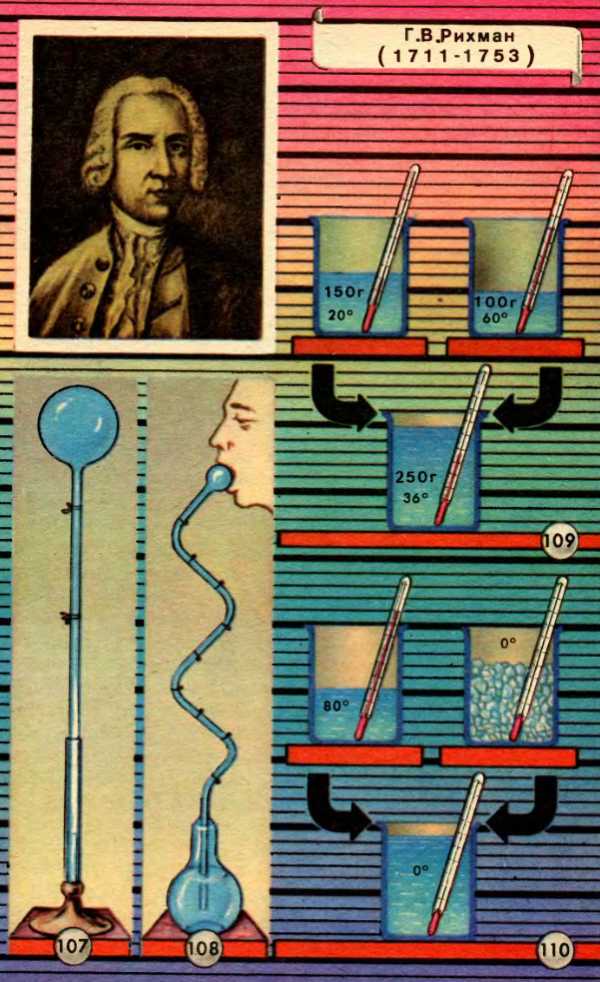
Первое представление о температуре не было достаточно четким, и не всегда понятие «температура» отличали от понятия, получившего название «количество теплоты».
Перенесемся мысленно более чем на два столетия назад в конференц-зал Петербургской Академии наук. 14 декабря 1744 года. На дворе изрядный мороз, оконные стекла покрыты толстым слоем ледяных узоров, но в зале тепло и многолюдно. Присутствует на заседании и Михаил Васильевич Ломоносов. Его коллега и друг, профессор экспериментальной физики Георг Рихман читает доклад на тему «Размышление о количестве теплоты, которое должно получаться при смешении жидкостей, имеющих определенные градусы теплоты». Доклад начинался так: «Милостивые Государи! После того как 12 октября 1744 года в академической конференции было прочитано рассуждение преславного Крафта о тепле и холоде, я исследовал остроумно найденную им формулу для количества или градуса теплоты в жидких смесях…»
Рихман имел в виду найденную Крафтом опытным путем формулу для определения температуры смеси двух порций воды:
где a и b — массы этих порций, m и n — их температуры (рис. 109).
Рихман показал, что формула Крафта пригодна лишь для небольших порций воды, в противном случае отклонения фактической температуры смеси от расчетной становятся слишком значительными. Рихман предложил свою формулу для определения температуры смеси однородных жидкостей, которая затем перешла в учебники физики под названием «формулы Рихмана»:
Следует отметить, что Рихман в отличие от Крафта решил задачу не для двух порций воды, а для любого числа их. Мы привели сокращенную формулу только для двух порций воды.
Однако Рихман согласно господствовавшей в то время теории теплорода считал, что теплота есть некоторая материальная сущность, «тепловая материя», которая равномерно распределяется в данном объеме.
Рихман не разграничивал понятия «температура» и «количество теплоты». Это видно из приведенного вступления к его докладу. И температуру, и количество теплоты он обозначал одинаково: Calor (доклад был написан и зачитывался по-латыни). Не знал Рихман и единицы для измерения количества теплоты. И все же именно работа Рихмана положила начало точным количественным расчетам в области теплотехники. Но чтобы перейти к этим расчетам, надо было сделать еще один шаг. Этот шаг был сделан английским химиком Блэком (1727-1799).
История науки мало знает таких опытов, как следующий опыт Блэка. Согласно формуле Рихмана температура смеси двух равных порций одного и того же вещества, взятых при различных температурах, должна равняться средней арифметической между двумя данными температурами. Если температура равных порций воды до смешения были 80°C и 0°C, то температура смеси должна быть (80°C + 0°C) / 2 = 40°C, что и наблюдалось на опыте. Но когда Блэк смешал порцию горячей воды при 80°C с равной порцией льда при 0°C (рис. 110), он, к огромному своему удивлению, увидел, что температура смеси (после таяния льда) получилась не 40°C, а 0°C! «Тающий лед, – писал Блэк, – принимает в себя много тепла, но все действие последнего ограничивается только превращением льда в воду, которая нисколько не нагревается против бывшей температуры льда. При этом тепло как бы поглощается водой или скрывается в ней и термометр не обнаруживает его присутствия». Процесс плавления льда казался химику Блэку своего рода химической реакцией: лед + теплород = вода.
Вы получите немалое удовольствие и приобретете полезные знания, если повторите этот опыт Блэка, а также проведете следующие опыты.
Опыт 1. Возьмите два одинаковых сосуда. В один положите лед при 0°C, в другой налейте такое же количество воды при 0°C и по термометру наблюдайте за постепенным их нагреванием в комнате (при температуре воздуха около 20°C). Если через ¼ ч вода нагреется до 4°C (это зависит, конечно, от массы взятой воды, приведенное время лишь примерное), то весь лед растает (т. е. превратится в воду при 0°C) лишь через 5 ч.
Подумайте, как на основании этих данных вычислить теплоту плавления льда.
Опыт 2. (По описанию Блэка.) «Я взял два одинаковых сосуда с плоским дном и поставил их на горячую плиту, налив 8 унций (1 унция равна примерно 28,35 г) воды при 20°C. Оба сосуда начали кипеть через 3½ мин, и через 18 мин вся вода выкипела». Вычислите теплоту парообразования воды.
Вы можете повторить опыт, пользуясь одним сосудом. Постарайтесь объяснить причину расхождения между значением теплоты парообразования воды, вычисленным их опыта и приводимым в учебнике физики.
Опыты Блэка со льдом и водой, естественно, подводили к вопросу: не требуют ли различные вещества для нагревания на одно и то же число градусов различного количества теплоты?
В опыте по определению температуры смеси двух порций воды Блэк одну из порций заменил ртутью и установил, что «ртуть обладает меньшей емкостью по отношению к тепловой материи, чем вода».
Блэк точно разграничивал понятия «количество теплоты» и «температура». Он писал: «Когда мы говорим о распределении теплоты, всегда нужно различать количество теплоты и силу теплоты (по современной терминологии температуру) и не смешивать эти две величины».
Название единицы количества теплоты «калория» появилось лишь в 1852 году во Франции. В других странах, где метрическая система распространилась позже, термин «калория» появился тоже значительно позднее. В России термин «калория» стали применять лишь в 90-х годах прошлого столетия.
Теория теплорода, ложная в своей основе, сыграла в истории науки и положительную роль: она способствовала развитию учения о тепловых процессах, без чего немыслимо и их техническое использование. Теория теплорода отмерла, но, умирая, она оставила нам терминологию. Прогрессивные в прошлом термины «количество теплоты», «теплоемкость», «скрытая теплота» уже не соответствуют современному взгляду на тепловые процессы как на изменения внутренней энергии тела. Эти термины препятствуют правильному пониманию физической сущности тепловых явлений. Употребляя эти термины, авторы учебников физики обычно разъясняют их условное значение.
Постепенно и калория исчезает из употребления и заменяется другими общепринятыми единицами энергии: джоулями и киловатт-часами. (1 кал = 4,19 Дж = 1,16 * 10-3 Вт * ч.)
phscs.ru
Тепловое движение. Температура
Тепловое движение и температура. Постоянная Больцмана
В тепловом движении участвуют все молекулы вещества, поэтому с изменением характера теплового движения изменяется и состояние вещества, его свойства. Так, при повышении температуры вода закипает, превращаясь в пар. Если понижать температуру, вода замерзает и из жидкости превращается в твёрдое тело.
Температура является мерой интенсивности теплового движения молекул и характеризует состояние теплового равновесия системы макроскопических тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Температуру измеряют термометром. В любом термометре используется изменение какого-либо макроскопического параметра в зависимости от изменения температуры.
Единицей измерения температуры в системе единиц СИ является градус Кельвина (К). Формула перехода от шкалы Цельсия к шкале температур Кельвина (абсолютной шкале) имеет вид:
где температура по шкале Цельсия.
Минимальной температуре соответствует нуль по абсолютной шкале. При абсолютном нуле тепловое движение молекул прекращается.
Чем выше температура тела, тем больше скорости теплового движения молекул, а, следовательно, тем большей энергией обладают молекулы тела. Таким образом, температура служит мерой кинетической энергии теплового движения молекул.
Средняя квадратичная скорость движения молекул
Средняя квадратичная скорость движения молекул вычисляется по формуле:
где постоянная Больцмана, Дж/К.
Средняя кинетическая энергия движения одной молекулы
Средняя кинетическая энергия движения одной молекулы:
Физический смысл постоянной Больцмана заключается в том, что эта постоянная определяет связь между температурой вещества и энергией теплового движения молекул этого вещества.
Важно отметить, что средняя энергия теплового движения молекул зависит только от температуры газа. При данной температуре средняя кинетическая энергия поступательного хаотического движения молекул не зависит ни от химического состава газа, ни от массы молекул, ни от давления газа, ни от объема, занимаемого газом.
Примеры решения задач
ru.solverbook.com
Измерение температуры | Физика
Термометры. Для измерения температуры можно воспользоваться изменением любой макроскопической величины в зависимости от температуры: объема, давления, электрического сопротивления и т. д.
Чаще всего на практике используют зависимость объема жидкости (ртути или спирта) от изменения температуры. При градуировке термометра обычно за начало отсчета (0) принимают температуру тающего льда; второй постоянной точкой (100) считают температуру кипения воды при нормальном атмосферном давлении (шкала Цельсия). Шкалу между точками 0 и 100 делят на 100 равных частей, называемых градусами (рис. 25). Перемещение столбика жидкости на одно деление соответствует изменению температуры на 1° C.
Так как различные жидкости расширяются при нагревании не совсем одинаково, то установленная таким образом шкала будет до некоторой степени зависеть от свойств жидкости. 0 и 100° C будут, конечно, совпадать у всех термометров, но, скажем, 50° C совпадать не будут.
Какое же вещество выбрать, для того чтобы избавиться от этой зависимости? Было замечено, что в отличие от жидкостей все разреженные газы – водород, гелий, кислород – расширяются при нагревании одинаковым образом и одинаково меняют свое давление при изменении температуры. По этой причине в физике для установления рациональной температурной шкалы используют изменение давления определенного количества разреженного газа при постоянном объеме или изменение объема газа при постоянном давлении. Такую шкалу иногда называют идеальной газовой шкалой температур. При ее установлении удается избавиться еще от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчета, т. е. нулевой температуры. Ведь за начало отсчета вместо температуры таяния льда с тем же успехом , можно было бы взять температуру кипения воды.
Сейчас мы подробно рассмотрим, как можно использовать разреженные газы для определения температуры.
Газы в состоянии теплового равновесия. Возьмем несколько сосудов, заполненных различными газами, например водородом, гелием и кислородом. Сосуды имеют определенные известные объемы и снабжены манометрами. Это позволяет измерять давление в каждом из сосудов.
Количество газа ν в любом сосуде тоже известно. Тем самым известно и число молекул N в каждом сосуде. Согласно формулам (1.3), (1.7)
где NA – постоянная Авогадро, m – масса газа, а M – его малярная масса.
Приведем газы в состояние теплового равновесия. Для этого поместим сосуды в тающий лед и подождем, пока не установится равновесие и давление газов перестанет меняться (рис. 26). После этого можно утверждать, что все газы имеют одинаковую температуру 0° C. Но, разумеется, давления газов p, их объемы V и числа молекул N будут различными.
Можно, однако, ожидать, что между p, V, N одного газа и теми же величинами любого другого газа должна существовать связь, если только температуры газов одинаковы. На это указывает основное уравнение молекулярно-кинетической теории
Из курса физики VI класса известно, что, чем быстрее движутся молекулы, тем выше их температура. Естественно предположить, что при тепловом равновесии средние кинетические энергии молекул всех газов одинаковы. А это означает согласно (2.1), что одинаково для всех газов в состоянии теплового равновесия.
Конечно, это пока лишь предположение, нуждающееся в экспериментальной проверке. Такую проверку можно произвести, зная V и N всех газов и измеряя их давления при определенной температуре, например при температуре тающего льда.
Так, если 1 моль водорода занимает объем Vh3 = 0,1 м3, то при температуре 0° C его давление оказывается равным ph3 = 22,65 * 103 Па. Отсюда
Такое же значение отношения произведения давления газа на его объем к числу молекул получается и для всех других газов при температуре тающего льда. Обозначим это отношение через Θ0. Тогда
Таким образом, наше предположение оказалось верным.
Правда, соотношение (2.3) не является абсолютно точным. При давлениях в тысячи атмосфер, когда газы становятся весьма плотными, отношение перестает быть строго определенным, не зависящим от занимаемых газами объемов. Оно выполняется для достаточно разреженных газов, когда их можно считать идеальными.
Если все сосуды с газами поместить в кипящую при нормальном атмосферном давлении воду (100° C), то = Θ100 по-прежнему будет одним и тем же для всех газов, но увеличится. Теперь, как показывает опыт,
Можно благодаря этому утверждать, что величина Θ зависит от температуры. Более того, Θ ни от чего, кроме температуры, зависеть не может. Ведь Θ не зависит ни от сорта газа, ни от его объема и давления, ни от числа частиц в сосуде, ни от формы самого сосуда.
Определение температуры. Этот опытный факт позволяет рассматривать величину Θ как естественную меру температуры.
В принципе можно было бы считать температурой саму величину Θ и измерять температуру в энергетических единицах – джоулях. Однако, во-первых, это неудобные для практического использования единицы. 100° C соответствовала бы очень малая величина – порядка 10-21 Дж. А во-вторых, и это главное, уже давно принято измерять температуру в градусах. Будем считать величину Θ прямо пропорциональной температуре T, измеряемой в градусах:
Θ = kT, (2.5)
где k – коэффициент пропорциональности. Тогда
На основании этой формулы устанавливается температурная шкала, не зависящая от выбора вещества, используемого для измерения температуры.
phscs.ru
Температура и ее измерение | Физика
Температура — физическая величина, характеризующая тепловое состояние тел.
В окружающем нас мире происходят различные явления, связанные с нагреванием и охлаждением тел. Их называют тепловыми явлениями. Так, при нагревании холодная вода сначала становится теплой, а затем горячей; вынутая из пламени металлическая деталь постепенно охлаждается и т. д. Степень нагретости тела, или его тепловое состояние, мы обозначаем словами «теплый», «холодный», «горячий». Для количественной оценки этого состояния и служит температура.
Температура — один из макроскопических параметров системы. В физике тела, состоящие из очень большого числа атомов или молекул, называютмакроскопическими. Размеры макроскопических тел во много раз превышают размеры атомов. Все окружающие тела — от стола или газа в воздушном шарике до песчинки — макроскопические тела.
Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения, называют макроскопическими параметрами. К ним относятся объем, давление, температура, концентрация частиц, масса, плотность, намагниченность и т. д. Температура — один из важнейших макроскопических параметров системы (газа, в частности).
Температура — характеристика теплового равновесия системы.
Известно, что для определения температуры среды следует поместить в эту среду термометр и подождать до тех пор, пока температура термометра не перестанет изменяться, приняв значение, равное температуре окружающей среды. Другими словами, необходимо некоторое время для установления между средой и термометром теплового равновесия.
Тепловым, или термодинамическим, равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Это означает, что не меняются объем и давление в системе, не происходят фазовые превращения, не меняется температура.
Однако микроскопические процессы при тепловом равновесии не прекращаются: скорости молекул меняются, они перемещаются, сталкиваются.
Любое макроскопическое тело или группа макроскопических тел —термодинамическая система — может находиться в различных состояниях теплового равновесия. В каждом из этих состояний температура имеет свое вполне определенное значение. Другие величины могут иметь разные (но постоянные) значения. Например, давление сжатого газа в баллоне будет отличаться от давления в помещении и при температурном равновесии всей системы тел в этом помещении.
Температура характеризует состояние теплового равновесия макроскопической системы: во всех частях системы, находящихся в состоянии теплового равновесия, температура имеет одно и то же значение (это единственный макроскопический параметр, обладающий таким свойством).
Если два тела имеют одинаковую температуру, между ними не происходит теплообмен, если разную — теплообмен происходит, причем тепло передается от более нагретого тела к менее нагретому до полного выравнивания температур.
Измерение температуры основано на зависимости какой-либо физической величины (например, объема) от температуры. Эта зависимость и используется в температурной шкале термометра — прибора, служащего для измерения температуры.
Действие термометра основано на тепловом расширении вещества. При нагревании столбик используемого в термометре вещества (например, ртути или спирта) увеличивается, при охлаждении — уменьшается. Использующиеся в быту термометры позволяют выразить температуру вещества в градусах Цельсия (°С).
А. Цельсий (1701-1744) — шведский ученый, предложивший использовать стоградусную шкалу температур. В температурной шкале Цельсия за нуль (с середины XVIII в.) принимается
температура тающего льда, а за 100 градусов — температура кипения воды при нормальном атмосферном давлении.
Поскольку различные жидкости расширяются с повышением температуры по-разному, то температурные шкалы в термометрах с разными жидкостями различны.
Поэтому в физике используют идеальную газовую шкалу температур,основанную на зависимости объема (при постоянном давлении) или давления (при постоянном объеме) газа от температуры.
ibrain.kz
Физика. Закон, формула, лекция, шпаргалка, шпора, презентация, доклад, ГДЗ, решебник, конспект, кратко
Термодинамика изучает процессы, происходящие с макроскопическими системами, и их свойства, связанные с превращением энергии. Состояние макроскопической системы описывается такими параметрами, как объём, давление, температура.
Среди параметров, характеризующих состояние термодинамической системы, температура является особым параметром.
Температура — параметр, характеризующий состояние термодинамического равновесия, её значение во всех частях равновесной системы одинаково.
Это свойство отличает температуру от других параметров состояния, например объёма или давления. Их значения в состоянии теплового равновесия со временем также не изменяются, но не являются одинаковыми во всех частях равновесной системы. К примеру, если из холодного помещения внести в тёплую комнату пустую стеклянную бутылку, плотно закрытую пробкой, то через некоторое время температура бутылки, воздуха в ней и в комнате выровняется и останется одинаковой и неизменной при отсутствии внешних воздействий. Однако давление воздуха в бутылке будет больше, чем давление воздуха в комнате. Оно будет оставаться таким сколь угодно долго при отсутствии внешних воздействий. Таким образом, если температура одинакова для всех тел термодинамической системы, находящейся в равновесном состоянии, то значения других параметров — давления и объёма — могут быть разными для тел, входящих в систему. Материал с сайта http://doklad-referat.ru
Закон термодинамического равновесия и приведённое понятие температуры составляют содержание нулевого закона термодинамики.
На этой странице материал по темам:Краткое по физике сообщение о температуре
Доклад температура
Что такое температура?
doklad-referat.ru



