Химия строения атома – Лекция № 3 “Строение атома и периодическая система химических элементов” – Лекции по химии – Студентам – Каталог файлов
- Комментариев к записи Химия строения атома – Лекция № 3 “Строение атома и периодическая система химических элементов” – Лекции по химии – Студентам – Каталог файлов нет
- Советы абитуриенту
- Строение электронных оболочек атома: что такое нейтрон, протон и электрон
- Теория строения атома – Периодический закон и теория строения атома – Общая химия – Химия
- Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов
- Строение атома – ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ – ХИМИЯ – УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
- Атом в химии – это… Модель атома. Строение атома
- Родоначальник атомарной теории
- Как рассуждал Демокрит?
- От Демокрита к современным представлениям
- Учение Д. И. Менделеева
- Открытие Дальтона
- Экспериментальные подтверждения делимости атомов
- Изюм и пудинги
- Опыты Кюри
- «Планетарный» подход
- К каким выводам пришел Резерфорд?
- Парадоксы теории
- Учение Бора
- Постулаты Бора
- Модель атома Нильса Бора
- Квантовая теория строения атома
- Основоположники квантовой механики
- Некоторые выводы
- Современное представление о строении атома
- Доклад – Строение атома – Химия
- 1. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Строение электронных оболочек атома: что такое нейтрон, протон и электрон
Само слово «атом» впервые упоминалось в трудах философов Древней Греции, и в переводе оно означает «неделимый». Не имея современных приборов, философ Демокрит, используя логику и наблюдательность, пришел к выводу, что любое вещество не может дробиться бесконечно, и в итоге должна остаться какая-то неделимая мельчайшая частица вещества – атом вещества.
И если бы не было атомов, то любое вещество или предмет можно было уничтожить полностью. Демокрит стал основоположником атомистики – целого учения, которое основывалось на понятии об атоме.
Что такое атом?
Атом – это наименьшая электронейтральная частица любого химического элемента. Он состоит из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Положительно заряженное ядро – это сердцевина атома. Оно занимает мизерную часть пространства в центре атома, и в нем сосредоточены почти вся масса атома и весь положительный заряд.
Из чего состоит атом?
Составляют ядро атома элементарные частицы – нейтроны и протоны, а по замкнутым орбиталям вокруг атомного ядра движутся электроны.
Что такое нейтрон?
Нейтрон (n) представляет собой элементарную нейтральную частицу, относительная масса которой составляет 1,00866 атомной единицы массы (а.е.м.).
Что такое протон?
Протон (р) представляет собой элементарную частицу, относительная масса которой составляет 1,00728 атомной единицы массы, положительным зарядом +1 и спином 1/2. Протон ( переводится с греческого как основной, первый) относится к барионам. В ядре атома число протонов равно порядковому номеру химического элемента в Периодической системе Д.И. Менделеева.
Что такое электрон?
Электрон ( е–) представляет собой элементарную частицу, масса которой составляет 0,00055 а.е.м.; условный заряд электрона: — 1. Количество электронов в атоме равняется заряду ядра атома (соответствует порядковому номеру химического элемента в Периодической системе Менделеева).
Вокруг ядра электроны двигаются по орбиталям, которые строго определены и образуется электронное облако.
Область пространства вокруг атомного ядра, где с вероятностью более 90% присутствуют электроны, определяет форму электронного облака.
Электронное облако р-электрона по внешнему виду напоминает гантель; на трех р-орбиталях по максимуму могут находиться лишь шесть электронов.
Электронное облако s-электрона представляет собой сферу; на s-энергетическом подуровне максимальное количество электронов, которые могут там находиться – это 2.
Изображают орбитали в виде квадрата, снизу или сверху него прописывают значения главного и побочного квантовых чисел, которые описывают эту орбиталь.
Данная запись носит название графическая электронная формула. Она выглядит следующим образом:
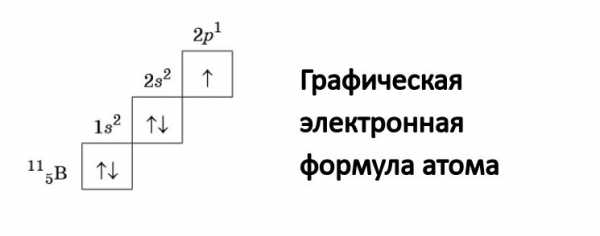
С помощью стрелок в данной формуле обозначают электрон. Направление стрелки соответствует направлению спина – это собственный магнитный момент электрона. Электроны, имеющие противоположные спины (на картинке это направленные в противоположные стороны стрелочки), получили название спаренные.
Электронные конфигурации атомов элементов можно представить в виде формул, в которых:
- Указывают символы подуровня;
- Степень у символа показывает число электронов данного подуровня;
- Коэффициент, стоящий перед символом подуровня обозначает его принадлежность к данному уровню.
Определение числа нейтронов
Для определения числа нейтронов N в ядре нужно воспользоваться формулой:
N=A-Z, где А – массовое число; Z – заряд ядра, который равняется числу протонов (порядковому номеру химического элемента в таблице Менделеева).
Как правило, параметры ядра записывают так: сверху – массовое число, а слева внизу от символа элемента прописывают заряд ядра.
Это выглядит так:
Данная запись обозначает следующее:
- Массовое число равняется 31;
- Заряд ядра (и как следствие, и число протонов) для атома фосфора равняется 15;
- Число нейтронов равно 16. Его высчитывают так: 31-15=16.
Массовое число примерно соответствует относительной атомной массе ядра. Это вызвано тем, что массы нейтрона и протона практически не имеют отличий.
Строение атомов первых десяти химических элементов таблицы Менделеева
Ниже мы представили часть таблицы, в которой приведено строение электронных оболочек атомов первых двадцати элементов Периодической системы химических элементов Д.И. Менделеева. Полная таблица электронных формул атомов представлена в отдельной нашей публикации.
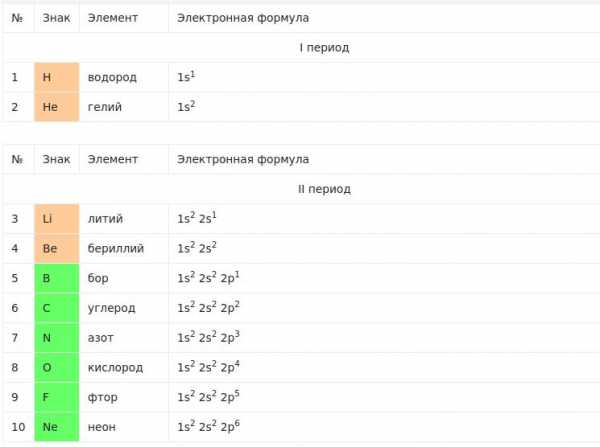
Химические элементы, в атомах которых происходит заполнение р-подуровня, носят название р-элементы. Электронов может быть от 1 до 6.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется 1 или 2 электронами получили название s-элементы.
Число электронных слоев в атоме химического элемента равняется номеру периода.
Правило Хунда
Существует правило Хунда, в соответствии с которым электроны располагаются на однотипных орбиталях одного энергетического уровня так, чтобы совокупный спин был максимально возможным. Это означает, что, когда энергетический подуровень заполняется, каждый электрон сначала занимает отдельную ячейку, и лишь потом запускается процесс их соединения.
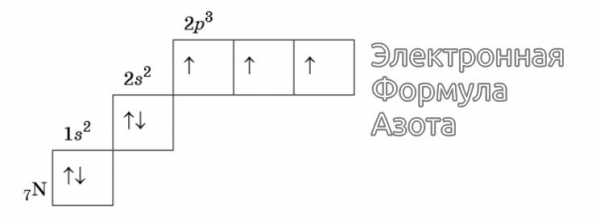
Изображение электронной формулы Азота в графическом виде
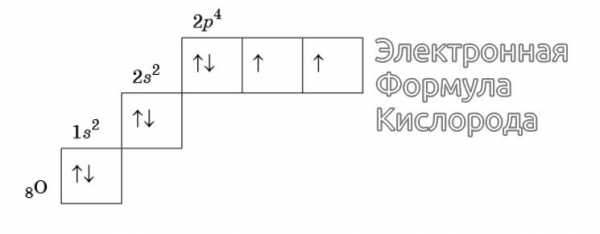
Изображение электронной формулы Кислорода в графическом виде
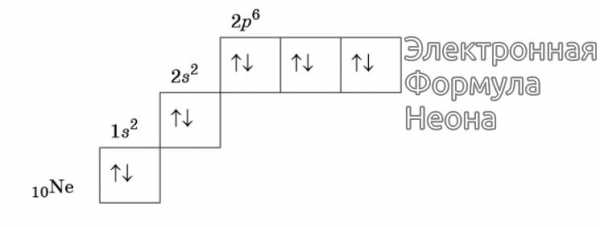
Изображение электронной формулы Неона в графическом виде
К примеру, у атома азота все р-электроны будут занимать отдельные ячейки, а у кислорода начнется их спаривание, которое завершится в полной мере у неона.
Что такое изотопы
Изотопы – это атомы одного и того же элемента, которые в своих ядрах содержат одинаковое количество протонов, но число нейтронов будет различное. Изотопы известны для всех элементов.
По этой причине атомные массы элементов в периодической системе представляют собой среднее значение из массовых чисел природных смесей изотопов и имеют отличия от целочисленных значений.
Есть ли что-то меньше ядра атома
Подведем итоги. Атомная масса природных смесей изотопов не может служить главнейшей характеристикой атома, и, как следствие, и элемента.
Подобной характеристикой атома будет являться заряд ядра, который определяет строение электронной оболочки и количество электронов в ней. Это интересно! Наука не стоит на месте и ученые смогли опровергнуть догму о том, что атом является самой маленькой частицей химических элементов. Сегодня мир знает кварки – из них состоят нейтроны и протоны.
www.sciencedebate2008.com
Теория строения атома – Периодический закон и теория строения атома – Общая химия – Химия
Теория строения атома
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.Строение атомных ядер
Ядра атомов состоят из элементарных частиц двух видов: протонов (p) и нейтронов (n). Сумма протонов и нейтронов в ядре одного атома называется нуклонним числом:,
где А – нуклонне число, N – число нейтронов, Z – число протонов.
Протоны имеют положительный заряд (+1), нейтроны заряда не имеют (0), электроны имеют отрицательный заряд (-1). Массы протона и нейтрона примерно одинаковы, их принимают равными 1. Масса электрона намного меньше чем масса протона, поэтому в химии ею пренебрегают, считая, что вся масса атома сосредоточена в его ядре.
Число положительно заряженных протонов в ядре равно числу отрицательно заряженных электронов, то атом в целом електронейтральний.
Атомы с одинаковым зарядом ядра составляют химический элемент.
Атомы различных элементов называются нуклидами.
Изотопы – атомы одного и того же элемента, имеющие разное нуклонне число вследствие разного количества нейтронов в ядре.
Изотопы Водорода
| Название | A | Z | N |
| Протий Н | 1 | 1 | 0 |
| Дейтерий D | 2 | 1 | 1 |
| Тритий T | 3 | 1 | 2 |
Радиоактивный распад
Ядра нуклидов могут распадаться с образованием ядер других элементов, а также , или других частиц.Спонтанный распад атомов некоторых элементов называется радіоактивністю, а такие вещества – радиоактивными. Радиоактивность сопровождается испусканием элементарных частиц и электромагнитных волн – излучениег.
Уравнение ядерного распада– ядерные реакции – записываются следующим образом:
Время, за которое распаду подвергается половина атомов данного нуклида, называется периодом полураспада .
Элементы, состоящие только из радиоактивных изотопов, называются радиоактивнымы. Это элементы 61 и 84-107.
Виды радиоактивного распада
1) -розпад. Излучаются -частицы, т.е. ядра атома Гелия . При этом нуклонне число изотопа уменьшается на 4, а заряд ядра-на 2 единицы, например:2) -розпад.В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электроны и антинейтрино. Во время -распада нуклонне число не изменяется, а заряд ядра увеличивается на 1, например:
3) -розпад. Возбужденное ядро испускает лучи с очень малой длиной волны, при этом энергия ядра уменьшается, нуклонне число и заряд ядра не изменяются, например:
Строение электронных оболочек атомов элементов первых трех периодов
Электрон имеет двойственную природу: он может вести себя и как частица, и как волна. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части вокруг ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятно нахождение электрона, называется орбіталлю.Каждый электрон в атоме находится на определенном расстоянии от ядра согласно запаса его энергии. Электроны с более-менее одинаковой энергией формируют энергетические рівни, или электронные слойи.
Число заполненных электронами энергетических уровней в атоме данного элемента равно номеру периода, в котором он расположен.
Число электронов на внешнем энергетическом уровне равно номеру группы, вкоторой расположен данный элемент.
В пределах одного энергетического уровня электроны могут отличаться формой электронной облакови, или орбитали. Существуют такие формы орбиталей:
s-форма:
p-форма:
Существуют также d-, f-орбитали и другие, с более сложной формой.
Электроны с одинаковой формой электронного облака образуют одноименные энергетические підрівни:s-, p-, d-, f-подуровни.
Количество подуровней на каждом энергетическом уровне равно номеру этого уровня.
В пределах одного энергетического подуровня возможен различный распределение орбиталей в пространстве. Так, в трехмерной системе координат для s-орбитали возможно только одно положение:
для р
для d-орбитали – пять, для f-орбитали – семь.
Орбитали изображают:
s-подуровень –
p-подуровень –
d-подуровень –
Электрон на схемах обозначается стрелкой, которая указывает его спин. Под спином понимают вращения электрона вокруг своей оси. Он обозначается стрелкой: или . Два электрона на одной орбитали записываются , но не .
Более двух электронов на одной орбитали находиться не может (принцип Паули).
Принцип наименьшего энергий: в атоме каждый электрон располагается так, чтобы его энергия была минимальной (что соответствует его крупнейшем связи с ядром).
Например, распределение электронов в атоме Хлорав:
Один неспаренный электрон определяет валентность Хлора в таком состоянии – I.
Во время получения дополнительной энергии (облучение, нагревание) возможно розпарування электронов (промотирования). Такое состояние атома называется збудженим. При этом количество неспаренных электронов увеличивается и, соответственно, меняется валентность атома.
Возбужденное состояние атома Хлорв:
Соответственно к числу неспаренных электронов Хлор может иметь валентность III, V и VII.
na-uroke.in.ua
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов
Билет № 3
1. Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома* равен нулю, так как заряды ядра и
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | 1 |
| нейтрон | n | 0 | 1 |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле:
N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень
важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,
на 2-м — 8 e−,
на внешнем уровне — 8 e−; - числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Решение:
- Записываем уравнение реакции: Zn + 2HCl = ZnCl2 + H2↑
- Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) - Находим количество вещества соляной кислоты: n (HCl) = m / M = 146 г / 36,5 г/моль = 4 моль
- Записываем над уравнением реакции имеющиеся данные, а под уравнением — число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
Zn + 2HCl = ZnCl2 + H2↑
2 моль 1 моль - Составляем пропорцию:
4 моль — x моль
2 моль — 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль — 1 моль) - Находим x:
x = 4 моль • 1 моль / 2 моль = 2 моль
Ответ: 2 моль.
автор: Владимир Соколов
staminaon.com
Строение атома – ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ – ХИМИЯ – УНИВЕРСАЛЬНЫЙ СПРАВОЧНИК ШКОЛЬНИКА
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Строение атома
Электроны
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущес твующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (она равна скорости света — 300 000 км/с) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
– ЗАПОМНИ. Молекула — мельчайшая электронейтральная частица вещества, состоящая из химически связанных атомов и определяющая его свойства.
Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Состояние электронов в атоме
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится.
Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего (рис. 1).
Рис. 1. Электронное облако атома водорода
– ЗАПОМНИ. Электронная конфигурация элемента — это запись распределения электронов в его атомах по энергетическим уровням, подуровням и орбиталям.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно 90 % электронного облака, и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей, которые обозначаются латинскими буквами s, р, d и f. Графическое изображение некоторых форм электронных орбиталей представлено на рис. 2.
Рис. 2. Форма s-, р- и d-орбиталей
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, — 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
– ЗАПОМНИ. Элементарные частицы, ядро атома, атом, молекула — объекты микромира.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле
N = 2n2,
где N — максимальное число электронов; n — номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более 8; на третьем — не более 18; на четвертом — не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй — два; третий — три; четвертый — четыре подуровня. Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n2.
– ЗАПОМНИ. Заряд электрона равен -1. В нейтральном атоме число электронов равно числу протонов в ядре атома.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, р, d, f.
Протоны и нейтроны
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной.
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
– ЗАПОМНИ. Заряд протона принят за 1, поэтому заряд ядра равен числу протонов в его составе.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Обозначаются протоны знаком 11р (или р+). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т. е. обозначают нейтроны знаком 0
compendium.su
Атом в химии – это… Модель атома. Строение атома
Мысли о сущности всего окружающего начали посещать человечество задолго до момента расцвета современной цивилизации. Сначала люди размышляли о существовании неких высших сил, которые, как они считали, предопределяли все бытие. Но уже довольно скоро философы и священнослужители начали задумываться над тем, из чего, собственно, состоит сама ткань этого бытия. Теорий было множество, но в исторической перспективе главенствующей стала атомарная.
 Что такое атом в химии? Это, а также все сопутствующие темы мы обсудим в рамках данной статьи. Надеемся, что в ней вы найдете ответы на все интересующие вас вопросы.
Что такое атом в химии? Это, а также все сопутствующие темы мы обсудим в рамках данной статьи. Надеемся, что в ней вы найдете ответы на все интересующие вас вопросы.
Родоначальник атомарной теории
С чего начинается первый урок химии? Строение атома – вот главная тема. Вы наверняка помните, что слово «атом» переводится с древнегреческого языка как «неделимый». Сейчас многие историки считают, что первым выдвинул теорию, гласившую о неких мельчайших частицах, из которых состоит все сущее, Демокрит. Он жил еще в пятом веке до нашей эры.
К величайшему сожалению, об этом выдающемся мыслителе практически ничего не известно. До нас не дошел ни один письменный источник тех времен. А потому об идеях величайшего ученого своего времени нам приходится узнавать исключительно из трудов Аристотеля, Платона, а также других древнегреческих мыслителей.
Итак, наша тема – “Строение атома”. По химии не все имели высокие оценки, но многие помнят о том, что все выводы древних ученых были построены исключительно на умозаключениях. Демокрит исключением не был.
Как рассуждал Демокрит?
Логика его была предельно проста, но вместе с тем гениальна. Представьте, что у вас есть самый острый нож во всем мире. Вы берете яблоко, к примеру, а затем начинаете его разрезать: на две половинки, на четвертинки, их снова делите… Словом, рано или поздно вы получите ломти такой мизерной толщины, что дальше их делить уже будет нельзя. Вот это и будет неделимый атом. В химии это утверждение считалось истинным едва ли не до конца 19 века.
От Демокрита к современным представлениям
Следует заметить, что от древнегреческих представлений о микромире сохранилось одно только слово «атом». Сейчас каждый школьник знает, что окружающий нас мир состоит из куда более фундаментальных и мелких частиц. Кроме того, с точки зрения современной науки теория Демокрита была не более чем чисто гипотетической выкладкой, не подкрепленной ровным счетом никакими доказательствами. Впрочем, в те времена не было электронных микроскопов, так что доказать свою правоту иными способами у мыслителя бы все равно не получилось.
Первые подозрения о том, что Демокрит на самом деле прав, появились у химиков. Они быстро обнаружили, что многие вещества в ходе реакций распадаются на более простые компоненты. Кроме того, именно химики вывели строгие закономерности данных процессов. Так, они обратили внимание, что для получения воды требуется восемь массовых долей кислорода и одна – водорода (закон Авогадро).
В Средние века любое материалистическое учение, в том числе и теория Демокрита, распространения и развития получить не могло в принципе. И только в XVIII веке ученые вновь возвращаются к атомистической теории. К тому времени химик А. Лавуазье, наш великий М. В. Ломоносов и талантливейший английский физик Д. Дальтон (о котором мы поговорим отдельно), уже убедительно доказали своим коллегам реальность существования атомов. Следует подчеркнуть, что даже в просвещенном 18 веке долгое время атомарная теория многими выдающимися умами того времени всерьез не рассматривалась.
Как бы там ни было, но даже эти великие ученые еще не выдвигали теорий о строении самого атома, так как он считался единой и неделимой частицей, основой всего сущего.
К сожалению, химические опыты не могли наглядно доказать реальность превращения атомов одних веществ в другие. Но все же основополагающей наукой в изучении строения атомов стала именно химия. Атомы и молекулы долгое время изучались одним гениальным русским ученым, без которого нельзя представить себе современную науку.
Учение Д. И. Менделеева
 Огромную роль в становлении атомарного учения сыграл Д. И. Менделеев, который еще в 1869 году создал свою гениальную периодическую систему. Впервые научному сообществу была представлена теория, которая не только не отвергала, но и разумно дополняла все предположения материалистов. Уже в 19 веке ученые смогли доказать существование электронов. Все эти выводы заставили лучшие умы 20-го века серьезно изучить атом. В химии это время также было ознаменовано множеством открытий.
Огромную роль в становлении атомарного учения сыграл Д. И. Менделеев, который еще в 1869 году создал свою гениальную периодическую систему. Впервые научному сообществу была представлена теория, которая не только не отвергала, но и разумно дополняла все предположения материалистов. Уже в 19 веке ученые смогли доказать существование электронов. Все эти выводы заставили лучшие умы 20-го века серьезно изучить атом. В химии это время также было ознаменовано множеством открытий.
Но учение Менделеева ценно не только этим. До сих пор остается неясным, как именно формировались атомы различных химических элементов. Но великий русский ученый смог убедительно доказать, что все они без исключения состоят в близком родстве друг с другом.
Открытие Дальтона
Но суметь интерпретировать множественные разрозненные данные смог только Джон Дальтон, имя которого навеки запечатлено в открытом им самим законе. Обычно ученый исследовал только поведение газов, но круг интересов у него был намного шире. В 1808 году он приступил к публикации своей новой фундаментальной работы.
Именно Дальтон предположил, что каждому химическому элементу соответствует определенный атом. Но ученый, как и Демокрит за много веков до него, все же полагал, что они являются полностью неделимыми. В его черновиках немало схематичных рисунков, на которых атомы представлены в виде простых шариков. Эта идея, зародившаяся более 2500 лет назад, просуществовала едва ли не до нашего времени! Впрочем, только сравнительно недавно было открыто действительно глубокое строение атома. Химия (9 класс в частности) даже сегодня во многом руководствуется теми идеями, которые были впервые озвучены в 18 веке.
Экспериментальные подтверждения делимости атомов
Впрочем, до конца 19 века практически все ученые считали, что атом – тот предел, за которым ничего нет. Они думали, что основой всего мироздания является именно он. Этому способствовали различные эксперименты: как ни крути, но изменялись только лишь молекулы, в то время как с самими атомами веществ не происходило ровным счетом ничего, чего бы не смогла объяснить простейшая химия. Строение атома углерода, к примеру, остается совершенно неизменным даже в разных аллотропных состояниях.
Словом, долгое время не было ровным счетом никаких экспериментальных данных, которые хотя бы косвенно подтверждали подозрения некоторых ученых о том, что имеются какие-то более фундаментальные частицы. Только в 19 веке (не в последнюю очередь благодаря опытам супругов Кюри) было доказано, что в определенных условиях атомы одних элементов могут превращаться в другие. Эти открытия легли в основу современных представлений об окружающем нас мире.
Изюм и пудинги
В 1897 году Дж. Томсоном, английским физиком, было установлено, что в любом атоме имеется некое количество отрицательно заряженных частиц, которые он же назвал «электронами». Уже в 1904 году ученый создал первую атомарную модель, которая более известна под обозначением «пудинг с изюмом». Название вполне точно отражает суть. Судя по теории Томсона, атом в химии – это некий «сосуд» с равномерно распределенным в нем зарядом и электронами.
Заметим, что подобная модель имела хождение даже в 20-м веке. Впоследствии оказалось, что она была совершенно неверной. Но все же это была первая осознанная попытка человека (причем на научной основе) воссоздать окружающий его микромир, предложив модель атома, достаточно простую и наглядную.
Опыты Кюри
Принято считать, что супруги Пьер и Мария Кюри положили начало атомной физике. Конечно же, вклад этих гениальных людей, фактически пожертвовавших своим здоровьем и жизнью, нельзя недооценить, но их опыты имели и куда более фундаментальное значение. Практически одновременно с Резерфордом они доказали, что атом – гораздо более сложная и разнородная структура. Само явление радиоактивности, которое они исследовали, именно об этом и говорило.
 Уже в начале 1898 года Мария публикует первую статью, посвященную радиации. Вскоре Мария и Пьер Кюри доказали, что в смеси хлористых соединений урана и радия начинают появляться другие вещества, в существовании которых сомневалась официальная химия. Строение атома с тех пор начали исследовать вплотную.
Уже в начале 1898 года Мария публикует первую статью, посвященную радиации. Вскоре Мария и Пьер Кюри доказали, что в смеси хлористых соединений урана и радия начинают появляться другие вещества, в существовании которых сомневалась официальная химия. Строение атома с тех пор начали исследовать вплотную.
«Планетарный» подход
Наконец Резерфорд решил произвести бомбардировку атомов тяжелых металлов α-частицами (полностью ионизированный гелий). Ученый сразу же предположил, что легкие электроны никак не смогут поменять траекторию движения частиц. Соответственно, рассеивание могут вызывать только какие-то более тяжелые элементы, которые могут содержаться в ядре атома. Сразу заметим, что изначально Резерфорд никак не претендовал на изменение теории «пудинга». Эта модель атома считалась безукоризненной.
А потому результат, при котором почти все частицы без проблем проходили через тонкий слой серебра, его не удивил. Вот только вскоре выяснилось, что некоторые атомы гелия отклонялись сразу на 30°. Это было совсем не то, о чем говорила в то время химия. Состав атома по Томсону предполагал равномерное распределение электронов. Но этому явно противоречили наблюдаемые явления.
Чрезвычайно редко, но все же некоторые частицы улетали под углом даже 180°. Резерфорд был в глубочайшем недоумении. Ведь это резко противоречило «пудингу», заряд в котором должен был быть (по теории Томсона) распределен равномерно. Следовательно, неравномерно заряженные участки, которые могли бы отталкивать ионизированный гелий, должны были отсутствовать.
К каким выводам пришел Резерфорд?
Эти обстоятельства и натолкнули ученого на мысль, что атом практически пуст и только в центре сосредоточено какое-то образование с положительным зарядом – ядро. Так и возникла планетарная модель атома, постулаты которой следующие:
- Как мы уже и говорили, в центральной части расположено ядро, причем его объем (по отношению к размеру самого атома) ничтожно мал.
- Практически вся атомарная масса, а также весь положительный заряд находятся именно в ядре.
- Вокруг него вращаются электроны. Важно, что их число равно значению положительного заряда.
Парадоксы теории
 Все было бы хорошо, но данная модель атома никак не объясняет их невероятную устойчивость. Следует помнить, что электроны движутся по своим орбитам с огромным ускорением. По всем законам электродинамики такой объект со временем должен утратить свой заряд. Если принимать во внимание постулаты Ньютона и Максвелла, то электроны вообще должны сыпаться на ядро, словно град на землю.
Все было бы хорошо, но данная модель атома никак не объясняет их невероятную устойчивость. Следует помнить, что электроны движутся по своим орбитам с огромным ускорением. По всем законам электродинамики такой объект со временем должен утратить свой заряд. Если принимать во внимание постулаты Ньютона и Максвелла, то электроны вообще должны сыпаться на ядро, словно град на землю.
Конечно, ничего такого в реальности не происходит. Любой атом не только совершенно устойчив, но и может существовать совершенно неограниченное время, причем никакого излучения от него идти не будет. Такое несоответствие объясняется тем, что к микромиру мы пытаемся применять законы, которые действительны только в отношении классической механики. Они же, как оказалось, к явлениям атомарного масштаба неприменимы совершенно. А потому строение атома (химия, 11 класс) авторы учебников стараются объяснить как можно более простыми словами.
Учение Бора
Датским физиком Нильсом Бором было доказано, что на микромир нельзя распространять те же законы, положения которых справедливы для макроскопических объектов. Именно ему принадлежит идея о том, что микромир «руководствуется» исключительно квантовыми законами. Конечно, тогда не существовало самой квантовой теории, но Бор фактически стал ее родоначальником, выразив свои мысли в виде трех постулатов, которые «спасали» атом, неминуемо бы погибший, если бы он «жил» согласно теории Резерфорда. Именно эта теория датчанина легла в основу всей квантовой механики.
Постулаты Бора
- Первый из них гласит: любая атомная система может находиться только в особых атомных состояниях, причем для каждого из них характерно определенное значение энергии (Е). Если состояние атома стационарное (спокойное), то излучать он не может.
- Второй постулат говорит о том, что излучение световой энергии происходит только в случае перехода из состояния с большей энергией в более умеренное. Соответственно, выделяемая энергия равна разнице значений между двумя стационарными состояниями.
Модель атома Нильса Бора
Эту полуклассическую теорию ученый предложил в 1913 году. Примечательно, что в ее основу он положил планетарную модель Резерфорда, который незадолго до него описал атом вещества. Мы уже говорили, что классическая механика противоречила выкладкам Резерфорда: исходя из нее, предполагалось, что со временем электрон должен был обязательно упасть на поверхность атома.
Чтобы «обойти» это противоречие, ученый ввел специальное допущение. Его суть заключалась в том, что излучать энергию (что и должно было приводить к их падению) электроны могут, только двигаясь по каким-то определенным орбитам. При движении же их по другим траекториям якобы химические атомы оставались в пассивном состоянии. Согласно теории Бора таковыми орбитами являлись те, количественный момент движения по которым был равен постоянным Планка.
Квантовая теория строения атома
 Как мы уже говорили, на сегодняшний день в ходу квантовая теория строения атома. Химия последних лет руководствуется исключительно ею. В ее основе лежат четыре основополагающих аксиомы.
Как мы уже говорили, на сегодняшний день в ходу квантовая теория строения атома. Химия последних лет руководствуется исключительно ею. В ее основе лежат четыре основополагающих аксиомы.
1. Во-первых, двойственность (корпускулярно-волновая природа) самого электрона. Проще говоря, ведет себя эта частица и как материальный объект (корпускула), и как волна. Как частица он имеет определенный заряд и массу. Способность же к дифракции роднит электроны с классическими волнами. Длина этой самой волны (λ) и скорость частицы (v) могут быть связаны друг с другом специальным соотношением де Бройля: λ = h / mv. Как можно догадаться, m – масса самого электрона.
2. Координату и скорость частицы замерить с абсолютной точностью совершенно невозможно. Чем точнее определяется координата, тем выше неопределенность в скорости. Как, впрочем, и наоборот. Это явление получило название неопределенности Гейзенберга, которое может быть выражено в виде следующего соотношения: ∆x∙m∙∆v > ћ/2. Дельта Х (∆х) выражает неопределенность положения координаты в пространстве. Соответственно, дельта V (∆v) отображает скоростные погрешности.
3. Вопреки всем ранее распространенным мнениям, электроны не проходят по строго определенным орбитам, как поезда по рельсам. Квантовая теория гласит, что электрон может находиться в любой точке пространства, но вероятность этого различна для каждого отрезка.
Та часть пространства вокруг непосредственно атомного ядра, в которой эта вероятность максимальна, называется орбиталью. Современная химия строение электронных оболочек атомов изучает именно с этой точки зрения. Конечно, в школах учат правильному распределению электронов по уровням, но, по всей видимости, в реальности они расходятся совсем иначе.
4. Ядро атома состоит из нуклонов (протонов и нейтронов). Порядковый номер элемента в периодической системе указывает на количество протонов в его ядре, а сумма протонов и нейтронов равна атомарной массе. Вот как объясняет строение ядра атома химия современности.
Основоположники квантовой механики
 Отметим тех ученых, которые внесли наибольший вклад в развитие столь важной отрасли: французский физик Л. де Бройль, немец В. Гейзенберг, австриец Э. Шредингер, англичанин П. Дирак. Все эти люди впоследствии были удостоены Нобелевской премии.
Отметим тех ученых, которые внесли наибольший вклад в развитие столь важной отрасли: французский физик Л. де Бройль, немец В. Гейзенберг, австриец Э. Шредингер, англичанин П. Дирак. Все эти люди впоследствии были удостоены Нобелевской премии.
Как же далеко в этом плане ушла химия? Строение атома большинство химиков тех лет считали достаточно простым: многие только к 1947 году окончательно признали реальность существования элементарных частиц.
Некоторые выводы
Вообще, при создании квантовой теории не обошлось без математиков, так как все эти процессы можно рассчитать только с использованием сложнейших вычислений. Но самая главная трудность заключается вовсе не в этом. Те процессы, которые описываются данной теорией, недоступны не только нашим органам чувств, несмотря на всю современную научную технику, но и воображению.
Ни один человек даже приблизительно не может представить себе процессы в микромире, так как они совершенно не похожи на все те явления, которые мы наблюдаем в макромире. Вдумайтесь только: последние открытия дают повод предполагать, что кварки, нейтрино и прочие фундаментальные частицы существуют в девятимерном (!) измерении. Как человек, живущий в трехмерном пространстве, может даже приблизительно описывать их поведение?
В настоящий момент нам остается лишь уповать на математику и мощь современных компьютеров, которые, быть может, будут использованы для моделирования микромира. Ощутимо помогает и химия: строение атома наверняка будет пересмотрено, после того как недавно ученые, работающие в этой области, сообщили об открытии нового типа химической связи.
Современное представление о строении атома
Если вы внимательно прочитали все вышеизложенное, то наверняка и сами сможете сказать, каково сегодняшнее представление о строении атомов веществ. Но все же мы поясним: это несколько видоизмененная теория Резерфорда, дополненная бесценными постулатами Нильса Бора. Проще говоря, сегодня считается, что электроны движутся по хаотичным, размытым траекториям возле ядра, которое состоит из нейтронов и протонов. Та часть пространства вокруг него, в которой появление электрона наиболее вероятно, называется орбиталью.
Пока не представляется возможным точно сказать, как будут меняться наши представления о строении атома в дальнейшем. Ежедневно ученые работают над проникновением в тайны микромира: БАК (Большой андронный коллайдер), Нобелевские премии в области физики – все это является результатом данных изысканий.
Но даже сейчас мы не представляем и приблизительной картины того, что еще скрывают атомы. Понятно лишь, что сам атом в масштабах микромира – огромный многоквартирный дом, в котором нами обследован разве что первый этаж, да и то не полностью. Практически ежегодно появляются сообщения о возможности открытия все новых и новых элементарных частиц. Когда процесс исследования атомов будет полностью закончен, сегодня прогнозировать не возьмется никто.
 Достаточно сказать, что наши представления о них начали меняться только с 1947 года, когда были открыты так называемые V-частицы. До этого люди лишь немного углубили теории, на которых с 19 века основывалась химия. Строение атома – увлекательная загадка, разгадыванием которой заняты лучшие умы человечества.
Достаточно сказать, что наши представления о них начали меняться только с 1947 года, когда были открыты так называемые V-частицы. До этого люди лишь немного углубили теории, на которых с 19 века основывалась химия. Строение атома – увлекательная загадка, разгадыванием которой заняты лучшие умы человечества.
fb.ru
Доклад – Строение атома – Химия
Строение атома1. Ядро и электроныРазвитие естествознания на границе XIX-XX веков показало, что помимо химических превращенийсуществует целый ряд процессов, в которых атомы выступают как сложные объекты,состоящие из положительно заряженной части — ядра и отрицательно заряженныхэлектронов, суммарный заряд которых в точности компенсирует заряд ядра. Врезультате работ английского физика Дж. Дж. Томсона и американского физика Р.С.Малликена было установлено, что электрон имеет массу 9,1•1031 кг,или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основнаямасса атома сосредоточена в ядре, которое занимает очень малую часть его объема:диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4диаметра атома. Наглядно это соотношение размеров можно представить себе, еслиувеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместитсявнутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят изположительно заряженных частиц — протонов и незаряженных частиц — нейтронов. Протонимеет заряд, равный заряду электрона, но со знаком плюс, его масса практическиравна массе нейтрона. Отметим, что в химии принято выражать заряды ионов вединицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
/>
Таким образом, число протонов в ядре определяет его заряд ипорядковый номер, а сумма чисел протонов и нейтронов — округленную общую массуядра в атомных единицах, или массовое число атома. Очевидно, что вэлектронейтральном атоме число протонов в атомном ядре равно числу электронов вэлектронной оболочке атома.
2. Атомный номер элемента. изотопыПорядковый номер элемента принято называть его атомнымномером и обозначать буквой Z. Атомный номер лежит воснове систематизации химических элементов и определяет их положение впериодической системе.
При определенном атомном номере, т.е. при определенном числепротонов, в ядре могут находиться разные числа нейтронов, поэтому могутсуществовать отличающиеся по массе разновидности атомов одного и того жеэлемента — изотопы.
Например, природный водород представляет собой смесьизотопов с массовыми числами 1 и 2, а.
/>
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке- 92 электрона
В периодической таблице, элементы расположены в порядкеувеличения заряда ядра, а в отдельных клеточках таблицы принято приводитьсредневзвешенные атомные массы, поэтому они часто сильно отличаются отцелочисленных.
/>
Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электроннойпушки (2). Заряженные пластины (3) и (4) разгоняют поток полученныхположительных ионов, который проходит через щель в пластине (4) и попадает вполе магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд:масса. За второй щелью (в) расположен детектор (7), который регистрирует числочастиц, прошедших через щель. Меняя напряженность магнитного поля, можнопоследовательно регистрировать относительное количество ионов с различноймассой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показаначасть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельныеполосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений массатомов и разделение изотопов стало возможным в результате созданиямасс-спектрометрии — метода, основанного на воздействии магнитного поля нанаправленные пучки заряженных частиц.
3. Ядерная модель атома
Первая модель атома была предложена в начале XX века Э. Резерфордом,новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся сбольшой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношениюк Солнцу. По представлениям классической электромагнитной теории в таком атомеэлектрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Черезкороткое время электрон неизбежно должен упасть на ядро. Это очевидноенесоответствие фактам было не единственным недостатком модели Резерфорда: плавноеизменение энергии электронов в атоме не согласовывалось с появившимисянаблюдениями над спектрами атомов. Одним из достижений второй половины XIX векабыла разработка атомного спектрального анализа — точного и чувствительногометода, сыгравшего важнейшую роль в открытии новых элементов и послужившегоэкспериментальной основой изучения строения атомов. Метод основан на испусканиисвета свободными атомами, получающимися при сильном нагреваний вещества; приэтом атомы переходят из основного состояния с минимальной энергией ввозбужденные состояния с более высокими энергиями.
/>
Возвращаясь в основное состояние, атомы излучают свет. Оказалось,что атомные спектры излучения состоят из отдельных линий, отвечающих толькоопределенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров иустойчивость атомов, знаменитый датский физик Нильс Бор предложил двапостулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зренияклассической механики, допустимы лишь определенные орбиты, по которым электрондвижется не излучая.
Частота поглощаемого или испускаемого атомом излучения припереходе из одного разрешенного состояния в другое определяется разностьюэнергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантованииэнергии. Планк установил, что, хотя свет, испускаемый раскаленным телом,кажется сплошным, световая энергия поглощается или излучается отдельнымипорциями — квантами Е = hv, пропорциональными частоте световогоэлектромагнитного колебания. Коэффициент пропорциональности h= 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образомв науку было введено понятие кванта света, или некоторого светового пакета — фотона,отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергииатома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснениянаблюдаемых энергетических характеристик атомов с двумя и более электронами; главныйже ее недостаток заключался в том, что она не давала логического обоснованияприроды квантования и устойчивости не меняющихся во времени состояний атома. Однако,несмотря на эти недостатки, сами идеи Бора о квантовании и стационарныхсостояниях легли в основу современного описания строения атома с позицийквантовой механики.
4. Волновые свойства электрона
/>
Вскоре после 1920 г. был сделан следующий важный шаг впознании микромира: было установлено, что не только световые кванты, но и любыемикрочастицы, в том числе электроны, обладают двойственной природой — частицыкак таковой и волны.
Например, электрону при скорости3 • 10е м/с отвечает длина волны
/>
В частности, удалось обнаружить дифракцию электронов напериодической решетке кристаллов и на молекулах газов. Частице с массой покоят, движущейся со скоростью v, соответствует длина волныX, которая может быть найдена из уравнения де Бройля: сопоставимая с размерамиатома. В то же время можно говорить и об импульсе и даже о массе движущегосяфотона, хотя, конечно, его масса покоя равна нулю. Это обстоятельствосущественным образом влияет на характер информации, которую дает спектроскопия.При столкновении фотона с электроном меняются импульс фотона и частота света,тем самым давая экспериментатору информацию об импульсе электрона. Однако,поскольку импульсы фотона и электрона сопоставимы, при этом меняется и импульсэлектрона, который надо определить. Ситуация в какой-то степени подобна попыткеизмерить скорость бегуна с помощью наблюдателя, который прыгает ему на плечи сразбега. Математически эти соображения описываются принципом неопределенностиГейзенберга, согласно которому возможность одновременного определения положениямикрочастицы в пространстве и ее импульса ограничена постоянной Планка. Это, вчастности, означает, что если мы хотим определить с большой точностью энергиюэлектрона в атоме, то мы не сможем столь же точно определить его положение поотношению к ядру.
5. Квантово-механическая модель атомаПредставления о стационарных состояниях атома и двойственнойприроде электрона, а также требования принципа неопределенности былииспользованы австрийским физиком Эрвином Шредингером, который в 1926 г. предложилмодель, описывающую электрон в атоме как своего рода стоячую волну, причемвместо точного положения электрона в пространстве рассматривалась вероятностьего пребывания в определенном месте.
Для того чтобы представить себе электрон в виде трехмернойстоячей волны, остановимся сначала на более простой одномерной модели стоячейволны, в качестве которой можно взять струну, закрепленную на концах. Струнаспособна издавать звуки только определенных частот, так как на ее длине можетуложиться лишь целое число полуволн — это и есть квантование энергии колебанийструны. Для описания характера стоячих волн одномерной системы достаточноодного числа п, которое однозначно определяет длину волны и число узловыхточек, в которых струна неподвижна, как и на закрепленных концах.
Моделью двумерной системы, испытывающей стационарныеколебания, может служить круглая мембрана, закрепленная по периметру, например,в телефонной трубке. Здесь также возможны лишь определенные, квантованныеколебания, для описания которых необходимы уже два числа.
Теперь очевидно, что для описания пространственного движенияэлектрона в атоме как трехмерной стоячей волны необходимы и достаточны тричисла, получившие название квантовых чисел. Квантово-механическое описаниеатома не требует никаких дополнительных постулатов, квантование энергии электронаестественным образом возникает из природы самого атома или так называемыхграничных условий, которые сводятся к тому, что электрон не покидает атом испособен двигаться с конечной скоростью.
/>
В волновой механике электрон, как и любая микрочастица,описывается с помощью волновой функции. Его движение определяется уравнением,предложенным Шредингером, — знаменитым уравнением Шредингера. Решением этогоуравнения является волновая функция \|/, которая соответствует разрешеннойэнергии электрона и описывает зависимость амплитуды стационарной волны,соответствующей электрону, от трех его пространственных координат. Квадратволновой функции определяет вероятность пребывания электрона в некоторойпространственной области. Здесь мы как раз встречаемся со случаем точногознания энергии электрона и вероятностного описания его положения в пространстве.Во многих случаях удобно рассматривать электрон как размытое в пространствеоблако отрицательного заряда. Плотность такого электронного облака в любойточке пропорциональна V) /2. Модель электронного облака наглядноописывает распределения электронной плотности в пространстве, хотя онафизически несовершенна, так как одноименно заряженные части облака должныотталкиваться друг от друга, вызывая его рассеивание. На самом же деле электронне отталкивается «сам от себя». Это обстоятельство несколькоограничивает аналогию между электроном и облаком, но не мешает нам говорить обэлектронных облаках во всех случаях, когда мы не интересуемся деталями,связанными с их потенциальной энергией. Представлением об электронных облакахмы будем широко пользоваться в этой книге.
6. Одноэлектронный атом. квантовые числаВ случае атома водорода и одноэлектронных ионов уравнениеШредингера может быть решено точно.
/>
Таким образом может быть получен набор волновых функцийэлектрона или атомных орбиталей. Словом «орбиталь», в отличие от«орбиты», подчеркивается волновая природа электрона. Каждая АОзависит от трех пространственных координат электрона и характеризуетсяопределенными значениями трех квантовых чисел п, I, т.д.ля описанияодноэлектронного атома, в котором электрон принимает участие в единственномвзаимодействии — с ядром, обладающим сферически-симметричным электростатическимполем, удобно использовать не декартову систему координат с переменными х, у,г, а сферическую с переменными.
Для наших целей нет необходимости заниматься математическойстороной решения сложного дифференциального уравнения Шредингера, однако длядальнейших химических выводов важно, что в сферических координатах возможноразделение переменных, и само его решение \j/n приобретает более удобный для дальнейшего анализа вид:
/>
Здесь Rnt — радиальнаясоставляющая волновой функции, зависящая от единственной переменной г — расстоянияэлектрон — ядро и характеризуемая только двумя квантовыми числами п и I, а Ylm — угловаясоставляющая волновой функции, описывающая зависимость распределенияэлектронной плотности от углов 9 и ф, т.е. форму и ориентацию АО, ихарактеризуемая квантовыми числами I и т. Рассмотрим последовательно физическийсмысл квантовых чисел п, I, ти характер различных АО.
Квантовое число п называется главным квантовым числом. Величинап определяет номер электронного слоя: чем меньше п, тем прочнее электрон связанс ядром и тем ближе, в среднем, он находится к ядру. Главное квантовое числоможет принимать целочисленные положительные значения 1, 2, 3 и т.д. Набор АО содинаковым п составляет слой. Основному состоянию атома водорода соответствуетп = 1, при этом Е1 = — 1312 кДж. Такое количество энергии выделится приобразовании одного моля атомов водорода из протонов и электронов, находящихсяна бесконечном удалении друг от друга. В одноэлектронном атоме или водноэлектронном ионе с зарядом ядра Z главное квантовоечисло однозначно определяет энергию электрона Еп:
Еп = — Rtf/a2
Здесь R — постоянный множитель,равный 1312 кДж, если энергия отнесена к 1 молю атомов и заряд Z измеряется в единицах заряда электрона.
Второе квантовое число I называется орбитальным, оноопределяет возможные квантованные величины орбитального момента количествадвижения электрона. Число I может принимать целочисленные значения от 0 до п — 1.
/>
/>
По традиции, сложившейся в процессе изучения атомныхспектров, значения I обычно обозначают буквами: s, р, d, f и далее по английскому алфавитувместо 0, 1, 2, 3 и т.д. Для нас самое главное то, что при описании электрона ввиде облака число I определяет его форму. Так, s-электроныимеют шарообразные, сферически симметричные облака, лишь в этом случае волноваяфункция \|/ не зависит от углов Э и ф; р-электроны {I =1) имеют гантелеобразные облака, d-электроны образуютоблака еще более сложной формы.
Вернемся к уравнению, в котором при RM стоят индексы nl. Как ужеотмечалось, это значит, что первое и второе квантовые числа вместе полностьюопределяют характер радиальной части волновой функции. Рассмотрим, как меняетсяплотность электронного облака с расстоянием от ядра. На рис.2.10 по оси ординатотложена вероятность нахождения электрона в пространстве, заключенном междусферами с радиусами г и г + dr. Из рисунка видно, чтовсе эти кривые, которые называются кривыми радиального распределенияэлектронной плотности, проходят через один или несколько максимумов. Еслимаксимумов несколько, то они разделены узловыми точками, в которых плотностьравна нулю. Последний от ядра максимум — самый большой, главный. Числомаксимумов равно п — I, число узловых точек равно — 1. Таким образом, с учетомуглового и радиального распределения облако, соответствующее ls-электрону,можно представить себе как диффузный шар переменной плотности, имеющей одинмаксимум и постепенно сходящей на нет при удалении от центра. Облако 2″-электронаподобно сфере с двумя сгущениями плотности и т.д.
/>
Видно, что среднее расстояние электрона от ядра существенноразлично для разных атомных орбиталей: оно растет с увеличением п, а при равныхп — с уменьшением I. Чем меньше I при одинаковых п, тем дальше от ядра и темниже главный максимум и тем большая часть электронной плотности находится ближек ядру за счет внутренних максимумов.
Третье квантовое число т — магнитное — определяетнаправление орбитального момента электрона, а с точки зрения моделиэлектронного облака — ориентацию его в пространстве. Магнитное квантовое числоможет принимать целочисленные значения от — I до +1, что соответствует разрешеннымквантовой механикой значениям проекции орбитального момента на заданноенаправление в пространстве. Следует отметить, что определенное направлениеможет быть задано внешним полем — электрическим или магнитным. В отсутствиевнешнего поля все разрешенные ориентации электронного облака равновероятны.
Поскольку облако s-электроновсферически симметрично, вопрос о его ориентации просто не имеет смысла. Вслучае р-электронов возможны три значения магнитного квантового числа — 1,0 и+1 и, соответственно, разрешены три взаимно перпендикулярные ориентациигантелеобразного облака. У d-электронов возможны пятьзначений т, у /электронов — семь.
Итак, три квантовых числа — главное, орбитальное и магнитное- позволяют задать атомную орбиталъ и достаточно подробно охарактеризовать одноэлектронныйатом: мы точно знаем энергию электрона и можем качественно описать электронноеоблако — его форму, ориентацию в присутствии внешнего поля, число сгущенийэлектронной плотности и число внутренних узловых поверхностей, где плотностьсходит к нулю.
Однако тремя квантовыми числами не исчерпываются данные,необходимые для полного описания состояния электрона в атоме. Детальноеисследование атомных спектров показало, что электрон обладает собственныммоментом количества движения, который получил название спинового момента илиспина. При вероятностном описании электрона как стоячей волны или какэлектронного облака спин не имеет классических аналогий — это просто свойствомикрочастиц.
Спин электрона характеризуется спиновым квантовым числом ms, которое может иметь два значения +1/2 и — 1/2,т.е. спин может иметь два противоположных направления.
Таким образом, для полной характеристики состояния электронав атоме необходимы четыре квантовых числа. Первые три из них определяютраспределение его плотности в пространстве, а четвертое — его спин. Знаниесмысла и возможных значений квантовых чисел имеет исключительное значение дляхимика, поэтому ниже мы приводим краткую сводку важнейших сведений такого рода.
/>
Решение уравнения Шредингера для атома водорода позволяет, впринципе, рассчитать его основные характеристики с любой точностью, дажеточнее, чем их дает эксперимент. Наиболее важными экспериментальнымихарактеристиками любых атомов являются энергии отрыва и присоедниенияэлектронов. Энергию отрыва электрона от атома, молекулы или иона не совсемправильно принято называть потенциалом ионизации. Потенциал ионизацииобозначают обычно буквой / и измеряют в электрон-вольтах. Экспериментальноизмеренный потенциал ионизации водорода равен 13,6 эВ* или как раз 1312 кДж.
Другой важной энергетической характеристикой атома являетсясродство к электрону — энергия, которая выделяется при присоединении к немудополнительного электрона. Сродство обычно обозначают буквой А с указаниемчастицы, например для водорода Ан = 73 кДж/моль. Знак «плюс»здесь говорит о том, что атом водорода приобретает второй электрон с выделениемэнергии, образуя ион Н.
7. Многоэлектронные атомыПри переходе от одноэлектронного атома к многоэлектронному вдополнение к взаимодействию электрон — ядро появляется новый тип взаимодействий- электронов друг с другом. Взаимодействие любого электрона с остальнымизависит от состояния каждого электрона и не может быть точно учтено, еслинеизвестны волновые функции всех остальных электронов, которые, в свою очередь,не могут быть рассчитаны, если неизвестно взаимодействие данного электрона состальными. Получается замкнутый круг, который принципиально не дает возможноститочно решить уравнение Шредингера для многоэлектронного атома. Эта трудность, ксчастью, может быть преодолена посредством приближенного решения, суть которогозаключается в следующем. Каждый электрон рассматривается отдельно такимобразом, как будто он находится в одноэлектронном атоме, заряд ядра которогочастично экранирован усредненным сферически-симметричным полем остальныхэлектронов. Отдельный электрон при этом испытывает только кулоновскоепритяжение центра, состоящего из ядра и остальных электронов, т.е. действиенекоторого центрально-симметричного положительного эффективного заряда,меньшего, чем заряд ядра. При таком подходе для многоэлектронных атомовсохраняют смысл понятия атомной орбитали и четырех квантовых чисел, толькоистинный заряд ядра заменяется эффективным.
Рассмотрим для примера с этой точки зрения атом гелия восновном состоянии. Если бы в нем совсем не было межэлектронноговзаимодействия, то оба электрона находились бы на орбитали с п = 1 в полезаряда Z = +2 и по формуле имели бы энергию Е = = — 13,6• 4 = — 54,4 эВ, равную экспериментально определенному потенциалу ионизацииодноэлектронного иона Не+. Другой крайний вариант — идеальноеэкранирование заряда ядра одним электроном по отношению к другому, которыйтогда испытывал бы действие заряда ядра, уменьшенного ровно на единицу, т.е. ядрас Z = +1. Тогда мы получаем точно такую же ситуацию,как в атоме водорода, и потенциал ионизации должен быть равен 13,6 эВ.
Для реального атома гелия истина лежит где-то между этимикрайностями, действительно, его потенциал ионизации составляет 24,6 эВ. Поформуле можно подсчитать заряд Z*, который должениспытывать на себе электрон с этой энергией в одноэлектронном атоме: Z* = ^24,6/13,6 = 1,34. Это и есть тот самый эффективныйзаряд, который действует на каждый электрон в атоме гелия.
В общем случае эффективный заряд ядра Z*- это положительный заряд, который «чувствует» электрон вмногоэлектронном атоме на заданной АО. Пользуясь эффективными зарядами ядер, мыможем оценивать энергию атомных орбиталей в многоэлектронном атоме.
8. Электронная конфигурация атома
Распределение электронов по АО называют электроннойконфигурацией атома. Порядок заполнения АО электронами определяется двумяважнейшими принципами.
Согласно принципу минимума энергии наиболее устойчивому состояниюатома отвечает размещение электронов на орбиталях с наименьшей энергией, т.е. обеспечиваетсяминимум потенциальной энергии системы, состоящей из электронов с ядром.
Согласно принципу Паули любые два электрона в атоме воизбежание бесконечно большого взаимного отталкивания должны отличаться друг отдруга хотя бы одним квантовым числом. Так, если два электрона находятся наодной АО, то они должны иметь противоположные спины.
В соответствии с указанными принципами атом гелия в основномсостоянии имеет электронную конфигурацию Is2,при которой оба электрона находятся на ls-орбитали иимеют противоположные спины. Суммарный спин атома равен нулю. Схематически этуситуацию можно изобразить в виде ячейки с двумя стрелками:
/>
/>
Атом лития, следующий за гелием в периодической системе,содержит три электрона. По принципу минимума энергии два из них расположатся,как и в атоме гелия, на ls-орбитали. Третий электрон всоответствии с принципом Паули должен располагаться на АО с п = 2. Однако такихвозможностей две — 2s — и 2р-орбитали, и электрон будетиметь меньшую энергию на той из них, где он будет испытывать действие болеевысокого эффективного заряда. Рассмотрим с этой точки зрения кривые распределенияэлектронной плотности в атоме лития в зависимости от расстояния от ядра. Изэтих кривых хорошо видно, что замкнутый слой Isрасположен гораздо ближе к ядру, чем основная плотность 2s- или 2р-электрона. Однако внутренний максимум 2в-электрона практическиполностью проникает в ls-электронную плотность вблизкой к ядру области, и определенная часть его плотности «чувствует»на себе почти полный заряд ядра Z=+3. Единственныймаксимум 2р-электрона далек от ядра, а в области сосредоточения ls-электронов находится лишь незначительная его часть. Следовательно,в атоме лития электрон на 2в-орбитали испытывает на себе действие несколькоболее высокого эффективного заряда, он несколько хуже экранирован от ядра ls-электронами, чем электрон на 2р-орбитали, и прочнее связанс ядром. Соответственно, в основном состоянии атом лития будет иметьэлектронную конфигурацию ls22s1, а конфигурация ls22p1 отвечает возбужденному состоянию.
Рассматривая одноэлектронный атом, мы пришли к заключению,что при одинаковых п за счет внутренних максимумов ближе к ядру находитсябольшая часть плотности того электрона, который расположен на орбитали сменьшим значением I. Это в основном и определяет тот важнейший для всей химиифакт, что в одном слое s-электроны испытывают на себесамый большой эффективный заряд, р-электроны — меньший, d-электроны- еще меньше и т.д.
Другими словами, res-электронынаиболее прочно связаны с ядром и находятся на наиболее низком энергетическомуровне, далее следуют яр-электроны, а затем — red-электроны.Таким образом, энергия электронов в многоэлектронных атомах зависит не толькоот п, но и от I; при равных п она возрастает в порядке увеличения I. Порядокзаполнения АО для любого атома описывается эмпирическими правилами Клечковского:
/>
АО заполняются в порядке увеличения суммы п + I. Приодинаковых значениях суммы п + I АО заполняются в порядке увеличения п.
Отметим, что одному и тому же Сочетанию значений п и I могутотвечать несколько атомных орбиталей, различающихся значениями магнитногоквантового числа т. Например, 2р-электрон может находиться в любой из трехячеек с т, равным — 1, 0 или +1:
/>
Во всех этих трех случаях электрон будет иметь одну и ту жеэнергию, но разные волновые функции. В таких случаях говорят, что состояниеэлектрона вырождено.
В данном случае оно трижды вырождено, т.е. три состояния имеютодинаковую энергию. Если в атоме появляется второй р-электрон, гомежэлектронное отталкивание будет минимальным, когда оба электрона находятся вразных ячейках и имеют одинаковые спины.
/>
В общем случае при определении электронной конфигурации основногосостояния атома удобно пользоваться правилом Хунда: минимальной энергииотвечает максимальный суммарный спин.
Например, основному состоянию атома азота отвечаетэлектронная конфигурация:
/>
Указанные принципы позволяют легко определить электроннуюконфигурацию любого атома; для основных состояний электронные конфигурацииатомов приведены в табл.2.1
Энергия электронов, находящихся на различных орбиталяхатома, которую для краткости принято называть энергией атомных орбиталей,показана на рис. в зависимости от атомного номера. При Z= 1 число энергетических уровней соответствует числу значений п. При Z > 1 уровни расщепляются на подуровни с разнымизначениями I, причем энергия подуровней увеличивается в порядке возрастания I. Хотяход отдельных кривых довольно сложен, но в целом он разумно объясняется втерминах эффективных зарядов таким же образом, как и различие 2s — и 2р — подуровней.
Электронные конфигурации атомов восновном состоянии
/>
Возвращаясь к литию, отметим, что этот элемент в какой-тостепени аналогичен водороду из-за того, что его атом содержит один 2в-электрон,и литий легко образует ион Li+. Однакопервый потенциал ионизации лития /i = 5,39 эВсущественно меньше, чем у водорода, здесь уже сказывается рост главногоквантового числа). Поэтому литий легко реагирует с большинством неметаллов,хорошо растворяется в кислотах, теряя электрон и переходя в ион Li*, т.е. проявляет свойства типичного активного металла.
Второй потенциал ионизации лития I2= 75,7 эВ очень велик, так как его ls-электронырасположены гораздо ближе к ядру, чем 2в-электрон. На этом примере хорошо видно,что электроны внутренних замкнутых слоев не распространяются на периферию атомаи настолько прочно связаны с ядром, что, как правило, непосредственно незатрагиваются в химических процессах. В химии оказывается очень полезнымразделение электронов на внешние, или валентные, и внутренние, или основные.«Химическая» роль последних сводится к участию в формированииэффективного заряда, действующего на валентные электроны.
/>
9 ЭлектроотрицательностьИдея эффективного заряда лежит в основе оценки ряда полезныххарактеристик атомов, которыми мы будем широко пользоваться в этой книге. Срединих особенно важна электроотрицательность, которая представляет собойобобщенную характеристику элемента, связанную не с электронами на отдельныхорбиталях, а с внешними электронами вообще. Под электроотрицательностьюпонимают усредненную характеристику способности атома, находящегося всоединении, притягивать электрон. При этом пренебрегают разницей в состоянияхатомов в различных соединениях. В отличие от потенциала ионизации и сродства кэлектрону, электроотрицательность — не строго определенная физическая величина,а полезная условная характеристика.
В табл.2.2 приведены значения электроотрицательности элементовпо шкале Олреда — Рохова, основанной на вычислении силы кулоновскогопритяжения, действующей на внешний электрон. Отметим, что весь диапазонзначений ЭО элементов заключен между 0,9 для наименее электроотрицательныхметаллов 1-й и 2-й групп и 4,1 для наиболее электроотрицательного фтора.
www.ronl.ru
1. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
ɆɈɋɄɈȼɋɄɂɃ ȺȼɌɈɆɈȻɂɅɖɇɈ-ȾɈɊɈɀɇɕɃɂɇɋɌɂɌɍɌ
ȽɈɋɍȾȺɊɋɌȼȿɇɇɕɃ ɌȿɏɇɂɑȿɋɄɂɃ ɍɇɂȼȿɊɋɂɌȿɌ
Ⱥ Ⱥ ɅɂɌɆȺɇɈȼɂɑ ȿ ȼ ɇɈȼɈɋȿɅɈȼȺ Ƚ ɘ ɈɋɌȺȿȼȺ Ⱥ Ⱥ ɉȺɇȺɋȿɇɄɈ ȿ ȼ ɉɈɅəɄɈȼȺ
ɋɌɊɈȿɇɂȿ ȺɌɈɆȺ ɂ ɏɂɆɂɑȿɋɄȺə
ɋȼəɁɖ
ɆɈɋɄɈȼɋɄɂɃ ȺȼɌɈɆɈȻɂɅɖɇɈ-ȾɈɊɈɀɇɕɃɂɇɋɌɂɌɍɌȽɈɋɍȾȺɊɋɌȼȿɇɇɕɃ ɌȿɏɇɂɑȿɋɄɂɃ ɍɇɂȼȿɊɋɂɌȿɌ
Ⱥ Ⱥ ɅɂɌɆȺɇɈȼɂɑ ȿ ȼ ɇɈȼɈɋȿɅɈȼȺ Ƚ ɘ ɈɋɌȺȿȼȺ Ⱥ Ⱥ ɉȺɇȺɋȿɇɄɈ ȿ ȼ ɉɈɅəɄɈȼȺ
ɋɌɊɈȿɇɂȿ ȺɌɈɆȺ ɂ ɏɂɆɂɑȿɋɄȺə
ɋȼəɁɖ
ɍɱɟɛɧɨɟ ɩɨɫɨɛɢɟ
ɉɨɞ ɨɛɳɟɣ ɪɟɞɚɤɰɢɟɣ ɩɪɨɮ ɂ Ɇ ɉɚɩɢɫɨɜɚ
ɍɬɜɟɪɠɞɟɧɨ
ɜ ɤɚɱɟɫɬɜɟ ɭɱɟɛɧɨɝɨ ɩɨɫɨɛɢɹ ɪɟɞɫɨɜɟɬɨɦ ɆȺȾɂ ȽɌɍ
ɋɬɪɨɟɧɢɟ ɚɬɨɦɚ ɢ ɯɢɦɢɱɟɫɤɚɹ ɫɜɹɡɶ
ɍȾɄ 4.4 ȻȻɄ .1
Ʌ 68
Ʌɢɬɦɚɧɨɜɢɱ, Ⱥ Ⱥ. ɋɬɪɨɟɧɢɟ ɚɬɨɦɚ ɢ ɯɢɦɢɱɟɫɤɚɹ ɫɜɹɡɶ: ɭɱɟɛɧɨɟ ɩɨɫɨɛɢɟ ɞɥɹ ɜɭɡɨɜ / Ⱥ Ⱥ Ʌɢɬɦɚɧɨɜɢɱ ȿ ȼ ɇɨɜɨɫɟɥɨɜɚ Ƚ ɘ Ɉɫɬɚɟɜɚ Ⱥ Ⱥ ɉɚɧɚɫɟɧɤɨ ȿ ȼ ɉɨɥɹɤɨɜɚ ɩɨɞ ɨɛɳɟɣ ɪɟɞ ɂ.Ɇ ɉɚɩɢɫɨɜɚ ɆȺȾɂȽɌɍ . – Ɇ 2009. – 69 ɫ
Ɋɟɰɟɧɡɟɧɬɵ Ⱥ Ⱥ əɪɨɫɥɚɜɨɜ – ɞ-ɪɯɢɦ ɧɚɭɤ ɩɪɨɮ. ɯɢɦɢɱɟɫɤɨɝɨ ɮɚɤɭɥɶɬɟɬɚ ɆȽɍ ɢɦ Ɇ ȼ Ʌɨɦɨɧɨɫɨɜɚ
ȼ ɩɨɫɨɛɢɢ ɪɚɫɫɦɨɬɪɟɧɵ ɫɨɜɪɟɦɟɧɧɵɟ ɩɪɟɞɫɬɚɜɥɟɧɢɹ ɨ ɫɬɪɨɟɧɢɢ ɚɬɨɦɚ ɢ ɯɢɦɢɱɟɫɤɨɣ ɫɜɹɡɢ.
ɉɨɫɨɛɢɟ ɫɨɞɟɪɠɢɬ ɬɟɨɪɟɬɢɱɟɫɤɢɣ ɦɚɬɟɪɢɚɥ ɩɪɢɦɟɪɵ ɪɟɲɟɧɢɹ ɬɢɩɨɜɵɯ ɡɚɞɚɱ ɩɪɟɞɥɚɝɚɟɦɵɯ ɫɬɭɞɟɧɬɚɦ ɆȺȾɂ ȽɌɍ ɧɚ ɤɨɧɬɪɨɥɶɧɵɯ ɢ ɷɤɡɚɦɟɧɚɰɢɨɧɧɵɯ ɪɚɛɨɬɚɯ ɜɨɩɪɨɫɵ ɞɥɹ ɫɚɦɨɤɨɧɬɪɨɥɹ ɉɪɢɜɟɞɟɧɵ ɜɚɪɢɚɧɬɵ ɞɨɦɚɲɧɢɯ ɡɚɞɚɧɢɣ ɩɨ ɬɟɦɟ ©ɋɬɪɨɟɧɢɟ ɚɬɨɦɚ ɢ ɯɢɦɢɱɟɫɤɚɹ ɫɜɹɡɶ» ɨɛɳɟɝɨ ɤɭɪɫɚ ɯɢɦɢɢ ɢɡɭɱɚɟɦɨɝɨ ɫɬɭɞɟɧɬɚɦɢ ɆȺȾɂ ȽɌɍ
ɉɨɫɨɛɢɟ ɩɪɟɞɧɚɡɧɚɱɟɧɨ ɞɥɹ ɫɬɭɞɟɧɬɨɜ ɜɫɟɯ ɫɩɟɰɢɚɥɶɧɨɫɬɟɣ ɞɧɟɜɧɨɝɨ ɨɬɞɟɥɟɧɢɹ ɆȺȾɂ ȽɌɍ ɢɡɭɱɚɸɳɢɯ ɬɟɦɭ ©ɋɬɪɨɟɧɢɟ ɚɬɨɦɚ ɢ ɯɢɦɢɱɟɫɤɚɹ ɫɜɹɡɶª ɜ ɨɛɳɟɦ ɤɭɪɫɟ ɯɢɦɢɢ ɧɚ ɤɚɮɟɞɪɟ ɯɢɦɢɢ ɆȺȾɂ ȽɌɍ
ɍȾɄ 4.4 ȻȻɄ .1
¤ Ɇɨɫɤɨɜɫɤɢɣ ɚɜɬɨɦɨɛɢɥɶɧɨ-ɞɨɪɨɠɧɵɣɢɧɫɬɢɬɭɬ (ɝɨɫɭɞɚɪɫɬɜɟɧɧɵɣ ɬɟɯɧɢɱɟɫɤɢɣ ɭɧɢɜɟɪɫɢɬɟɬ 9
ВВЕДЕНИЕ
Химия – наука о веществах, их превращениях и явлениях, сопровождающих эти превращения. В результате химических процессов образуются новые вещества с новыми химическими и физическими свойствами.
Вещество представляет собой отдельный вид материи, дискретные частицы которого имеют конечную массу покоя. Веществом являются такие элементарные частицы, как протон, нейтрон, электрон и др. Сочетанием этих элементарных частиц образуются ядра атомов, атомы, молекулы, ионы, кристаллы и т.п.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют вид атомов с одинаковым зарядом ядер.Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Таким образом, каждому химическому элементу соответствует определенный вид атомов.
Наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами, называют молекулой.
Свойства вещества как вида материи, состоящего из дискретных частиц, имеющих массу покоя, определяются типом и количеством объединившихся частиц и описываются периодическим законом Д.И. Менделеева: свойства химических элементов и образуемых ими простых и сложных веществ являются периодической функцией положительно заряженного ядра атомов элементов.
1.1. Строение атома
Атом представляет собой сложную микросистему находящихся в движении и взаимодействии элементарных частиц. Экспериментально
studfiles.net



