Хром строение атома схема – Какие степени окисления характерны для хрома в его соединениях? Приведите примеры. Составьте схему размещения электронов по орбиталям в атоме хрома.
- Комментариев к записи Хром строение атома схема – Какие степени окисления характерны для хрома в его соединениях? Приведите примеры. Составьте схему размещения электронов по орбиталям в атоме хрома. нет
- Советы абитуриенту
- Элемент хром | Дистанционные уроки
- Строение атома хрома схема. Схема строения атома: ядро, электронная оболочка. Примеры
- Строение электронных оболочек атомов хрома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
- строение атома хрома и кислорода
- Строение атома серебра (Ag), схема и примеры
- ХРОМ Строение атома Атомные свойства Атомный вес молярная
- 1.1.1. Строение электронных оболочек атомов химических элементов.
Элемент хром | Дистанционные уроки
06-Ноя-2012 | комментариев 5 | Лолита Окольнова
За счет большого количества валентных электронов образует большое количество окрашенных соединений.
Электронное строение атома
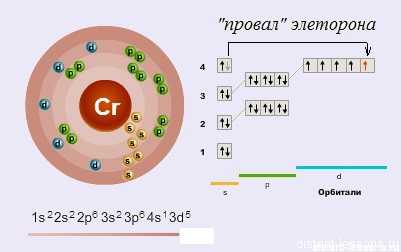
Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:
+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:
2Сr + 3F2 = 2CrF3
4Cr + 3O2 = 2Cr2O3 - Взаимодействие с водой (при нагревании):
2Cr + 3h3O = Cr2O3 + 3h3 - Взаимодействие с кислотами
— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует
— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + h3
Оксиды хрома
СrO — оксид хрома (II), (черного цвета) — основной оксид.
Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(Oh4).
СrO + 2HCl = CrCl2 + h3O (cоли — голубого цвета)
Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 + 2NaOH = 2NaCrO2 + h3O
Cr2O3 + 6HCl = 2CrCl3 + 3h3OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Соли Cr(3+) — зеленого цвета
СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и h3Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
CrO4(2-) — хроматы — желтого цвета
Сr2O7(2-) — бихроматы — оранжевого цвета
В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:
Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:

Отсюда, кстати, и название элемента: «хром» — это «цвет»!
У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Категории: |
Обсуждение: “Элемент Хром”
(Правила комментирования)distant-lessons.ru
Строение атома хрома схема. Схема строения атома: ядро, электронная оболочка. Примеры
Электронное строение атома, схема и примеры
Понятие «атом»
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Электронное строение атома
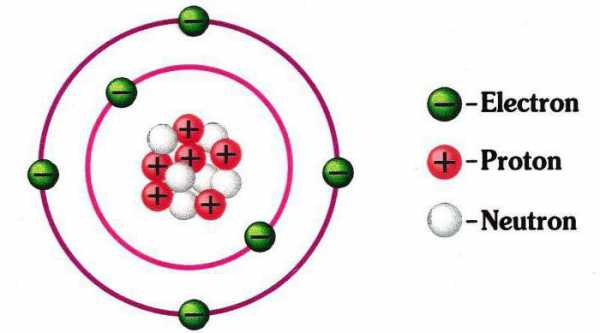
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков. Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия. Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
|
Значение l |
1 |
2 |
3 |
4 |
5 |
|
Обозначение |
s |
p |
d |
f |
h |
|
Форма |
шар |
объемная восьмерка |
более сложная форма |
||
Магнитное квантовое число показывает ориентацию орбитали в пространстве. Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси. Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2). Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э. Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
Примеры решения задач
ru.solverbook.com
Схема строения атома: ядро, электронная оболочка. Примеры
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства химических элементов (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
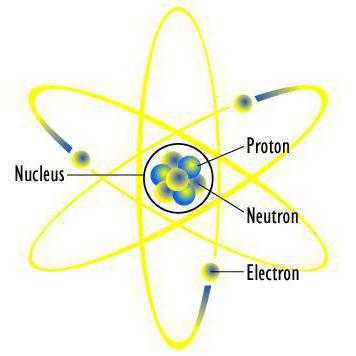
 Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
 Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в трёхмерном пространстве. Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в трёхмерном пространстве. Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
 Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. Число электронов обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
 Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул. Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х2. Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х2.
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про физические свойства галогенов, к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет периодическая система Менделеева, и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
 Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
 Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
fb.ru
p-элементы | Дистанционные уроки
12-Авг-2012 | комментария 4 | Лолита Окольнова
За годы работы репетитором я поняла, что имеет смысл разбирать строение электронных оболочек атомов р-элементов не только по группам, но и по периодам, т.к. во втором периоде заполняется p-орбиталь, в то время как в следующих периодах уже появляется d-орбиталь, что вносит некоторые изменения в свойства атомов.
Строение электронных оболочек атомов
2-го периода системы химических элементов.
Изменения по группам:
Как видно из рисунка, p-элементы начинаются в периодической системе с 3-й группы. До них идут s-элементы.
Начинается заполнение электронами p-подуровня:
Как видите, идет последовательное заполнение электронами p-подуровня
Давайте рассмотрим варианты валентности и степени окисления для элементов этих групп:
- III группа (главная подгруппа) — 3 электрона на внешнем уровне — валентность элементов будет равна номеру группы — 3; степень окисления +3 (атом может отдать 3 электрона — это энергетически более выгодно, чем присоединять 5 электронов)
- IV группа — на внешнем уровне 4 электрона — максимальная валентность будет равна 4, 2 неспаренных электрона — есть еще валентность =2. Степень окисления может быть как +4, так и -4.
- V группа — максимальная валентность — 5, еще возможна 3; степени окисления +5, +3 и -3 (но уже легче будет присоединить 3 электрона)
- VI группа — максимальная валентность 2, степень окисления: -2 (кислород всегда проявляет степень окисления -2, исключение — соединение кислорода со фтором OF2, г- де степень окисления кислорода +2). Это уже явные неметаллические свойства.
- VII группа — максимальная валентность — 1, степень окисления= -1. Фтор F — самый сильный неметалл.
- VIII группа — инертные газы… т.е. полностью заполненная 8-ми электронная оболочка.
Обратите внимание — слева на право по периодам количество электронов увеличивается (при этом радиус атома уменьшается) — для достижения стабильного состояния (завершенной 8-ми электронной оболочки) проще принять электроны, чем отдать, значит, НЕМЕТАЛЛИЧЕСКИЕ, окислительные свойства усиливаются!
Как влияет строение электронных оболочек атомов p-элементов на их химические свойства в следующих периодах, где появляется d-орбиталь, мы рассмотрим в следующей лекции.
- по этой теме есть вопросы в ЕГЭ — А1 и А5
- вопросы ГИА ( ОГЭ) по этой теме — А1 и А3
Категории: |
Обсуждение: “p-элементы”
(Правила комментирования)distant-lessons.ru
Урок 1. Схема строения атомов – HIMI4KA
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Основы строения атома
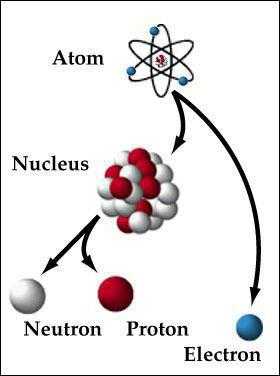
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×1023 а.е.м и наоборот 1 а.е.м. = 1,66×10-24 г. Число 6,022×1023 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10-19 | 1,67·10-24 | 1,00728 |
| Нейтрон | 0 | 1,67·10-24 | 1,00866 |
| Электрон | -1,6·10-19 | 9,10·10-28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Страница 1 из 3123»consei.ru
Строение электронных оболочек атомов хрома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Видеоурок: Строение атома: Строение электронных оболочек
Лекция: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
Строение атома XX столетие является временем изобретения “модели строения атома”. Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
XX столетие является временем изобретения “модели строения атома”. Исходя из предоставленного строения, удалось выработать следующую гипотезу: вокруг достаточно маленького по объему и размеру ядра, электроны совершают перемещения, схожие с перемещением планет вокруг Солнца. Последующее изучение атома показало, что сам атом и его строение гораздо сложнее, чем было установлено раньше. И в настоящее время, при огромных возможностях в научной сфере, атом исследован не до конца. Такие составляющие, как атом и молекулы, считаются предметами микромира. Поэтому данные части человек не способен рассмотреть самостоятельно. В этом мире установлены совершенно иные законы и правила, отличающиеся от макромира. Исходя из этого, исследование атома ведется на его модели.
Любому атому присвоен порядковый номер, закрепленный в Периодической таблице Менделеева Д.И. К примеру, порядковый номер атома фосфора (Р) – 15.
Итак, атом состоит из протонов (p+), нейтронов (n0) и электронов (e-). Протоны и нейтроны образуют ядро атома, оно имеет положительный заряд. А электроны, совершающие перемещения вокруг ядра, «конструируют» электронную оболочку атома, имеющую отрицательный заряд.
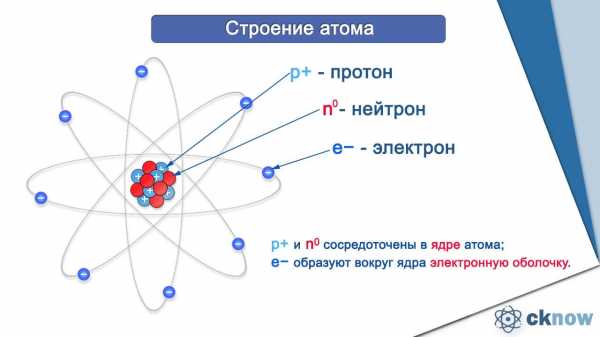
Сколько электронов в атоме? Это легко узнать. Достаточно посмотреть порядковый номер элемента в таблице.
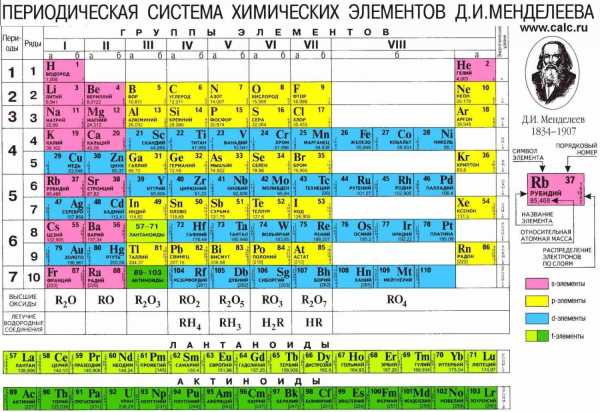
Так, число электронов фосфора равно 15. Количество электронов, содержащихся в оболочке атома, строго равно числу протонов, содержащихся в ядре. Значит и протонов в ядре атома фосфора 15.
Масса протонов и нейтронов, составляющих массу ядра атома, одинакова. А электроны меньше в 2000 раз. Это означает что вся масса атома сосредоточена в ядре, массой электронов пренебрегают. Массу ядра атома мы также можем узнать из таблицы. Посмотрите изображение фосфора в таблице. Внизу мы видим обозначение 30, 974 – это и есть масса ядра фосфора, его атомная масса. При записи мы округляем эту цифру. Исходя из сказанного, запишем строение атома фосфора следующим образом:
(внизу слева написали заряд ядра – 15, вверху слева округленное значение массы атома – 31).
Ядро атома фосфора:
(внизу слева пишем заряд: протоны имеют заряд равный +1, а нейтроны не заряжены, то есть заряд 0; вверху слева масса протона и нейтрона, равная 1 – условная единица массы атома; заряд ядра атома равен числу протонов в ядре, значит р=15, а число нейтронов нужно посчитать: из атомной массы вычесть заряд, т.е. 31 – 15 = 16).
Электронная оболочка атома фосфора включает в себя 15 отрицательно заряженных электронов, уравновешивающих положительно заряженные протоны. Поэтому, атом – электронейтральная частица.
Энергетические уровниРис.1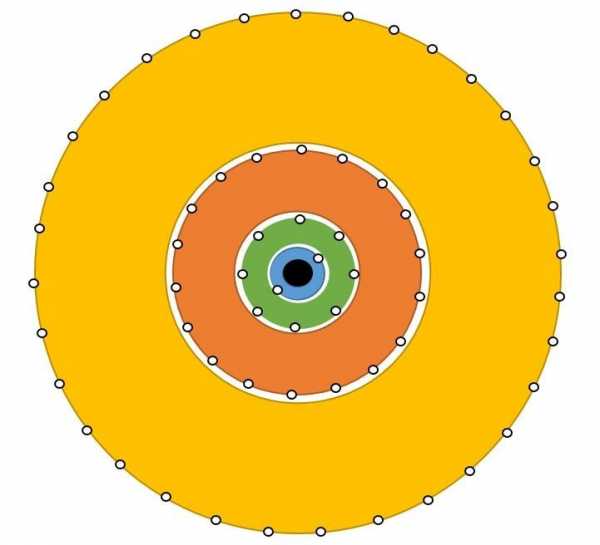 Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие – то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Далее нам необходимо подробно разобрать как распределяются электроны в атоме. Их движение не хаотично, а подчинено конкретному порядку. Какие – то из имеющихся электронов, притягиваются к ядру с достаточно большой силой, а другие наоборот, притягиваются слабо. Первопричина такого поведения электронов скрывается в разной степени удаленности электронов от ядра. То есть, ближе находящийся к ядру электрон, станет прочнее с ним взаимосвязан. Эти электроны просто нельзя отсоединить от электронной оболочки. Чем электрон дальше от ядра, тем проще «вытащить» его из оболочки. Так же, запас энергии электрона возрастает, по мере удаления от ядра атома. Энергия электрона определяется главным квантовым числом n, равняющимся любому натуральному числу (1,2,3,4…). Электроны, имеющие одинаковое значение n, образуют один электронный слой, как бы отгораживаясь от иных электронов, передвигающихся на удаленном расстоянии. На рисунке 1 изображены электронные слои, содержащиеся в электронной оболочке, в центре ядро атома.
Вы можете заметить, как по мере удаления от ядра увеличивается объем слоя. Следовательно, чем дальше слой от ядра, тем больше в нем электронов.
Электронный слой, содержит в себе электроны, сходные по показателям энергии. Из – за этого, такие слои нередко именуют энергетическими уровнями. Сколько же уровней может содержать атом? Количество энергетических уровней равно номеру периода в таблице Менделеева Д.И. в котором находится элемент. К примеру, фосфор (Р) находится в третьем периоде, значит атом фосфора имеет три энергетических уровня.Рис. 2
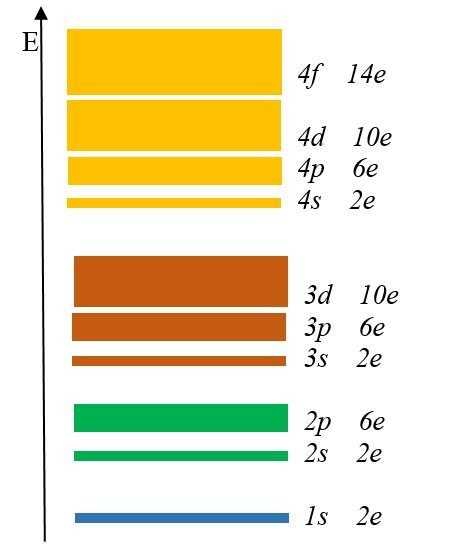 Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня.
Как узнать максимальное количество электронов, располагающихся на одном электронном слое? Для этого используем формулу Nmax = 2n2, где n – это номер уровня. Получим, что первый уровень содержит всего 2 электрона, второй – 8, третий – 18, четвертый – 32.
Каждый энергетический уровень содержит в себе подуровни. Их буквенные обозначения: s-, p-, d- и f-. Посмотрите на рис. 2:Здесь изображены подуровни. Е – это энергия (вспомните, что она возрастает по мере удаления электрона от ядра).
Разным цветом обозначены энергетические уровни, а полосками разной толщины подуровни.
Самый тонкий подуровень обозначается буквой s. 1s – это s-подуровень первого уровня, 2s – это s-подуровень второго уровня и так далее.
На втором энергетическом уровне появился p-подуровень, на третьем – d-подуровень, а на четвертом f-подуровень.
Запомните увиденную закономерность: первый энергетический уровень включает одну s-подуровень, второй два s- и p- подуровня, третий три s-, p- и d-подуровня, а четвертый уровень четыре s-, p-, d- и f-подуровня.
На s-подуровне могут находится только 2 электрона, на p-подуровне- максимум 6 электронов, на d-подуровне – 10 электронов, а на f-подуровне до 14 электронов.
Электронные орбиталиОбласть (место) где может находится электрон называется электронным облаком или орбиталью. Имейте ввиду, что говорится о вероятной области нахождении электрона, поскольку скорость его движения в сотни тысяч раз больше скорости движения иглы швейной машинки. Графически эта область изображается в виде ячейки:
В одной ячейке может находится два электрона. Судя по рисунку 2 можно сделать вывод о том, что s-подуровень, включающий не более двух электронов может содержать только одну s-орбиталь, обозначается одной ячейкой; p-подуровень имеет три р-орбитали (3 ячейки), d-подуровень пять d-орбиталей (5 ячеек), а f-подуровень семь f-орбиталей (7 ячеек).
Форма орбитали зависит от орбитального квантового числа (l – эль) атома. Атомный энергетический уровень, берет начало с s – орбитали, имеющей l = 0. Представленная орбиталь имеет сферическую форму. На уровнях, идущих после s – орбитали, образуются p – орбитали с l = 1. P – орбитали напоминают форму гантели. Орбиталей, имеющих данную форму, всего три. Каждая возможная орбиталь содержит в себе не больше 2 – ух электронов. Далее располагаются более сложного строения d-орбитали (l = 2), а за ними f-орбитали (l = 3).
Рис. 3 Форма орбиталей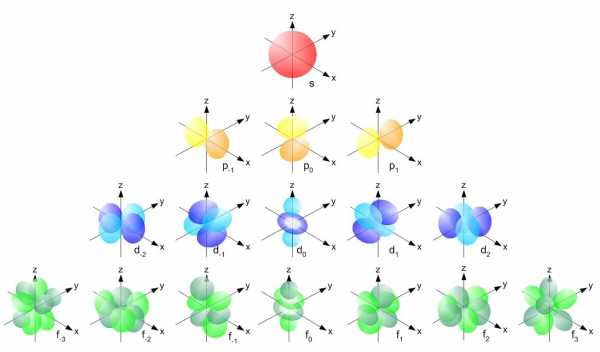 Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:
Электроны в орбиталях изображаются в виде стрелочек. Если орбитали содержат по одному электрону, то они однонаправленны – стрелкой вверх:Если же в орбитали два электрона, то они имеют два направления: стрелкой вверх и стрелкой вниз, т.е. электроны разнонаправленны:
Такое строение электронов называется валентным.
Существуют три условия наполнения атомных орбиталей электронами:
1 условие: Принцип минимального количества энергии. Заполнение орбиталей начинается с подуровня, имеющего минимальную энергию. Согласно данному принципу подуровни заполняются в таком порядке: 1s22s22p63s23p6 4s23d104p65s24d105р66s25d14f14… Как мы видим, в некоторых случаях электрону энергетически выгоднее занять место в подуровне вышележащего уровня, хотя подуровень нижележащего уровня не заполнен. Например, валентная конфигурация атома фосфора выглядит так:
Рис. 4
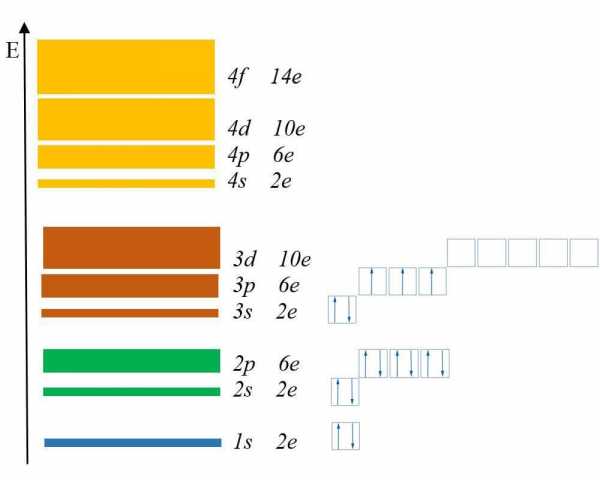
2 условие: Принцип Паули. Одна орбиталь включает 2 электрона (электронную пару) и не больше. Но возможно и содержание всего одного электрона. Его именуют неспаренным.
3 условие: Правило Хунда. Каждую орбиталь одного подуровня сначала заполняют по одному электрону, затем в них добавляются по второму электрону. В жизни мы видели аналогичную ситуацию, когда незнакомые пассажиры автобуса сначала занимают по одному все свободные сидения, а потом рассаживаются по два.
Электронная конфигурация атома в основном и возбужденном состоянии
Энергия атома, находящегося в основном состоянии, наименьшая. Если атомы начинают получать энергию из вне, к примеру, когда вещество нагревается, то они из основного состояния переходят в возбужденное. Этот переход возможен при наличии свободных орбиталей, на которые могут переместиться электроны. Но это временно, отдавая энергию, возбужденный атом возвращается в своё основное состояние.
Закрепим полученные знания на примере. Рассмотрим электронную конфигурацию, т.е. сосредоточение электронов по орбиталям атома фосфора в основном (невозбужденном состоянии). Еще раз обратимся к рис. 4. Итак, вспомним, что атом фосфора имеет три энергетических уровня, которые изображаются полудугами: +15)))
Распределим, имеющиеся 15 электронов на эти три энергетических уровня:Такие формулы называются электронными конфигурациями. Есть еще электронно – графические, они иллюстрируют размещение электронов внутри энергетических уровней. Электронно – графическая конфигурация фосфора выглядит так: 1s2 2s2 2p6 3s2 3p3 (здесь большие цифры – это номера энергетических уровней, буквы – это подуровни, а маленькие цифры – количество электронов подуровня, если их сложить, получится число 15).
В возбужденном состоянии атома фосфора 1 электрон переходит с 3s-орбитали на 3d-орбиталь, а конфигурация выглядит так: 1s2 2s2 2p6 3s1 3p33d1.cknow.ru
Строение электронных оболочек атомов
Рассмотрим строение отдельно взятого электронного уровня (слоя). Начиная со значения главного квантового числа n = 2, электронные уровни (L, M, N, O, P, Q – слои) подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи электрона с ядром. Число подуровней равно значению главного квантового числа, но не превышает четырех. Таким образом, 1 уровень имеет один подуровень, 2 – два, третий – 3, четвертый – 4 подуровня. Подуровни, в свою очередь, составлены из орбиталей. Принято подуровни обозначать латинскими буквами: s- первый, ближайший к ядру подуровень каждого энергетического уровня: он состоит из одной s-орбитали; p- второй подуровень, он состоит из трех р-орбиталей, d- третий подуровень, он состоит из пяти d-орбиталей; f- четвертый подуровень, содержит семь f-обиталей. Таким образом, для каждого значения n имеется (2l + 1) орбиталей.
Выше показано, что состояние электронов можно описать набором четырёх квантовых чисел, но для полного объяснения строения электронных оболочек атомов нужно знать еще три основных положения:
1) принцип В. Паули. В 1925 г. швейцарский физик В. Паули (в 1945 г. ему была присуждена Нобелевская премия по физике) установил правило, названное принципом Паули (или запретом Паули): в атоме не может быть двух электронов, обладающих одинаковыми свойствами. Поскольку свойства электронов характеризуются квантовыми числами, принцип Паули часто формулируют так: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел n, l, ml, и ms должно обязательно различаться. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2, другой с ms= -1/2. Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l, ml.
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml = 0 и msможет иметь любое из двух значений: +1/2 или –1/2. Мы видим, что если n = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении n электроны, прежде всего, отличаются побочным квантовым числом l, принимающим значения от 0 до (n – 1) . При заданных n и l может быть (2l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l, ml соответствует два разных значения проекции спина ms. Если на орбитале находится один электрон, то он называется неспаренным, если два, то это спаренные электроны. Принцип Паули поясняется формулой N = 2n2. А именно: если например, на третьем уровне (n = 3) содержится 32 = 9 орбиталей, а на каждой орбитали по 2 электрона, то максимальное число электронов составит 2∙32 = 18.
Иллюстрация принципа Паули
2) правило Ф. Хунда (Гунда). Заполнение ячеек электронами происходит по правилу Гунда: в пределах подуровня электроны располагаются сначала каждый в отдельной ячейке (в виде так называемых «холостых» – валентных электронов), затем, когда все ячейки данного подуровня окажутся занятыми, начинается уплотнение электронов вновь поступающими, т. е. происходит их «спаривание». Иначе говоря, электроны в пределах данного подуровня (S, P, D, F) Заполняются таким образом, чтобы суммарный спин был максимальным. Например, если в трех р-ячейках необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке: в этом случае суммарный спин равен 3/2.
3) принцип наименьшей энергии (правило В.М. Клечковскогоили правило (n+l)). Последовательность заполнения атомных орбиталей в зависимости от значения главного и орбитального квантовых чисел изучена отечественным ученым Всеволодом Маврикиевичем Клечковским (1900-1972). Он установил, что энергия электрона возрастает по мере увеличения суммы квантовых чисел (n + l).
Первое правило В.М. Клечковского (1952): последовательность заполнения определяется возрастанием суммы n + l: сначала заполняется тот подуровень, где сумма (n + l) меньше.
Второе правило В.М. Клечковского: при равенстве сумм (n + l) заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа, то есть сначала заполняется тот подуровень, для которого n меньше, а l больше, а потом уже подуровень с большим n.
studfiles.net
Строение электронной оболочки атома
Строение электронной оболочки атомаПлан
1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома: принцип Паули, принцип наименьшей энергии, правило Клечковского, правило Гунда.
3. Определения понятий: «электронная оболочка», «электронное облако», «энергетический уровень», «энергетический подуровень», «электронный слой».
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного химического элемента. Согласно квантовой теории каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число n характеризует энергию и размеры орбитали и электронного облака, принимает значения целых чисел – от 1 до бесконечности (n = 1, 2, 3, 4, 5, 6…). Орбитали, имеющие одинаковые значения n, близки между собой по энергии и по размерам, они образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1 – K, 2 – L, 3 – M, 4 – N, 5 – O, 6 – P, 7 – Q). С увеличением порядкового номера энергия орбиталей увеличивается.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число l характеризует формы орбиталей и облаков, принимает значения целых чисел от 0 до n – 1.
| Энергетическийуровень | Значения главногоквантового числа n | Значения побочногоквантового числа l |
| K | 1 | 0 (s) |
| L | 2 | 0, 1 (s, p) |
| M | 3 | 0, 1, 2 (s, p, d) |
| N | 4 | 0, 1, 2, 3 (s, p, d, f) |
Орбитали, для которых l = 1, имеют форму вытянутой восьмерки и называются р-орбиталями. Они содержатся на всех энергетических уровнях, кроме первого (К).
Орбитали, для которых l = 2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l = 3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Espd f, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантовых чисел, но отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число ml характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l = 0, ml= 0 – одна орбиталь;
p-подуровень: l = 1, ml= –1, 0, +1 – три орбитали;
d-подуровень: l = 2, ml= –2, –1, 0, +1, +2 – пять орбиталей.
Таким образом, число орбиталей на подуровне равно 2l + 1. Общее число орбиталей на одном энергетическом уровне – n2. Общее число электронов на одном энергетическом уровне – 2n2. Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуются тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число ms, спин (от англ. spin – кружение, вращение) – характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: .
Заполнение электронной оболочки атома подчиняется следующим законам.
П р и н ц и п П а у л и. В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
П р и н ц и п н а и м е н ь ш е й э н е р г и и. Основное (устойчивое) состояние атома характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
П р а в и л о К л е ч к о в с к о г о. Электроны заполняют энергетические подуровни в порядке увеличения их энергии. Этот порядок определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
П р а в и л о Г у н д а. На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Например, электронные формулы магния, железа и теллура имеют вид:
Mg(+12) 1s22s22p63s2;
Fe(+26) 1s22s22p63s23p64s23d6;
Te(+52) 1s22s22p63s23p64s23d104p65s24d105p4.
Исключения в четвертом периоде составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10. Таким образом, электронные формулы атомов хрома и меди имеют вид:
Cr(+24) 1s22s22p63s23p64s13d5;
Cu(+29) 1s22s22p63s23p64s13d10.
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы, например:
Тест по теме «Строение электронной оболочки атома»
(Возможно несколько правильных ответов)
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, это:
а) магний; б) углерод; в) сера; г) цинк.
2. Электронная конфигурация иона Cl+ в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
а) [Ne] 3s23p5; б) [Ne] 3s13p6;
в) [Ne] 3s23p4; г) [Ne] 3s23p6.
3. Элементу 2-го периода для завершения внешнего уровня не хватает трех электронов. Этот элемент:
а) бор; б) углерод; в) азот; г) фосфор.
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
а) 4d6; б) 2s22p4; в) 3s23p4; г) 3s13d5.
5. Чему равно орбитальное квантовое число 3р-электрона?
а) 1; б) 3; в) 0; г) +1/2.
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
а) 1; б) 4; в) 5; г) 6.
7. Электронную конфигурацию внешнего электронного слоя 3s23p6 имеют соответственно атом и ионы:
а) Ar, Cl–, S2–; б) Kr, K+, Ca2+;
в) Ne, Cl–, Ca2+; г) Ar, Cl–, Ca2+.
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
а) 1; б) 2; в) 4; г) 6.
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
а) 2, 8, 12, 2; б) 2, 8, 8, 6;
в) 2, 8, 13, 1; г) 2, 8, 14, 0.
10. Ионы Ag+ и Cs+ имеют соответственно следующие электронные формулы внешнего и предвнешнего энергетических уровней:
а) …4d105s0 и …5p66s1; б) …4d95s1 и …5p66s0;
в) …4d105s0 и …5p66s0; г) …4d105s0 и …5p56s1.
lib2.podelise.ru
Страница 1 из 3123»consei.ru
строение атома хрома и кислорода
Химические элементы хром и железо находятся в 4 четвертом большом периоде, в 4 ряду. У атомов элементов больших периодов заполнение электронных оболочек идет сложнее чем у атомов малых периодов. Начиная с третьего элемента у атомов идет заполнение предпоследнего энергетического уровня до, а на внешнем уровне находится 1 или 2 электрона:Изобразим электронные формулы хрома и железа и увидим, что идет заполнение предпоследнего уровня d-подуровня:
₊₂₄Cr 1s²2²2p⁶3s²3p⁶3d⁵4s¹
₊₂₆Fe 1s²2²2p⁶3s²3p⁶3d⁶4s²
Имея такое строение в химических реакциях атомы хрома и железа могут отпускать электроны с последнего и предпоследнего уровня, при этом они могут проявлять разные степени окисления:
Хром в соединениях чаще всего проявляет степени окисления +3 и +6. Примеры соединений хрома со степенью окисления +3 – оксид хрома (III) Сr₂О₃, хлорид хрома (III) СrСI₃, сульфат хрома (III) Сr₂(SO₄)₃.Примеры соединений хрома со степенью окисления +6: оксид хрома (VI) СrО₃, хромовая кислота H₂CrO₄, хромат натрия Na₂CrO₄, бихромат калия К₂Сr₂О₇. Но существуют соединения в которых атомы хрома проявляют степени окисления +2 – оксид хрома (II) CrO, гидроксид хрома (II) Cr(OH)₂; +4 – оксид хрома (IV) оксид хрома (II)CrO₂ , гидроксида не существует.
CrO -оксид хрома (II), основной оксид
Сr₂О₃, хлорид хрома (III), амфотерный оксид
CrO₂ оксид хрома (II), несолеобразующий оксид
СrО₃ оксид хрома (VI), кислотный оксид
Восстановительные свойства Cr2O3:
Будучи соединением хрома в промежуточной степени окисления, Cr2O3 в присутствии сильного окислителя (в щелочной среде) окисляется до хромата: t,
Cr₂O₃ + 3KNO₃ + 2Na₂CO₃ → 2Na₂Cr⁺⁶O₄ + 3KNO₂ + 2CO₂
Cr⁺³ – 3е⁻ → Сr⁺⁶ восстановитель, процесс окисления
N⁺⁵+ 2e⁻ → N⁺³ окислитель, процесс восстановления
Окислительные свойства:
Сильные восстановители восстанавливают оксид хрома (III):
Cr₂O₃ + 2Al= 2CrO + Al₂O₃
Cr⁺³ + 6e → 2CrO окислитель. восстановление
Al⁰ – 3e → Al⁺³ восстановитель. окисление
Железов соединениях всего проявляет степени окисления +2,+3.Степень окисления железа Fe зависит от окислительной способности реагирующего вещества. У сильных окислителей таких как хлор, азотная кислота железо принимает степень окисления +3, у более слабых окислителей таких как сера, растворы серной и соляной кислоты +2. С кислородом и водой железо может иметь степень окисления и +2, и +3
2Fe⁰ + 3CI₂⁰ = 2Fe⁺³CI₃⁻
Fe⁰ -3e⁻ ⇒ Fe⁺³ восстановитель, процесс окисления
CI + e⁻ ⇒CI⁻ окислитель, процесс восстановления
otvet.mail.ru
Строение атома серебра (Ag), схема и примеры
Общие сведения о строении атома серебра
Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 42\7 электронов.
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
+47Ag)2)8)18)17)2;
1s22s22p63s23p63d104s24p64d95s2.
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
|
d |
4 |
2 |
0 |
+1/2 |
|
d |
4 |
2 |
+1 |
+1/2 |
|
d |
4 |
2 |
+2 |
+1/2 |
|
d |
4 |
2 |
-2 |
-1/2 |
|
d |
4 |
2 |
-1 |
-1/2 |
|
d |
4 |
2 |
0 |
-1/2 |
|
d |
4 |
2 |
+1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
ХРОМ Строение атома Атомные свойства Атомный вес молярная
 ХРОМ
ХРОМ
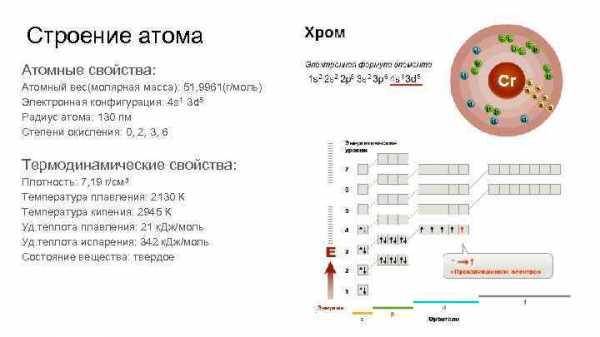 Строение атома Атомные свойства: Атомный вес(молярная масса): 51, 9961(г/моль) Электронная конфигурация: 4 s 1 3 d 5 Радиус атома: 130 пм Степени окисления: 0, 2, 3, 6 Термодинамические свойства: Плотность: 7, 19 г/см 3 Температура плавления: 2130 К Температура кипения: 2945 К Уд. теплота плавления: 21 к. Дж/моль Уд. теплота испарения: 342 к. Дж/моль Состояние вещества: твердое
Строение атома Атомные свойства: Атомный вес(молярная масса): 51, 9961(г/моль) Электронная конфигурация: 4 s 1 3 d 5 Радиус атома: 130 пм Степени окисления: 0, 2, 3, 6 Термодинамические свойства: Плотность: 7, 19 г/см 3 Температура плавления: 2130 К Температура кипения: 2945 К Уд. теплота плавления: 21 к. Дж/моль Уд. теплота испарения: 342 к. Дж/моль Состояние вещества: твердое
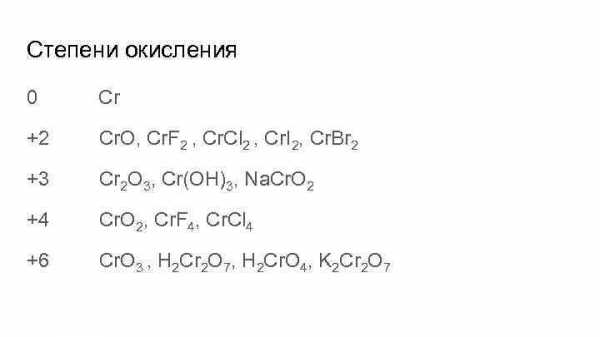 Степени окисления 0 Сr +2 Cr. O, Cr. F 2 , Cr. Cl 2 , Cr. I 2, Cr. Br 2 +3 Cr 2 O 3, Cr(OH)3, Na. Cr. O 2 +4 Cr. O 2, Cr. F 4, Cr. Cl 4 +6 Cr. O 3 , H 2 Cr 2 O 7, H 2 Cr. O 4, K 2 Cr 2 O 7
Степени окисления 0 Сr +2 Cr. O, Cr. F 2 , Cr. Cl 2 , Cr. I 2, Cr. Br 2 +3 Cr 2 O 3, Cr(OH)3, Na. Cr. O 2 +4 Cr. O 2, Cr. F 4, Cr. Cl 4 +6 Cr. O 3 , H 2 Cr 2 O 7, H 2 Cr. O 4, K 2 Cr 2 O 7
 Нахождение в природе Хромистый железняк(хромит) Fe. O*Cr 2 O 3 Магнезиохромит Mg. Cr 2 O 4 Свинцовая красная руда(крокоит) Pb. Cr. O 4
Нахождение в природе Хромистый железняк(хромит) Fe. O*Cr 2 O 3 Магнезиохромит Mg. Cr 2 O 4 Свинцовая красная руда(крокоит) Pb. Cr. O 4
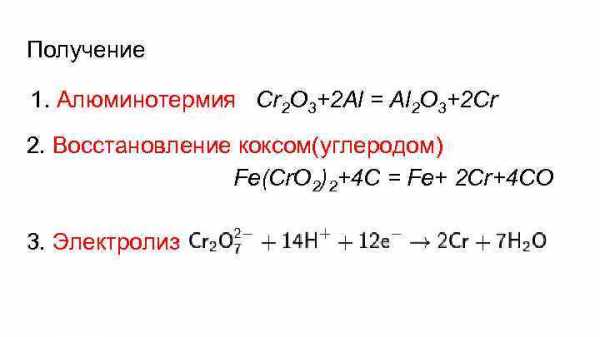 Получение 1. Алюминотермия Сr 2 O 3+2 Al = Al 2 O 3+2 Cr 2. Восстановление коксом(углеродом) Fe(Cr. O 2)2+4 C = Fe+ 2 Cr+4 CO 3. Электролиз
Получение 1. Алюминотермия Сr 2 O 3+2 Al = Al 2 O 3+2 Cr 2. Восстановление коксом(углеродом) Fe(Cr. O 2)2+4 C = Fe+ 2 Cr+4 CO 3. Электролиз
 Физические свойства В свободном виде — голубовато-белый металл. Один из самых твердых чистых металлов. Устойчив на воздухе. Обладает высокими температурами плавления и кипения. Коэффициент отражаемости 62%.
Физические свойства В свободном виде — голубовато-белый металл. Один из самых твердых чистых металлов. Устойчив на воздухе. Обладает высокими температурами плавления и кипения. Коэффициент отражаемости 62%.
 Химические свойства. Взаимодействие с неметаллами и водой. 4 Cr + 3 O 2 = 2 Cr 2 O 3 2 Cr + 3 Cl 2 = 2 Cr. Cl 3. 2 Cr + N 2 = 2 Cr. N 2 Cr + 3 S = Cr 2 S 3. Cr + 2 B = Cr. B 2 Cr + 2 Si = Cr. Si 2 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2
Химические свойства. Взаимодействие с неметаллами и водой. 4 Cr + 3 O 2 = 2 Cr 2 O 3 2 Cr + 3 Cl 2 = 2 Cr. Cl 3. 2 Cr + N 2 = 2 Cr. N 2 Cr + 3 S = Cr 2 S 3. Cr + 2 B = Cr. B 2 Cr + 2 Si = Cr. Si 2 2 Cr + 3 H 2 O = Cr 2 O 3 + 3 H 2
 Взаимодействие с кислотами Cr + 2 HCl = Cr. Cl 2 + H 2 Cr + H 2 SO 4 = Cr. SO 4 + H 2 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O. 2 Cr + 6 H 2 SO 4(конц)= Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr + 6 HNO 3(конц)= Cr(NO 3)3 + 3 NO 2 + 3 H 2 O.
Взаимодействие с кислотами Cr + 2 HCl = Cr. Cl 2 + H 2 Cr + H 2 SO 4 = Cr. SO 4 + H 2 4 Cr + 12 HCl + 3 O 2 = 4 Cr. Cl 3 + 6 H 2 O. 2 Cr + 6 H 2 SO 4(конц)= Cr 2(SO 4)3 + 3 SO 2 + 6 H 2 O Cr + 6 HNO 3(конц)= Cr(NO 3)3 + 3 NO 2 + 3 H 2 O.
 Взаимодействие с щелочью. Восстановление металлов из солей. 2 Cr + 6 KOH = 2 KCr. O 2 + 2 K 2 O + 3 H 2. Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O. 2 Cr + 3 Cu. Cl 2 = 2 Cr. Cl 3 + 3 Cu.
Взаимодействие с щелочью. Восстановление металлов из солей. 2 Cr + 6 KOH = 2 KCr. O 2 + 2 K 2 O + 3 H 2. Cr + KCl. O 3 + 2 KOH = K 2 Cr. O 4 + KCl + H 2 O. 2 Cr + 3 Cu. Cl 2 = 2 Cr. Cl 3 + 3 Cu.
 Соединения Оксид хрома(II) Cr(OH)2+2 HCl = Сr. Cl 2+ 2 H 2 O 2 Сr. Cl 2+2 HCl = 2 Cr. Cl 3 +H 2 4 Cr(OH)2+O 2+2 H 2 O=4 Сr(OH)3 Оксид хрома(III) (NH 4)2 Cr 2 O 7 = N 2+Cr 2 O 3 Cr(OH)3+3 Na. OH = Na 3[Cr(OH)6] Cr 2 O 3+2 Na. OH = 2 Na. Cr. O 2+H 2 O 4 K 2 Cr 2 O 7 = 2 Cr 2 O 3+4 K 2 Cr. O 4+3 O 2
Соединения Оксид хрома(II) Cr(OH)2+2 HCl = Сr. Cl 2+ 2 H 2 O 2 Сr. Cl 2+2 HCl = 2 Cr. Cl 3 +H 2 4 Cr(OH)2+O 2+2 H 2 O=4 Сr(OH)3 Оксид хрома(III) (NH 4)2 Cr 2 O 7 = N 2+Cr 2 O 3 Cr(OH)3+3 Na. OH = Na 3[Cr(OH)6] Cr 2 O 3+2 Na. OH = 2 Na. Cr. O 2+H 2 O 4 K 2 Cr 2 O 7 = 2 Cr 2 O 3+4 K 2 Cr. O 4+3 O 2
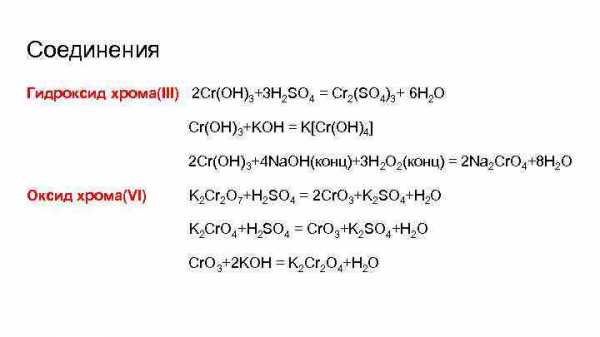 Соединения Гидроксид хрома(III) 2 Cr(OH)3+3 H 2 SO 4 = Cr 2(SO 4)3+ 6 H 2 O Cr(OH) 3+KOH = K[Cr(OH)4] 2 Cr(OH) 3+4 Na. OH(конц)+3 H 2 O 2(конц) = 2 Na 2 Cr. O 4+8 H 2 O Оксид хрома(VI) K 2 Cr 2 O 7+H 2 SO 4 = 2 Cr. O 3+K 2 SO 4+H 2 O K 2 Cr. O 4+H 2 SO 4 = Cr. O 3+K 2 SO 4+H 2 O Cr. O 3+2 KOH = K 2 Cr 2 O 4+H 2 O
Соединения Гидроксид хрома(III) 2 Cr(OH)3+3 H 2 SO 4 = Cr 2(SO 4)3+ 6 H 2 O Cr(OH) 3+KOH = K[Cr(OH)4] 2 Cr(OH) 3+4 Na. OH(конц)+3 H 2 O 2(конц) = 2 Na 2 Cr. O 4+8 H 2 O Оксид хрома(VI) K 2 Cr 2 O 7+H 2 SO 4 = 2 Cr. O 3+K 2 SO 4+H 2 O K 2 Cr. O 4+H 2 SO 4 = Cr. O 3+K 2 SO 4+H 2 O Cr. O 3+2 KOH = K 2 Cr 2 O 4+H 2 O
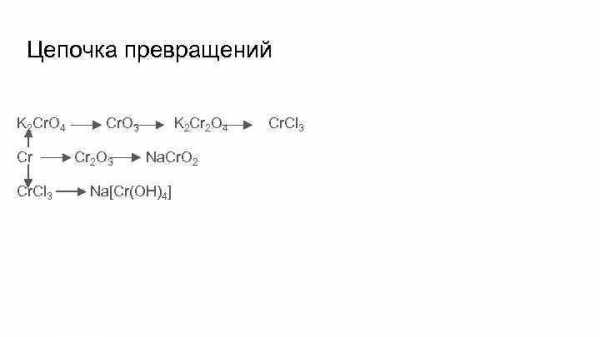 Цепочка превращений K 2 Cr. O 4 Cr Cr. Cl 3 Cr. O 3 Cr 2 O 3 K 2 Cr 2 O 4 Na. Cr. O 2 Na[Cr(OH)4] Cr. Cl 3
Цепочка превращений K 2 Cr. O 4 Cr Cr. Cl 3 Cr. O 3 Cr 2 O 3 K 2 Cr 2 O 4 Na. Cr. O 2 Na[Cr(OH)4] Cr. Cl 3
present5.com
1.1.1. Строение электронных оболочек атомов химических элементов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p+, no и e−. Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ≈ mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ≈ mn/me ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p+ | 1p+, 1n0 | 4p+, 3n0 | 4p+, 4n0 |
| оболочка | 1e− | 1e− | 4e− | 4e− |
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1Н, 2Н и 3Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и ↑.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули: на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15P = 1s22s22p63s23p3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 | |
| II | 3 | Li | литий | 1s22s1 |
| 4 | Be | бериллий | 1s22s2 | |
| 5 | B | бор | 1s22s22p1 | |
| 6 | C | углерод | 1s22s22p2 | |
| 7 | N | азот | 1s22s22p3 | |
| 8 | O | кислород | 1s22s22p4 | |
| 9 | F | фтор | 1s22s22p5 | |
| 10 | Ne | неон | 1s22s22p6 | |
| III | 11 | Na | натрий | 1s22s22p63s1 |
| 12 | Mg | магний | 1s22s22p63s2 | |
| 13 | Al | алюминий | 1s22s22p63s23p1 | |
| 14 | Si | кремний | 1s22s22p63s23p2 | |
| 15 | P | фосфор | 1s22s22p63s23p3 | |
| 16 | S | сера | 1s22s22p63s23p4 | |
| 17 | Cl | хлор | 1s22s22p63s23p5 | |
| 18 | Ar | аргон | 1s22s22p63s23p6 | |
| IV | 19 | K | калий | 1s22s22p63s23p64s1 |
| 20 | Ca | кальций | 1s22s22p63s23p64s2 | |
| 21 | Sc | скандий | 1s22s22p63s23p64s23d1 | |
| 22 | Ti | титан | 1s22s22p63s23p64s23d2 | |
| 23 | V | ванадий | 1s22s22p63s23p64s23d3 | |
| 24 | Cr | хром | 1s22s22p63s23p64s13d5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s22s22p63s23p64s23d5 | |
| 26 | Fe | железо | 1s22s22p63s23p64s23d6 | |
| 27 | Co | кобальт | 1s22s22p63s23p64s23d7 | |
| 28 | Ni | никель | 1s22s22p63s23p64s23d8 | |
| 29 | Cu | медь | 1s22s22p63s23p64s13d10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s22s22p63s23p64s23d10 | |
| 31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 | |
| 32 | Ge | германий | 1s22s22p63s23p64s23d104p2 | |
| 33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 | |
| 34 | Se | селен | 1s22s22p63s23p64s23d104p4 | |
| 35 | Br | бром | 1s22s22p63s23p64s23d104p5 | |
| 36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s22s22p1
А в возбужденном состояниии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s22s12p2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
scienceforyou.ru



