
Задачи по химии на изотопы – Задачи с решениями 13 – Строение ядра атома. Изотопы – ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. ОТРАБОТКА ТЕМАТИЧЕСКОГО МАТЕРИАЛА – ЕГЭ 2018. Тренажёр: Физика. – ЕГЭ 2018 – Справочное издание
- Комментариев к записи Задачи по химии на изотопы – Задачи с решениями 13 – Строение ядра атома. Изотопы – ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. ОТРАБОТКА ТЕМАТИЧЕСКОГО МАТЕРИАЛА – ЕГЭ 2018. Тренажёр: Физика. – ЕГЭ 2018 – Справочное издание нет
- Советы абитуриенту
- Изотопы элементов | Задачи 206
- Тест по теме «Периодический закон и система химических элементов д.И.Менделеева»
- Урок 2. Изотопы элементов – HIMI4KA
- Методика решения задач по общей химии
- Глинка Н.Л. Задачи и упражнения по общей химии
- Задачи на ядерные реакции. Уроки химии
- Интегрированный урок изучения нового материала по теме: “Изотопы”
Изотопы элементов | Задачи 206
Задача 206.
Символ одного из изотопов элемента . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид:
Ответ: .
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после распада, находим из формулы:
N% = 2-n. N0.
100%, гдеN% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
Ответ: 1,56%.
Задача 214.
Период полураспада – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение:
– распаду предшествует процесс , протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18г.
buzani.ru
Тест по теме «Периодический закон и система химических элементов д.И.Менделеева»
(Возможно несколько правильных ответов)
1. Среди всех элементов главной подгруппы I группы элемент литий обладает:
а) наиболее выраженными металлическими свойствами;
б) самой маленькой плотностью;
в) самой большой относительной атомной массой;
г) наименьшим радиусом атома.
2. Гипотетическая формула высшего оксида 115-го элемента периодической системы может иметь вид:
а) ЭО2; б) Э2О5; в) ЭО4; г) Э2О115.
3. Порядковый номер элемента с наибольшей электроотрицательностью в 4 группе периодической системы:
а) 6; б) 72; в) 82; г) 12.
4. Сколько энергетических уровней заполнено электронами в ионе калия?
а) 4; б) 3; в) 6; г) 5.
5. При сгорании 1,86 г органического вещества образовалось 3,96 г углекислого газа и 0,54 г воды. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса меньше 200 г/моль?
а) 3; б) 2; в) 15; г) 13.
6. В каких рядах химические элементы перечислены не в порядке уменьшения их атомных радиусов?
а) Ca, Mg, Be; б) S, Cl, Br;
в) Li, Na, K; г) B, Be, Li.
7. В порядке возрастания энергии ионизации расположены следующие элементы:
а) Na, Mg, Al, Si; б) Na, Mg, Ca, Si;
в) Na, Ca, Mg, Si; г) Si, Al, Mg, Na.
8. По происхождению (этимологии) названий «лишним» в перечне элементов будет:
а) селен; б) теллур; в) ниобий; г) церий.
9. Одинаковое по абсолютной величине, но разное по знаку значение степени окисления в летучем водородном соединении и в высшем оксиде имеет элемент:
а) бор; б) азот; в) сера; г) углерод.
10. Свойства высших оксидов элементов 3-го периода изменяются следующим образом:
а) амфотерные, основные, кислотные;
б) основные, кислотные, амфотерные;
в) основные, амфотерные, кислотные;
г) кислотные, амфотерные, основные.
Ключ к тесту
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
б, г | б | а | б | г | б, в, г | а, в | в | г | в |
Задачи на изотопы
Уровень А
1. Рассчитать изотопный состав (в %) водорода (средняя относительная атомная масса Ar = 1,008) и лития (Ar = 6,9), предполагая, что каждый элемент состоит только из двух изотопов, относительные атомные массы которых отличаются на единицу.
Ответ. Водород: 1Н – 99,2% и 2Н – 0,8%; литий: 6Li – 10% и 7Li – 90%.
2. Относительная атомная масса природного водорода составляет 1,00797. Этот водород является смесью изотопов протия (Ar = 1,00782) и дейтерия (Ar = 2,0141). Какой процент дейтерия в природном водороде?
Ответ. 0,015%.
3. Среди приведенных символов элементов укажите изотопы и изобары:
Ответ. У изотопов одинаковые химические символы, у изобаров одинаковые атомные массы.
4. Природный литий (Ar = 6,9) состоит из изотопов с массовыми числами 6 и 7. Сколько процентов первого изотопа* он содержит?
Ответ. 10%.
5. Масса атома изотопа магния равна 4,15•10–23 г. Определите число нейтронов, которое содержит ядро этого атома.
Ответ. 13.
6. Медь имеет два изотопа с массовыми числами 63 и 65. Массовая доля их в природной меди составляет соответственно 73% и 27%. На основании этих данных рассчитайте среднюю относительную атомную массу природной меди.
Дано:
(63Cu) = 73%,
(65Cu) = 27%.
Найти:
Ar(Cu).
Решение
Пусть m(образца) = 100 г, тогда m(63Cu) = 73 г; m(65Cu) = 27 г.

Ответ. 63,54.
7. Средняя относительная атомная масса природного хлора равна 35,45. Вычислите массовые доли двух его изотопов, имеющих массовые числа 35 и 37.
Ответ. 77,5% и 22,5%.
8. Определите относительную атомную массу бора, если известны массовые доли его изотопов (10В) = 19,6% и (11В) = 80,4%.
Ответ. 10,804.
9. Литий состоит из двух природных изотопов с массовыми числами 6 (1 = 7,52%) и 7 (2 = 92,48%). Рассчитайте относительную атомную массу лития.
Ответ. 6,9248.
10. Рассчитайте относительную атомную массу кобальта, если известно, что в природе существуют два его изотопа: с массовыми числами 57 (1 = 0,17%) и 59 (2 = 99,83%).
Ответ. 58,9966.
11. Относительная атомная масса бора составляет 10,811. Определите процентное содержание в природном боре изотопов с массовыми числами 10 и 11.
Ответ. 18,9% и 81,1%.
12. Галлий имеет два природных изотопа с массовыми числами 69 и 71. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если относительная атомная масса элемента 69,72.
Ответ. 1,78:1.
13. Природный бром имеет два изотопа с массовыми числами 79 и 81. Относительная атомная масса брома 79,904. Определите массовую долю каждого из изотопов в природном броме.
Ответ. 54,8% и 45,2%.
Уровень Б
1. Кремний имеет три стабильных изотопа – 30Si (3,05 %(мол.)), 29Si и 28Si. Вычислите содержание (в %(мол.)) самого распространенного изотопа кремния. Как будут отличаться молярные массы диоксида кремния, имеющего разный изотопный состав, если учесть, что кислород имеет три стабильных изотопа с массовыми числами 16, 17 и 18?
Ответ. 94,55%; 18 видов молекул диоксида кремния.
2. Образец состоит из смеси двух изотопов одного элемента; 30% составляет изотоп, в ядре атома которого – 18 нейтронов; 70% составляет изотоп, в ядре атома которого – 20 нейтронов. Определите порядковый номер элемента, если средняя относительная атомная масса элемента в смеси изотопов составляет 36,4.
Ответ. 17.
3. Химический элемент состоит из двух изотопов. В ядре атома первого изотопа – 10 протонов и 10 нейтронов. В ядре атома второго изотопа – нейтронов на 2 больше. На 9 атомов более легкого изотопа приходится один атом более тяжелого изотопа. Вычислите среднюю относительную атомную массу элемента.
Ответ. 20,2.
4. Изотоп 137Cs имеет период полураспада 29,7 лет. 1 г этого изотопа прореагировал со взрывом с избытком воды. Каков период полураспада цезия в образовавшемся соединении? Ответ обоснуйте.
Ответ. T1/2 = 29,7 лет.
5. Через сколько лет количество радиоактивного стронция-90 (период полураспада 27 лет), выпавшего с радиоактивными осадками в результате ядерного взрыва, станет менее 1,5% от того количества, которое было обнаружено в момент после ядерного взрыва?
Ответ. 163,35 лет.
6. В методе меченых атомов радиоактивные изотопы используют для того, чтобы «проследить маршрут» некоторого элемента в организме. Так, пациенту с больной поджелудочной железой вводят препарат радиоактивного изотопа йода-131 (претерпевает –-распад), что позволяет врачу проследить за прохождением йода по организму больного. Напишите уравнение радиоактивного распада и рассчитайте, через какое время количество радиоактивного йода, введенного в организм, уменьшится в 10 раз (период полураспада 8 сут).
Ответ.
7. Сколько времени потребуется для того, чтобы три четверти никеля превратились в медь в результате –-распада, если период полураспада изотопа 6328Ni составляет 120 лет?
Дано:
T1/2(6328Ni) = 120 лет.
Найти: .
Решение
Ответ. 240 лет.
8. Найдите массу изотопа 81Sr (период полураспада 8,5 ч), оставшуюся после 25,5 ч хранения, если первоначальная масса составляла 200 мг.
Ответ. 25 мг.
9. Вычислите процент атомов изотопа 128I (период полураспада 25 мин), оставшихся нераспавшимися после его хранения в течение 2,5 ч.
Ответ. 1,5625%.
10. Период полураспада –-радиоактивного изотопа 24Na равен 14,8 ч. Напишите уравнение реакции распада и вычислите, сколько граммов дочернего продукта образуется из 24 г этого изотопа за 29,6 ч.
Ответ.
11. Изотоп 210Ро, излучающий -частицы, используется в смеси с бериллием в нейтронных источниках. Через какое время интенсивность таких источников уменьшится в 32 раза? Период полураспада изотопа равен 138 дням.
Ответ. 690 сут.
studfiles.net
Урок 2. Изотопы элементов – HIMI4KA
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.

Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
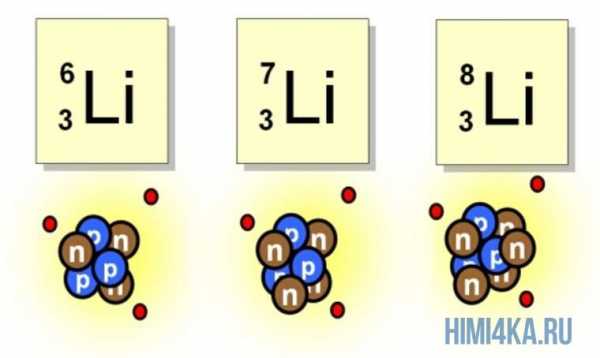
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
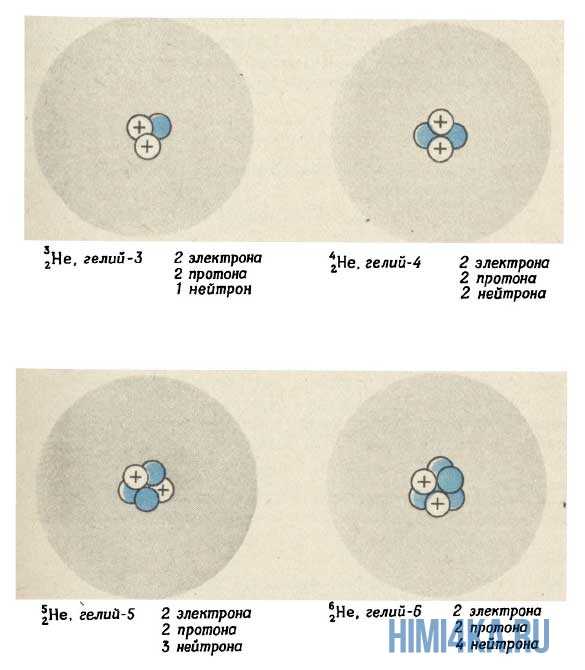
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Методика решения задач по общей химии
приобрестиМетодика решения задач по общей химии
скачать (394.6 kb.)
Доступные файлы (1):
n1.docx
Шукова Марина Геннадьевна
Задачи по общей химии
Самара
Шукова М.Г.
Задачи по общей химии: Учебное пособие для студентов высших учебных заведений – Самара, 2009.
Учебное пособие составлено на основе решения контрольных работ для СГАУ, СИИЖТ, ПГАТИ, СГТУ, МГУП и других учебных заведений.
Содержание
1. Атом 5
2. Молекула. Моль. Стехиометрические законы. Основные газовые законы. Закон Авогадро. Мольный объем газа 6
3. Выводы химических формул 8
4. Эквивалент. Закон эквивалентов 11
5. Электронная структура атомов 15
6. Периодическая система элементов. Основные классы неорганических соединений 19
6. Химическая связь 24
7. Энергетика химических реакций 28
8. Скорость химической реакции. Химическое равновесие 32
9. Способы выражения растворенного вещества в растворе. 35
10. Растворы слабых электролитов 39
10. Растворы сильных электролитов. Обменные реакции 40
11. Гидролиз солей 41
12. Растворимость. Произведение растворимости 42
13. Окислительно-восстановительные реакции 43
14. Электродные потенциалы. Уравнение Нернста 45
15. Химические источники тока 46
16. Электролиз 47
17. Коррозия 48
18. Комплексные соединения 49
19. Свойства элементов и их соединений 49
20. Жесткость воды 51
21. Введение в органическую химию 51
1. Атом
Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.
Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Z электронов.
Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым Z, но разными N.
Изобары – атомы с одинаковым A, но разными Z.
Изотоны – атомы с одинаковым N, но разными A.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина):
Она численно равна атомной массе элемента.
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) и число протонов Z (нижний).
Задача 1. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение. Число электронов равно Z = 73, следовательно, число протонов так же равно Z = 73.
Массовое число атома А = Z + N = 181, тогда число нейтронов равно: N = А – Z = 181 – 73 = 108
Это – тантал 181 73Ta
Задача 2. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробными числами? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
Решение: Ядра, содержащие одинаковое число протонов, входят в состав атомов одного и того же элемента. Но они могут содержать различное число нейтронов и, следовательно, иметь разную массу. Разновидности атомов одного и того же химического элемента, отличающиеся своей массой, называются изотопами («равное место»).
Почти все химические элементы состоят из нескольких изотопов, поэтому их атомные массы, являющиеся средними арифметическими величинами от масс изотопов, выражаются не целыми, а дробными числами. Для водорода известно три изотопа: протий 11Н (легкий или обычный водород), дейтерий 21Н или D (тяжелый водород) и тритий 31Н или Т (сверхтяжелый водород).
Кислород состоит из трех изотопов: 168О; 178О;188О.
Среди многочисленных изотопов различных элементов можно найти ядра разного заряда, но с одинаковой массой. Различные элементы, атомы которых обладают одинаковой массой, называют изобарами («равная тяжесть»).
Очевидно, что изобары содержат одинаковое число нуклонов, но разные числа протонов и, следовательно, нейтронов. Например, изобары: 4018Ar;4019K;4020Ca.
Задача 3. Символ одного из изотопов элемента 5224Э. Указать: а) название элемента; б) число протонов и нейтронов в ядре) число электронов в электронной оболочке атома.
Решение. Число протонов Z = 24, число нейтронов N = А – Z = 52-24 = 28.
Это – хром 5224Cr
Число электронов равно порядковому номеру или числу протонов.
24Cr – ( 2к ( 8 к ( 8 к ( 6 к
n = 1 n = 2 n = 3 n = 4
24Cr – 1s2 2s22р6 3s23р6 4s23d4
Задача 4. Природный магний состоит из изотопов 24Mg; 25Mg; 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6; 10,1 и 11,3.
Решение:
Средняя атомная масса природного магния:
А = 24*0,786 + 25*0,101 + 26* 0,113 = 24,327 а.е.м.
Задача 4. Природный хлор представлен двумя изотопами 35Сl и 37Сl. Во сколько раз ядер 35Сl больше, чем ядер 37Сl?
Для решения использованием правило креста (правило Пирса).
Найдем разницу в числах по диагонали 35-35,5 =-0,5; 37-35,5 =1,5
35Сl 35 1,5
35,5
37Cl 37 0,5
Ответ: Полученное соотношение 1,5:0,5 свидетельствует, что атомов хлора с массовым числом 35 в три раза больше.
nashaucheba.ru
Глинка Н.Л. Задачи и упражнения по общей химии
Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264с., ил.
Задачи 206-227
206. Символ одного из изотопов элемента 5224Э. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома. Решение
207. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа. Решение
208. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента. Решение
209. В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора. Решение
210. Природный магний состоит из изотопов 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3. Решение
211. Природный галлий состоит из изотопов 71Ga и 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72? Решение с ключом
212. Найти массу изотопа 81Sr (T1/2=8,5 ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг. Решение
213. Вычислить процент атомов изотопа 128I (T1/2=25 мин), оставшихся не распавшимися после его хранения в течение 2,5 ч. Решение с ключом
214. Период полураспада β– – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24 г 24Na за 29,6 ч. Решение с ключом
215. Закончить уравнения реакций радиоактивного распада: а) 23892U→α; б) 23592U→α; в) 23994Pu→α; г) 8637Rb→β–; д) 23490Th→β–; е) 5725Mn→β–; ж) 189F→β+; з) 116C→β+; и) 4522Ti→β+. В каких случаях дочерний атом является изобаром материнского атома? Решение с ключом
216. Какой тип радиоактивного распада наблюдается при следующих превращениях: а) 22688Ra→22286Rn; б) 23993Np→23994Pu; в) 15262Sm→14860Nd; г) 11146Pd→11147Ag? Решение с ключом
217. Записать уравнения ядерных реакций: а) 6128Ni+11H→?→?+10n; б) 105B+10n→?+42He; в) 2713Al+11H→?+42He; г) ?+11H→8335Br→?+10n. Решение с ключом
218. Написать полные уравнения ядерных реакций: а) 7030Zn[p, n]?; б) 5123V[α, n]?; в) 5626Fe[D, ?]5727Co; г) ?[α, D]3417Cl; д) 5525Mn[?, α]5223V. Решение с ключом
219. Как изменяются массовое число и заряд атома изотопа: а) при последовательном испускании α-частицы и двух β-частиц; б) при поглощении ядром двух протонов и испускании двух нейтронов; в) при поглощении одной α-частицы и выбрасывании двух дейтронов? Решение с ключом
220. Сколько α и β–-частиц должно было потерять ядро 226Ra для получения дочернего элемента с массовым числом 206, принадлежащего IV группе периодической системы элементов? Назвать этот элемент. Решение с ключом
221. Ядро атома изотопа 23892U в результате радиоактивного распада превратилось в ядро 22688Ra. Сколько α- и β–-частиц испустило при этом исходное ядро? Решение с ключом
222. Изотоп 40K превращается в изотоп 40Ca. Какой тип радиоактивного распада при этом реализуется: а) α-распад; б) β–-распад; в) β+-распад; г) захват электрона; д) спонтанное деление? Решение
223. Какой тип радиоактивного распада приведет к образованию дочернего ядра, являющегося изобаром по отношению к исходному ядру: а) α-распад; б) β–-распад; в) β+-распад; г) захват электрона; д) ни один из этих процессов? Решение
224. Как изменяется массовое число и заряд атома при испускании одной α-частицы и двух β–-частиц: а) заряд уменьшится на 2, а массовое число – на 4; б) заряд увеличится на 2, а массовое число уменьшится на 4; в) заряд не изменится, а массовое число уменьшится на 4; г) ни заряд, ни массовое число не изменятся? Решение
225. Фотон жесткого γ-излучения выбивает из ядра 2612Mg протон. При этом образуется: а) ядро-изотоп 2612Mg; б) ядро-изобар 2612Mg; в) ядро-изотоп 2311Na; г) ядро-изобар 2311Na. Решение
226. К какому радиоактивному семейству относится изотоп 207Pb: а) 232Th; б) 237Np; в) 227Ac; г) 238U? Решение
227. Может ли в природе находиться изотоп 222Rn с T½=3,2 дня а) да; б) нет? Потому что: 1) период полураспада этого изотопа много меньше времени существования Земли; 2) этот изотоп является членом радиоактивного семейства; 3) у радона есть более долгоживущие изотопы. Решение
reshchem.ucoz.ru
Задачи на ядерные реакции. Уроки химии
Сегодня у нас урок по химии 67 – Задачи на ядерные реакции. Как изучить? Полезные советы и рекомендации – повторите урок по химии 6 — периодический закон и периодическая система химических элементов. Строение атома. Химическая связь и строение вещества.
При обнаружении неточностей, или если появятся неясные моменты, просьба написать в комментариях. Отвечу на все вопросы.
52
- Символ одного из элементов 24Э. Указать: а) название элемента: б) число протонов и нейтронов в ядре: в) число электронов в электронной оболочке атома.
- Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести его запись символа с указанием заряда ядра и массового числа.
- Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
- В природных соединениях хлор находится в виде изотопов 37Cl (24,5%) и 35Cl (75,5%) (масс.). Вычислить среднюю атомную массу природного хлора.
- Природный магний состоит из изотопов 24Mg, 25Mg и 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6 , 10,1 и 11,3 .
- Природный галлий состоит из изотопов 71Ga и 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
- Записать уравнения ядерных реакций: ®
61 1 1 10 1 4
а) 28Ni + 1H →? →? + 0n; б) 5B + 0n →? + 2He;
27 1 4 1 83 1
в) 13Al + 1H →? + 2He; г) ? + 1H → 35Br →? + 0n
- Написать полные уравнения ядерных реакций:
70 51 56 57 34
а) 30Zn (β, n)?; б) 23V (α, n)?; в) 26Fe (β,?) 27Co; г) ? (α,β) 17Cl;
55 52
д) 25Mn (?,α) 23V.
- Как изменяются массовое число и заряд атома изотопа: а) при последовательном испускании α — частицы и двух В-частиц: б) при поглощении ядром двух протонов и испускании двух нейтронов: в) при поглощении одной α — частицы и выбрасывании двух нейтронов.
- Сколько α — и β — частиц должно было потерять ядро Ra226 для получения дочерного элемента с массовым числом 206, принадлежащего V группе периодической системы элементов? Назвать этот элемент.
238
- Ядро атома изотопа 92U в результате радиоактивного распада
226
превратилось в ядро 88Ra. Сколько α и β — частиц испустило при этом исходное ядро.
Это у нас был урок по химии 67 – Задачи на ядерные реакции.
Расскажите об этой статье друзьям:
Friend me:
к нашему сайту.
sovety-tut.ru
| 2. Д/З. Подготовка уча-щихся к восприятию новых знаний. Формулирование цели урока. | Учитель физики. Окружающий нас мир
полон тайн и загадок. Что может быть интереснее
постиженье этих тайн. И что может быть прекраснее
человеческого стремления к вершине познания
окружающего мира. В XIX в. ученые столкнулись с
рядом непонятных явлений, которые необходимо
было объяснить. В 1906 г. был открыт новый элемент
ионий (заряд ядра +90, относительная атомная масса
230 атомных единиц массы (а. е. м.), а в 1907 г. —
элемент мезоторий (заряд ядра +88) и элементы радий
В и радий D(заряды их ядер совпадали – + 82). Вопрос,
который физики поставили перед химиками: новые
это элементы или нет ? Учитель химии. Химическим
путем невозможно отличить ионий и торий,
мезоторий и радий, радий В и радий D и свинец. Это
наводило на мысль, что открыты не новые элементы.
Тогда что это за элементы? Учитель физики.
Элементы удалось разделить с помощью
масс–спектрографа Астона, а не химическим путем.
Масс–спектрограф – прибор для измерения масс
заряженных частиц. Принцип измерения масс
заряженных частиц основан на том, что радиус
окружности, по которой движется заряженная
частица в однородном магнитном поле,
пропорционален массе частицы. Зная радиус
окружности, можно найти массу частицы: m~R Полагая, что ионы однозарядные, определим, какому химическому элементу они соответствую. Не – m1 = 4 а.е.м. Не – m2 = 3 а.е.м. Мы получили Не, который в таблице Менделеева находиться под номером 2, но массовые числа этих элементов различны. То есть мы получили элементы с одинаковым порядковым номером и с разными массовыми числами, такие элементы называются изотопами, и это тема нашего урока. |
Уч-ся находят какие химические элемента имеют такой же порядковый номер в таб. Менделеева. | 3. Д/З. Восприятие, осмысление и первичное запоминание нового материала. | Учитель химии. Что же такое изотопы?
Изотопы – это вещества, имеющие одинаковый
заряд, но отличающиеся относительной атомной
массой. В периодической системе под символами
химических элементов приведены дробные значения
их атомных масс. Почему? Чтобы ответить на этот
вопрос давайте решим задачу и определим значение
атомной массы Fe – I вариант и Ca – II вариант.
Данные возьмём в таблице: для железа известны 4
изотопа с атомными массами, а для кальция 5
изотопов с массами. Что же у нас получилось? У Fe –
55,9 У Ca – 40,1 Посмотрите: у всех такие цифры. А
теперь обратимся к периодической системе Д. И.
Менделеева. Какое массовое число у Fe, у Ca. Таким
образом, мы с вами показали, что атомная масса
химического элемента является средним значением
всех его изотопов с учётом распространённости в
природе. А число изотопов для каждого элемента
может быть разным. Учитель физики. В чем
различие строения ядер изотопов? Пример:
Различие – в нейтронах. Зависят ли, физические свойства соединений от масс ядер мы послушаем сообщение. СООБЩЕНИЕ. Атомы водорода и кислорода, образующие воду, могут иметь различные массовые числа и отличаться друг от друга своими физико-химическими свойствами. При этом они имеют одинаковый заряд атомных ядер. Известны, пять изотопов водорода и пять изотопов кислорода. Радиоактивны 4Н, 5Н, 14О, 15О, они очень короткоживущие. Наиболее широко известны: 1Н, 2Н, 3Н, 16О, |7О, 18О. Эти изотопы могут образовывать 18 изотопических разновидностей воды. В земных водах содержится легкой воды 99,75%, тяжелой кислородной — 0,18%, а тяжелой водородной - 0,01%. Изотопические разновидности воды различаются прежде всего своими физико-химическими характеристиками:
Оксид дейтерия (тяжелая вода) активно реагирует с водой: D2О + Н2О 2НDО. Растворимость некоторых солей в тяжелой воде заметно меньше, чем в обычной. С повышением содержания дейтерия уменьшается скорость некоторых реакций. Учитель химии. Мир химических элементов очень многообразен. И наряду с изотопами в 1934 году были открыты изобары. А изобары это вещества с одинаковой молекулярной массой, но с разным числом протонов и электронов, а следовательно и разными химическими свойствами. Например Ar и К. имея одинаковые массы, они отличаются зарядом ядра и резко отличаются химическими свойствами К – щелочной металл, а Аr – инертный газ. Но в том-то и, гениальность, проявление научной интуиции великого русского химика Д. И. Менделеева, что он в указанном случае и ещё в 3Х предпочёл расположить элементы не по массе, а по сходству в свойствах. Он предугадал истинный порядок размещения химических элементов по возрастанию зарядов их атомных ядер, хотя о строении их атомов ничего не знал. И именно наличие изотопов доказывает, что свойства элементов определяются зарядом их атомных ядер. Знаете, можно много говорить о том какой элемент: простой или смешанный – для химии это не имеет особого значения, так как она не может их различить даже с помощью самых тонких методов анализа. Но иногда это отличие становится гибельным как для жителей Хиросимы и Чернобыля. И наш век не случайно называют атомным: атомные корабли, атомные электростанции, атомные бомбы. Ведь большинство изотопов образуется в результате радиоактивного распада. Но Константин Эдуардович Циолковский сказал, что: “Человек на то имеет разум и науку, чтобы обезопасить себя от всякого бедствия”. А теперь давайте послушаем сообщение о применении изотопов для блага, а не во вред. |
Дети формулируют свое определение.
Ответы записать на доске Отвеч. уч-ся Ученик делает сообщение Сообщение ученика |
4. Д/З. Выявление уровня осмысления уч-ся нового материала. | Учитель физики. Давайте теперь
применим наши знания и умения для вычисления
массового числа, числа протонов, нейтронов,
электронов, нуклонов. ВОПРОСЫ
1.Массовое число 2.Число протонов 3.Число нейтронов 4.Число электронов 5.Число нуклонов |
Уч-ся отвечают на вопросы на листочках с копиркой после чего копирку с первым листом сдают, а второй лист оставляют для самопроверки |
xn--i1abbnckbmcl9fb.xn--p1ai



