Решение сложных задач по химии: Решение сложных задач на нахождение формулы вещества
- Комментариев к записи Решение сложных задач по химии: Решение сложных задач на нахождение формулы вещества нет
- Разное
- Решение сложных задач на нахождение формулы вещества
- «Решение задач по химии повышенной сложности»
- Решение задач
- Как решать 34 задание ЕГЭ по химии, примеры и алгоритмы решения заданий 34 по химии (Ростов-на-Дону)
- Решение расчетных задач повышенной сложности по химии. 8 класс
- «Хочешь сотку — поищи по закоулкам учебников». Как ЕГЭ по химии снесло шаблон – Общество – Новости Санкт-Петербурга
- Решение сложных задач по химии 9
- 1.
- (PDF) Решение задач в химии
- Задачи составления комплексных решений: знание с чего начать
- Произошла ошибка при настройке пользовательского файла cookie
- Решение сложных химических равновесий с использованием метода на основе геометрического программирования на JSTOR
- Разработка компьютерной оценки решения сложных задач в химии | International Journal of STEM Education
- Образец и процедура
- Меры
- Зависимая переменная: комплексная компетентность в решении проблем
- Разработка компьютерной оценки CPS
- Измерение «понимания и характеристики проблемы»
- Измерение «представления проблемы»
- Измерение «решения проблемы»
- Измерение «отражения и передачи решения»
- Данные файла журнала
- Качество схемы кодирования
- Ковариаты комплексной компетенции решения проблем
- Анализ данных
- Молниеносное решение сложных физических задач
Решение сложных задач на нахождение формулы вещества
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH 2F2 (на один атом углерода приходится два атома водорода и два атома фтора).
2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.
4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.
Но на сегодняшний день полного отказа от фреонов еще не произошло.
Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
КупитьВильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н. у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.
Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании.
Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Что ещё почитать?
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.
Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.
Тогда
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.
Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
Отсюда легко находим молекулярную массу карбоновой кислоты.
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
Число протонов равно количеству электронов:
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#
«Решение задач по химии повышенной сложности»
Тема 1. Структура химической задачи.
Две стороны химической задачи. Анализ задачи, выделение химической и математической частей, способы задания условий: неполные, лишние и неопределенные математические данные задачи.
Понятие о взаимно обратных задачах. Обратная задача и ее составление. Составление простых и сложных задач по химическим формулам веществ.
Структура задач по уравнениям химических реакций. Их составление.
Сложные задачи, использование комбинированных знаний из разных разделов химии и других предметов. Оригинальность вопроса нестандартных задач, наличие неопределенности, исторических сведений, включение разнообразных названий веществ. Занимательные задачи. Тривиальная и современная номенклатура химических соединений.
Тема 2. Вычисления по химическим формулам.
Расчёты с использованием газовых законов, относительной плотности смеси газов, объёмной и мольной доли веществ в смеси.
Вычисления средней молярной массы смеси. Нахождение массовой доли элемента в веществе, массы химического элемента в образце вещества, определение химического элемента на основании его массовой доли и степени окисления в бинарных соединениях.
Нахождение молекулярной формулы вещества по его абсолютной и относительной плотности паров и массовой доле элементов.
Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания.
Нахождение массы элемента, если известна масса вещества; и массы вещества, если известна масса элемента.
Решение задач на смеси алгебраическим способом.
Тема 3. Задачи на растворы.
Различные способы решения задач на растворимость. Растворимость кристаллогидратов и их осаждение из насыщенных растворов. Задачи с использованием сведений о растворимости кристаллогидратов или связанные с их получением. Задачи на вычисление массовой доли растворенного вещества при растворении кристаллогидратов и обратные задачи. Сравнение понятий «растворимость» и «массовая доля растворенного вещества в растворе». Правило смешения и алгебраический способ решения задач на смешивание растворов.
Понятие концентрации раствора. Молярная концентрация. Решение олимпиадных задач с применением разнообразных способов выражения содержания растворенного вещества в растворах. Переход от одной концентрации к другой.
Тема 4. Вычисления по уравнениям реакций.
Расчёт количества вещества, массы продукта реакции, если исходное вещество дано с примесями, расчёт массы исходного вещества, соединяющего примеси, по продуктам реакции.
Задачи на избыток-недостаток.
Расчёт продукта реакции, веществ, содержащихся в растворах после реакции, если одно из реагирующих веществ дано в избытке.
Расчёты массовой доли выхода продукта реакции
Тема 5. Вычисления по термохимическим уравнениям реакций.
Термохимические уравнения реакций. Расчёты по термохимическим уравнениям. Тепловой эффект реакции. Энтальпия.
Тема 6. Окислительно-восстановительные реакции.
Окислитель, восстановитель, процессы окисления и восстановления. Составление уравнений окислительно-восстановительных реакций. Расчёты по уравнениям окислительно-восстановительных реакций. Электролиз.
Тема 7. Решение заданий и задач повышенной сложности, олимпиадных задач.
Решение задач
ХИМИЯПредлагаем цикл занятий “Развивай навыки решения задач по химии” (программа 12.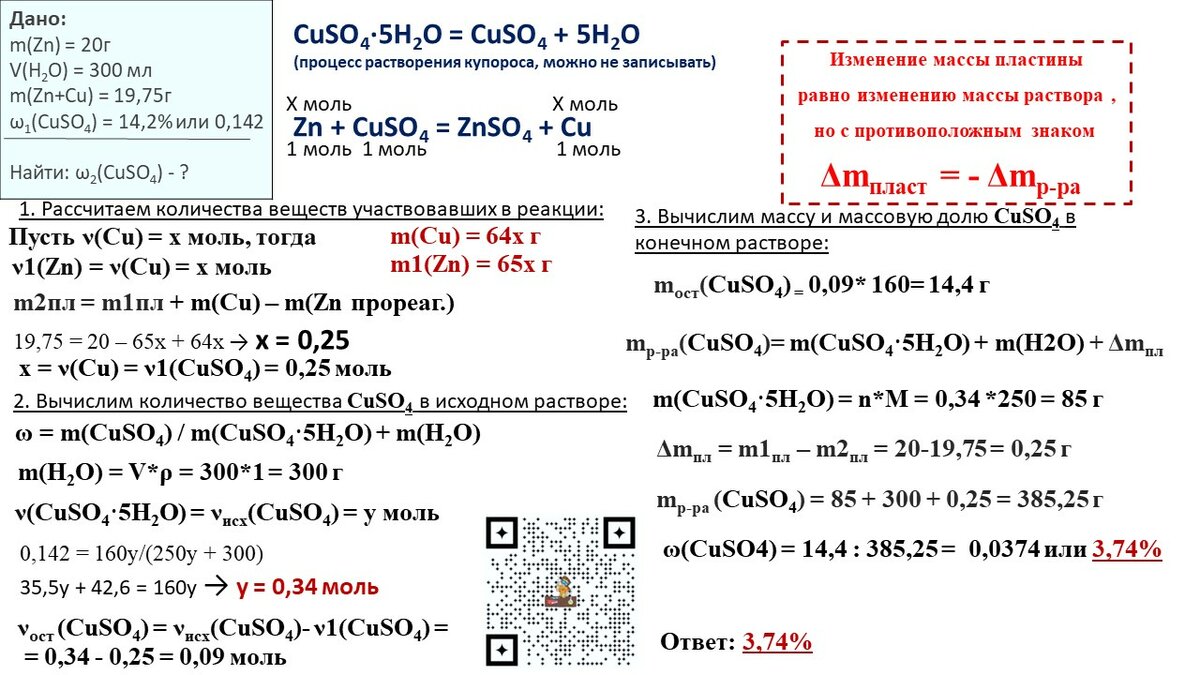 5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ химии.
5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ химии.
Достаточно часто решение задач по химии доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по химии освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящие формулы и путь решения.
Наша цель, чтобы в результате данных занятий участники приобрели следующие навыки и умения:
- научились правильно определять заданные величины в заданиях и таблицах данных;
- научились использовать и преобразовывать формулы в соответствии с условиями задач;
- определять свой путь решения задачи;
- выбрать соответствующие формулы в комплексных задачах;
- правильно составлять химические формулы по названиям;
- правильно составлять уравнения реакций;
- проверять правильность составленного уравнения реакций;
- находить взаимосвязь уравнений реакций с расчетами.

Темы занятий:
- Количество вещества. Молярная масса. Молярный объем. Число Авогадро. Число атомов и молекул.
- Уравнения реакций. Степени окисления. Индексы. Коэффициенты. Цепи реакций.
- Задачи с уравнениями реакций. Молярное соотношение. Преобладание реагентов.
- Задачи, в вычисление которых используют растворы. Молярная масса. Молярная концентрация. Кристаллогидраты. Смешивание растворов.
- Комбинированные задачи с уравнениями реакций и растворами.
ЗАПИСАТЬСЯ
ФИЗИКА
Предлагаем цикл занятий “Развивай навыки решения задач по физике” (программа 12.5 ч , 5 дней) для учеников 8-9 классов. К курсу также могут присоединиться ученики 10-12-х классов, которые хотят улучшить свои знания основ физики.
Достаточно часто решение задач по физике доставляет определенные сложности. Почему? У каждого будет свой ответ. Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.
Мы в свою очередь на дополнительных занятиях по физике освоим алгоритмы решения задач, которые помогут справиться не только с задачами уровня основной школы, но и сформируют базовые навыки для решения задач уровня средней школы. Во время занятий поможем систематизировать алгоритмы решения задач таким образом, чтобы в процессе решения можно было легко выбрать наиболее подходящий путь решения и формулы.
Цель команды нашей школы, чтобы в результате этих занятий участники приобрели следующие навыки и умения:
- правильно определить заданные величины и задании и в таблицах данных;
- использовать и преобразовывать формулы в соответствии с условиями задач;
- объединить несколько формул решений в одно;
- определить свой путь решения задачи;
- преобразовывать и анализировать единицы измерения;
- вычислить и преобразовать числа в нормальную форму;
- оценить достоверность полученного ответа;
- отобразить в задании происходящие процессы и развить воображение.

Темы занятий:
- Механика (скорость, ускорение, сила, гравитация)
- Энергия (потенциальная и кинетическая энергия, теплота, сохранение энергии)
- Волны (свет, звук)
- Электричество (Закон Ома, электрические цепи, мощность)
- Комбинированные задачи (в которых объединены несколько тем по физике)
ЗАПИСАТЬСЯ
ОПЛАТА И ДРУГАЯ ВАЖНАЯ ИНФОРМАЦИЯ
Занятия будут проходить 1 раз в неделю, 5 раз.
Длительность одного занятия – 2,5 часа (включен перерыв – 15 минут).
В каждом занятии 20% времени предусмотрено на разъяснение теории и 80% времени на практическое решение задач.
Количество участников: до 16 учеников
Взять с собой: тетрадь для записей, ручка, калькулятор.
Занятия будут проходить удаленно через платформу Google Classroom
Включенные в программу задачи дифференцированы по нескольким уровням сложности, начиная с базового и вплоть до уровня олимпиадных задач. Таким образом каждый участник приобретет новые знания и навыки независимо от уровня знаний на начало занятий. Занятие проводит учитель с ассистентом, чтобы была возможность при решении задач уделить каждому участнику индивидуальное внимание и обеспечить максимально эффективные процесс обучения. Уровень освоения материала будет оцениваться с помощью теста в конце каждого занятия. По окончанию всего цикла занятий будет проведен завершающий тест для закрепления и проверки приобретенных знаний и навыков.
Таким образом каждый участник приобретет новые знания и навыки независимо от уровня знаний на начало занятий. Занятие проводит учитель с ассистентом, чтобы была возможность при решении задач уделить каждому участнику индивидуальное внимание и обеспечить максимально эффективные процесс обучения. Уровень освоения материала будет оцениваться с помощью теста в конце каждого занятия. По окончанию всего цикла занятий будет проведен завершающий тест для закрепления и проверки приобретенных знаний и навыков.
Цена: 75 Eur за всю программу (5 раз), 20 Eur за отдельное занятие (отдельно можно посещать только темы 1, 2, 3, 4 занятия).
Оплатить занятия следует до начала первого занятия по Счету, который будет вам выставлен и выслан после заполнения заявки – анкеты.
ЗАПИСАТЬСЯ
ДАТЫ БЛИЖАЙШИХ КУРСОВ
ДРУГИЕ КУРСЫ:
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Как решать 34 задание ЕГЭ по химии, примеры и алгоритмы решения заданий 34 по химии (Ростов-на-Дону)
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
| Дано: | Анализ и решение: |
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».
При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».
Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, h3O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).
Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.
2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:
Пусть прореагировало x моль Cu(NO3)2, тогда
г)
3) По уравнению (1) находим количество прореагировавшего HNO3:
г)
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а)
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а)
в) находим количество вещества HNO3 в отобранной порции:
а)
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).
б) По уравнению (3).
в)
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Дано: | Анализ и решение: |
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова
и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».
2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»
3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»
4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество Nh5NO3.
Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.
В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество Nh5NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(Nh5NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12h3O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,
б)
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):
в) по уравнению (3):
г)
3) По уравнению (3) находим количество Nh5NO3:
а)
4) По уравнению (3) находим количество образовавшегося Al(OH)3:
5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
6) Находим массовую долю Nh5NO3 в растворе:
а)
б)
РЕКОМЕНДУЕМЫЕ ТОВАРЫ
Решение расчетных задач повышенной сложности по химии. 8 класс
Программа «Решение расчетных задач повышенной сложности по химии» способствует выявлению и развитию талантливых обучающихся, обучающихся, проявивших выдающиеся способности, а также профессиональной ориентации и самоопределению обучающихся.
Олимпиадные задания по химии можно условно разделить на два класса: расчетные, решение которых можно привести к несложным алгоритмам, и качественные, для решения которых необходимы знание большого количества фактологического материала, химическая эрудиция, а подчас и общая эрудиция. Условно, потому что крайне редко встречаются чисто расчетные или чисто качественные задачи. Первым шагом, «зацепкой» для решения качественных задач часто служит расчёт. А также встречаются задачи, которые можно решить как с помощью химической эрудиции, так и произведя вычисления. Однако веществ известно почти 30 млн, поэтому даже очень хороший химик не может помнить формулы всех соединений вместе с их физическими и химическими свойствами. В связи с этим школьнику, проявляющему способности и желание принимать участие в олимпиадах, просто необходимо владеть навыками решения расчетных задач по химии.
А также встречаются задачи, которые можно решить как с помощью химической эрудиции, так и произведя вычисления. Однако веществ известно почти 30 млн, поэтому даже очень хороший химик не может помнить формулы всех соединений вместе с их физическими и химическими свойствами. В связи с этим школьнику, проявляющему способности и желание принимать участие в олимпиадах, просто необходимо владеть навыками решения расчетных задач по химии.
Региональный и заключительный этапы проводятся для 9 и старших классов, а химию в школе начинают изучать в 8, позже всех остальных предметов. Поэтому для успешного участия в олимпиадах, необходимо максимально интенсифицировать изучение химии восьмиклассниками, в чем может помочь настоящий курс.
Цель программы: подготовка восьмиклассников к предстоящему участию в муниципальном, региональном и заключительном этапах Всероссийской олимпиады школьников.
Практика, предусмотренная ДООП: решение задач повышенной сложности
Целевая аудитория:
- обучающиеся 8 классов школ Кемеровской области с хорошими и отличными знаниями по химии, мотивированные к изучению химии и участию в олимпиадах высокого уровня;
- победители олимпиад по математике, физике, биологии и другим предметам, проявляющие интерес к дисциплинам естественнонаучного цикла;
- дети из классов с углубленным изучением предметов, системы дополнительного образования.

В результате освоения программы обучающийся будет:
Знать:
- способы выражения концентрации веществ;
- основы стехиометрии.
Уметь:
- производить расчеты без химических реакций;
- производить расчеты с использованием химических реакций.
Программа состоит из пяти модулей общей продолжительностью 28 часов.
«Хочешь сотку — поищи по закоулкам учебников». Как ЕГЭ по химии снесло шаблон – Общество – Новости Санкт-Петербурга
автор фото Ирина Бужор/КоммерсантъПоделитьсяРассказы о рыдающих в классах выпускниках и пребывающих в ужасе учителях заполнили рунет после единого государственного экзамена по химии. В социальных сетях обсуждаются задания, кто-то их счёл слишком сложными, а для кого-то нестандартная формулировка стала поводом для творческого подхода к решению. «Фонтанка» публикует шесть самых сложных задач одного из вариантов ЕГЭ по химии-2020 и предлагает читателям их раскусить.
Через четыре дня после ЕГЭ по химии на сайте Change.org опубликован десяток петиций с требованием отменить результаты экзамена из-за сложности заданий. Самой популярной оказалась инициатива, созданная инженером-химиком Сергеем Арутюняном. К 20 июля её подписали около 40 тысяч человек.
«Утверждать, что задания ЕГЭ по химии рассчитаны на среднего школьника — лицемерие!!!!» — отмечается в петиции. «На сегодняшнем экзамене ученики рыдали, кого-то забрали медицинские работники! Столько сил, нервов, денег ушло на подготовку!» — говорится в другой петиции. На портале встречаются аналогичные инициативы, касающиеся и других предметов: истории, профильной математики. Есть и обобщающая петиция с заголовком: «Перестаньте давать сложные варианты ЕГЭ!»
Для подготовки к экзамену школьники решают примеры заданий, опубликованные на сайте Федерального института педагогических измерений (ФИПИ). Основная претензия протестующих в том, что рекомендованные варианты отличались от материалов, выданных на ЕГЭ по химии.
«Я в прошлом году сдавала химию, и, сравнив варианты прошлого года и этого, я поняла, что сложность повысилась на 30–50% в первой части и на 10% — во второй, даже формулировки заданий были мега-интересные и необычные», — написала в одном из профильных пабликов Сабрина.
«Супер! Наконец-то нормальный экзамен, сделанный именно для проверки знаний по предмету. Хочешь сотку — поищи по закоулкам учебников повышенного уровня реакции и свойства. №34 была полуолимпиадной. Короче, весело всё было!» — прокомментировал участник ЕГЭ Стас.
В Петербурге ЕГЭ сдавали чуть более четырёх тысяч человек. Один из них — химик и репетитор Азат Диваев. По его мнению, экзамен в этом году вышел за рамки школьного курса, были «задания на внимательность и «соображалку», но они не проверяют прямые знания по химии».
Больше всего споров вызвало задание №34 по атомистике (задачи на массовые доли атомов в смеси химических веществ или соотношения числа атомов разных химических элементов в смеси). Они стали новинкой ЕГЭ по химии этого года, их анонсировали на вебинаре ФИПИ в конце апреля.
Они стали новинкой ЕГЭ по химии этого года, их анонсировали на вебинаре ФИПИ в конце апреля.
«Все же, на мой взгляд, основная проблема — это не сложность предмета. Предмет очень логичный и простой, если в нем разобраться. Но если пытаться решать задания, которые ты никогда не решал, ничего хорошего от этого не будет. Во всем нужна тренировка, в том числе в задачах на атомистику. А добавление новых заданий непосредственно перед экзаменом упраздняет социальные лифты. Сильные школьники не поступают в вузы. Не становятся хорошими специалистами, врачами, химиками», — отметил Диваев.
Петербургский учитель высшей категории — победитель международной олимпиады учителей химии Александр Евсюков отмечает нестандартные формулировки некоторых заданий, но все они соответствовали школьному уровню. Задание №35, по его мнению, стало только лучше: вместо большого количества математики и небольшой части на понимание химических нюансов в этом году доля математики уменьшилась, а доля химии возросла.
«Иногда репетитор с учеником занимается, учит решать какие-то задания (например, второй части ЕГЭ) по готовым шаблонам, без понимания смысла. В результате, как только шаблон чуть меняется (в этом году было именно так), ученик тут же впадает в панику, не зная, что делать, — комментирует Евсюков. — Залогом успешной подготовки, на мой взгляд, являются работа ученика и единая выстроенная система как содержательной, так и психологической подготовки. Если ученик готовится, например, с репетитором или учителем в рамках факультатива, важна нацеленность обоих на результат. Бывает и так, что ученик заводит себе нескольких репетиторов и ещё пару-тройку онлайн-курсов. Плохо это или хорошо — вопрос сложный, но часто это приводит к полной бессистемности и, как следствие, каше в голове. Образно говоря, в ученика вкладывают много полезной информации и умений, но всё это оказывается просто сваленным в кучу, и в критический момент возникает путаница. Например, во время стресса на экзамене».
Результаты участники ЕГЭ по химии узнают не позднее 30 июля. Рособрнадзор проверит задания после того, как станут известны отметки.
Рособрнадзор проверит задания после того, как станут известны отметки.
«Фонтанка» публикует самые сложные задания одного из вариантов этого года и предлагает читателям попробовать свои силы в их решении:
30. Даны вещества: гидроксид железа (II), пероксид водорода, дигидрофосфат магния, гидроксид калия. Допустимо использование водных растворов. Напишите окислительно-восстановительную реакцию из предложенного перечня веществ. В продуктах должны получиться соль и вода.
31. Напишите реакцию ионного обмена. В продуктах должен выделиться осадок.
32. К раствору сульфата хрома (III) добавили раствор сульфита натрия и наблюдали образование осадка и выделение бесцветного газа. Полученный газ поглотили раствором перманганата калия, подкисленным серной кислотой, а осадок обработали раствором содержащим пероксид водорода и гидроксид натрия и нагрели. В полученный при этом желтый раствор добавили раствор серной кислоты. Напишите 4 уравнения.
34. Смесь цинка и карбоната цинка, в которой соотношение числа атомов цинка к числу
атомов кислорода равно 5:6, растворили в 500 г разбавленного раствора серной кислоты.
При этом все исходные вещества прореагировали полностью, и выделилось 22,4 л смеси газов. К этому раствору добавили 500 г 40%-ного раствора гидроксида натрия.
Вычислите массовую долю сульфата натрия в конечном растворе.
35. Вещество А имеет формулу С5Н8О2, оно получается гидратацией вещества Б, которое реагирует с аммиачным раствором оксида серебра в соотношении 1:2.
Лена Ваганова, «Фонтанка.ру»
Решение сложных задач по химии 9
Loading…
2020-2021 учебный год
Группы объединения
Решение сложных задач по химии 9.

В
Образовательная программа:
Срок обучения: 1
Форма обучения: очная
Год обучения: 1
Количество часов в неделю: 1
Время и место проведения занятий:
- Понедельник c 13:10 до 13:55
Адрес: 455038, Челябинская область, Магнитогорск, пр.
 Ленина, 124/3, МАОУ «Академический лицей»
Ленина, 124/3, МАОУ «Академический лицей»
Фактическая наполняемость: 25
Плановая наполняемость:25
Вакантных мест нет
1.
 8: Решение химических проблем – Chemistry LibreTexts
8: Решение химических проблем – Chemistry LibreTextsЦели обучения
- Объясните подход размерного анализа (факторная метка) к математическим вычислениям, связанным с величинами.
- Опишите, как использовать анализ размеров для преобразования единиц для данного свойства и вычислений, включающих два или более свойств.
- Преобразование между тремя основными единицами измерения температуры: Фаренгейтом, Цельсием и Кельвином.
Часто бывает так, что интересующее количество может быть нелегко (или даже возможно) измерить напрямую, но вместо этого оно должно быть вычислено на основе других непосредственно измеряемых свойств и соответствующих математических соотношений.Например, рассмотрите возможность измерения средней скорости спортсмена, бегущего на спринт. Обычно это достигается путем измерения времени , необходимого спортсмену для пробега от стартовой линии до финишной линии, и расстояния между этими двумя линиями, а затем вычисления скорости из уравнения, которое связывает эти три свойства:
\ [\ mathrm {speed = \ dfrac {distance} {time}} \]
Спринтер олимпийского качества может пробежать 100 м примерно за 10 с, что соответствует средней скорости
.
\ [\ mathrm {\ dfrac {100 \: m} {10 \: s} = 10 \: m / s} \]
Обратите внимание, что эта простая арифметика включает деление чисел каждой измеренной величины, чтобы получить число вычисленной величины (100/10 = 10) и аналогичным образом деление единиц каждой измеренной величины, чтобы получить единицу вычисленной величины (m / с = м / с).Теперь рассмотрите возможность использования этого же соотношения для прогнозирования времени, необходимого человеку, бегущему с этой скоростью, для преодоления расстояния 25 м. Используется такое же соотношение между тремя свойствами, но в этом случае предоставляются две величины: скорость (10 м / с) и расстояние (25 м). Чтобы получить искомое свойство, время, уравнение необходимо переставить соответствующим образом:
\ [\ mathrm {time = \ dfrac {distance} {speed}} \]
Время может быть вычислено как:
\ [\ mathrm {\ dfrac {25 \: m} {10 \: m / s} = 2.5 \: s} \]
Опять же, арифметика чисел (25/10 = 2,5) сопровождалась той же арифметикой по единицам измерения (м / м / с = с), давая число и единицу результата, 2,5 с. Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае м / м), результатом становится «1» – или, как обычно выражается, единицы «отменяются».
Обратите внимание, что, как и в случае с числами, когда единица делится на идентичную единицу (в данном случае м / м), результатом становится «1» – или, как обычно выражается, единицы «отменяются».
Эти расчеты являются примерами универсального математического подхода, известного как размерный анализ (или метод метки факторов). Анализ размеров основан на этой предпосылке: единицы величин должны подвергаться тем же математическим операциям, что и соответствующие числа .Этот метод может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными, многоэтапными вычислениями, включающими несколько различных величин.
Коэффициенты пересчета и анализ размеров
Отношение двух эквивалентных величин, выраженных в разных единицах измерения, может использоваться в качестве коэффициента преобразования единиц. Например, длины 2,54 см и 1 дюйм эквивалентны (по определению), и поэтому коэффициент преобразования единиц может быть получен из отношения,
\ [\ mathrm {\ dfrac {2.54 \: cm} {1 \: дюйм} \ 🙁 2.54 \: cm = 1 \: дюйм) \: или \: 2.54 \: \ dfrac {cm} {дюйм}} \]
Несколько других часто используемых коэффициентов пересчета приведены в таблице \ (\ PageIndex {1} \).
| Длина | Объем | Масса |
|---|---|---|
| 1 м = 1,0936 ярда | 1 л = 1,0567 кварты | 1 кг = 2.2046 фунтов |
| 1 дюйм = 2,54 см (точно) | 1 кварт = 0,94635 л | 1 фунт = 453,59 г |
| 1 км = 0,62137 миль | 1 фут 3 = 28,317 л | 1 (экирдупуа) унция = 28,349 г |
| 1 миля = 1609,3 м | 1 столовая ложка = 14,787 мл | 1 (тройская) унция = 31,103 г |
Когда мы умножаем величину (например, расстояние в дюймах) на соответствующий коэффициент преобразования единиц, мы преобразуем количество в эквивалентное значение с различными единицами измерения (например, расстояние в сантиметрах).Например, вертикальный прыжок баскетболиста на 34 дюйма можно преобразовать в сантиметры следующим образом:
\ [\ mathrm {34 \: \ cancel {in.} \ Times \ dfrac {2.54 \: cm} {1 \: \ cancel {in.}} = 86 \: cm} \]
Поскольку эта простая арифметика включает в себя величин , предпосылка размерного анализа требует, чтобы мы умножали как числа , так и единицы . Числа этих двух величин умножаются, чтобы получить номер количества продукта, 86, тогда как единицы умножаются, чтобы получить
.\ [\ mathrm {\ dfrac {дюйм.\ times cm} {дюймы}}. \]
Как и в случае с числами, соотношение одинаковых единиц численно равно единице,
\ [\ mathrm {\ dfrac {дюйм} {дюйм} = 1} \]
, и единичный продукт, таким образом, упрощается до см . (Когда идентичные единицы делятся, чтобы получить коэффициент 1, они называются «отменяющими».) Используя размерный анализ, мы можем определить, что коэффициент преобразования единиц был установлен правильно, проверив, чтобы подтвердить, что исходная единица будет отменена, и результат будет содержать искомую (преобразованную) единицу.
Пример \ (\ PageIndex {1} \): использование коэффициента преобразования единиц
Масса соревновательного фрисби 125 г. Преобразуйте его массу в унции, используя коэффициент преобразования единиц, полученный из соотношения 1 унция = 28,349 г (Таблица \ (\ PageIndex {1} \)).
Решение
Если у нас есть коэффициент преобразования, мы можем определить массу в килограммах с помощью уравнения, аналогичного тому, которое используется для преобразования длины из дюймов в сантиметры.
\ [x \: \ mathrm {oz = 125 \: g \ times unit \: conversion \: factor} \ nonumber \]
Мы записываем коэффициент преобразования единиц в двух формах:
\ [\ mathrm {\ dfrac {1 \: oz} {28.349 \: g} \: и \: \ dfrac {28.349 \: g} {1 \: oz}} \ nonumber \]
Правильный коэффициент преобразования единиц – это соотношение, которое отменяет единицы граммов и оставляет унции.
\ [\ begin {align *}
x \: \ ce {oz} & = \ mathrm {125 \: \ cancel {g} \ times \ dfrac {1 \: oz} {28.349 \: \ cancel {g} }} \\
& = \ mathrm {\ left (\ dfrac {125} {28.349} \ right) \: oz} \\
& = \ mathrm {4.41 \: oz \: (три \: значащие \: цифры )}
\ end {align *} \]
Упражнение \ (\ PageIndex {1} \)
Преобразует объем 9.345 кварты в литры.
- Ответ
8,844 л
Помимо простых преобразований единиц, метод меток факторов может использоваться для решения более сложных задач, связанных с вычислениями. Независимо от деталей, основной подход один и тот же – все факторы , участвующие в вычислении, должны быть соответствующим образом ориентированы, чтобы гарантировать, что их метки (единицы) будут соответствующим образом отменены и / или объединены, чтобы дать желаемую единицу в результате .Вот почему он называется методом факторной метки. По мере продолжения вашего изучения химии вы столкнетесь с множеством возможностей применить этот подход.
Пример \ (\ PageIndex {2} \): вычисление величин по результатам измерений
Какова плотность обычного антифриза в г / мл? Образец антифриза объемом 4,00 кварты весит
фунта 9,26 фунта.Решение
Поскольку \ (\ mathrm {density = \ dfrac {mass} {volume}} \), нам нужно разделить массу в граммах на объем в миллилитрах.3 \: mL} = 1.11 \: г / мл} \ nonumber \]
В качестве альтернативы расчет может быть настроен таким образом, чтобы последовательно использовать три коэффициента преобразования единиц измерения, как показано ниже:
\ [\ mathrm {\ dfrac {9.26 \: \ cancel {lb}} {4.00 \: \ cancel {qt}} \ times \ dfrac {453.59 \: g} {1 \: \ cancel {lb}} \ times \ dfrac {1.0567 \: \ cancel {qt}} {1 \: \ cancel {L}} \ times \ dfrac {1 \: \ cancel {L}} {1000 \: mL} = 1.11 \: г / мл} \ nonumber \]
Упражнение \ (\ PageIndex {2} \)
Каков объем в литрах 1000 унций, если 1 л = 1.{-2} \: L} \)
Пример \ (\ PageIndex {3} \): вычисление величин по результатам измерений
На пути из Филадельфии в Атланту, расстояние около 1250 км, Lamborghini Aventador Roadster 2014 года использует 213 л бензина.
- Какую (среднюю) экономию топлива в милях на галлон получил родстер во время этой поездки?
- Если бензин стоит 3,80 доллара за галлон, какова стоимость топлива для этой поездки?
Решение
(a) Сначала мы конвертируем расстояние из километров в мили:
\ [\ mathrm {1250 \: км \ раз \ dfrac {0.62137 \: mi} {1 \: km} = 777 \: mi} \ nonumber \]
, а затем переведите объем из литров в галлоны:
\ [\ mathrm {213 \: \ cancel {L} \ times \ dfrac {1.0567 \: \ cancel {qt}} {1 \: \ cancel {L}} \ times \ dfrac {1 \: gal} {4 \: \ cancel {qt}} = 56.3 \: gal} \ nonumber \]
Затем,
\ [\ mathrm {(средний) \: пробег = \ dfrac {777 \: mi} {56,3 \: гал} = 13,8 \: миль / галлон = 13,8 \: миль на галлон} \ nonumber \]
В качестве альтернативы расчет можно настроить таким образом, чтобы все коэффициенты пересчета использовались последовательно, как показано ниже:
\ [\ mathrm {\ dfrac {1250 \: \ cancel {km}} {213 \: \ cancel {L}} \ times \ dfrac {0.62137 \: mi} {1 \: \ cancel {km}} \ times \ dfrac {1 \: \ cancel {L}} {1.0567 \: \ cancel {qt}} \ times \ dfrac {4 \: \ cancel { qt}} {1 \: gal} = 13,8 \: миль на галлон} \ nonumber \]
(b) Используя ранее рассчитанный объем в галлонах, находим:
\ [\ mathrm {56.3 \: gal \ times \ dfrac {$ 3.80} {1 \: gal} = $ 214} \ nonumber \]
Упражнение \ (\ PageIndex {3} \)
Toyota Prius Hybrid использует 59,7 л бензина для проезда из Сан-Франциско в Сиэтл на расстояние 1300 км (две значащие цифры).
- Какую (среднюю) экономию топлива в милях на галлон получил Prius во время этой поездки?
- Если бензин стоит 3 доллара.90 за галлон, какова была стоимость топлива в этой поездке?
- Ответьте на
51 миль на галлон
- Ответ б
$ 62
Преобразование единиц температуры
Мы используем слово температура для обозначения жара или холода вещества. Один из способов измерить изменение температуры – это использовать тот факт, что большинство веществ расширяются при повышении их температуры и сжимаются при понижении температуры.Ртуть или спирт в обычном стеклянном термометре изменяют свой объем при изменении температуры. Поскольку объем жидкости изменяется больше, чем объем стекла, мы можем видеть, как жидкость расширяется, когда становится теплее, и сжимается, когда становится холоднее.
Чтобы разметить шкалу на термометре, нам понадобится набор справочных значений: два из наиболее часто используемых – это температура замерзания и кипения воды при заданном атмосферном давлении. По шкале Цельсия 0 ° C определяется как температура замерзания воды и 100 ° C как температура кипения воды.Пространство между двумя температурами разделено на 100 равных интервалов, которые мы называем градусами. По шкале Фаренгейта точка замерзания воды определяется как 32 ° F, а температура кипения – как 212 ° F. Пространство между этими двумя точками на термометре Фаренгейта разделено на 180 равных частей (градусов).
Определение температурных шкал Цельсия и Фаренгейта, как описано в предыдущем абзаце, приводит к немного более сложной взаимосвязи между значениями температуры на этих двух шкалах, чем для разных единиц измерения для других свойств.Большинство единиц измерения для данного свойства прямо пропорциональны друг другу (y = mx). На примере знакомых единиц длины:
\ [\ mathrm {length \: in \: feet = \ left (\ dfrac {1 \: ft} {12 \: in.} \ Right) \ times length \: in \: inch} \]
где
- y = длина в футах,
- x = длина в дюймах, а
- коэффициент пропорциональности m является коэффициентом преобразования.
Температурные шкалы Цельсия и Фаренгейта, однако, не имеют общей нулевой точки, поэтому связь между этими двумя шкалами является линейной, а не пропорциональной (\ (y = mx + b \)).Следовательно, преобразование температуры из одной из этих шкал в другую требует большего, чем простое умножение на коэффициент преобразования m, это также должно учитывать различия в нулевых точках шкалы (\ (b \)). \ circ F} +32)} \]
Как упоминалось ранее в этой главе, единицей измерения температуры в системе СИ является кельвин (K).В отличие от шкал Цельсия и Фаренгейта шкала Кельвина представляет собой шкалу абсолютных температур, в которой 0 (ноль) К соответствует самой низкой температуре, которая теоретически может быть достигнута. Открытие в начале 19 века взаимосвязи между объемом газа и температурой предполагало, что объем газа будет равен нулю при -273,15 ° C. В 1848 году британский физик Уильям Томпсон, который позже принял титул лорда Кельвина, предложил шкалу абсолютных температур, основанную на этой концепции (дальнейшее рассмотрение этой темы дается в главе этого текста, посвященной газам).\ circ C} = T _ {\ ce K} -273,15 \]
Значение 273,15 в этих уравнениях было определено экспериментально, поэтому оно неточно. На рисунке \ (\ PageIndex {1} \) показано соотношение между тремя температурными шкалами. Напомним, что мы не используем знак градуса с температурами по шкале Кельвина. \ circ C} +273.2 \, K \ hspace {20px} (две \: значащие \: цифры)} \ nonumber \]
Упражнение \ (\ PageIndex {5} \)
Преобразование 50 ° F в ° C и К.
- Ответ
10 ° С, 280 К
Сводка
Измерения производятся с использованием различных единиц. Часто бывает полезно или необходимо преобразовать измеренную величину из одной единицы в другую. Эти преобразования выполняются с использованием коэффициентов преобразования единиц, которые выводятся с помощью простых приложений математического подхода, называемого методом меток факторов или анализом размеров.\ circ C} = \ ce K-273.15 \)
Глоссарий
- анализ размеров
- (также метод метки факторов) универсальный математический подход, который может применяться к вычислениям, начиная от простого преобразования единиц измерения и заканчивая более сложными многоэтапными вычислениями, включающими несколько различных величин
- по Фаренгейту
- единица температуры; вода замерзает при 32 ° F и закипает при 212 ° F по этой шкале
- коэффициент преобразования
- соотношение эквивалентных величин, выраженных в разных единицах; используется для преобразования одной единицы в другую
Авторы и авторство
(PDF) Решение задач в химии
Независимо от того, являются ли задачи в данном исследовании алгебраическими или концептуальными, большая часть исследований
по решению проблем в химии сосредоточена на темах, которые поддаются решению
математических задач. например, проблемы стехиометрии или газового закона.Химики,
, однако, обычно участвуют в решении нематематических задач, таких как органический синтез
или интерпретация спектров. Имеются ли существенные различия между способами решения задач
химиками в математической и нематематической областях химии
? Каковы характеристики хорошего решателя нематематических задач?
Исследования показали, что способ представления проблем
в значительной степени влияет на то, насколько быстро (и насколько) они решаются, но мы очень мало знаем о факторах, которые влияют на представления
, или о том, как научить студентов генерировать эффективные представления.
Исследования, которые фокусируются на обучении эффективным репрезентативным стратегиям для четко определенного класса задач
, могут принести солидные дивиденды.
Исследования показали, что мы не можем научить решать проблемы, но есть свидетельства того, что определенные подходы
к обучению могут улучшить навыки решения проблем учащихся посредством групповой работы.
Тем не менее, еще многое предстоит узнать об эффективном использовании кооперативного или
коллективного подходов к формированию навыков решения проблем (Shibley and Zimmaro, 2002).
Нам необходимо понимать взаимодействия, которые происходят, когда группы работают эффективно, роль
лидера, то, как лидер группы выбирается (или отклоняется), как можно улучшить групповую работу
, характеристики неэффективных групп и скоро. Мы знаем, что
обучения происходит в социально опосредованной среде среди практикующих химиков, начиная с аспирантуры
, и все же мы так мало знаем о социально опосредованном обучении среди
новичков.Мы также относительно мало знаем об изменениях, которые происходят в навыках решения проблем
по мере того, как люди проходят через развитие опыта от первого знакомства с химией
в старшей школе до получения степени магистра.
Мы нашли примеры, когда аспиранты пытались (обычно безуспешно) использовать
знаний из неорганической химии для решения задач органического синтеза, и мы
нашли примеры студентов и аспирантов, которые терпели неудачу в своих попытках использовать
.модели из органической химии для решения задач в курсах неорганической химии.Но мы
относительно мало знаем о препятствиях, которые мешают эффективной передаче навыков решения проблем
через границы предметной области.
В Purdue мы смотрим на взаимосвязь между исследованиями по решению проблем в химии
и работой, которая была проделана по «решению проблем», включенных в акт написания
. Есть много других связей, которые следует изучить между тем, что химики
изучают о решении проблем, и работой в других предметных областях.На ум приходит, например, работа
по ситуационному обучению (Lave, Wenger, 1991). Лаве и
Венгер утверждают, что обучение происходит в результате участия в сообществах практиков.
Вместо того, чтобы сосредоточиться на когнитивных процессах и концептуальных структурах, они предлагают
изучить виды социальных взаимодействий, которые обеспечивают надлежащий контекст для обучения, чтобы иметь место
. Также следует поддерживать связи между работой над моделью и моделью, выявляющей
действий (Lesh, et al., 2000), и решение проблем по химии, и способы улучшить
навыков решения проблем наших студентов.
Задачи составления комплексных решений: знание с чего начать
Беседы за ужином в честь Дня благодарения могут быть неудобными…
Но проблем с составом решения быть не должно. Напомним, что раствор – это однородная смесь двух или более веществ. Химики придумали много способов описать состав раствора.Некоторые способы более уместны, чем другие, в зависимости от ситуации.
Вот те, с которыми вам будет очень уютно:
Всего несколько уравнений, которые можно запомнить и вставить в них числа. Звучит просто. Но так бывает не всегда. Особенно, когда вам прямо не дают то, что вам нужно. Вместо этого вам дается куча других вещей в надежде, что вы сможете расшифровать, что с ними делать. В этом случае невероятно важно иметь системный подход к проблеме, иначе вы наверняка застрянете.
Вот что нужно помнить при решении задачи композиции сложного решения:
- ВСЕ ПРЕДОСТАВЛЯЕМОЕ СООТВЕТСТВУЕТ И ПОДКЛЮЧЕНО.
- ВЫ ДЕЛАЛИ ЧТО-ТО НЕПРАВИЛЬНО, ЕСЛИ ВЫ НЕ ИСПОЛЬЗОВАЛИ ВСЕ ПРЕДЛАГАЕМЫЕ.
- ВЫБИРАЙТЕ, КАК КАЖДОЕ ПРЕДОСТАВЛЕНИЕ ОТНОСИТСЯ К ТО, ЧТО ВАС ПРОСИТ НАЙТИ.
- Определите, что вас просят рассчитать в связи с вопросом.
- Разделите это на компоненты. Вы будете рассчитывать их как отдельные объекты.
- Например, представьте, что вам предлагается вычислить молярность раствора. Проведите линию, чтобы разделить рабочую зону пополам. Назовите одну половину «молей растворенного вещества», а другую половину – «литрами раствора».
- Разместите данную информацию под тем заголовком, к которому она больше всего относится.
- Это потребует от вас очень внимательного изучения данной информации и запоминания некоторых принципов подключения
- Будьте внимательны.Правильная маркировка является ключевым моментом. Знание того, что измеряется, так же важно, как и единица измерения. Подсказка: между словами «растворенное вещество», «растворитель» и «раствор» существует огромная разница.
- Используя предоставленную информацию, которая к ним относится, рассчитайте компоненты.
- Соедините компоненты вместе, чтобы получить окончательный ответ.
Электролит в автомобильных свинцовых аккумуляторных батареях – 3.75 М раствор серной кислоты плотностью 1,230 г / мл. Рассчитайте массовый процент и моляльность серной кислоты.
Нас просят найти две разные вещи, поэтому мы будем выполнять эти шаги дважды.
Начнем с массового процента:
1. Массовый процент
2.
3. 4.
5.
Теперь давайте найдем моляльность:
1. Моляльность
2.
3.
4.
5.
Практика действительно делает совершенство, но поддержание организованности и использование всего, что указано в задаче, может помочь взяться за дело.
Проблемы с работой в области химии? Работайте с таким репетитором, как Виемма, чтобы исправить свой курс!
Хотите больше о химии от Viemma?
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Решение сложных химических равновесий с использованием метода на основе геометрического программирования на JSTOR
AbstractОпределение состава химической системы в состоянии равновесия – важная проблема, которая возникает во многих областях науки и техники.Для сложных равновесий требуется использование цифрового компьютера. Химик часто считает использование современных компьютерных кодов неэффективным и неприятным занятием. В данной статье представлен глобально сходящийся алгоритм решения задач химического равновесия. Этот алгоритм стал эффективным и простым в использовании, и теперь он успешно применяется химиками для решения важных проблем. Он основан на применении принципов геометрического программирования для решения систем нелинейных уравнений.Несмотря на то, что она представлена в форме, которая может быть быстро понятна практикующему специалисту, методология является математически строгой. Были разработаны и тщательно протестированы компьютерные программы, не требующие знакомства с деталями методологии. Эти программы могут использоваться в качестве общих исследовательских инструментов для исследования решения нелинейных уравнений в областях, отличных от химии.
Journal InformationСпециалисты по операционной в каждой области исследования найдут интересную информацию в этом сбалансированном, полном спектре отраслевого обзора.Основное чтение для практиков, исследователей, преподавателей и студентов OR. Вычислительная техника и технология принятия решений Окружающая среда, энергия и природные ресурсы Финансовые услуги Логистика и цепочки поставок Производственные операции Оптимизация Государственные и военные службы Моделирование Стохастические модели Телекоммуникации Транспорт
Информация для издателяINFORMS, насчитывающая более 12 500 членов со всего мира, является ведущей международной ассоциацией профессионалов в области исследования операций и аналитики.INFORMS продвигает передовой опыт и достижения в области исследования операций, науки об управлении и аналитики для улучшения операционных процессов, принятия решений и результатов с помощью множества высоко цитируемых публикаций, конференций, конкурсов, сетевых сообществ и услуг по профессиональному развитию.
Разработка компьютерной оценки решения сложных задач в химии | International Journal of STEM Education
Образец и процедура
Участниками были ученики 10-го класса, посещавшие Немецкую гимназию в федеральной земле Берлин ( N = 420; 52.4% женщин). Эти студенты работали над компьютерной оценкой умения решать сложные задачи. Кроме того, были проведены тесты с карандашом и бумагой, в ходе которых оценивались ковариаты, такие как предварительные знания в области химии, подвижный интеллект (Gf) и общий интерес. Средний возраст учеников составлял 15,8 лет (SD = 0,7 года) в диапазоне от 14 до 18 лет. Некоторые студенты сообщили, что их родным языком не является немецкий (23,8%). Однако, по имеющимся данным, Koppelt (2011) показал, что это не повлияло на результаты оценки.Процедура оценки была разделена на две сессии по 90 минут каждая, которые проводились в два смежных дня, в результате было получено 395 полных наборов данных.
Меры
Зависимая переменная: комплексная компетентность в решении проблем
В следующем разделе дается подробное описание проектных характеристик CBA и показаны примеры элементов и индикаторов, которые использовались для оценки четырех измерений CPS.
Разработка компьютерной оценки CPS
Компьютерная оценка была реализована с помощью простой в использовании среды разработки ChemLabBuilder (Meßinger 2010).В этой среде можно определить различные лабораторные инструменты, такие как химические вещества, машины для синтеза или анализа и различные формы информационных материалов. Инструмент требует ввода в действие входов, выходов и данных, которые отображаются в результирующих файлах журнала. Кроме того, степень интерактивности может быть адаптирована в соответствии с количеством переменных и их взаимосвязями.
Чтобы оценить комплексную компетенцию в решении проблем, были реализованы различные задачи, которые можно было отнести к одному из четырех этапов решения проблем, представленных Коппельтом (2011) (см. Раздел «Решение проблем в науке»).В этих задачах учащиеся могли решать отдельные задачи независимо от их выполнения по предыдущим. После завершения двух этапов исследования без оценки продолжительностью 10 минут каждый, студенты сначала должны были идентифицировать неизвестные химические вещества с помощью анализатора и синтезатора (обсуждение важности этапов исследования в оценках CPS см. Leutner et al. 2005 ). Во-вторых, студенты должны были идентифицировать и синтезировать ароматизирующее вещество (в данном случае метилбутират), отвечающее различным критериям.Чтобы создать привлекательную и мотивирующую среду для решения проблем, задача была встроена в контекстную структуру.
В рамках компьютерной оценки были разные машины, представляющие сложные системы. Студенты должны были взаимодействовать с этими системами в процессе решения задач, чтобы получить информацию об их функциях. Эта конструктивная особенность требует приобретения системных знаний, что имеет решающее значение для решения сложных проблем (Goode and Beckmann 2010; Sonnleitner et al.2013). Поскольку отношения между зависимыми и независимыми переменными были раскрыты в начале (Funke 2010), системы позволяли различные настройки для определения количества коррелированных переменных и их сложности.
Чтобы использовать интерактивность системы, идентификация неизвестных химических веществ должна была осуществляться с помощью аналитических спектров. Такая поддерживающая и косвенная обратная связь была необходима для того, чтобы стимулировать взаимодействие студентов с системами.Тем не менее, интерактивность системы сыграла важную роль в оценке CPS и в моделировании проблем, специфичных для предметной области, с помощью вычислительных средств (Jonassen 2004; Scherer and Tiemann 2012). Из-за администрирования различных подзадач, которые относились к этапам решения проблем, студенты должны были сосредоточиться на основной задаче при наличии соревновательных целей. Эта программная функция относится к ориентации на цель и полителии (Blech and Funke, 2010).
Более того, студентам пришлось преодолеть некоторые трудности в окружающей среде: название химического вещества было неизвестно, и студенты должны были предложить правдоподобный синтез.Кроме того, необходимо было оптимизировать выход реакции. Таким образом, задача решения проблем была сложной и построена таким образом, чтобы студенты с низким уровнем предварительных знаний также могли успешно решить задачу (Scherer and Tiemann 2012).
Подводя итог, можно сказать, что основные характеристики сложных сред решения проблем были учтены в рамках процедуры разработки тестов (см., Например, Funke 2010). Однако из-за того, что мы сосредоточились на фиксированной химической системе с определенными переменными, временная динамика не была реализована.Соответственно, наша среда была основана на требованиях учебного плана по обучению концепциям химического равновесия и химии сложных эфиров в 10 классе, которые не относились к изменяющимся во времени условиям.
Измерение «понимания и характеристики проблемы»
Оценка успеваемости учащихся по «пониманию и характеристике проблемы» включала анализ неизвестных химических веществ. Ответы студентов сравнивались с прямым решением (переменные от PUC01 до PUC07 в таблице 2).Чтобы идентифицировать вещества, студенты должны были рассмотреть информацию, приведенную в лабораторных журналах («спектры» и «молярная масса»), извлечь соответствующие свойства и, наконец, связать их друг с другом, чтобы предложить название вещества. Например, химическое вещество показало молярную массу 46 г / моль. Этим веществом может быть этанол или муравьиная кислота. Только путем определения класса вещества с помощью спектрального выхода и информации, представленной в таблице, студенты смогли предложить правильное название.На рисунке 1 показан снимок экрана этой подзадачи.
Таблица 2 Примеры переменных, измеряющих способность «понимать и характеризовать проблему (PUC)» Рисунок 1Снимок экрана CBA, показывающий пример элемента для измерения PUC. PUC, понимание и характеристика проблемы.
Пункты PUC различались по сложности в зависимости от количества информации, необходимой для процесса идентификации (см. Таблицу 2).Оценка ответов студентов производилась с использованием компьютерных средств. Каждый из семи пунктов (т.е. неизвестные вещества) был закодирован дихотомически, что дало максимальный балл в семь.
Измерение «представления проблемы»
Компьютерная среда позволила нам разрабатывать интерактивные и статические задачи. Чтобы обеспечить меры по представлению проблемы (PR), мы реализовали статические элементы с вариантами множественного выбора, в которых учащиеся должны были заполнить концептуальные карты или таблицы с различными форматами структурных представлений химических веществ.Полученные в результате элементы были закодированы политомически (для получения дополнительной информации см. Koppelt 2011 и Scherer 2012).
Измерение «решения проблемы»
Для анализа эффективности «решения проблемы (PS)», достижения состояния цели ( PS01a , PS01b ) и общего поведения учащихся при решении проблем ( PS02a до PS04 ). В этом операционализации состояние цели относится к оптимальному решению, которое может быть достигнуто с помощью различных типов настроек системы.Впоследствии решение студентов напрямую сравнивалось с оптимальным целевым состоянием. Таблица 3 содержит примеры переменных, измеряющих PS, которые были оценены путем анализа файлов журнала студентов.
Таблица 3 Примеры переменных, измеряющих компетенцию «решения проблемы (PS)»В этой записи поведения при решении проблем была дана отдельная таблица, содержащая список анализов и синтезов.С помощью этих записей можно было определить количество повторных анализов и синтезов. Поскольку деятельность студентов в лаборатории, а также входные и выходные данные системы были записаны, им была предоставлена возможность отслеживать или вызывать настройки и выходные данные во время выполнения заданий. Следовательно, мы кодировали элементы PS02 до нуля, если анализ или синтез применялись более двух раз. Эта особенность соответствовала операционализации систематического поведения при решении проблем, предложенной Künsting et al.(2011). Более того, если учащиеся выполняли синтез с веществами, которые ранее не были идентифицированы, записи «синтез (взгляд ученика)» отображались со знаком вопроса, а переменная PS04 была закодирована до нуля (см. Рисунок 2).
Рисунок 2Лабораторный журнал из журнала студента.
Взятые вместе, пункты PS требовали различных когнитивных процессов, таких как тактические и целенаправленные действия, достижение требуемых условий и систематическое изменение факторов (Scherer and Tiemann 2012).Другие аспекты измерения PS описаны в Koppelt (2011).
Измерение «отражения и передачи решения»
Для реализации этого шага мы разработали статические задачи, которые оценивали различные возможности отражения и передачи решения (SRC). Сначала ученики должны были ответить на вопросы с несколькими вариантами ответов, в которых они должны были вспомнить свои стратегии решения. Во-вторых, они должны были выбрать одно из представленных представлений о решении проблемы (например, журнальная статья) и решить, подходят ли они для разных аудиторий (для получения дополнительной информации об этом подходе см. Bernholt et al.2012). Опять же, пункты были закодированы дихотомически и политомно.
Данные файла журнала
Для каждого учащегося был получен единственный файл журнала, который содержал следующую информацию: ответы на вопросы с множественным выбором, множественный выбор и составные элементы ответа (представленные в виде чисел или номинальных записей), необходимое время для решения задачи, количество действий, список химических веществ, используемых в анализах и синтезах, последовательность действий в рамках компьютерной оценки, а также последовательность анализов и синтезов.Чтобы отфильтровать эти необработанные данные, мы установили переменные, которые были назначены для измерения вышеупомянутых факторов CPS. При этом записи о построенных элементах ответа и последовательности действий были закодированы в соответствии с их правильностью и эффективностью. Для получения дополнительной информации см. Коппельт (2011), Шерер (2012) и Шерер и Тиман (2012).
Качество схемы кодирования
Чтобы проверить схему кодирования на ясность и надежность, 20% файлов журнала были закодированы двумя независимыми оценщиками.Таким образом обеспечивается объективность процедуры кодирования. Мы определили коэффициент Коэна κ как меру межэкспертной надежности и получили статистически значимые значения ( p <0,05) в диапазоне от 0,85 до 1,00 на четырех этапах. Значения 1,00 возникли из-за того, что выбранные задачи были проанализированы только компьютерными средствами. Следовательно, не было необходимости в дальнейшей интерпретации ответов студентов на эти задания.
Ковариаты комплексной компетенции решения проблем
Чтобы исследовать внешнюю валидность оценки CPS, мы провели тесты на связанных конструкциях CPS.Этот подход является обычным для оценки дискриминантной валидности и предоставляет информацию об уникальности конструкций и качестве инструментов оценки. В этом контексте валидность упоминается как характеристика теста, поддерживающая интерпретацию взаимосвязей между оценками теста и эмпирическими данными (Messick, 1995). Достоверность и описательная статистика тестов на коварианты представлены в таблице 4.
Таблица 4 Описательная статистика и корреляции тестов по ковариатамВо-первых, был проведен тест предшествующих знаний по предметной области, который включал три шкалы в различных областях содержания: химия сложных эфиров, взаимосвязь между структурой и свойством и природа химического равновесия.Тест состоял из 22 заданий с множественным выбором, которые оценивались дихотомически. Полученный суммарный балл рассматривался как мера предшествующих знаний студентов в предметной области.
Во-вторых, ученики должны были поработать над тестом плавного интеллекта , который содержал 36 пунктов. Они касались фигурной, числовой и вербальной шкал по 12 пунктов каждая. Студентам приходилось работать над образными и словесными аналогиями (например, «яблоки: сок = картофель:?»), А также над задачами математического мышления (подробности см. В Schroeders et al.2010). Все вопросы были оценены дихотомически и включены в общий фактор (Gf).
Наконец, мы проверили общий интерес студентов, применив две шкалы теста AIST (немецкий: Allgemeiner Interessens-Struktur-Test ; Bergmann and Eder 2005). Мы выбрали реалистичную (AIST-r) и исследовательскую (AIST-i) шкалы для дальнейшего анализа, поскольку они отражают аспекты научного интереса с приемлемыми психометрическими свойствами. Тест на общий интерес содержал 20 утверждений, которые оценивались по четырехбалльной шкале Лайкерта и суммировались до окончательной оценки по каждой шкале (0 = , я полностью не согласен, до 3 = , полностью согласен, ).
Анализ данных
Применение вероятностных моделей измерения
Для оценки способностей учащихся к решению задач исходные баллы были масштабированы с помощью моделей теории ответа на вопросы (IRT), которые реализованы в программном пакете ACER ConQuest 2.0 (Ву и др., 2007). Эти модели полезны при моделировании многомерных компетенций, поскольку они позволяют проводить прямые сравнения между конкурирующими моделями и показывают взаимосвязь между трудностями, связанными с заданиями, и параметрами способностей человека.Они стали заметными в разработке тестов и естественнонаучном образовании (Neumann et al. 2011). Мы выбрали IRT-анализ как современный подход к моделированию сложных и многомерных конструкций (Bond and Fox 2007). Модели IRT подходят для моделирования категориальных данных без предположения о нормально распределенных переменных и допускают нелинейные отношения между скрытыми переменными и элементами (Wirth and Edwards 2007). Следуя модельным подходам к решению проблем и исследовательским способностям, предложенным многими преподавателями естественных наук и педагогами-психологами (например,г., Куо и Ву, 2013; Neumann et al. 2011; Scherer 2012; Quellmalz et al. 2012; Wüstenberg et al. 2012), эти анализы оказались подходящими для применения подтверждающего анализа размерности, особенно из-за категоричности оценок учащихся (Bond and Fox 2007). Поскольку задания оценивались дихотомически и политомически, в данном исследовании использовалась модель частичного кредита. Эта модель учитывает пороги между категориями и может быть обобщена на многомерные аналоги, интерпретируя способности человека и трудности с предметами как многомерные векторы.Дополнительно была принята во внимание структура ковариационно-дисперсионной матрицы. Мы также отмечаем, что зависимостями элементов в ответах студентов можно пренебречь (для получения дополнительной информации см. Scherer 2012). Масштабирование IRT применялось в два этапа: первый шаг включал анализ на основе всех администрируемых элементов с целью идентификации элементов. что не соответствовало модели IRT. Одно- и четырехмерные модели использовались для исследования скрытой структуры конструкции и надежности каждого фактора (см. Рисунок 3).
Рисунок 3Две конкурирующие модельные структуры. (а) однофакторная модель и фасетная модель (б) с четырьмя коррелированными факторами, представляющими этапы решения проблемы. Буквы l , m , n и o обозначают количество элементов на каждом из четырех этапов.
Впоследствии только элементы с умеренной дискриминацией, средневзвешенное значение квадрата (wMNSQ) от 0,75 до 1,33 и абсолютное значение t ниже 1.96, были включены во второй этап (Adams and Khoo 1996). И снова к данным были применены одно- и четырехмерные модели. Полученные в результате параметры человека и предмета были использованы для получения описательной статистики. В этой процедуре был применен алгоритм Монте-Карло цепи Маркова для многомерных моделей IRT (Wu et al. 2007).
Для оценки соответствия модели были приняты во внимание общие информационные критерии, такие как информационный критерий Акаике (AIC) и байесовский информационный критерий (BIC).Эти индексы даются следующим образом:
AIC = dev + 2npBIC = dev + logN · np,
, где «dev» представляет окончательное отклонение модели, N – размер выборки и n p – количество параметров для оценки модели. Эмпирически предпочтительны модели с меньшими значениями AIC и BIC. Для сравнения конкурирующих моделей использовались информационные критерии и тест отношения правдоподобия × 2 для окончательных отклонений.
Ссылаясь на наше теоретическое предположение о четырех факторах решения проблемы, мы только проверили, превосходит ли четырехмерная модель модель с одним фактором.Можно было бы протестировать другие модели CPS с меньшим количеством измерений, но мы сосредоточились на валидации предложенной модели с четырьмя факторами, поскольку не было концептуальных и эмпирических доказательств для объединения или дифференциации этих шагов (Koppelt 2011; OECD 2013; Scherer 2012).
Моделирование структурных уравнений
Для анализа взаимосвязей между CPS и связанными конструкциями мы создали модели структурных уравнений, которые были проанализированы в Mplus 6.0 (Muthén and Muthén, 2010). В этом анализе параметры человека процедуры масштабирования IRT использовались в качестве индикаторов CPS. В процессе оценки отсутствующие значения обрабатывались с применением процедуры максимального правдоподобия полной информации (FIML) (Enders 2010). Согласно тесту Литтла MCAR, данные, вероятно, полностью соответствуют механизму пропуска случайным образом ( × 2 (309) = 335,16, p = 0,15), что узаконило использование FIML. В этом подходе к моделированию CPS служил результатом, а ковариаты – предикторами.Мы, наконец, выбрали моделирование структурным уравнением (SEM), чтобы получить довольно экономную модель, которая отражает отношения между CPS и ковариатами. В свете относительно небольшого размера выборки альтернативные подходы, такие как IRT-моделирование со скрытой регрессией, могли бы дать более смещенные оценки.
Молниеносное решение сложных физических задач
Расчет, который настолько сложен, что для его выполнения на мощном настольном компьютере уходит двадцать лет, теперь можно выполнить за один час на обычном ноутбуке.Физик Андреас Экстрём из Технологического университета Чалмерса вместе с международными коллегами-исследователями разработал новый метод невероятно быстрого вычисления свойств атомных ядер.
Новый подход основан на концепции, называемой эмуляцией, где приблизительный расчет заменяет полный и более сложный расчет. Хотя исследователи сокращают путь, решение оказывается почти таким же. Это напоминает алгоритмы машинного обучения, но в конечном итоге исследователи разработали совершенно новый метод.Это открывает еще больше возможностей для фундаментальных исследований в таких областях, как ядерная физика.
«Теперь, когда мы можем моделировать атомные ядра с помощью этого метода, у нас есть совершенно новый инструмент для построения и анализа теоретических описаний сил между протонами и нейтронами внутри атомного ядра», – говорит руководитель исследования Андреас Экстрём, доцент кафедры Физика в Чалмерсе.
Основы для понимания нашего существования
Этот предмет может показаться нишевым, но на самом деле он имеет фундаментальное значение для понимания нашего существования, стабильности и происхождения видимой материи.Большая часть атомной массы находится в центре атома, в плотной области, называемой атомным ядром. Составляющие ядра частицы, протоны и нейтроны, удерживаются вместе чем-то, что называется сильной силой. Хотя эта сила занимает центральное место в нашем существовании, никто точно не знает, как она работает. Чтобы расширить наши знания и раскрыть фундаментальные свойства видимой материи, исследователи должны иметь возможность моделировать свойства атомных ядер с большой точностью.
Фундаментальные исследования, над которыми работают Андреас Экстрём и его коллеги, проливают новый свет на самые разные темы – от нейтронных звезд и их свойств до внутренней структуры и распада ядер.Фундаментальные исследования в области ядерной физики также вносят важный вклад в астрофизику, атомную физику и физику элементарных частиц.
Открывая двери для совершенно новых возможностей
«Я невероятно рад, что могу производить вычисления с такой точностью и эффективностью. По сравнению с нашими предыдущими методами, кажется, что теперь мы выполняем вычисления с молниеносной скоростью. В нашей текущей работе здесь, в Chalmers, мы надеемся улучшить эмуляцию метод дальше, и выполнить расширенный статистический анализ наших квантово-механических моделей.Похоже, что с помощью этого метода эмуляции мы можем добиться результатов, которые ранее считались невозможными. Это, безусловно, открывает двери для совершенно новых возможностей », – говорит Андреас Экстрём.
Проект финансируется Европейским исследовательским советом в рамках стартового гранта ERC.
Подробнее о работе по изучению секретов атомных ядер.
Подробнее о математическом сокращении
Новый метод эмуляции основан на так называемом продолжении собственного вектора (EVC).Он позволяет имитировать многие квантово-механические свойства атомных ядер с невероятной скоростью и точностью. Вместо того, чтобы напрямую решать трудоемкую и сложную задачу многих тел снова и снова, исследователи создали математический ярлык, используя преобразование в специальное подпространство. Это позволяет использовать несколько точных решений для более быстрого получения приближенных решений.
Если эмулятор работает хорошо, он генерирует решения, которые почти точно – примерно на 99 процентов – аналогичны решениям исходной проблемы.Это во многом те же принципы, которые используются в машинном обучении, но это не нейронная сеть или гауссовский процесс – в основе этого лежит совершенно новый метод. Метод эмуляции EVC не ограничивается атомными ядрами, и в настоящее время исследователи изучают различные типы приложений.
###
Новые результаты опубликованы в двух статьях:
«Продолжение собственного вектора как эффективный и точный эмулятор для количественной оценки неопределенности», опубликовано в журнале Physics Letters B , написанном Себастьяном Кенигом, Андреасом Экстрёмом, Каем Хебелером, Дином Ли и Ахимом Швенком.Исследователи работают в Университете штата Северная Каролина, США, Технологическом университете Чалмерса, Технологическом университете Дармштадта, Германия, и Университете штата Мичиган, США.
«Анализ глобальной чувствительности объемных свойств атомного ядра», опубликованный в Physical Review Letters, написанный Андреасом Экстрёмом, Чалмерсом и Гауте Хагеном, Национальная лаборатория Окриджа, США.
За дополнительной информацией обращайтесь:
Андреас Экстрём, доцент кафедры физики, Технологический университет Чалмерса, Швеция, +46 31 772 36 85 andreas.




 Ленина, 124/3, МАОУ «Академический лицей»
Ленина, 124/3, МАОУ «Академический лицей»