So таблица менделеева: Таблица Менделеева online
- Группа so(4,2) и симметрийные свойства Периодической системы элементов Д. И. Менделеева Текст научной статьи по специальности «Физика»
- Химики предложили улучшить таблицу Менделеева: Наука и техника: Lenta.ru
- Химия созидания. Как природа заполняла таблицу Менделеева со времен Большого в
- В Москве состоялось открытие Года Периодической таблицы химических элементов
- Периодическая система Менделеева • Джеймс Трефил, энциклопедия «Двести законов мироздания»
- Выставка «Умеющий видеть сквозь время» — Озерский технологический институт
- ГРУППА SO(4,2) И СИММЕТРИЙНЫЕ СВОЙСТВА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА | Гурский
- Периодическая таблица элементов обращается 150 | WUWM 89,7 FM
- Сера – Информация об элементе, свойства и использование
- Периодическая таблица элементов по WebElements
- Как далеко заходит таблица Менделеева?
- Неизменная таблица Менделеева Химии отмечает большой день рождения
- | Определение, элементы, группы, сборы, тенденции и факты
- Периодическая таблица элементов | Химия
Группа so(4,2) и симметрийные свойства Периодической системы элементов Д. И. Менделеева Текст научной статьи по специальности «Физика»
Доклады БГУИР
2016 № 4 (98)
УДК [541.1+539.2]
ГРУППА SO(4,2) И СИММЕТРИЙНЫЕ СВОЙСТВА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
АЛ. ГУРСКИЙ, ЛИ. ГУРСКИЙ
Белорусский государственный университет информатики и радиоэлектроники П. Бровки,6, Минск,220013, Беларусь
Поступила в редакцию 1 апреля 2016
Рассматривается групповой метод классификации элементов для определения их расположения в Периодической системе элементов Д.И. Менделеева. Сравниваются расположение энергетических элементов по периодам в диаграмме экспериментально установленных электронных оболочек элементов с энергетическими уровнями электронных оболочек элементов, определенных по правилам лексикографического упорядочения Маделунга-Клечковского.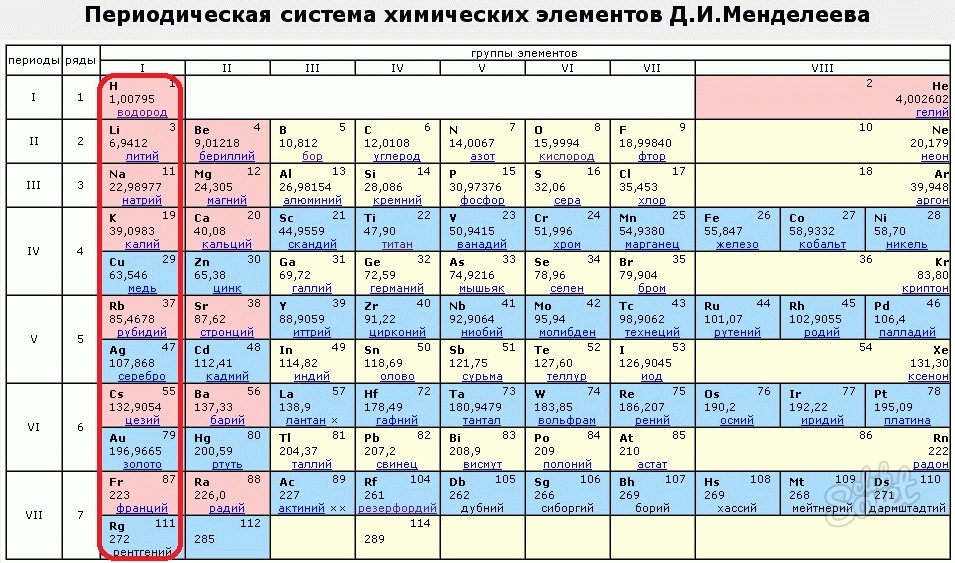
Ключевые слова: периодический закон, группа SO(4,2), подгруппы О(4), уравнение Шредингера, правило Маделунга-Клечковского.
Введение
В работе [1] приводятся современная формулировка периодической зависимости свойств химических элементов, примеры использования групп симметрии в науке и способы представления состояний атомов и электронов в квантовой механике, основанные на закономерностях, определяющих строение и свойства материи. Эти данные позволяют утверждать, что теория групп симметрии и закономерности строения материи имеют связи.
Следует отметить, что основные постулаты квантовой механики имеют фундаментальное значение при использовании в различных разделах теоретической физики. В нерелятивистской квантовой механике эволюция любой физической системы во времени определяется уравнением Шредингера дщ/д = /Гу, где Г – оператор энергии (гамильтониан, массовый оператор). Здесь у – элемент гильбертова пространства или пространства состояний Н. Вся информация о физической системе содержится в векторе состояния (волновой функции) у. При теоретическом рассмотрении обычно используются квадратичные формы вида А у, у, где А – линейный оператор в Н. В дальнейшем рассматриваются только эрмитовы операторы, соотносящиеся с разными физическими величинами: импульсом, координатой, моментом импульса, энергией, зарядом. В этой связи необходимо отметить, что точное описание электронного строения из первых принципов с использованием уравнения Шредингера, несмотря на огромные возможности современной вычислительной техники даже для сравнительно простых атомных систем, является практически неразрешимой задачей.
условиях качественные закономерности поведения реальных физических систем. В связи с этим разработка и применение новых эффективных методов, которые делали бы возможным аналитический анализ качественных особенностей поведения атомно-молекулярных систем, являются важной и актуальной задачей, решению которой и посвящены исследования настоящей работы. К таким методам относятся и методы, основанные на использовании групп С. Ли, естественно возникающих при рассмотрении непрерывных симметрий. С любой группой С. Ли можно связать некоторую алгебру Ли, которая полностью отражает локальную структуру группы, во всяком случае, если группа Ли связна. Таким образом, существует теоретическое обоснование уникального соответствия между группами С. Ли и более простыми объектами, известными как алгебры Ли. Группы С. Ли часто выступают как симметрии какой-либо структуры на некотором многообразии (в данной статье – Периодической системы элементов).
С любой группой С. Ли можно связать некоторую алгебру Ли, которая полностью отражает локальную структуру группы, во всяком случае, если группа Ли связна. Таким образом, существует теоретическое обоснование уникального соответствия между группами С. Ли и более простыми объектами, известными как алгебры Ли. Группы С. Ли часто выступают как симметрии какой-либо структуры на некотором многообразии (в данной статье – Периодической системы элементов).
Группа 80(4,2) и симметрийные свойства Периодической системы элементов
Рис. 1. Диаграмма энергетических уровней экспериментально установленных электронных оболочек элементов (в настоящее время известны 123 элемента)
Известно, что вся совокупность явлений в атомной и молекулярной физике определяется с использованием законов квантовой механики, учитывающих особенности электромагнитных взаимодействий, а теоретическое определение электронного строения вещества базируется на соответствующих решениях уравнения Шредингера с полностью определенным гамильтонианом.
После открытия периодического закона Д.И. Менделеевым и до настоящего времени задача по установлению закономерностей заполнения электронных оболочек элементов является объектом исследований химиков, физиков и ученых других специальностей в ее фундаментальных и прикладных аспектах. Однако, несмотря на достаточно точное описание свойств атомов на основе численного решения уравнений Хартри-Фока, проблема систематизации одноэлектронных состояний остается открытой. В настоящей статье и работах [1-5] решается задача – показать, что использование группы 80(4,2) позволяет
приблизиться к определению порядка заполнения электронных оболочек элементов в соответствии с экспериментальными данными, позволившими представить современную форму Периодической системы элементов. Эти результаты не исчерпывают всю проблему в целом, так как включают феноменологический параметр и оставляют открытым вопрос о характере атомного потенциала, соответствующего обнаруженной симметрии, но являются важным этапом в решении данной задачи.
Теоретический анализ базируется на рассмотрении диаграммы энергетических уровней электронных оболочек элементов, обобщающей результаты экспериментального изучения строения атомов (Периодическая система элементов Д.И. Менделеева (рис. 1). Общепринятым при обсуждении строения атомов является использование представлений модели независимых частиц [6, 7]. Именно поэтому в соответствии с правилом Паули [8] клетки на рис. 1 снабжены символами, указывающими значения главного п и орбитального I квантовых чисел. Здесь 2/ +1 – число проекций орбитального момента на заданное направление, удвоение 2(2/ +1) обусловлено числом возможных ориентаций спина электрона. При сферической симметрии самосогласованного поля энергии этих электронов будут одинаковыми, вследствие чего 2/ +1 клеток расположены на одном уровне. Цифры внутри клеток указывают атомный номер элемента 2 и равное ему количество электронов в нейтральном атоме. Их расположение в определенной клетке указывает на занятость электронами последнего и всех предшествующих состояний.
Периодичность свойств элементов обусловлена фундаментальными закономерностями строения электронных оболочек атомов, при этом распределение электронов внешней оболочки определяется, прежде всего, значениями орбитального квантового числа I. Эта периодичность ясно видна на диаграмме, рис. 1, – атомы, размещенные в одном вертикальном столбце, обладают подобными химическими свойствами. Например, атомы элементов: ю№, 1вАг, збКг, 54Хе, 8бКи – инертные газы; атомы элементов: зЫ, 19К, 37ЯЬ, 55С8, 87рг – щелочные металлы; атомы элементов: 29Си, 47Ag, 79Аи – благородные металлы; и т.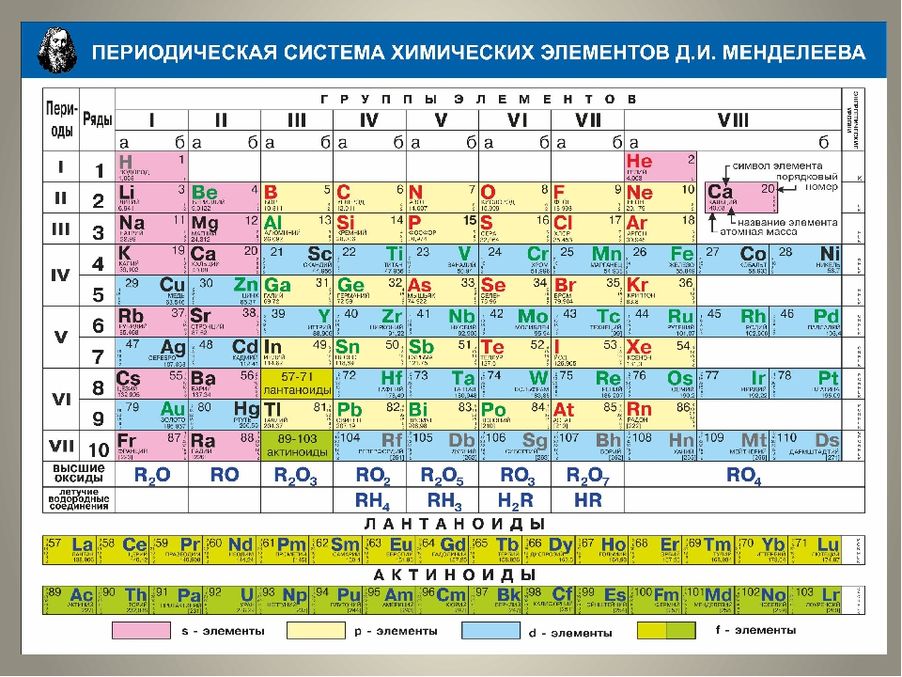 д. Приведенная на рис. 1 диаграмма без детализации содержания, приводимого в клетках Периодической системы, отражает экспериментальные данные о строении электронных оболочек атомов, и она является основой для дальнейшего анализа.
д. Приведенная на рис. 1 диаграмма без детализации содержания, приводимого в клетках Периодической системы, отражает экспериментальные данные о строении электронных оболочек атомов, и она является основой для дальнейшего анализа.
 1). Наборы состояний водородоподобной системы, т.е. представление группы 80(4,2), и наборы состояний в электронных оболочках атомов, приведенные на диаграмме, рис. 1, – это наборы, между которыми можно установить некоторое соответствие. Для этого «реорганизация» осуществляется с помощью правил лексикографического упорядочения Маделунга-Клечковского [15, 16]: при заданных значениях 1) суммы главного квантового числа п и орбитального квантового числа I, т.е. числа п+1, 2) главного квантового числа п и 3) числа 5, определяющего ориентацию спина, заполняются состояния с разными значениями проекций орбитального момента М&; затем заполняются состояния с различными значениями проекций орбитального момента Ыь для противоположной ориентации спина. После чего наступает очередь такого же заполнения состояний со значением числа п, большим на единицу, при той же величине суммы чисел п+1. После исчерпания всех возможных значений главного квантового
1). Наборы состояний водородоподобной системы, т.е. представление группы 80(4,2), и наборы состояний в электронных оболочках атомов, приведенные на диаграмме, рис. 1, – это наборы, между которыми можно установить некоторое соответствие. Для этого «реорганизация» осуществляется с помощью правил лексикографического упорядочения Маделунга-Клечковского [15, 16]: при заданных значениях 1) суммы главного квантового числа п и орбитального квантового числа I, т.е. числа п+1, 2) главного квантового числа п и 3) числа 5, определяющего ориентацию спина, заполняются состояния с разными значениями проекций орбитального момента М&; затем заполняются состояния с различными значениями проекций орбитального момента Ыь для противоположной ориентации спина. После чего наступает очередь такого же заполнения состояний со значением числа п, большим на единицу, при той же величине суммы чисел п+1. После исчерпания всех возможных значений главного квантовогочисла п при неизменном значении суммы чисел п+1, наступает очередь заполнения состояний со значением суммы чисел п+1, на единицу большим.
Рис. 2. Лексикографическое упорядочение энергетических уровней электронных оболочек элементов
по правилам Маделунга-Клечковского
Описанное правило при выполнении упомянутой выше «реорганизации» мультиплетов представления группы 80(4,2) фактически дает определение электронной оболочки значениями суммы чисел п+1 и относит к мультиплету состояний, составляющих оболочку, состояния с одинаковыми значениями суммы чисел п+1. Результат, полученный с использованием правил лексикографического упорядочения Маделунга-Клечковского, представлен диаграммой (рис. 2).
Сопоставление диаграмм рис. 1 и 2 показывает, что, оставаясь в рамках представления группы 80(4,2), возможно существенно приблизить теоретическое истолкование для представлений групп классификации состояний электронов в многоэлектронном атоме к экспериментальным результатам (рис. -состояния для главного квантового числа п, на единицу большего. Отказ от использования при классификации состояний квантовых чисел, относящихся к одному электрону, и переход на формальную точку зрения с оставлением проблемы интерпретации квантовых чисел будущему, не устранил уже упоминавшегося удвоения первого периода [11].
-состояния для главного квантового числа п, на единицу большего. Отказ от использования при классификации состояний квантовых чисел, относящихся к одному электрону, и переход на формальную точку зрения с оставлением проблемы интерпретации квантовых чисел будущему, не устранил уже упоминавшегося удвоения первого периода [11].
Полного успеха в решении обсуждаемой проблемы с помощью использования правил лексикографического упорядочения Маделунга-Клечковского достичь не удалось. Одна из главных причин заключается в том, что у этих эмпирических правил, с помощью которых «деформировалось» представление группы 80(4,2), нет теоретического обоснования и, более того, и не может быть. Это обусловлено тем, что главное квантовое число п является собственным значением одного из генераторов группы 80(4,2), в то время как ни квантовое число I, ни сумма чисел п+1 не могут быть собственными значениями каких-либо эрмитовых
операторов. Это объясняется следующим: число I возникает только при определении собственных значений оператора квадрата орбитального момента. Собственные значения оператора квадрата орбитального момента, как известно, равны 1(1+1). Таким образом, на основании изложенного нельзя однозначно сделать выводы о невозможности осуществить необходимую для приведения к эмпирически наблюдаемому составу электронных оболочек «реорганизацию» представлений группы 80(4,2) и определить «правильный» порядок заполнения электронных оболочек. Можно предположить, что динамическое правило определения состава электронных оболочек многоэлектронных атомов позволит выполнить необходимую для приведения к эмпирически наблюдаемому составу электронных оболочек «реорганизацию» представлений группы 80(4,2) и определить «правильный» порядок заполнения электронных оболочек атомов элементов.
Это объясняется следующим: число I возникает только при определении собственных значений оператора квадрата орбитального момента. Собственные значения оператора квадрата орбитального момента, как известно, равны 1(1+1). Таким образом, на основании изложенного нельзя однозначно сделать выводы о невозможности осуществить необходимую для приведения к эмпирически наблюдаемому составу электронных оболочек «реорганизацию» представлений группы 80(4,2) и определить «правильный» порядок заполнения электронных оболочек. Можно предположить, что динамическое правило определения состава электронных оболочек многоэлектронных атомов позволит выполнить необходимую для приведения к эмпирически наблюдаемому составу электронных оболочек «реорганизацию» представлений группы 80(4,2) и определить «правильный» порядок заполнения электронных оболочек атомов элементов.
Динамическое правило для состава электронных оболочек многоэлектронных атомов
До сих пор, обсуждая симметрийные свойства Периодической системы, классификацию электронных состояний и их отношение к представлениям группы динамической симметрии водородоподобного атома, не рассматривался вопрос о том какими волновыми функциями в рамках модели независимых частиц описываются электроны в атомах. Ответ на этот вопрос может быть следующим. В многоэлектронном атоме движение электрона происходит не только в кулоновском поле ядра, но и в поле остальных электронов. В результате энергия многоэлектронного атома определяется не только главным квантовым числом п, но и орбитальным числом I, что и объясняет структуру диаграммы на рис. 1, при этом для определения явного вида «наилучшей» волновой функции в модели независимых частиц необходимо решить уравнение Хартри-Фока для рассматриваемого атома. Приведенное рассуждение ведет к заключению, что волновые функции электрона в многоэлектронном атоме будут значительно отличаться от водородоподобных волновых функций, а отсюда, в свою очередь, к тому, что состояния, принадлежащие представлению группы 50(4,2), могут и не иметь отношения к состояниям электронов в атомах, отличных от атома водорода. В этой важной проблеме такое заключение оказывается не соответствующим действительности. В работах [17, 18] показано, что «водородоподобные» волновые функции с должным образом определенным эффективным зарядом являются удивительно хорошим приближением к волновым функциям метода Хартри-Фока.
Ответ на этот вопрос может быть следующим. В многоэлектронном атоме движение электрона происходит не только в кулоновском поле ядра, но и в поле остальных электронов. В результате энергия многоэлектронного атома определяется не только главным квантовым числом п, но и орбитальным числом I, что и объясняет структуру диаграммы на рис. 1, при этом для определения явного вида «наилучшей» волновой функции в модели независимых частиц необходимо решить уравнение Хартри-Фока для рассматриваемого атома. Приведенное рассуждение ведет к заключению, что волновые функции электрона в многоэлектронном атоме будут значительно отличаться от водородоподобных волновых функций, а отсюда, в свою очередь, к тому, что состояния, принадлежащие представлению группы 50(4,2), могут и не иметь отношения к состояниям электронов в атомах, отличных от атома водорода. В этой важной проблеме такое заключение оказывается не соответствующим действительности. В работах [17, 18] показано, что «водородоподобные» волновые функции с должным образом определенным эффективным зарядом являются удивительно хорошим приближением к волновым функциям метода Хартри-Фока. Этот вывод основан на вычислении эффективных зарядов для поля, действующего на электрон, из значений моментов волновых функций Хартри-Фока. Хорошо известно [6,7], что моменты
Этот вывод основан на вычислении эффективных зарядов для поля, действующего на электрон, из значений моментов волновых функций Хартри-Фока. Хорошо известно [6,7], что моменты
да
с”) = \ сСсск+2\Я„, (с )|2 (1)
0
водородоподобных радиальных волновых функций однозначно определяются эффективным зарядом данного состояния и, наоборот, эффективный заряд однозначно определяется любым из моментов, приведенных в формулах (2):
2.. = п
5п2 +1 -3/(/ +1). 7 _ 3п -/(/ +1) -„2 Л.7-„\пА\ ±
2/2\ ‘ 2зФФ = 2(с) ‘ 2эфф = п \с/’ 2эфф = X + 2 \
1
Если волновые функции Хартри-Фока действительно хорошо представляются водородоподобными волновыми функциями, то эффективные заряды, вычисленные по формулам (2) через моменты одной и той же волновой функции Хартри-Фока, не должны сильно отличаться. Это подтверждается для различных 5-, р- и й- состояний атомов С8 результатами работ [17, 18].
Это подтверждается для различных 5-, р- и й- состояний атомов С8 результатами работ [17, 18].
Изложенное позволяет утверждать, что состояния водородоподобной системы имеют непосредственное отношение к состояниям диаграммы рис. 1 для электронов в многоэлектронных атомах, если удастся изменить характер вырождения собственных значений одноэлектронного гамильтониана водородоподобной системы, не изменяя принадлежащих этому гамильтониану собственных функций. Речь должна идти именно о характере вырождения собственных значений, так как и близость величин эффективных зарядов состояний, принадлежащих данной электронной оболочке [6], и порядок заполнения электронами
состояний в оболочке [6, 7] явно свидетельствуют об энергетической близости этих «соревнующихся» [7] состояний.
Эффективные заряды электронных состояний в 55Cs+ [17]
Zэфф (r 2) (r) (r -1) (r -2) Среднее значение Zэфф
Zls 54,2 54,30 54,47 54,55 54,38+0,10
Z2s 50,4 50,60 50,22 50,58 50,56+0,10
Z2p 49,1 49,49 50,15 50,51 49,83+0,40
Z3s 43,2 43,42 41,70 42,13 42,62+0,75
Z3p 41,2 41,36 40,97 42,02 41,05+0,16
Z3d7 37,8 38,44 39,73 40,45 39,12+0,60
Z4s9 33,1 33,20 30,45 30,31 31,79+1,3
Z4p2 30,6 30,62 28,87 29,91 30,00+0,06
Z4d8 25,0 25,26 25,25 26,74 25,33+0,20
Z5s5 20,3 20,39 17,48 16,13 18,58 +1,8
Z5p1 17,3 17,37 15,21 15,12 16,25+1,0
Заключение
Таким образом, показано, что сущность развития групповых методов при классификации элементов для определения их расположения в Периодической системе элементов заключается в необходимости изменения характера вырождения собственных значений одноэлектронного гамильтониана водородоподобной системы, при этом 1) с сохранением группы SO(4,2) в качестве группы динамической симметрии, но 2) без изменения собственных функций гамильтониана и 3) с сохранением близости эффективных зарядов почти вырожденных состояний. Решить эту проблему можно, вводя в гамильтониан член, выражающийся через операторы алгебры Ли группы SO(4,2) и нарушающий симметрию относительно преобразований из подгруппы О(4) этой группы. Для этого вполне достаточно включить в гамильтониан член, содержащий оператор квадрата орбитального момента, т.е. сделать допущение, что состояние электрона в многоэлектронном атоме моделируется уравнением
Решить эту проблему можно, вводя в гамильтониан член, выражающийся через операторы алгебры Ли группы SO(4,2) и нарушающий симметрию относительно преобразований из подгруппы О(4) этой группы. Для этого вполне достаточно включить в гамильтониан член, содержащий оператор квадрата орбитального момента, т.е. сделать допущение, что состояние электрона в многоэлектронном атоме моделируется уравнением
(ш/2) (2 + N + 2f (12)) \у) = Z3(J у), (3)
где f(P) – функция, которая задается таким образом, чтобы максимально приблизиться к эмпирическому характеру вырождения одноэлектронных состояний в многоэлектронных атомах. Эти подходы требуют детального анализа и будут рассмотрены в следующей статье.
GROUP SO(4,2) AND SYMMETRY PROPERTIES OF D.I. MENDELEEV’S PERIODIC SYSTEM ELEMENTS
A.L. GURSKII, L. I. HURSKI Abstract
I. HURSKI Abstract
The group-based method of classification of chemical elements for definition of their place in the Mendeleev’s periodic system of elements is considered. The arrangement of energetic elements in periods according to the diagram of experimentally defined atomic electron shells is compared to energy levels of elements estimated from the Madelung-Klechkovsky lexicographic ordering rules. It is shown that for adequate description of the set of elements in the framework of approach based on the use of the group method, the changig the peculiarirties of the eigenvalues degeneration of the electron hamiltonian describing a hydrogen-like system is necessary. For this, it is sufficient to include into the hamiltonian a term containing operator of squared orbital momentum.
Keywords: periodic law, the group SO(4,2), subgroups of O(4), equation Schrodinger, the rule of Madelung-Kleczkowska.
Список литературы
1. Гурский А.Л., Гурский Л.И. // Докл. БГУИР. 2015. № 8 (94). С. 38-43.
2. Гурский Л.И, Комаров Л.И. // Докл. АН Беларуси. 1997. Т. 41, № 4. С. 49-52.
3. Гурский Л.И., Комаров Л.И., СолодухинА.М. // Изв. НАН Беларуси. Сер. физ.-мат.наук. № 2. 1998. С. 58-65.
4. Gurskii L.I., KomarovL.I., Solodukhin A.M. // International Jornal of Quantum Chemistry. 1999. Vol. 72. P. 499-508.
5. Гурский Л.И. // Вестн. Фонда фундаментальных исследований. 2004. № 3 (29). С. 61-79.
6. Полинг Л., Полинг П. Химия. М.,1978.
7. Ландау Л.Д., Лифшиц Е.М. Квантовая механика. Нерелятивистская теория. М., 1989.
Нерелятивистская теория. М., 1989.
8. Паули В. Волновая механика. М., 1947.
9. Румер Ю.Б., Фет А.И. // Теоретическая и математическая физика. 1971. Т. 9, № 2. С. 203-210.
10. Конопельченко Б.Г. Группа SO(4,2) + R и таблица Менделеева. Новосибирск, 1972.
11. Novaro O.A., Barrondo M. // Jornal Phys., B. 1972. Vol. 5, № 6. P. 1104-1110.
12. Фет А.И. Математическое моделирование в биологии и химии: новые подходы. Новосибирск, 1992. С. 118-203.
13. Zhuvikin G.V., Hefferlin R. Symmetry principles for periodic systems of molecules. JR-PHYS-SC/SPBU 1. Joint Report #1 of the Physics Departaments Southern College, Collegedate, USA, St.Petersburg University, St. Petersburg, Russia, 1994.
14. Фет А.И. Группа симметрии химических элементов. Новосибирск, 2010.
15. Маделунг Э. Математический аппарат физики. М., 1960.
16. Клечковский В.М. Распределение атомных электронов и правило последовательного заполнения (n+0-групп. М., 1968.
17. Kregar M. // Physica Scripta. 1984. Vol. 29. P. 438-437.
18. Kregar M. // Physica Scripta. 1985. Vol. 29. P. 246-254.
Химики предложили улучшить таблицу Менделеева: Наука и техника: Lenta.ru
Сразу двое ученых опубликовали работы, посвященные новым интерпретациям привычной всем таблицы Менделеева. Один из исследователей, Марис Киблер (Maurice Kibler), предлагает использовать теоретико-групповой подход, аналогичный тому, который применяется в квантовой механике. Статья ученого еще нигде не опубликована, однако ее препринт доступен на сайте arXiv.org
Статья ученого еще нигде не опубликована, однако ее препринт доступен на сайте arXiv.org
В рамках своего исследования Киблер изучал группу SO(4,2)xSU(2). Первый множитель называется специальной псевдоортогональной группой для пространства 4+2, а второй – специальной унитарной группой плоскости. Эти объекты естественным образом возникают при описании явлений квантовой механики.
Каждый элемент Киблер предлагает кодировать набором его электронов. При этом каждый электрон предлагается для удобства считать размещенным на энергетических уровнях атома водорода. Состояние каждого такого электрона однозначно задается четырьмя так называемыми квантовыми числами. Такая “водородно-электронная” классификация заметно отличается от привычной всем классификации по свойствам и атомным номерам обычной таблицы Менделеева.
По словам ученого, новый подход может оказаться полезным для анализа свойств будущих сверхтяжелых элементов. Теоретически, данный подход может пригодиться при изучении так называемого “острова стабильности” – группы устойчивых сверхтяжелых элементов.
Другой исследователь, Мод Абубар из Индии, предложил на его взгляд более правильную запись периодической таблицы. Он предлагает записывать элементы по концентрическим окружностям, поместив отдельно ближе к центру гелий и водород. По словам Абубара, подобная запись отражает относительный размер атомных ядер, поскольку размеры ячеек к краю таблицы увеличиваются. При этом, однако, читать круглую таблицу гораздо менее удобно, чем прямоугольную.
Периодическая таблица химических элементов была создана Менделеевым в 1869 году. Сейчас известно несколько сот вариантов изображения данной таблицы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой положение элемента в столбце определяет его физико-химические свойства. При этом элементы занумерованы атомными числами, то есть зарядами ядер.
Химия созидания. Как природа заполняла таблицу Менделеева со времен Большого в
Окружающий нас мир – набор химических элементов, которые начали формироваться еще 13,8 миллиарда лет назад. Какие процессы привели к созданию этих стройматериалов вселенной, рассказывается в материале Los Angeles Times
В этом году исполнилось 150 лет с тех пор, как Дмитрий Менделеев составил периодическую таблицу химических элементов. С тех пор ученые всего мира трудились над тем, чтобы заполнить ее ряды, а также понять свойства каждого вещества. Однако работа велась и в другом направлении. Исследователи прочесывали космос, чтобы выяснить происхождение всех элементов таблицы.
Будь всегда в курсе событий вместе с телеграм-каналом Быстрый Фокус.
После десятилетий усилий они определили, что подавляющее большинство элементов возникло, благодаря жизни и смерти звезд. Теперь они обеспечивают химическое разнообразие новому поколению светил и планет.
Большинство элементов на Земле (за исключением немногих, недавно синтезированных людьми) – наследие туманности, породившей Солнечную систему 4,5 миллиарда лет назад. Это и железо в наших небоскребах, и кремний в наших компьютерах, и золото в наших украшениях, и кальций в наших костях.
“Элементы создают реальную связь между нашей галактикой, нашей вселенной и всем человечеством”, – говорит астрофизик из Университета Оклахомы Джон Коуэн.
Так как же природа заполнила периодическую таблицу? Начнем эту историю с начала. С самого начала.
Возьмем немного водородаВ течение первых минут после Большого взрыва в облаке новорожденных частиц по мере его расширения и охлаждения объединились атомы водорода (атомный номер 1). Некоторые из них быстро соединились в гелий (атомный номер 2). Эти два элемента и по сей день составляют 98% вселенной и являются основными компонентами звезд. Передовой астроном Сесилия Пейн-Гапошкина указала на это, когда опубликовала оценку состава Солнца в 1925 году, опровергнув распространенное мнение о том, что он похож на состав Земли.
Вселенная состоит на 98% из водорода и гелия, образовавшихся вскоре после Большого взрыва
Самые первые звезды сформировались примерно через 100 миллионов лет после Большого взрыва, отмечает Дженнифер Джонсон, астроном из Университета штата Огайо, автор свежего обзора происхождения элементов, опубликованного в журнале Science. Они были массивными, и в течение длительного времени генерировали энергию, “сжигая” водород и объединяя атомы в гелий посредством ядерного синтеза, как Солнце делает и сегодня.
Однако рано или поздно у всех звезд заканчивается водородное топливо. Тогда они в неистовом темпе начинают производить все более тяжелые элементы, заполняя в процессе следующие три строки таблицы Менделеева.
Некоторое время они перерабатывают гелий в углерод (атомный номер 6) и кислород (атомный номер 8). Затем, ближе к концу жизни, звезда превращает углерод в такие элементы, как натрий (атомный номер 11) и магний (атомный номер 12). Следом атомы кислорода начинают сливаться в кремний (атомный номер 14), фосфор (атомный номер 15) и серу (атомный номер 16). Под занавес своего существования светило производит металлы, такие как железо (атомный номер 26).
По мнению Джонсон, это поразительно и прозаично одновременно, “как человеческая жизнь”.
Затем наступает то, что астрономы зловеще называют “железной катастрофой”. Термоядерная реакция не позволяет соединять элементы тяжелее железа, поэтому звезда внезапно выдыхается. Менее чем за секунду она коллапсирует, а затем взрывается как сверхновая, извергая “новоиспеченные” элементы в космос.
Сверхновые могут испускать космические лучи, которые разделяют более крупные атомы, способствуя образованию лития (атомный номер 3), бериллия (атомный номер 4) и бора (атомный номер 5). Данный процесс является основным источником этих элементов во вселенной.
Самый тяжелый металлТо, что элементы вплоть до железа выкованы в звездах, было известно довольно давно. Сложнее было определить происхождение остальных. Ответ начал обретать форму в 1957 году, когда на свет вышла знаменательная статья, написанная супругами-астрономами Джеффри и Маргарет Бербидж, а также Уильямом Фаулером и Фредом Хойлом. Труд, начинавшийся с размышлений Шекспира о звездах, стал настолько известным, что и по сей день ученые называют ее просто B2FH по инициалам авторов.
Тяжелые элементы образуются, когда исходный атом, например углерод или железо, бомбардируется нейтронами и захватывает их в свое ядро. “Он поглощает их все, – говорит Анна Фребель, астроном из Массачусетского технологического института. – И возникает вопрос: нравится ему это или нет? Обычно нет”. Таким образом, атом проходит радиоактивный распад и в итоге появляется более тяжелый и более стабильный элемент.
Самые тяжелые элементы, такие как уран и плутоний образуются из-за слияния нейтронных звезд, вес которых может быть вдвое больше Солнца при диаметре всего в 20 км
В B2FH изложена физика того, как этот процесс может происходить быстро или медленно.
Хаос сверхновой был одним из очевидных кандидатов на быструю версию, но в последние годы ученые начали подвергать эту идею сомнению. “Вероятно, даже при мощном взрыве сверхновой недостаточно энергии, чтобы создать все эти элементы”, – считает Фребель.
3 года назад она опубликовала результаты исследования маленькой галактики, содержащей множество золота и других тяжелых элементов. Если бы все они появились на свет, благодаря сверхновым, то их бы потребовалось так много, что “галактику разнесло бы на части”.
Теперь исследователи предпочитают делать ставку на другое явление: слияние нейтронных звезд. Нейтронные звезды – это ультраплотные сферы, остающиеся после смерти массивных звезд. Они могут иметь диаметр всего в 20 км и вес в 2,5 раза больше, чем у Солнца. Иногда две из них сцепляются в смертельном танго, вращаясь по спирали навстречу друг другу, пока не столкнутся. При этом испускается дождь нейтронов, достаточно интенсивный, чтобы создать самые тяжелые элементы во вселенной, такие как уран (атомный номер 92) и плутоний (атомный номер 94).
Данная идея обрела плотный фундамент в 2017 году, когда обсерватория LIGO впервые обнаружила столкновение нейтронных звезд. Исследователи изучили свет от взрыва и обнаружили контрольные следы тяжелых элементов, в том числе золота.
Ученым предстоит еще многое узнать о роли сверхновых и слияния нейтронных звезд, но, по словам Фребель, человечество становится все ближе к пониманию источника формирования каждого элемента.
Медленно, но верноПервые слияния нейтронных звезд произошли после того, как умерло первое поколение светил и по космосу разлетелись всевозможные новые атомы. Однако состав вселенной не переставал меняться. В течение следующего миллиарда лет новые космические процессы вели к увеличению количества определенных элементов, поскольку начали формироваться более мелкие звезды.
Они недостаточно велики, чтобы производить что-то более тяжелое, чем углерод и кислород, или взрываться как массивные сверхновые. Вместо этого, когда термоядерная реакция в их ядрах прекращается, они угасают в белых карликов, способных сталкиваться, тем самым запуская безудержный термоядерный синтез, превращающий почти все в звезде в железо.
До этого, в процессе длительного умирания, некоторые маломассивные светила также могут производить тяжелые элементы. Нейтроны, оставшиеся со времен создания гелия, проникают в ядра других элементов со скоростью примерно один раз в несколько недель или месяцев, постепенно создавая более тяжелые атомы. Для превращения атома железа в редкоземельный элемент, например в лантан (атомный номер 57) или лютеций (атомный номер 71), требуется более 100 захваченных нейтронов.
Зато подобных звезд много, и существуют они долго, так что производят примерно половину элементов тяжелее железа. Астроном Пол Меррилл нашел доказательства данного процесса в 1951 году. Работая в обсерватории Маунт-Уилсон неподалеку от Лос-Анджелеса, он обнаружил радиоактивный элемент технеций (атомный номер 43) в угасающей древней звезде.
Ученые знали, что технеций нестабилен и быстро распадается. Это означало, что он не мог изначально существовать в звезде, которой уже миллиарды лет, понял Меррилл. Элемент мог оказаться там только в том случае, если был создан внутри светила.
Остывающее горнилоСегодня, спустя 13,8 млрд лет после Большого взрыва, звезды преобразовали около 2% водорода и гелия во вселенной в другие элементы. Теперь они существуют в разных количествах, в зависимости от частоты и производительности процессов, в результате которых они появляются. Например, платина (атомный номер 78) встречается в миллион раз реже железа, потому что слияния нейтронных звезд происходят не очень часто (это одна из причин того, почему драгоценные металлы драгоценны).
Состав вселенной перестанет меняться примерно через 10 триллионов лет, когда прекратится образование звезд
Присутствие таких элементов, как углерод и кислород, помогло охладить различные уголки галактики, чтобы могли образоваться меньшие звезды, такие как Солнце. А появление металлов позволило планетным системам сформироваться из дисков газа и пыли, кружившихся вокруг этих новых светил.
По мере старения вселенной более тяжелых элементов в ней будет становиться все больше, и примерно через 10 трлн лет, когда образование звезд прекратится, ее состав перестанет меняться.
Ведутся споры о том, сколько водорода останется на этом этапе. Джонсон считает, что значительное количество сохранится в межгалактической среде, в то время как Фребель подозревает, что большая его часть будет преобразована. Однако в определенном смысле он продолжит существовать, отмечает она, поскольку все элементы построены на базе атомов водорода, образовавшихся в первые минуты после Большого взрыва. С тех пор они путешествуют по космосу, трансформируясь в тот или иной элемент.
Некоторые оказались здесь, на Земле. Покойный астроном Карл Саган говорил, что “мы сделаны из звездного материала”. Но Фредель добавляет: “Мы также сделаны из материала Большого взрыва”.
По материалам Los Angeles Times
В Москве состоялось открытие Года Периодической таблицы химических элементов
6 февраля в здании президиума Российской академии наук (РАН) состоялось торжественное открытие Международного Года Периодической таблицы химических элементов Дмитрия Ивановича Менделеева. Инициативу России в проведении Года таблицы Менделеева поддержали зарубежные страны, международные научные организации, а также более 80 национальных академий наук и научных обществ.
Текущий 2019 год провозглашен Международным годом Периодической таблицы химических элементов в честь 150-летия открытия великим российским ученым Дмитрием Ивановичем Менделеевым Периодического закона химических элементов. Идея была предложена Российской академией наук, Российским химическим обществом имени Д.И.Менделеева, Министерством науки и высшего образования РФ, российскими и зарубежными учёными.
Инициативу быстро поддержали в Правительстве РФ, и 29 декабря 2018 года Председатель Правительства Российской Федерации Дмитрий Медведев подписал распоряжение “О проведении в 2019 году Международного года Периодической таблицы химических элементов”. Идея также была поддержана и другими странами мира — так было принято решение весь 2019 год чествовать заслуги Менделеева во всем мире. Открытие года состоялось 29 января в Париже; в России торжественное открытие прошло 6 февраля в стенах главного здания Российской академии наук (РАН).
В преддверии торжественного открытия организационный комитет по подготовке и проведению в текущем году Международного года Периодической таблицы химических элементов собрался на последнее перед открытием заседание. Члены оргкомитета — Председатель Правительства Российской Федерации Дмитрий Медведев, министр науки и высшего образования РФ Михаил Котюков, министр просвещения РФ Ольга Васильева, ректор Московского государственного университета Виктор Садовничий, президент Российской академии наук Александр Сергеев и другие — обсудили актуальные проблемы развития науки сегодня.
Заседание оргкомитета открылось вступительным словом Председателя Правительства Российской Федерации Дмитрия Медведева. В начале своего выступления он обозначил серьезную проблему — сегодня государство до сих пор остается главным источником финансирования науки: “Наша экономика пока еще не воспринимает науку как помощника в развитии, поэтому цепочка от перспективной идеи до ее реального внедрения в России как правило слишком длинная”, — отметил Дмитрий Медведев.
По мнению Председателя Правительства РФ, новые технологии и инновации для экономики и бизнеса — это возможность успешно конкурировать на мировом и внутреннем рынках. “Государство должно не только вкладываться в науку, но так же, как бизнес, давать учёным запрос на открытия, ставить перед ними задачи такого масштаба, которого они достойны”. Дмитрий Медведев уверен, что если этого не делать, то наша страна будет проигрывать в мировой конкуренции за идеи и технологические решения.
Дмитрий Медведев также отметил, что поддержка талантливых учёных, развитие перспективных отраслей науки – это действительно приоритет для государства. По его мнению, эти слова должны быть не лозунгом, а реальностью. “Россия должна войти в топ-5 – ведущую пятёрку стран мира, которые ведут исследования в ключевых сферах научно-технологического развития. Цель сложная, но в общем достижимая”, — отметил Председатель Правительства РФ.
Облегчить путь к достижению этих целей призван национальный проект “Наука”, о котором на заседании оргкомитета подробно говорил министр науки и высшего образования Михаил Котюков. Он отметил, что в последние годы благодаря пристальному вниманию государства к развитию исследований и разработок в нашей стране уже подготовлена достаточно серьёзная база и наблюдается положительная динамика по ключевым направлениям. “Могу отметить, что Россия по итогам 2017 года уже входит в пятёрку стран-лидеров по таким направлениям, как органическая химия, общая математика, и ряду общественно-гуманитарных направлений”. Кроме того, по словам Котюкова, Россия уже находится в десятке стран-лидеров по количеству научных публикаций в серьезных международных изданиях.
На заседании оргкомитета выступил и президент Российской академии наук Александр Сергеев. В своей речи он отметил большую важность утверждения имени Менделеева за Периодической таблицей химических элементов во всем мире. По каким-то причинам не все хотят называть ее “таблицей Менделеева”. Добиться признания заслуг Мендлеева во всем мире и утвердить его имя за таблицей — одна из главных задач на этот год: “Мы в Академии наук считаем, что есть три основные цели, которые наша страна должна была поставить и решить в этом году: первая – чтобы всё-таки таблицу все стали называть именем Менделеева; вторая – чтобы мы получили наконец Нобелевскую премию в этом году; и третья – чтобы мы выиграли олимпиаду по химии летом в Париже. То есть таблица, Нобелевская премия, олимпиада”, — отметил Сергеев.
Открытие Года Периодической системы химических элементов Дмитрия Ивановича Менделеева продолжилось в Большом зале РАН. “Хедлайнерами” открытия стали президент РАН Александр Сергеев и вице-президент Лондонского королевского общества сэр Мартин Полякофф — они прочитали две обширные лекции о Периодической системе Мендлеева. Александр Сергеев рассказал гостям церемонии об истории открытия и создания Периодической системы — от античности до Мендлеева.
Мало кто знает, но Дмитрий Менделеев был далеко не первым человеком, который пытался упорядочить известные химические элементы. Первую попытку предпринял немецкий химик Иоганн Дёберейнер, создавший “Триады Дёберейнера” и объединивший таким образом сходные по свойствам элементы в три группы. Затем французский химик Александр де Шанкуртуа создал “Земную спираль”, английский ученый Джон Ньюлендс — “Октавы Ньюлендса”, немецкий ученый Юлиус Мейер — “Таблицу Мейера”. Однако привести хаос из химических элементов в порядок удалось только российскому химику, именем которого и названа Периодическая таблица, которая висит сегодня во всех химических классах мира.
За 150 лет с момента открытия Мендлеевым Периодического закона таблица химических элементов значительно расширилась. Российская наука внесла неоценимый вклад в открытие новых элементов и “заполнение” таблицы Мендлеева. Рутений, самарий, дубний, флеровий, московий и оганессон — элементы, открытые и синтезированные российскими учеными. Последний из них — оганессон — назван в честь своего первооткрывателя, академика Юрия Цолаковича Оганесяна. Юрий Цолакович — единственный живущий на нашей планете человек, в честь которого назван химический элемент.
Сэр Мартин Полякофф уже не первый год называет Юрия Оганесяна “супергероем”. На церемонии присвоения названий новым химическим элементам, проходившей в Москве в 2017 году, он даже подарил ему супергеройский костюм с вышитыми на нем таблицами Мендлеева. Последних у английского химика хранится бесчисленное множество, в разных видах и формах — таблицы Менделеева на галстуках, на рисунках, в виде кубиков, в каждом из которых находится химический элемент таблицы, и даже на волоске самого сэра Мартина тоже есть таблица Мендлеева. Это самая маленькая таблица во всем мире, которая даже вошла в книгу рекордов Гиннеса.
Все эти таблицы сэр Мартин Полякофф показывал на своей лекции. Он не переставал убеждать участников церемонии открытия в важности и особой значимости таблицы Мендлеева для каждого человека на нашей планете. Человек с давних времен стремился упорядочить окружающий его хаос, но получилось это только у одного — у российского химика Дмитрия Ивановича Мендлеева.
Дарья Субботина
Фото: Николай Малахин, Кирилл Малов
Выступление Дмитрия Медведева на открытии Международного года Периодической таблицы химических элементов в России
Видео
Периодическая система Менделеева • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Господин Менделеев не знал, а его последователи узнали, но начисто позабыли или антинаучно проигнорировали то, что атомы есть комплементарные пары из взаимно дополнительных вложенных друг в друга фундаментальных сущностей вещества: ядер атомов как внутренней сущности и электронных облаков как внешней сущности. Иначе говоря, атомы есть фракталы вложенностей – матрёшки.Отсюда следует, что на самом деле натуральный ряд элементов представляет собой не один ряд элементов, а два комплементарных ряда фундаментальных сущностей вещества – ядер атомов и электронных облаков!
Следующий грубейший научный промах Менделеева и его последователей: начало каждого периода щелочным металлом и окончание благородным газом. Ведь в первом периоде Периодической системы элементов в редакции Менделеева до 1902 года первым являлся не щелочной металл, а неметалл химически активный двух атомный газ водород, имеющий крайне низкую температуру кипения! В то время, как во всех последующих периодах первым был элемент группы щёлочноземельных металлов. Прокол в Периодической таблице элементов жутчайший! А в периодической таблице элементов в редакции Менделеева от 1902 и 1906 годов первым элементом в периодах являлся элемент группы благородных газов.
Правильные, естественные окончания абсолютно каждого периода атомного мира материи является не благородный газ, а щёлочноземельный металл – по Мейеру Ю.Л. (приоритет от 1862 года на правильное окончание периодов на элементе группы щёлочноземельных металлов), Менделееву Д.И. (приоритет от 1869 и 1870 годов на правильное предсказание свойств нескольких не известных тогда элементов и исправление атомных масс нескольких известных элементов, а также на формулировку формулы периодического явления, ошибочно названного и до сих пор ошибочно считающегося периодическим законом, и приоритет от 1902 года на гипотезу о двух элементах материального эфира – ньютония и корония, предшествующих водороду), Веберу А. (приоритет от 1905 года на идею отображать каждый из всех периодов одним рядом), Жанету Ч. (приоритет от 1928 года на отображение каждого из всех правильных периодов одним рядом), Резерфорду Э. (приоритет от 1911 года на правильное объяснение устройства атомов из компактного электростатически положительно заряженного ядра и обширного электростатически отрицательного заряженного электронного облака), Мозли Г. (приоритет от 1913 года на экспериментальное, по рентгеновскому спектру, доказательство того, что номер элемента равен количеству протонов я ядре атома или количеству электронов в электронном облаке не ионизированного атома), Бору Н. (приоритет от 1913 года на идею о стационарных орбитах не возбуждённых электронов в оболочках слоёв электронного облака атома), и Макееву А.К. (приоритет от 2000, 2010, 2013 годы на пакет свыше 20 настоящих периодических законов и фундаментальных научных положений, описывающих строение и порядок формирования электронного облака атома по мере роста электростатического заряда ядер атомов; на расширение периодической системы элементов перед водородом на 10 элементов вакуумных уровней материи; создание модели строения материи вакуума и фотона, теоретического доказательства того, что кванты электростатического и магнитного полей в составе материи фотона в их векторах движения имеют скорость в корень квадратный из двух раз быстрее движения всей системы материи фотона в его векторе движения)!
Тогда мировой науке официально следует принять то что первый правильный (естественный) период атомных уровней материи содержит 4 элемента, которые радикально отличаются друг от друга по физическим и химическим свойствам: водород (химический активный двух атомный газ), гелий (химически инертный одно атомный газ), литий (химически активный щелочной металл) и бериллий (химически активный щёлочноземельный металл-металлоид). Поэтому последние 4 элемента каждого последующего правильного (естественного) периода позиционно аналогичны неметаллу химически активному подобному галогенам двухатомному газу водороду, неметаллу химически инертному одноатомному газу гелию, химически активному щелочному металлу литию и химически активному щёлочноземельному металлу бериллию!
В Матрице автоматизма материи – периодической таблице элементов вакуумных и атомных уровней материи Мейера, Жанета и Макеева проявляется очень важный запрет-закон Макеева, не замеченный Паули – запрет каждому слою электронного облака атома заполнять больше чем одну его оболочку в пределах каждого такого естественного периода, в котором этот слой заполняется электронами.
Смотрите подробности здесь:
1. Makeyev A.K. Julius Lothar Meyer was first which built the periodic table of elements // Eropean applied sciences, April, 2013, 4 (2) – pp. 49-61. ISSN 2195-2183
2. Макеев А.К. Система естественных циклов автоматизмов материи. Материалы 1-ой международной научно-практической конференции “Перспективы развития естествознания в 21 веке” // Апробация. Ежемесячный научно-практический журнал, № 2, 2012. 110 с., С. 88-100. ISSN 2305-4484
3. Макеев А.К. Частицы электростатического и магнитного полей в системе материи фотона движутся намного быстрее, чем движется сам фотон. // Научная дискуссия: материалы IV международной заочной научно-практической конференции. Часть I. (20 августа 2012) – Москва: Изд. “Международный центр науки и образования”, 2012. 142 с., С. 47-65. ISBN 978-5-905945-37-3 УДК 08. ББК 94. Н 34. http://www.internauka.org/node/479
4. Макеев А.К. Матрица автоматизмов материи и матрица элементарных артикуляций в каркасе голограммы всезнания // Научно-техническая библиотека. 27 марта 2013. 84 с. http://www.sciteclibrary.ru/rus/catalog/pages/12751.html
Кстати, авторитет и приоритет России, как родины фундаментальной азбучной истины физикохимии – Естественной системы элементов нисколько не пострадал! Ведь автором этой “периодической таблицы” элементов в правильных границах всех периодов и пакета из более чем двадцати настоящих периодических законов и фундаментальных научных положений является гражданин России, москвич Макеев Александр Константинович, врач и мультидисциплинарный исследователь и изобретатель, с приоритетом от 2000 года! В соавторстве с немецким врачом, физиком и химиком Мейером Юлиусом Лотаром, с приоритетом от 1862 года. И в соавторстве с французским инденером и учёным, предпринимателем Жанетом Чарльзом, с приоритетом от 1928 года.
Менделеева по справедливости не наградили Нобелевской Премией в 1906 году. Ведь его Периодическая таблица химических элементов грубо не верна в окончаниях всех периодов! Он даже не смог сформулировать ни одного настоящего периодического закона!
Теперь Комитет по присуждению Премии им. Альфреда Нобеля может с чистой душой, не опасаясь проявления со временем подвоха, присудить свою высокую Премию настоящему создателю Естественной системы элементов и открывателю целого пакета настоящих периодических законов россиянину Макееву Александру Константиновичу! Ау, нынешние Нобелевские Лауреаты, имеющие на то право, замолвите словечко в Нобелевский Комитет, пожалуйста!
Выставка «Умеющий видеть сквозь время» — Озерский технологический институт
В библиотеке института оформлена выставка
«Умеющий видеть сквозь время»
Материалы к юбилею Дмитрия Ивановича Менделеева
(185 со дня рождения ученого)
На стенде представлена литература о Д.И. Менделееве
Книги
1. Вишневский Л.Д. Под знаком углерода. Элементы IV группы период. системы Д.И. Менделеева / Л.Д. Вишневский. — М.: Просвещение, 1974. -192 с.: ил.
2. Годовиков А.А. Периодическая система элементов Д.И. Менделеева и силовые характеристики элементов: АН СССР. Сибирское отделение. Труды института геологии и геофизики. Вып. 480/ А.А. Годовиков. — Новосибирск: Наука, 1981. -95 с.
3. Кедров Б.М. Прогнозы Д.И. Менделеева в атомистике. Атомные веса и первичность/ Б.М. Кедров. – М.: Атомиздат, 1978. — 200 с.
4. Кедров Б.М. Прогнозы Д.И. Менделеева в атомистике. За гранью системы элементов/ Б.М. Кедров. — М.: Атомиздат, 1979. -184 с.
5. Козлов В.В. Всесоюзное Химическое общество им. Д.И. Менделеева 1868-1968/ В.В. Козлов; Под ред. акад. С.И. Вольфковича. — М.: Наука, 1971. -563 с.
6. Кудрявцев П.С. История физики. От античной физики до Менделеева Т1./ П.С. Кудрявцев; Под ред. А.К. Тимирязева. — М.: Госпедиздат, 1948. -535 с. Экземпляры: всего:6 — (6)
7. Курбатов В. Менделеев Д.И./ В. Курбатов. — М; Л: Детгиз, 1950. — 93 с.
8. Д.И. Менделеев и физико-химические науки./ А.А. Макареня; А.А. Макареня. — М.: Атомиздат, 1972. -256 с.
9. Д.И. Менделеев о радиоактивности и сложности элементов/ Макареня А.А.. -3-е изд., перераб. и доп. – М.: Атомиздат, 1975. -112 с.
10. Менделеев Д.И. 150 лет со дня рождения 1834 — 1984/ Отв. ред. А.Ю. Цивадзе. — М.: Наука, 1986. -248 с.
11. Менделеев Д.И. В воспоминаниях современников. -М.: Атомиздат, 1973. -272 с.
12. Менделеев Д.И. — великий русский химик: Сборник статей/ Под ред. А.Ф. Капустинского. – М.: Советская наука, 1949. -152 с.
13. Менделеев Д.И. В воспоминаниях современников/ Сост. А.А. Макареня, И.Н. Филимонова. – М.: Атомиздат, 1969. -224 с.
14. Миттова И.Я. История химии с древнейших времен до конца ХХ века. В 2-х томах : учебное пособие для вузов, Том 2-ой/ Миттова И.Я., Самойлов А.М. -Долгопрудный: Интеллект, 2012. –С.132-180: цв.ил.
15. Попова Л.Ф. От лития до цезия. Элементы 1-ой группы периодической таблицы Д.И. Менделеева: Пособие для учащихся/ Л.Ф. Попова. — М.: Просвещение, 1972. — 128 с.
16. Семенькова Н.И. Изучение периодического закона Д.И. Менделеева в школе: Книга для учителя. Из опыта работы/ Н.И. Семенькова. – М.: Просвещение, 1992. -96 с.
17. Семишин В.И. Литература по периодическому закону Д.И. Менделеева. Часть 2.: Справочник в двух частях/ В.И. Семишин, З.Ф. Семишина. — М.: Высшая школа, 1975. -96 с.
18. Семишин В.И. Периодическая система химических элементов Д.И. Менделеева / В.И. Семишин. — Л.: Химия, 1972. -188 с.
19. Соколовская З. К. 400 биографий ученых. «Научно-биографическая литература»: Библиографический справочник/ З. К. Соколовская; Под ред. А. Л. Яншина. — М: Наука, 1988. – С.190-191.
20. Фигуровский Н.А. Дмитрий Иванович Менделеев.1834 -1907/ Фигуровский Н.А.. -М: АН СССР, 1961. -316 с.
21. Фигуровский Н.А. Очерк общей истории химии : От древнейших времен до начала Х1Хвека/ Фигуровский Н.А.. -М: Наука, 1969. -456 с. Фигуровский Н.А. Открытие химических элементов и происхождение их названий/ Фигуровский Н.А.. -Москва: Наука, 1970. -208 с.
22. Фигуровский Н.А. Очерк общей истории химии. Развитие классической химии в 19 столетии./ Н.А. Фигуровский. — Москва: Наука, 1979. -678 с.
Статьи из периодических изданий
Менделеев Д. И. и Периодический закон
1. Байкина Л.В. Наш подход к изучению темы «Открытие периодического закона»: К 140-летию открытия периодического закона/ Л.В. Байкина // Химия в школе. — 2008. — №10. — с.36-40
2. Главный закон химии : Менделеев Д.И. // Рассказы о русском первенстве. -М : Молодая гвардия. — 1950. — с.60-65
3. Курганский С.М. Мир элементов пятой группы: к 140-летию открытия периодического закона/ С.М. Курганский // Химия в школе. — 2008. — №6. — с.66-72
4. Фигуровский Н.А. Периодический закон Менделеева Д.И./ Н.А. Фигуровский // История химии. – М. : Просвещение. — 1979. — с.151-159.
Менделеев Д.И.
5. Величайший ученый России Д.И. Менделеев // Народное образование. — 2003. — №1. — Ст. Гл.10. — с135-139.
6. Менделеев Д.И. (1834-1907) // Большая Советская энциклопедия. Т.16. -М : Советская энциклопедия. — 1974. — с.67-69.
7. Менделеев Д.И. (1834-1907) // Люди русской науки. Очерки о выдающихся деятелях естествознания и техники. – М.: Гос. изд-во физико-математ. литературы. — 1961. — с.456- 471.
8. Менделеев Д.И. // Биографический словарь деятелей естествоиспытания и техники. Т2 .М-Я. – М.: Большая советская энциклопедия. — 1959. — с.25-28
9. Репин Л.Б. Дмитрий Менделеев (1834-1907)- умеющий видеть сквозь время : Новеллы об ученых/ Л.Б.Репин // Люди и формулы. – М.: Молодая гвардия. — 1972. — с.123-140.
10. Соколовская З.К. Менделеев Д.И./ З.К. Соколовская // 400 биографий ученых. Биобиблиографический справочник. – М.: Наука. — 1988. — с.190-191.
Статьи к 175 летию со дня рождения ученого
11. Беляк Е.Л. Заповедная земля Менделеева: к 175-летию со дня рождения/ Е.Л. Беляк // Химия в школе. — 2009. — №1. — с.73-76
12. Васильева Т.К. Познавательная игра «И ты можешь стать ученым»/ Т.К. Васильева // Химия в школе. — 2007. — №1. — с.66-76
13. Виргинский В.С. Химическая технология. Химия: Менделеев Д.И./ В.С. Виргинский // Очерки истории науки и техники,1870-1917. –М.: Просвещение. — 1988. — Ст. именной указатель. — с. 300.
14. Интеллектуальная игра «Великий русский химик»: К 175-летию со дня рождения Д. И. Менделеева // Химия в школе. — 2009. — №1. — с.60-71
15. Крюкова Н.С. Друзья и соратники Д. И. Менделеева: Из истории химии/ Н.С. Крюкова // Химия в школе. — 2008. — №8. — с.77-79
16. Крюкова Н.С. Малая Родина великого учёного: Из истории химии. К 175-летию со дня рождения Менделеева Д.И./ Н.С. Крюкова // Химия в школе. — 2008. — №9. — с.70-73
17. Крюкова Н.С. Роль Менделеева в развитии нефтяной промышленности России/ Н.С. Крюкова // Химия в школе. — 2009. — №1. — с.77-80.
18. Курганский С.М. Вопросы викторины о жизни и деятельности Д.И. Менделеева/ С.М. Курганский // Химия в школе. — 2007. — №2. — с.75-80.
19. Макареня А.А. Менделеев и Достоевский: встречи, дискуссии, переписка : Из истории химии/ А.А. Макареня // Химия в школе. — 2008. — №6. — с.77-80.
20. Махова Л.В. Д.И. Менделеев: мысли, раздумья, чувства : Из истории химии/ Л.В. Махова // Химия в школе. — 2008. — №10. — с.67-76.
21. Подольный И.А. Моя менделеевская коллекция: Из истории химии/ И.А. Подольный // Химия в школе. — 2006. — №1. — с.77-80
22. Хачатрян И.Н. К юбилею Д.И. Менделеева: Стих/ И.Н. Хачатрян // Химия в школе. — 2009. — №1. – с обл.
23. Чугаев Л.А. Дмитрий Иванович Менделеев. Биография русского гения : к 175-летию со дня рождения/ Л.А. Чугаев // Экология и жизнь. — 2009. — №1.-с.12-19.
Материалы к 2019 Международному году
Периодической таблицы Д. И. Менделеева
(150 лет с опубликования первой схемы Периодической таблицы)
20 декабря 2017 года Генеральная ассамблея ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов. Ранее эта инициатива была выдвинута Российской Федерацией в рамках ЮНЕСКО и была одобрена.
Периодическая таблица химических элементов — это не просто руководство или каталог всех известных атомов во Вселенной; это, по сути, окно во Вселенную, помогающее расширить понимание окружающего мира. В следующем году исполняется 150 лет со дня создания этой таблицы российским ученым Дмитрием Ивановичем Менделеевым.
«Периодическая таблица химических элементов — одно из наиболее важных научных достижений, отражающее суть не только химии, но также физики, биологии и других дисциплин. Она представляет собой уникальный инструмент, дающий ученым возможность предсказывать появление и свойства элементов на Земле и во Вселенной в целом», — заявил Жан-Пол Нгоме-Абиага, программный специалист, координатор мероприятий в рамках празднования Года в ЮНЕСКО. «Эта инициатива, наряду с мероприятиями по всему миру, подчеркнет важность Периодической таблицы для науки, технологий и устойчивого развития человечества».
Празднование в 2019 году Международного года периодической таблицы химических элементов воздаст должное недавно совершенным передовым открытиям, а именно открытию в результате тесного международного научного сотрудничества четырех сверхтяжелых элементов периодической таблицы Менделеева с атомными номерами 113 (нихоний), 115 (московий), 117 (теннесин) и 118 (оганессон) и присвоению им названий.
Международный год периодической таблицы химических элементов станет продолжением тематики Международного года химии (2011 г.) и Международного года кристаллографии (2014 г.). Проведение этого года также даст ЮНЕСКО возможность активно содействовать популяризации фундаментальных наук в интересах устойчивого развития, в том числе благодаря Международной программе ЮНЕСКО по фундаментальным наукам (МПФН).
«Я надеюсь, что запланированные на 2019 год праздничные мероприятия помогут продемонстрировать важную роль фундаментальных наук в решении глобальных проблем. Данные мероприятия проиллюстрируют прогресс, порожденный научными открытиями, и побудят следующие поколения расширять границы человеческого познания, как это сделал Дмитрий Менделеев в XIX веке», — отметил Жан-Пол Нгоме-Абиага.
Международный год периодической таблицы химических элементов позволит наладить долгосрочное партнерство на международном уровне благодаря учреждению руководящего комитета, в состав которого, войдут, в частности, Международный союз теоретической и прикладной химии, научные общества, профильные организации, а также сети партнеров ЮНЕСКО. Цель создания такого комитета – содействовать мероприятиям в областях естественнонаучного образования, информационно-разъяснительной деятельности, выставочной работы и развития потенциала, проводимым сетью партнеров в поддержку празднования в 2019 г. Международного года периодической таблицы.
В сентябре 2019 года в Санкт-Петербурге Российское химическое общество им. Д.И. Менделеева проведет XXI Менделеевский съезд по общей и прикладной химии, посвященный Международному году Периодической таблицы химических элементов.
Выставка в библиотеке института. Октябрь 2018
Материал подготовила библиотекарь А.И. Сеченова
ГРУППА SO(4,2) И СИММЕТРИЙНЫЕ СВОЙСТВА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА | Гурский
1. Гурский А.Л., Гурский Л.И. // Докл. БГУИР. 2015. № 8 (94). С. 38-43.
2. Гурский Л.И., Комаров Л.И. // Докл. АН Беларуси. 1997. Т. 41, № 4. С. 49-52.
3. Гурский Л.И., Комаров Л.И., Солодухин А.М. // Изв. НАН Беларуси. Сер. физ.-мат.наук. № 2. 1998. С. 58-65.
4. Gurskii L.I., Komarov L.I., Solodukhin A.M. // International Jornal of Quantum Chemistry. 1999. Vol. 72. P. 499-508.
5. Гурский Л.И. // Вестн. Фонда фундаментальных исследований. 2004. № 3 (29). С. 61-79.
6. Полинг Л., Полинг П. Химия. М.,1978.
7. Ландау Л.Д., Лифшиц Е.М. Квантовая механика. Нерелятивистская теория. М., 1989.
8. Паули В. Волновая механика. М., 1947.
9. Румер Ю.Б., Фет А.И. // Теоретическая и математическая физика. 1971. Т. 9, № 2. С. 203-210.
10. Конопельченко Б.Г. Группа SO(4,2) + R и таблица Менделеева. Новосибирск, 1972.
11. Novaro O.A., Barrondo M. // Jornal Phys., B. 1972. Vol. 5, № 6. P. 1104-1110.
12. Фет А.И. Математическое моделирование в биологии и химии: новые подходы. Новосибирск, 1992. С. 118-203.
13. Zhuvikin G.V., Hefferlin R. Symmetry principles for periodic systems of molecules. JR-PHYS-SC/SPBU 1. Joint Report #1 of the Physics Departaments Southern College, Collegedate, USA, St.Petersburg University, St. Petersburg, Russia, 1994.
14. Фет А.И. Группа симметрии химических элементов. Новосибирск, 2010.
15. Маделунг Э. Математический аппарат физики. М., 1960.
16. Клечковский В.М. Распределение атомных электронов и правило последовательного заполнения (n+l)-групп. М., 1968.
17. Kregar M. // Physica Scripta. 1984. Vol. 29. P. 438-437.
18. Kregar M. // Physica Scripta. 1985. Vol. 29. P. 246-254.
Периодическая таблица элементов обращается 150 | WUWM 89,7 FM
Может быть, вы почувствовали определенную химию с 2019 годом, но не знаете, почему? Может быть, потому, что в этом году исполняется 150 лет Периодической таблице элементов. Он считается основополагающим документом современной химии, который вы, возможно, изучали в школе.
Профессор химии UW-Madison Бассам Шахашири знает как историю стола, так и его современную актуальность.Он говорит, что таблица появилась в результате сотрудничества нескольких ученых, но большую заслугу заслуживает Дмитрий Менделеев.
«Димитрий Менделеев, русский химик, он предложил – иногда люди говорят, что он обнаружил – образец аналогичного поведения [определенных элементов] и систематизировал их», – объясняет Шахашири.
Что касается современной актуальности и того, как меняется использование элементов, Шахашири цитирует литий (символ Li) в таблице: «Литиевые батареи очень полезны для нас. Литий также используется в медицине для различных целей.«
Шахашири также отмечает, что образ свинца (символ Pb) менее популярен, чем во времена Менделеева. В настоящее время свинец часто рассматривается как загрязнитель почвы и воды. разговор здесь:
Бассам Шахашири: Менделеев, русский химик, читал курс, писал конспекты лекций и пытался написать книгу по неорганической химии о химическом поведении веществ.И ему пришло в голову, что, возможно, существует образец повторяющегося сходства в поведении определенных элементов. И вот что он сделал. Он предположил, что иногда люди говорят, что он обнаружил образец подобного поведения и расположил элементы в соответствии с их атомным весом. Позже оказалось, что это не совсем так, но в науке так. Мы изучаем периодическую таблицу как элементы, расположенные в соответствии с атомным номером, который является целым числом, целым числом. Это количество протонов в атоме этого элемента.Таким образом, они варьируются от одного, который представляет собой элемент водород, до элемента 118, который представляет собой общее количество элементов в периодической таблице на сегодняшний день,
Чак Квирмбах: Создал ли он это и другие, которые, безусловно, могут способствовать это, они пытались служить какой-то индустрии, как производители пушек?
Shakhashiri: Все мы люди от природы любопытны. Мы задаем вопросы, всевозможные вопросы. Знаешь, почему небо голубое? Мы проводим наблюдения и пытаемся понять смысл этих наблюдений, и в этом вся суть науки.Речь идет об исследовании поведения, естественного поведения и попытках описать словами, языком и символами, какой может быть образец поведения. Так что это действительно результат любопытства. Это не должно было служить какой-либо другой цели, но любопытство ведет к открытиям, а открытие ведет к применению.
Quirmbach: Какие приложения взлетели?
Шахашири: Сказочные приложения. Когда элементы были расположены в этой таблице в периодической таблице, сразу же было легко увидеть, что есть недостающие элементы, которые еще не были обнаружены, которые не были идентифицированы.Итак, начался поиск, чтобы найти их, идентифицировать и охарактеризовать их. Так что это было очень, очень важным следствием размещения элементов в таком организованном виде, который мы называем периодической таблицей. Позже, когда мы перешли к так называемым тяжелым элементам, к элементам, которые имеют 92 протона и более, например, к урану. Затем, когда люди начали теоретизировать, вносить предложения, ученые говорили, что, может быть, мы сможем синтезировать элементы, из которых мы сможем создать новые элементы, и трансурановые элементы были синтезированы несколькими людьми.Одна группа в Калифорнийском университете в Беркли, возглавляемая ученым Гленном Сиборгом, приступила к созданию новых элементов. И Гленн Сиборг предположил, что, возможно, должно быть больше элементов, о которых мы не знаем, и другие ученые не только в Соединенных Штатах, но и в России и других странах провели серьезные эксперименты, которые привели к идентификации некоторых из этих синтетических элементов. На самом деле они не были обнаружены. Они были созданы, они синтезированы, и, что интересно, некоторые из этих тяжелых элементов не имеют долгого срока службы, они распадаются, выделяют энергию и распадаются.У них очень стабильные, у некоторых время жизни порядка секунд. И это еще одно следствие этих открытий и того, как разработать технологию для обнаружения этих преобразований, так что это очень, очень интригующее и очень полезное занятие. Как вы понимаете, это тоже очень сложно, но именно здесь проявляется награда, награда.
Quirmbach: И напомните мне синтетические элементы, которые тоже есть на столе, не так ли?
Shakhashiri: Они находятся в таблице, элементы последней строки, которые вы видите внизу таблицы.Их делают группы ученых, мужчин и женщин. И это еще один аспект, который я хочу включить в этот разговор. Как названы эти элементы. Первоначально элементы были названы, многие из них, большинство из них, в честь местоположения, региона, где они были изолированы и обнаружены, но с новыми синтетическими элементами эта заслуга принадлежит людям, которые первыми идентифицировали их. А потом идет много проверок. Есть интернациональная группа. Он называется Международный союз чистой и прикладной химии.Эта организация имеет последнее слово по поводу наименования элемента, о котором группа заявляет, что она обнаружила, опять же, я намеренно использую слово обнаружено, здесь они синтезируют. Но кто знает, может быть, во Вселенной есть какие-то из этих элементов, но время их жизни очень короткое. Но затем Международный союз чистой и прикладной химии, после очень тщательного изучения, принимает окончательное решение о названии элементов и, конечно, силе в периодической таблице в соответствии со своим атомным номером.
Quirmbach: Можете ли вы утверждать, что этот стол все еще полезен сегодня не только учителям и классам?
Шахашири: Конечно, это полезно, и иногда учителя в классе используют его не так, как нужно.Это не просто запоминание названий и символов этих элементов. Подумайте о моделях поведения и о том, как химические и физические свойства различных веществ, с которыми мы сталкиваемся, связаны друг с другом. Я знаю, что во многих классах, если люди говорят запомнить, я обычно говорил в классе: запомни названия и символы первых 36 элементов периодической таблицы, первое задание на моих первокурсниках на курсах химии в UW-Мэдисоне, и студенты говорили: хорошо , почему я должен запоминать, и я сказал, потому что, когда вы говорите об элементе калий, вы должны знать, что он представлен символом K, а не символом P, символ P относится к фосфору.Итак, существуют способы, с помощью которых можно поучительно использовать периодическую таблицу как организованное средство химического поведения, чтобы научить студентов осознавать ее красоту. Это то, что я пропагандирую не только в своем собственном обучении, но и на семинарах, которые я провожу с учителями, с другими и с общественностью в целом. Таким образом, периодическая таблица элементов, периодическая таблица элементов могут быть использованы с пользой гораздо, гораздо важнее, чем запоминание имен и символов, но знание того, что они обозначают, является идентичностью элемента.Почему символы калия K? Почему элементы в периодической таблице расположены столбцами? Какая модель поведения? Как это соотносится со структурой электронов вне ядра? Все виды прекрасных проявлений можно распознать и правильно использовать.
Quirmbach: Давайте рассмотрим этот пример немного подробнее о K и калии, он больше связан по вертикали с натрием над ним или с кальцием справа от него? Другими словами, группировки более вертикальны или горизонтальны, или немного того и другого?
Шахашири: Корреляции есть повсюду.Это очень хороший вопрос, Чак. Шаблон, о котором я говорил, – это вертикальный узор. По химическим свойствам соединения лития, натрия, калия, рубидия и цезия очень похожи друг на друга. Есть периодическое повторение. Вот почему она называется периодической таблицей, если есть периодичность в отношениях между калием и кальцием, которая находится рядом с ней на горизонтальной линии. То, что находится на горизонтальной линии, проходит через периодическую таблицу, где количество электронов начинает увеличиваться по мере того, как вы двигаетесь слева направо за таблицей.И вы можете видеть, что из-за того, что атомный номер отличается, атомный номер увеличивается. Таким образом, количество электронов должно возрасти. Итак, прелесть периодической таблицы в том, что элементы, расположенные в столбцах вверх и вниз, обладают схожими свойствами. Но есть и общие черты внутри группы.
Quirmbach: Вы когда-нибудь задумывались о том, как изображения или популярные изображения некоторых из этих элементов изменились с годами. Я думаю, что, например, свинец и фосфор в наши дни часто рассматриваются как загрязнители в воде и других местах.Литий, о котором в детстве я мало что знал, а сейчас мы слышим о большом количестве лития, используемого в батареях. Это хороший способ взглянуть на эту таблицу, в которой элементы менялись, часто использовались и отображались?
Shakhashiri: Ну, наше собственное осознание меняется, и это снова возвращается к тому, что происходит в классе, а также к тому, что происходит при популяризации понимания науки. Итак, литиевые батареи нам очень пригодятся. Литий также используется в медицине для различных целей.Лид на моем сайте saifan.org, у меня есть одностраничное описание свойств лида. Свинец – коварное вещество. Итак, понимание свойств, пользы и опасностей – очень важная часть того, что мы делаем в науке и что мы делаем в обществе. Поэтому очень важно задать вопрос: почему левая нога вообще оказалась в бензине? Именно для улучшения детонации в двигателях была добавлена антидетонационная присадка. Но потом мы обнаружили, что это имеет очень плохие последствия для окружающей среды и здоровья.Таким образом, лозунг был такой: «Уйти вперед и найти других замену». Периодические таблицы можно найти много полезного. И всем нам интересно задавать вопросы, которые вы здесь задаете.
Quirmbach: Ну, почти мой последний вопрос: мы на 118 прямо сейчас. Знаете ли вы, что могут быть добавлены другие люди, пытающиеся синтезировать больше. Все они будут синтетическими или будут добавлены так называемые натуральные?
Shakhashiri: Что ж, это было одно из предсказаний, которые сделали Гленн Сиборг, его группа и другие, не только один человек.что может быть другой набор, другая серия элементов, атомный номер которых очень, очень велик, может быть, вы знаете, вплоть до 137, может быть, даже выше, что было бы стабильно, но не было обнаружено пока и не синтезированы. Это то, о чем мы все должны подумать и дать возможность ученым, которые являются специалистами в этих областях, и оказать им поддержку, обдумывать и разрабатывать эксперименты, методы и технологии для исследования прекрасного сложного мира, в котором мы живем.
Quirmbach: Потому что между 118 и 137 может быть что-то очень ценное, решающее множество проблем, ваша надежда?
Шахашири: Кто знает, именно поэтому мы проводим эксперименты, чтобы удовлетворить свое любопытство, и когда мы сможем делать открытия, я искренне надеюсь и желаю, чтобы мы использовали эти открытия с пользой. Как только вы что-то обнаруживаете, вы должны принять решение о том, как использовать это с пользой, и я надеюсь и искренне желаю, чтобы все научно-технические открытия находили хорошее применение.
Д-р Лоуренс и г-жа Ханна Гудман оказывают поддержку в области отчетности по инновациям.
У вас есть вопрос об инновациях в Висконсине, который вы бы хотели изучить из WUWM Чаком Квирмбахом? Отправьте его ниже.
_
Сера – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: сера
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе вонючие отложения, скунсы и запах ада. Все они начинаются с буквы S, как и элемент этой недели. Вот Стив Майлон.
Стив Майлон
«Как пахло?» Это был единственный вопрос, который мне нужно было задать своему коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о химическом составе, лежащем в основе.Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным только для восстановленной серы.
Может быть, поэтому сера имеет такую плохую репутацию. Мой сын полгода не ел яйца, когда почувствовал запах своего первого тухлого яйца. В Библии кажется, что всякий раз, когда что-то случается или вот-вот должно произойти, горящая сера изображена на картинке:
Например,
В Бытие мы слышим, «Господь пролил дождем горящую серу на Содом и Гоморру»
А в Откровении мы читаем, что грешники найдут свое место в огненном озере из горящей серы.”
Странно то, что в обоих случаях мы не должны ожидать образования чего-либо неприятного запаха. Когда сера горит на воздухе, она обычно образует диоксид серы или триоксид серы, последний из которых не имеет запаха [исправлено из аудиозаписи подкаста файл, в котором говорится, что диоксид серы не имеет запаха]. Эти соединения могут дополнительно окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке Соединенных Штатов, как угли, богатые серой. сгорели для выработки электричества в штатах Среднего Запада и унесены преобладающими ветрами на восток, где проливается серная кислота, вызывая всевозможные экологические проблемы.
Кроме того, горящий уголь и туман создают смог во многих промышленных городах, вызывая респираторные заболевания у местных жителей. Здесь также виноваты диоксид серы и серная кислота. Но опять же, с этой формой серы не связано никакого запаха.
Так что, если говорят, что ад или дьявол «пахнет серой», может быть, это не так уж и плохо.
Но уменьшите серу, отдав ей пару электронов, и ее запах будет безошибочным. Требование восстановления серы до сульфида явно потеряно при переводе.
Ад, пахнущий сероводородом или любым другим количеством сероорганических соединений, совсем не будет хорошим местом. Органические сульфидные соединения, известные как тиолы или меркаптаны, настолько плохо пахнут, что их обычно добавляют в природный газ без запаха в очень небольших количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит, когда пониженная сера придает неприятный (вонючий) привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе.
Итак, откуда берется «запах ада» в бескислородных отложениях. Интересно, что некоторые бактерии эволюционировали, чтобы использовать окисленную серу, сульфат, в качестве акцептора электронов во время дыхания. Подобно тому, как люди превращают элементарный кислород в воду, эти бактерии восстанавливают сульфат до сероводорода – они явно не обращают внимания на запах.
Запах – не единственный интересный химический состав, который сопровождает восстановленную серу.Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов.
Промышленность – это то место, где вы почти наверняка найдете серу или, что более важно, серную кислоту, которая используется в различных процессах, от производства удобрений до нефтепереработки.На самом деле серная кислота считается самым производимым химическим веществом в промышленно развитом мире. Представьте, что элемент с такой адской репутацией стал одним из самых важных. 12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты.
Представьте себе более высокие температуры, сопровождаемые большей биологической активностью, приводящей к большему выбросу DMS в атмосферу. Образовавшееся облако может охладить нагреющуюся планету. Это похоже на то, как планктон раскрывает зонт, частично состоящий из серы. Из символа проклятия в спасителя … что за поворот !!.
Крис Смит
Стив Майлон нюхает вонючую историю о Sulphur. К счастью, элемент на следующей неделе намного менее пахучий.
Джон Эмсли
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем азот, полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием. Ему оставили один процент, который не вступил в реакцию, и он обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент.
Крис Смит
И этот новый элемент был аргоном, прозванным ленивым элементом, потому что первоначально ученые думали, что он ни с чем не вступит в реакцию. Теперь мы знаем, что это неправда, и Джон Эмсли будет здесь, чтобы раскрыть секреты аргона в программе «Химия в ее элементе» на следующей неделе. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
| 7 | 87 223,02 Франций | 88 226,03 Радий | ** | 103 262.11 Лоуренсий | 104 267,12 Резерфордий | 105 270,13 Дубний | 106 269,13 Сиборгий | 107 270.13 Бориум | 108 269,13 Калий | 109 278,16 Мейтнерий | 110 281,17 Дармштадтиум | 111 281.17 Рентгений | 112 285,18 Копернициум | 113 286,18 Нихоний | 114 289,19 Флеровий | 115 289.20 Московий | 116 293,20 Ливерморий | 117 293,21 Теннессин | 118 294,21 Оганессон | ** Актиноиды | ** | 89 227.03 Актиний | 90 232,04 Торий | 91 231,04 Протактиний | 92 238,03 Уран | 93 237,05 Нептуний | 94 244.06 Плутоний | 95 243,06 Америций | 96 247,07 Кюрий | 97 247,07 Беркелиум | 98 251,08 Калифорний | 99 252.08 Эйнштейний | 100 257,10 Фермий | 101 258,10 Менделевий | 102 259,10 Нобелий |
|---|
Как далеко заходит таблица Менделеева?
До декабря 2015 года в периодической таблице были дыры, элементы были синтезированы, но еще не признаны официально.Но когда мы вступаем в Международный год Периодической таблицы, классическая периодическая таблица была заполнена до седьмой строки: в конце 2015 года Международный союз теоретической и прикладной химии официально подтвердил элементы 113, 115, 117 и 118. Новая элементы также получили свои окончательные названия: нихониум, московий, теннессин, оганессон. Усилия по поиску следующих элементов, 119 и 120, продолжаются.
Периодическая таблица элементов – «стойкий символ» химии, химик Эрик Р.Шерри восторгалась. «Он украшает стены лекционных залов и лабораторий всех типов, от университетов до промышленных предприятий», – писал он в American Scientist . «Это одна из самых мощных икон науки. Он отражает суть химии в одном элегантном узоре ». Дмитрий Менделеев впервые опубликовал схему организации всех известных на тот момент элементов в 1869 году, и эта система, хотя и не была совершенной, стала фундаментальной в изучении химии.
Вначале даже Менделеев не осознавал масштабов своего открытия.
Менделеев не был первым, кто предложил систему категоризации элементов, но, как отмечает Скерри, «его версия оказала наибольшее влияние на научное сообщество». В периодической таблице элементы упорядочены по строкам в соответствии с их атомным номером, числом протонов в ядре атома и по столбцам в соответствии с конфигурациями самых удаленных электронов атома. Эта конфигурация обычно определяет «индивидуальность» элемента, а также его размер и форму.Мягкие металлы, такие как литий и калий, которые сильно реагируют с другими, населяют одну колонку, в то время как фтор и йод, неметаллические реактивные элементы, живут в другой.
Менделеев предсказал не только существование неизвестных тогда элементов, но и их свойства. Вначале даже Менделеев не осознавал масштабов своего открытия, пишет историк науки Майкл Гордин. «Если бы Менделеев осознавал значение периодической системы, он, скорее всего, не переложил бы ее презентацию в Российское химическое общество в марте 1869 года на Н.А. Меншуткин, когда он уезжал проверять сыродельные кооперативы ». Но это быстро изменилось: «к 1871 году Менделеев совершенно ясно выразил свою веру в то, что он выделил новый закон химии».
Из 1-го английского издания книги Дмитрия Менделеева «Принципы химии» (1891 г.) через Wikimedia CommonsЭтот закон доводится до предела, поскольку химики синтезируют новые элементы. Уже сейчас, когда атомные номера становятся все выше, химические свойства некоторых из новых элементов не похожи на свойства других элементов той же группы.Это, как пишет Скерри в статье для Scientific American за 2013 год, «может подорвать само логическое обоснование существования таблицы: повторяющиеся закономерности, давшие название таблице Менделеева». Сколько именно элементов еще предстоит открыть? Есть ли конец периодической таблицы Менделеева? Когда мы его достигнем? Что он учит нас о природе элементов?
Создание новых элементов
До тех пор, пока физики не исследовали обломки ядерных реакторов и взрывов, были известны только 92 элемента природного происхождения, вплоть до урана.В радиоактивном материале физики обнаружили новые элементы: нептуний, плутоний, америций, эйнштейний и другие. Однако, помимо элемента 100, фермия, даже водородные бомбы не были достаточно мощными, чтобы производить новые элементы, поэтому ученые изменили свою тактику.
Вместо грубой силы ключом была ловкость. Ученые использовали циклотроны и ускорители, чтобы довести ионы более легких элементов до высокой скорости, а затем выстрелили ими по ядрам элементов с более высокими атомными номерами. Если все шло правильно, ядра атомов в пучке и мишени сливались.Цель: добавить протон и увеличить атомный номер, тем самым создав новый элемент. Соответственно, первый элемент, созданный таким образом, получил название менделевий.
Исследовательские центры в США и России, в основном Национальная лаборатория Лоуренса Беркли и Объединенный институт ядерных исследований в Дубне, развивались в 1950-х, 60-х и 70-х годах. Каждые несколько лет открывался и назывался новый элемент, который в конечном итоге достигал элемента 106 (сиборгий). Центр исследований тяжелых ионов GSI им. Гельмгольца (GSI) в Германии одержал верх, изменив свой подход к «холодному синтезу»: фокусировка низкоэнергетического луча на цель с высоким атомным номером привела к открытию элементов из бория. (107) до копернициума (112).
Создавая новые сверхтяжелые элементы, ученые сражаются против основ природы.
Создание нового элемента – мимолетная радость, и на самом деле это, по-видимому, основная причина для ученых, которые их создают. Как пишет ведущий физик-ядерщик Юрий Оганесян, в честь которого назван элемент 118, в Scientific American пишет: «Бомбардируя тяжелые ядра ионными пучками более легких ядер, ученые создают сверхтяжелые ядра, которые настолько нестабильны, что расщепляются на части, зачастую лишь крошечные. доли секунды после их создания.”
Создавая новые сверхтяжелые элементы, ученые сражаются против основ природы: в элементах с низким атомным весом протоны и нейтроны слипаются, потому что сильное ядерное взаимодействие объединяет их. Но когда все больше и больше протонов упаковывается в ядро, сильная ядерная сила начинает уступать другой силе, кулоновской силе. Эта сила заставляет частицы одного заряда раздвигать друг друга. Большинство сверхтяжелых ядер подвергаются ядерному делению за миллисекунды, расщепляясь на более легкие элементы, или они сначала выплевывают несколько альфа-частиц, состоящих из двух протонов и двух нейтронов, а затем расщепляются.
На берегу острова стабильности
С элементами 113–118 первооткрыватели приближались к дразнящей цели: острову стабильности. Теории предсказывают, что когда определенное «магическое» число протонов и нейтронов упаковано в ядро, ядро становится более стабильным и долгоживущим. Кальций, никель, олово и свинец имеют исключительно стабильные ядра, что, по мнению теоретиков, связано с тем, что эти элементы имеют магическое число протонов и / или нейтронов. Эти «магические числа» соответствуют заполненным ядерным оболочкам, которые могут сделать ядро более стабильным.
Элементы, вокруг которых встречаются магические числа протонов и нейтронов, «остров стабильности», привлекают исследователей сверхтяжелых элементов. Но точное местоположение острова в периодической таблице неизвестно. Некоторые из недавно синтезированных элементов кажутся более стабильными: одна форма элемента 117 со 177 нейтронами задерживается на 112 миллисекунд. Следующим «магическим числом» для нейтронов будет 184, но пока максимум – 177 нейтронов. Ученые могут приближаться к берегу, но они еще не достигли суши.
Периодический закон (по Круксу), опубликованный в 1933 году на Wikimedia Commons. Это потому, что создание даже небольшого количества нового сверхтяжелого элемента – это сверхтяжелая задача. Создание элемента 117 представляло особую проблему. Единственное место, где производится достаточное количество мишени, берклия, – это Окриджская национальная лаборатория в Теннесси, в тысячах миль от Дубны, где группа Оганесяна провела столкновение. Производство беркелия началось за два года до начала эксперимента в Дубне.Потребовалось 250 дней облучения, чтобы произвести достаточное количество берклия, и 90 дней обработки, чтобы очистить его. Затем часы начали тикать. Берклий радиоактивен с периодом полураспада 327 дней. Все 22 миллиграмма должны были быть доставлены в ОИЯИ в течение временного окна, в котором ускоритель и пучок были доступны. Это сработало: за 150 дней бомбардировки драгоценной мишени из берклия кальцием было создано шесть атомов элемента 117.
Работа по созданию элемента 119, следующего сверхтяжелого элемента, началась в декабре 2017 года в лаборатории RIKEN в Вако, Япония.С 2019 года команда Оганесяна в Дубне готовится к охоте на 119 человек. Еще в 2007 году исследователи в Дубне и GSI в Германии начали попытки синтезировать элемент 120. До сих пор не было обнаружено никаких признаков того или иного элемента.
В неизвестность
Попытки заполнить восьмую строку периодической таблицы могут привести к новому пониманию физики атомов. У элементов есть периодическая структура в своих химических свойствах, потому что эти свойства в значительной степени определяются пространством, в котором электроны атома обитают вокруг его ядра, особенно в самой внешней области.Эти области, математически описываемые как «орбитали», бывают дискретного диапазона размеров и форм, а структуры внешних орбиталей изменяются периодическим или повторяющимся образом. Таким образом, атомы с разными атомными номерами могут иметь похожие формы, что приводит к повторяющемуся или «периодическому» рисунку блоков элементов, которые имеют одинаковые внешние орбитальные формы. С элементом 121 электроны займут совершенно новую орбиталь, с которой никогда раньше не сталкивались, – g-орбитали.
Никто толком не знает, где закончится стол.
Насколько крупнее может увеличиться таблица Менделеева, все еще остается открытым вопросом. «Мы знаем, что количество элементов в таблице Менделеева конечно. Необходимо ответить на вопрос: как далеко мы можем зайти? » написали физики Питер Армбрустер и Фриц Петер Хессбергер, соавторы элементов 108-112, в Scientific American . На момент написания, в 1998 году, они уже признали, что было достигнуто: «Мы прошли долгий путь с 1940-х годов, когда Нильс Бор предсказал, что фермий, элемент 100, будет последним элементом периодической таблицы.”
Ричард Фейнман предсказал, что элемент 137 будет последним. Но на самом деле никто не знает, где закончится стол. Расчеты конца таблицы основаны на теории относительности. Когда ядра становятся больше, больше протонов в ядре означает большую силу, притягивающую электроны, поэтому электроны, движущиеся вокруг них, должны двигаться все быстрее и быстрее, достигая скоростей, которые составляют значительную часть скорости света. На этих скоростях электроны становятся «релятивистскими», а атомы ведут себя не так, как ожидалось, исходя из их положения в таблице.В конце концов, расчеты предсказывают, что электроны должны будут двигаться быстрее света, что невозможно. Исходя из этого, некоторые ученые предсказывают, что концом может быть элемент 170, поскольку это может быть точка, в которой достаточно протонов, чтобы попросить электроны сделать невозможное.
Периодическая таблица, опубликованная в мае 2016 г. на Wikimedia Commons. Мы видим некоторые релятивистские эффекты в элементах повседневной жизни. В атомах золота электроны вращаются вокруг ядра со скоростью, превышающей половину скорости света.Это изменяет орбитали электронов так, что золото поглощает синий свет, а фотоны всех других цветов отражаются. Мы наблюдаем белый свет минус синий свет, характерный золотисто-желтый блеск обручальных колец, который отличает золото от окружающих его серебристых элементов в периодической таблице.
Будут ли химические свойства вновь открытых элементов подчиняться периодичности, или релятивистские эффекты приведут к трещинам в периодическом законе? Поскольку новые сверхтяжелые вещества производятся в очень малых количествах, химики не могут исследовать их с помощью традиционных подходов, таких как засунуть элемент в колбу и наблюдать, как он реагирует с другими химическими веществами.Вместо этого они разрабатывают эксперименты, чтобы получить простые ответы «да-нет» об их свойствах, спрашивая, например, будет ли элемент 112 при очень низкой температуре связываться с золотом, как металл? Будет ли он оседать на льду, как благородный газ?
Уже в 1990-х годах первые эксперименты показали, что резерфорд (104) и дубний (105) не ведут себя в соответствии с их положением в периодической таблице. Согласно периодическому закону, эти два элемента должны вести себя как элементы, находящиеся прямо над ними, гафний и тантал.Вместо этого резерфорд реагирует как плутоний, который находится довольно далеко в периодической таблице, в то время как дубний ведет себя как протактиний, удаленный элемент в таблице. Но не все супертяжеловесы ведут себя неожиданно. Сиборгий (106) и бориум (107) действуют так, что в соответствии с тем, что предсказывала таблица Менделеева, научные статьи по ним были озаглавлены «Странно обыкновенный сиборгий» и «Скучный бориум», – отмечает Скерри.
Остается ли периодическая таблица Менделеева периодической для очень тяжелых атомов, как признает Шерри, «не имеет большого практического значения, по крайней мере, в обозримом будущем.Потеря предсказательной способности в сверхтяжелой сфере не повлияет на полезность остальной части таблицы ». Однако «вопрос о влиянии специальной теории относительности затрагивает самое сердце химии как дисциплины». Если периодический закон потеряет предсказательную силу из-за специальной теории относительности, химия будет больше полагаться на физику. Но если периодический закон останется (в основном) действующим, химия сохранит некоторую независимость.
Неизменная таблица Менделеева Химии отмечает большой день рождения
Висящие на стене квадраты выглядят как неровная стена из блоков алфавита.Буквы не образуют слов. Столбцы неровные. Эта диаграмма – символ химии – известна как Периодическая таблица элементов. Дмитрий Менделеев (MEN-duh-LAY-ev), российский ученый, работающий в Санкт-Петербурге, предложил раннюю версию. Это было 150 лет назад. Но даже сегодня эта диаграмма помогает ученым разобраться в атомах и молекулах, составляющих нашу Вселенную.
Элементы – это строительные блоки всей материи. Их атомы соединяются вместе, образуя буквально все – нас, воздух, которым мы дышим, организмы, которые разделяют наш мир, и все остальные молекулы газа или частицы массы, встречающиеся во всей нашей Вселенной.
Строки и столбцы периодической таблицы соответствуют так называемому периодическому закону . Он утверждает, что общие черты среди химических элементов повторяются в регулярных паттернах по мере того, как элементы становятся больше. Эти паттерны связывают элементы со схожим химическим поведением и помогают химикам рассказать, как атомы реагируют с образованием молекул. То, как выстраиваются строки и столбцы в этой таблице, указывает на общие черты между группами связанных элементов. Понимание этих отношений помогает химикам создавать новые соединения.Это также помогает им понять, как устроена жизнь. Это даже помогает им предсказать, как будут вести себя новые материалы.
В 1869 году русский химик Дмитрий Менделеев предложил периодический закон и свою первую таблицу Менделеева. Он опубликовал эту периодическую таблицу два года спустя в учебнике Основы химии ( Основы химии ). Ряд строк показывает, что химия носит периодический характер, а это означает, что определенные свойства повторяются. Основываясь на повторяющихся шаблонах, он оставил пробелы для четырех элементов, которые, как он ожидал, будут существовать.В течение 10 лет ученые откроют три из них.
Дмитрий Менделеев / Институт истории науки
Но хорошо известная таблица Менделеева – далеко не единственная таблица Менделеева. Ученые построили множество, некоторые из которых имеют самые разные формы. Некоторые разработали химики. Ученые и учителя в других областях разработали другие.
«Альтернативные формы полезны из-за различных аспектов науки, которые они иллюстрируют», – отмечает Кармен Джунта. Он химик в колледже Ле Мойн в Сиракузах, штат Нью-Йорк.Y. Эти менее традиционные периодические таблицы дают возможность не только выделить некоторые из особенностей химии, говорит он, но и лучше их сфокусировать.
Учителя и родители, подпишитесь на шпаргалку
Еженедельные обновления, которые помогут вам использовать Новости науки для студентов в учебной среде
В 2019 году мир отмечает периодическую таблицу Менделеева во всех ее формах и то, как она помогает организовать и осмыслить строительные блоки нашей Вселенной.
ЭлементарноСразу после Большого взрыва Вселенная состояла только из водорода и гелия – двух самых легких элементов. Гравитация сближала эти атомы во все больших количествах. В конце концов это создаст плотные, раскаленные огненные печи, которые мы знаем как звезды. В центре этих звезд сильное давление сливало атомные ядра – центры атомов – создавая более крупные ядра.
Это медленно выкованные более крупные и тяжелые элементы. Они включали углерод, элемент, необходимый для всей жизни, какой мы ее знаем.Эти звездные кузницы также образовали кислород, которым мы должны дышать.
Создание элементов крупнее железа требовало еще большей космической огневой мощи. Тяжелые атомные ядра образовались в результате взрыва массивных умирающих звезд. Эти сверхновые силой столкнули более мелкие элементы вместе.
Менделеев в своей периодической таблице 1869 года расположил элементы в порядке возрастания массы. Он был одним из первых ученых, которые осознали, что в химии есть повторяющиеся закономерности. По мере того, как элементы становятся больше, некоторые из их свойств в конечном итоге повторяются.Некоторые элементы предпочитают реагировать, становясь положительно заряженными. Некоторые предпочитают заряжаться отрицательно. Такие закономерности позволили ученым предугадать, будут ли сочетаться разные типы элементов и как они это делают.
Менделеев написал в своем исследовательском журнале, что идея этого стола пришла ему во сне. Он начал с скандала. Но когда химические свойства повторились, он начал новую серию. Он выстроил элементы с похожим поведением в столбцы. Он оставил пробелы. Эти отверстия, рассуждал он, обозначают элементы, которые, вероятно, существовали, но еще не были обнаружены.
Когда он опубликовал эту таблицу, Менделеев предсказал свойства и массы четырех новых элементов. В конце концов все четыре были обнаружены – три всего за 10 лет.
Самая ранняя спираль была спроектирована французским геологом Александром-Эмилем Бегуайе де Шанкуртуа в 1862 году. У нее не было «рядов». Вместо этого все элементы намотаны вокруг цилиндра в одну длинную линию.
Александр-Эмиль Бегуйе де Шанкуртуа / Wikimedia Commons
Александр-Эмиль Бегуйе де Шанкуртуа был французским геологом.За семь лет до знаменитой таблицы Менделеева он создал спиральную «таблицу». Он расположил элементы по атомному весу. Он показал повторяющиеся периоды. Однако перерывов между рядами не было. Вместо этого он намотал свою длинную тонкую диаграмму на цилиндр. Таким образом, каждая строка перетекала в следующую. И похожие элементы выстроились друг над другом аккуратными столбиками.
Другие ученые составили аналогичные диаграммы. Вскоре усилия по систематизации всех известных элементов нарастали.По мере развития всех этих диаграмм одна из них стала доминирующей. Его сегодня можно встретить в классах и в учебниках по всему миру.
Каждый из 118 известных элементов имеет свой собственный химический символ – одну или две буквы, которые гордо представляют название элемента из его поля в периодической таблице. Некоторые из этих сокращений очевидны, например, H для водорода или C для углерода. Другие восходят к древним временам. Например, символ натрия – Na. Почему? На латыни натрий называется natrium .
Каждое поле в таблице имеет целое число, обычно в верхнем левом углу. Названный атомным номером, он показывает, сколько протонов или положительно заряженных частиц упаковано в ядро элемента. Это ядро также включает нейтроны (частицы с массой, но без заряда). Ядро окружает облако, состоящее из отрицательно заряженных электронов гораздо меньшего размера.
Нижнее число в квадрате диаграммы для каждого элемента включает цифры после десятичной точки. Это значение представляет собой атомную массу элемента.Он представляет собой среднюю массу атома этого элемента.
Периодическая таблица Менделеева проста, мощна и продолжает давать новые эксперименты, – говорит Эрик Шерри. Он преподает химию в Калифорнийском университете в Лос-Анджелесе. Он также пишет книги о таблице Менделеева. Он описывает организационные принципы, лежащие в основе периодической таблицы, как «абсолютно важное открытие».
Двойные башни стали доминироватьСамая распространенная сегодня таблица Менделеева иногда известна как версия «башен-близнецов».Водород (H) венчает высокую башню слева. Гелий (He) наверху правой башни.
Периодический круглый стол расставляет элементы из массива дерева. Он разработан, чтобы показать, как электроны расположены в виде узоров внутри каждого элемента. В этой конструкции в форме дерева периоды роста становятся частью более широких дисков. Подобные элементы накладываются друг на друга. Вы можете удалить каждый слой, чтобы увидеть элементы в каждой «строке».
Гэри Кац / Институт истории науки
По мере того, как атомы становятся больше, они становятся более сложными.В этих диаграммах период в периодической таблице относится к ряду элементов, демонстрирующих некоторый повторяющийся цикл. В таблице ширина строки, также называемая периодом, определяется таким образом, чтобы сохранялась модель поведения элементов в столбце. Сначала узор повторяется в двух элементах, так что ширина ряда составляет два элемента. Затем узор повторяется в восьми элементах. Как отмечает Скерри, по мере того, как элементы становятся больше, «периоды становятся все длиннее и длиннее» – в конечном итоге с 18 элементами, а затем с 32.
Чем длиннее, тем больше периоды могут сделать базу из тяжелых элементов этой таблицы неуклюже широкой. Чтобы обойти это, диаграмма двойной башни обычно вытаскивает часть двух нижних рядов. Эти элементы размещаются внизу страницы, почти как сноски. Эти нижние ряды содержат группы элементов, известных как лантаноиды (LAN-tha-nydes) и актиниды (AK-tih-nydes).
Актиниды включают новейшие и самые крупные элементы. Многие из них радиоактивны, и не встречаются в природе.Вместо этого физики делают их в лабораториях, бомбардируя более мелкие элементы друг в друга. Эти радиоактивные сверхтяжелые элементы также очень нестабильны. Это означает, что они распадаются на более мелкие элементы за доли секунды.
Чем они полезныПериодическая таблица Менделеева может служить своего рода книгой рецептов. На диаграмме показано, как элементы соотносятся друг с другом. То, где элемент находится на столе, говорит химику, как он может или не может взаимодействовать с другими ингредиентами.Часто эти полезные характеристики включают его массу, температуру кипения и другие важные данные.
Расположение стола помогает химикам решать проблемы. Например, химики могут захотеть создать новое соединение с характеристиками, аналогичными существующему – только лучше. Таким образом, они могут искать замену с аналогичными функциями, начиная с другого элемента из того же столбца таблицы.
Настоящий дар этих таблиц, говорит Бриджит Ван Тиггелен, – это «хранение всей информации в одном месте, обучение и обмен ею.Историк, она работает европейским директором Института истории науки в Филадельфии, штат Пенсильвания,
.Диаграмма с двумя башнями имеет много преимуществ, – говорит Марк Лич. Он работает химиком в Англии в Манчестерском столичном университете. Он утверждает, что ни одна другая таблица не может так хорошо отображать повторяющиеся шаблоны, в то же время включая другие функции.
Например, все металлы находятся слева. Справа торчат неметаллы. На этой диаграмме также показано, как изменяется размер атома и насколько легко он может отдать электрон.Такие черты важны для понимания того, как атомы будут действовать, реагировать и вступать в брак с другими, образуя молекулы.
Альтернатива Роя Александера столу Twin Tower разрезала ряды на полоски. Когда он собрал их вместе, получилась трехмерная версия таблицы Менделеева. Он также оказался почти идентичным тому, что был создан физиком Джорджем Гамовым четверть века назад.
Рой Александр
Но диаграмма башен-близнецов не идеальна.
Химики часто спорят, например, где разместить водород и гелий.А плоская двухмерная таблица на самом деле не показывает, как строки соединяются друг с другом. Когда вы подходите к концу одного ряда, Шерри говорит: «У вас возникает ощущение, что вы как бы падаете».
Рой Александр работал строителем выставок. Ему не понравилось, как внезапно закончились ряды стола в башне-близнецах. Поэтому в 1965 году он разрезал традиционную таблицу Менделеева на полоски. Затем он собрал их вместе, создав трехмерную версию.
Спустя годы он узнал, что физик Георгий Гамов построил почти идентичную таблицу в 1940-х годах.Александр вспоминает: «Было удивительно, насколько он выглядел идентичным моему патентному рисунку».
Учет все более продолжительных периодовКогда Бегуйе де Шанкуртуа впервые создал свою периодическую таблицу, многие из крупнейших элементов еще не были обнаружены. По мере увеличения элементов общие черты повторяются все реже. В конце концов, более длинные ряды с элементами лантаноидов и актинидов сделали традиционную таблицу неуклюже широкой.
Трехмерный стол может включать эти более длинные строки, просто делая спираль шире.Канадский химик Фернандо Дюфур разработал ElemenTree, чтобы проиллюстрировать это (см. Фото). Он сделал каждый период в виде шестиугольного слоя, который содержал все элементы, которые обычно появляются в одном ряду на диаграмме двух башен. Подобные элементы по-прежнему выстраиваются вертикально.
Канадский химик Фернандо Дюфур разработал ElemenTree, показанный здесь, для обработки все более крупных «рядов» в виде кольца в этой трехмерной периодической «таблице».
Ingenium / Канадские музеи науки и техники / Ingenium
Но стол в форме дерева – не единственный трехмерный ответ.В 1950-х годах учительница химии Дженни Клаусон использовала цилиндр для своего стола. Но вместо того, чтобы выпирать лишние элементы, она подтянула некоторые из них к центру.
Еще одна проблема со столом с двумя башнями – куда поместить водород и гелий. Например, водород иногда действует больше как металл. Он сбрасывает свой электрон и притягивает отрицательно заряженные ионы. В других случаях он действует как неметалл, захватывает лишний электрон и становится отрицательно заряженным. Затем он действует больше как фтор или хлор и поглощает положительные ионы.
Чтобы учесть это, химик Теодор Бенфей создал в 1960-х годах плоский спиральный столик. Он поместил водород и гелий в центр большого синего круга. Каждая из трех внешних спиц внутри круга представляет собой группу похожих элементов. Чтобы включить более крупные элементы и возрастающие периодические циклы, он добавил террасы, выступающие из круга. К ним относятся переходные металлы, лантаноиды и актиниды.
Плоский стол, такой как башни-близнецы, удобно повесить на стену или распечатать в книге.Однако Лич добавляет: «На самом деле нет причин, по которым таблица Менделеева не является трехмерной».
Развлечения и игры?Одно из последних дополнений к растущей библиотеке периодических таблиц поступило от Европейского химического общества (ECS). Компания ECS, расположенная в Брюсселе, Бельгия, стремится привлечь внимание к относительной нехватке многих важных элементов. В нем отмечается, что в обычный сотовый телефон входит 30 элементов. И многие из этих элементов не являются широко доступными.
Одна из новейших таблиц была разработана Европейским химическим обществом. Он показывает каждый «блок» на диаграмме, размер которого соответствует его относительной численности или редкости на Земле. Показанная здесь таблица с надписью на английском языке, таблица также имеет версии на 32 других языках, включая галисийский, иврит, шотландский гэльский, русский и китайский (мандаринский).
Европейское химическое общество (CC BY-ND)
«Нам необходимо внимательно изучить нашу склонность к выбрасыванию и ненадлежащей переработке таких предметов», – утверждает ECS.«Если не будут предложены решения, мы рискуем увидеть, что многие природные элементы, из которых состоит окружающий нас мир, закончатся – будь то из-за ограниченных запасов, их расположения в зонах конфликтов или нашей неспособности полностью их переработать».
ECS признает, что этот новый стол «заставляет задуматься». И это не случайно. Он хочет, чтобы люди поняли, как важно не тратить зря «исчезающие элементы». В нем говорится, что каждый должен «задаться вопросом, действительно ли необходимы обновления наших телефонов и других электронных устройств.«А когда наша электроника умирает, – говорится в документе, -« нам нужно убедиться, что мы перерабатываем », чтобы относительно дефицитные элементы« не попадали на свалки и не загрязняли окружающую среду ».
Чтобы изучить, как люди используют элементы, ECS разработала бесплатную онлайн-видеоигру Elementary Escapades.
«Есть много места для новых периодических таблиц», – говорит Лич из Манчестера. Фактически, он стал хобби собирать новые и размещать их в Интернете. Он также всегда ищет старых.«Я, наверное, получаю новый каждую неделю», – говорит он.
Scerri также попросил студентов разработать новые. «У каждого из них, – говорит он, – есть свои собственные достоинства».
Таблица Менделеева| Определение, элементы, группы, сборы, тенденции и факты
Изучите периодический закон химии, чтобы понять свойства элементов и их взаимосвязь.
Объяснение таблицы Менделеева.
Encyclopædia Britannica, Inc. Посмотреть все видео к этой статьеПериодическая таблица , полностью периодическая таблица элементов , в химии организованный массив всех химических элементов в порядке возрастания атомного номера – i.е., полное число протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющийся образец, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства. Первоначальное открытие, сделанное Дмитрием И. Менделеевым в середине XIX века, имело неоценимое значение для развития химии.
таблица МенделееваСовременная версия периодической таблицы элементов (для печати).
Британская энциклопедия, Inc.Популярные вопросы
Что такое таблица Менделеева?
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из количества присутствующих валентных электронов, то есть количества электронов в крайних элементах. оболочка атома.
Откуда взялась периодическая таблица Менделеева?
Расположение элементов в периодической таблице определяется их электронной конфигурацией.Из-за принципа исключения Паули не более двух электронов могут заполнить одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов: водорода и гелия. Поскольку у атомов больше электронов, у них появляется больше орбит, доступных для заполнения, и поэтому строки содержат больше элементов, расположенных ниже в таблице.
Почему периодическая таблица Менделеева разделяется?
У периодической таблицы есть две строки внизу, которые обычно отделяются от основной части таблицы. Эти ряды содержат элементы ряда лантаноидов и актиноидов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (от актиния до лоуренсия) соответственно.Для этого нет никаких научных причин. Это сделано только для того, чтобы стол стал более компактным.
Фактически не было признано до второго десятилетия 20-го века, что порядок элементов в периодической системе соответствует порядку их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. . В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронного строения атомов и молекул.Это разъяснение повысило ценность закона, который используется сегодня так же активно, как и в начале 20 века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
В первые годы XIX века произошло быстрое развитие аналитической химии – искусства различения различных химических веществ – и, как следствие, накопление обширных знаний о химических и физических свойствах как элементы, так и соединения.Это быстрое расширение химических знаний вскоре потребовало классификации, поскольку на классификации химических знаний основана не только систематизированная химическая литература, но и лабораторные науки, посредством которых химия передается как живая наука от одного поколения химиков к другому. Связи между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отстала от классификации соединений. Фактически, между химиками не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общепринятыми.
интерактивная таблица МенделееваСовременная версия периодической таблицы элементов. Чтобы узнать название элемента, атомный номер, электронную конфигурацию, атомный вес и многое другое, выберите элемент из таблицы.
Encyclopædia Britannica, Inc.J.W. Доберейнер в 1817 году показал, что объединяющий вес, означающий атомный вес, стронция находится посередине между весом кальция и бария, а несколько лет спустя он показал, что существуют другие такие «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]).Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предложения Доберейнера между 1827 и 1858 годами, показав, что аналогичные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний – к щелочноземельным элементам. металлы, тогда как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут – к другому семейству элементов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчасПозднее были предприняты попытки показать, что атомные веса элементов могут быть выражены арифметической функцией, и в 1862 году А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся спиральная кривая привела тесно связанные элементы в соответствующие точки над или под друг другом на цилиндре, и, как следствие, он предположил, что «свойства элементов являются свойствами чисел», что является замечательным предсказанием в свете современных знаний.
Классификация элементов
В 1864 г. J.A.R. Ньюлендс предложил классифицировать элементы в порядке возрастания атомного веса, при этом элементам присваиваются порядковые номера от единицы и выше и разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных на тот момент элементов: водород, литий, бериллий, бор, углерод. , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Затем в 1869 году, в результате обширной корреляции свойств и атомных весов элементов, уделяя особое внимание валентности (то есть количеству одинарных связей, которые может образовывать элемент), Менделеев предложил периодический закон: согласно которому «элементы, расположенные в соответствии с величиной атомного веса, демонстрируют периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному выводу, опубликованному после появления статьи Менделеева.
Периодическая таблица элементов | Химия
В 1869 году русский химик Дмитрий Менделеев впервые предположил, что химические элементы обладают «периодичностью свойств».” Менделеев пытался организовать химические элементы в соответствии с их атомным весом, предполагая, что свойства элементов будут постепенно меняться по мере увеличения атомного веса. Однако он обнаружил, что химические и физические свойства элементы постепенно увеличивались, а затем внезапно менялись на разных шаги или периоды. Чтобы учесть эти повторяющиеся тенденции, Менделеев сгруппировал элементы в таблице, содержащей как строки, так и столбцы.
Периодическая таблица элементовСтруктура современной таблицы Менделеева
Современная периодическая таблица элементов основана на наблюдениях Менделеева; однако, вместо того, чтобы быть организованной по атомному весу, современная таблица упорядочена по атомному номеру (z).При перемещении слева направо по строке периодической таблицы свойства элементов постепенно меняются. В конце каждого ряда происходит резкое изменение химических свойств. Следующий элемент по порядку атомного номера более похож (химически говоря) на первый элемент в строке над ним; таким образом, новая строка начинается на столе.
Например, кислород (O), фтор (F) и неон (Ne) (z = 8, 9 и 10 соответственно) являются стабильными неметаллами, которые при комнатной температуре являются газами.Натрий (Na, z = 11), однако, представляет собой металлическое серебро, твердое при комнатной температуре, как и элемент литий (z = 3). Таким образом, натрий начинает новую строку в периодической таблице и помещается непосредственно под литием, подчеркивая их химический состав. сходства.
Строки в периодической таблице называются периодами. Как один движется слева направо в заданный период, химические свойства элементов медленно меняются. Столбцы в периодической таблице называются группами.Элементы в данной группе в периодической таблице обладают многими схожими химическими и физическими свойствами.
Контрольная точка понимания
Почему натрий находится непосредственно под литием в периодической таблице?
Электронная конфигурация и таблица
«Периодическая» природа химических свойств, обнаруженных Менделеевым, связана с электронной конфигурацией атомов элементов.Другими словами, способ, которым электроны атома расположены вокруг его ядра, влияет на свойства атома.
Теория атома Нильса Бора говорит нам, что электроны не являются расположены случайным образом вокруг ядра атома, но встречаются в определенных электронных оболочках (см. наш модуль Atomic Theory II для получения дополнительной информации). Каждая оболочка имеет ограниченную емкость для электронов. По мере заполнения нижних оболочек дополнительные электроны находятся в более удаленных оболочках.
Емкость первой электронной оболочки – два электрона, а второй – восемь. Таким образом, в нашем примере, рассмотренном выше, кислород с восемью протонами и восемью электронами несет два электрона на своей первой оболочке и шесть на своей второй оболочке. Фтор с девятью электронами несет два в своей первой оболочке и семь во второй. Неон с десятью электронами несет два в первом и восемь во втором.Поскольку количество электронов во второй оболочке увеличивается, мы можем представить, почему химические свойства постепенно меняются по мере того, как мы переходим от кислорода к фтору и неону.
У натрия одиннадцать электронов. Двое поместились в его первую оболочку, но помните, что вторая оболочка может нести только восемь электронов. Одиннадцатый электрон натрия не может поместиться ни в его первую, ни в его вторую оболочку. Этот электрон поселяется на еще одной орбите, третьей электронной оболочке натрия.Причина резкого изменения химических свойств при переходе от неона к натрию заключается в том, что между двумя элементами происходит резкий сдвиг в электронной конфигурации. Но почему натрий похож на литий? Давайте посмотрим на электронные конфигурации этих элементов.
Электронные конфигурации для выбранных элементовКак вы можете видеть на иллюстрации, в то время как натрий имеет три электронные оболочки, а литий две, их общая характеристика состоит в том, что у них обоих есть только один электрон в их крайних точках. электронная оболочка.Эти электроны внешней оболочки (называемые валентными электроны) важны для определения химических свойств элементов.
Химические свойства элемента определяются тем, как его атомы взаимодействуют с другими атомами. Если мы изобразим внешнюю (валентную) электронную оболочку атома как сферу, охватывающую все внутри, то только валентная оболочка может взаимодействовать с другими атомами – почти так же, как это только краска на внешней стороне вашего дома. который “взаимодействует” с, и промокает, дождевая вода.
Валентная оболочка атома «покрывает» внутренние электронные оболочкиЭлектроны валентной оболочки в атоме определяют способ его взаимодействия с соседними атомами и, следовательно, определяют его химические свойства. Поскольку и натрий, и литий имеют один валентный электрон, они обладают схожими химическими свойствами.
Контрольная точка понимания
Химические свойства элемента определяются количеством электронов в
Сокращение электронной конфигурации
Для элементов в группах, обозначенных A в периодической таблице (IA, IIA и т. Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
| Сокращение конфигурации элемента | ||||
|---|---|---|---|---|
| Элемент | Сокращение конфигурации | |||
| Водород | H | 1e – | ||
| Литий | Li | 2e – | 1e – | |
| Фтор | F | 2e – | 7e – | |
| Натрий | Na | 2e – | 8e – | 1e – |
Для получения дополнительных сведений в таблице, приведенной ниже, показаны электронные конфигурации первых одиннадцати элементов.
