Первоначальная таблица менделеева: Первоначальный вид таблицы Менделеева
- Комментариев к записи Первоначальная таблица менделеева: Первоначальный вид таблицы Менделеева нет
- Разное
- Последний вариант таблицы Менделеева был другой. Изначальная Таблица Менделеева. Видео. Академик Золотарев А.Ю.
- Периодическая система химических элементов (таблица Менделеева)
- Изначальная таблица Менделеева включала эфир. Зачем же его исключили? : matveychev_oleg — LiveJournal
- Периодическая система Менделеева • Джеймс Трефил, энциклопедия «Двести законов мироздания»
- Менделеева первоначальная – Справочник химика 21
- История периодической таблицы
- 150 лет назад периодическая таблица Менделеева началась с видения одного химика
- Эволюция периодической системы.
- История Периодической таблицы
- Когда была изобретена Периодическая таблица?
- История Периодической таблицы
- Периодическая таблица
Последний вариант таблицы Менделеева был другой. Изначальная Таблица Менделеева. Видео. Академик Золотарев А.Ю.
Таблица Менделеева – это периодическая система химических элементов.
Имеющая статус официальной и именно ее представляют в школьной программе в курсе академической химии, начиная со средней школы и заканчивая высшими учебными заведениями. А также на ней базируются все постулаты академической науки в виде периодического закона химических элементов.
Данную таблицу химических элементов в свое время во сне увидел известный экономист, физик и химик Дмитрий Иванович Менделеев, по крайне мере об этом свидетельствуют некоторые сохранившиеся данные, вот эта цитата:
«Ясно вижу во сне таблицу, где элементы расставлены, как нужно. Проснулся, тотчас записал на клочке бумаги и заснул опять. Только в одном месте впоследствии оказалась нужной поправка»
Хотя сам Менделеев об этом говорил вот таким образом одному из журналов того времени:
Но это никак не мешает тому, что он мог ее действительно увидеть во сне, все время о ней думал и в итоге просто увидел ее в полном ее представлении.

Да вот вопрос какое это представление свыше?
Нам говорят, что она была вот такой:
Но есть факты свидетельствующие об обратном. В Москве в политехническом музее хранится подлинная таблица Менделеева, на которой изображен еще один элемент, который Менделеев называл эфиром. В Таблице он шел первым и имел атомарный вес равный нулю, т.е. по Менделеева не участвовавший в химических реакциях, но являющийся элементом – источником всех элементов периодической системы.
Впервые об эфире упомянул Аристотель – он называл его пятым элементом, причем в отличии от воздуха, огня, воды, земли является неизменным.
В 1800 году Огюстен Жан Френель предложил Волновую теорию света, которая тогда была победоносно принята научным сообществом.
 Френель предполагал, что свет распространяется в именно в эфире с помощью в виде волн.
Френель предполагал, что свет распространяется в именно в эфире с помощью в виде волн.Когда Максвелл открыл уравнения классической электродинамики и Г.Герц подтвердил теорию Максвелла, эфир стал носителем всего сущего.
Эфир – это гипотетическая субстанцию, не имеющая атомарного веса, не вступающая в химические реакции на элементарном уровне, являющаяся всепроникающей средой и заполняющая пространство, в котором распространяются электромагнитные волны, в том числе и видимый свет.
Д.И. Менделеев неоднократно высказывался о существования некой среды.
Вот цитаты:
«Легче всех эфир, в миллионы раз» – 1871 год
«При нулевом давлении у воздуха есть некоторая плотность, это и есть эфир!» – 1874 год
А после открытия инертных газов Менделеев в 1900 году включает в таблицу нулевую группу и даже оставляет место еще для более легких элементов, которые легче водорода.

Данная группа располагалась слева в ней также располагался Короний перед Водородом.
И собственно Ньютоний – именно его Менделеев считал мировым эфиром.
Дмитрий Иванович последние годы жизни был одержим идеей найти и доказать существования эфира. Но к сожалению ему это не удалось т.к. через 2 года после выхода книги “Попытка химического понимания мирового эфира” 1905 года, он покинул этот мир.
Интересен тот факт, что параллельно теориям и исследованиям Менделеева, Пуанкаре, Минковского, Ритца, Хевисайда стремительно развивалось другая часть научного сообщества, которая основывалась на принципиально других фундаментах. Данная часть научного сообщества не только преуспевала, но и набирала армию своих сторонников.
Как итог возникает новая теория обобщающая всю фундаментальную науку – это “Общая теория относительности”, предложенная Эйнштейном в 1905 году и почти на ура принятая всей академической наукой, как незыблемый фундамент построения всех исходящих физических (материальных) законов.
Основой данной теории стало постоянство скорости света в вакууме, как точкой отсчета всех остальных законов физики.
Отсюда вытекало следующее: светоносный эфир имеет под собой природу вещества с нулевой атомарной массой, а пространство в Теории Относительности не имеет природу вещества и является по сути пустотой в которой не действуют математические законы и все искажения в пространстве и времени можно объяснять деформацией самого пространства и времени (эффект расширение Вселенной)
После принятия мировым научным сообществом Общей Теории Относительности и прекращения дальнейших исследований Менделеева (1907 д.с.) и Пуанкаре (1912 д.с.).
Эфир (Ньютоний) был попросту удален из таблицы Менделеева, по следующим причинам:
1. Немыслимая скорость распространения колебаний.
2. Является веществом и при этом неощутим.
3. Математически исчисляем.
4. Постоянство и вездесущность.
5. Единство среды (было опровергнуто якобы дискретностью фотонов, также базируется на постулате СТО)
6.
 Реальность всех протекающих процессов в эфире зависит от точки наблюдения.
Реальность всех протекающих процессов в эфире зависит от точки наблюдения.Вот цитата Лауреата Нобелевской премии по физике Роберт Б. Лафлин о роли эфира в современной теоретической науке:
“Как это ни парадоксально, но в самой креативной работе Эйнштейна (общей теории относительности) существует необходимость в пространстве как среде, тогда как в его исходной предпосылке (специальной теории относительности) необходимости в такой среде нет… Слово «эфир» имеет чрезвычайно негативный оттенок в теоретической физике из-за его прошлой ассоциации с оппозицией теории относительности. Это печально, потому что оно довольно точно отражает, как большинство физиков на самом деле думают о вакууме… Теория относительности на самом деле ничего не говорит о существовании или несуществовании материи, пронизывающей вселенную… Но мы не говорим об этом, потому что это табу.”
По предположению некоторых ученых, считающих, что эфир существует размер данных частиц вещества эфира все частицы меньше и равные размеру 10 (-50) м .
Именно по этим частицам и перемещаются электромагнитные волны в том числе и видимый свет. Кстати нужно отметить, если предположить, что теория эфира верна, то все становится на свои места. Даже у науки и религии исчезнет предмет разногласия, они встретятся в конце туннеля причем, используя разные подходы познания мироздания. Одни при помощи математических законов, заведомо равных скрытым законам мироздания, а другие при помощи интуитивно-чувственного осознания происходящего.
Академик Золотарев Алексей Юрьевич. О Таблице Менделеева
Периодическая система химических элементов (таблица Менделеева)
https://ria.ru/20190129/1550014194.html
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов (таблица Менделеева) – РИА Новости, 29. 01.2019
01.2019
Периодическая система химических элементов (таблица Менделеева)
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. РИА Новости, 29.01.2019
2019-01-29T04:51
2019-01-29T04:51
2019-01-29T04:51
справки
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn23.img.ria.ru/images/99408/72/994087230_0:105:2000:1230_1920x0_80_0_0_b528d261d40438ab5524fc6ad7f580a3.jpg
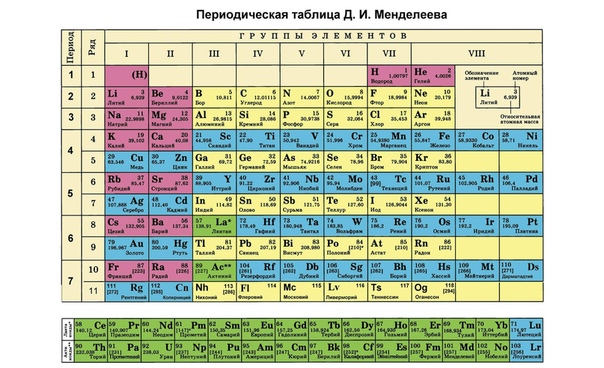
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация. Является табличным представлением периодического закона, открытого Дмитрием Менделеевым. Современная формулировка этого закона звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер.Прообразом Периодической системы химических элементов служит таблица “Опыт системы элементов, основанной на их атомном весе и химическом сходств”, составленная Менделеевым в 1869 году. По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры.
По мере совершенствования этой таблицы он развил представления о периодах и группах элементов и о месте каждого элемента в системе. В 1871 году в книге “Основы химии” Менделеевым была включена “Естественная система элементов Д. Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне. Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером). Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).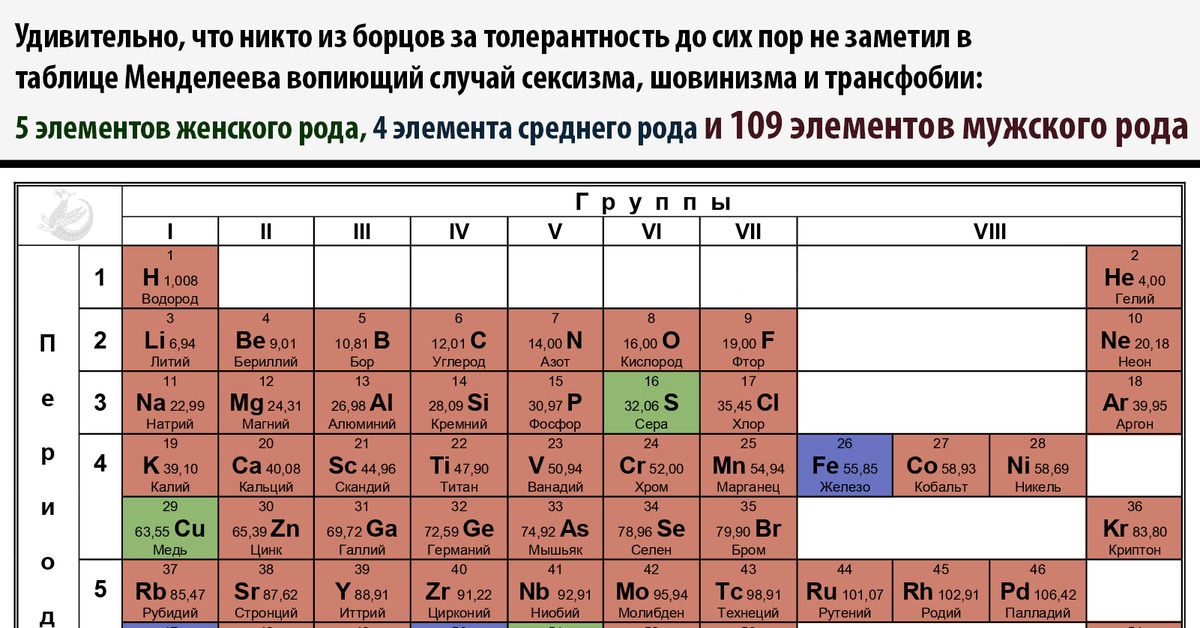 В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии.
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.Первый период содержит два элемента – водород и гелий. Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов. Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов. Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды. Лантаноиды и актиноиды помещены отдельно внизу таблицы.Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/99408/72/994087230_112:0:1889:1333_1920x0_80_0_0_597a34ca28aa89475eedcbd63e1a68a3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
справки
Периодическая система химических элементов – упорядоченное множество химических элементов и их естественная классификация.
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118). Девять из них были впервые получены в российском Объединенном институте ядерных исследований в Дубне.
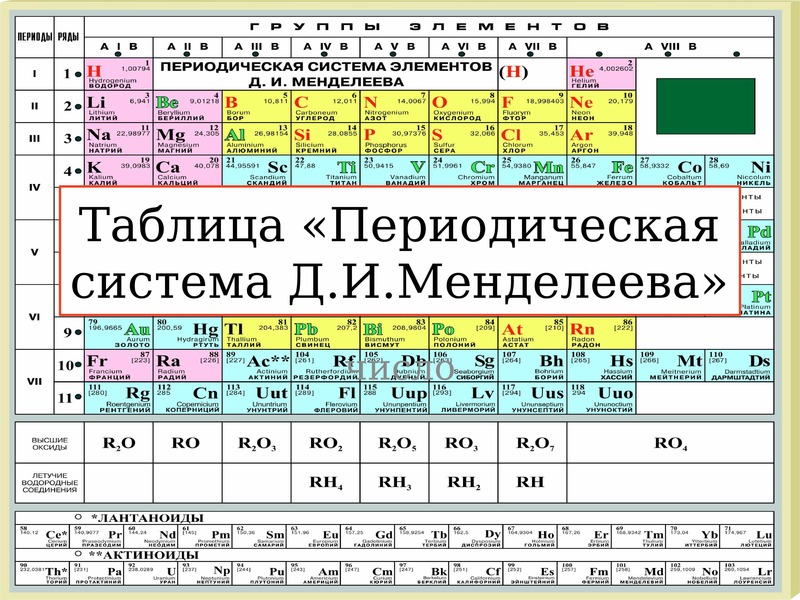 Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).
Последнее добавление в таблицу Менделеева было сделано в 2016 году, она пополнилась четырьмя элементами с 113, 115, 117 и 118 атомными номерами, которые соответственно были названы нихоний (Nh), московий (Mc), теннессин (Ts) и оганесон (Og). Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов, которые назвали “большой гонкой”.Опубликовано свыше 500 вариантов Периодической системы химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. Наиболее распространены две табличные формы: короткая и длинная (разрабатывалась Дмитрием Менделеевым, усовершенствована в 1905 году Альфредом Вернером).Современная форма Периодической системы химических элементов (в 1989 году Международным союзом теоретической и прикладной химии рекомендована длинная форма таблицы) состоит из семи периодов (горизонтальных последовательностей элементов, расположенных по возрастанию порядкового номера) и 18 групп (вертикальных последовательностей элементов в соответствии с количеством валентных электронов), а короткая форма таблицы – из восьми групп.
Номер группы элементов короткого варианта таблицы Менделеева соответствует числу валентных электронов во внешней электронной оболочке атомов. В длинном варианте таблицы номер группы в большей мере формален. Группы короткого варианта включают главную (а) и побочную (б) подгруппы, в каждой из которых содержатся элементы, сходные по химическим свойствам. Элементы некоторых групп имеют собственные тривиальные названия: щелочные металлы (группа 1 длинной формы таблицы), щелочноземельные металлы (группа 2), халькогены (группа 16), галогены (группа 17), благородные газы (группа 18).
В Периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Первый период содержит два элемента – водород и гелий.
Второй и третий периоды (литий – неон; натрий – аргон) содержат по восемь элементов.
Четвертый (калий – криптон) и пятый (рубидий – ксенон) периоды содержат по 18 элементов.
Шестой период (цезий – радон) содержит 32 элемента и включает особую группу элементов – лантаноиды.
Седьмой период (франций – оганесон), подобно шестому, содержит 32 элемента и включает особую группу элементов – актиноиды.
Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Периодическая система химических элементов сыграла и продолжает играть огромную роль в развитии многих естественнонаучных дисциплин. Она стала важным звеном в эволюции атомно-молекулярного учения, способствовала формулировке современного понятия “химический элемент” и уточнению представлений о простых веществах и соединениях, оказала значительное влияние на разработку теории строения атомов и возникновение понятия изотопии. С периодической системой связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и новых особенностей химического поведения уже открытых элементов. Периодическая система – важнейшая основа неорганической химии; она служит, например, задачам синтеза веществ с заранее заданными свойствами, созданию новых материалов, подбору специфических катализаторов для различных химических процессов. Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.
Периодическая система – научная база преподавания общей и неорганической химии, а также некоторых разделов атомной физики.По решению ООН 2019 год провозглашен Международным годом Периодической таблицы химических элементов.Материал подготовлен на основе информации РИА Новости и открытых источников
Изначальная таблица Менделеева включала эфир. Зачем же его исключили? : matveychev_oleg — LiveJournal
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит – ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность.Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, – альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем – один из пяти элементов бытия (по Аристотелю) – пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство.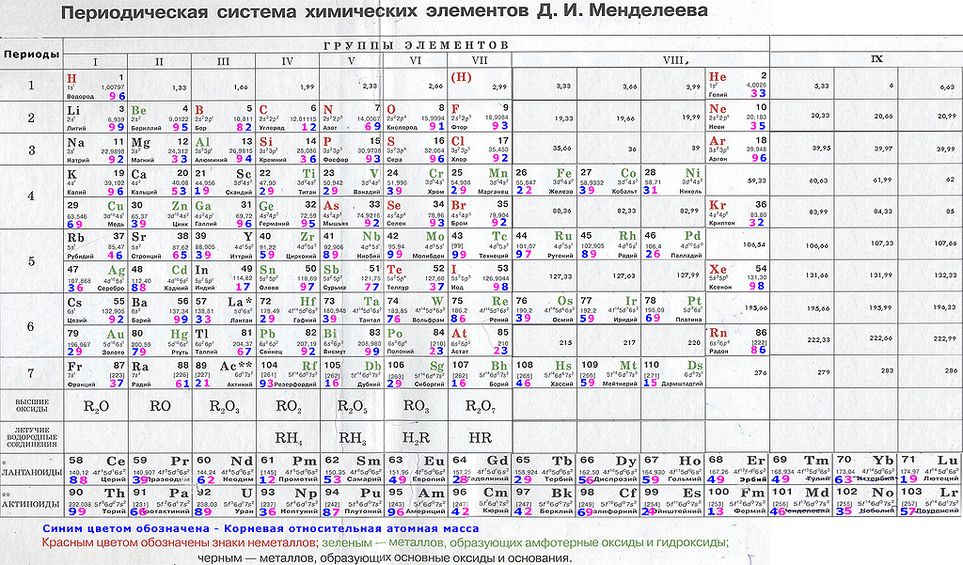 Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
У Менделеева было два фундаментальных научных открытия:
1 – Открытие Периодического закона в субстанции химии,
2 – Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир – частицы вещества размером ~ 10–100 метра (фактически – «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 – не видно, 2 – и не угадывается (из-за отсутствия нулевой группы).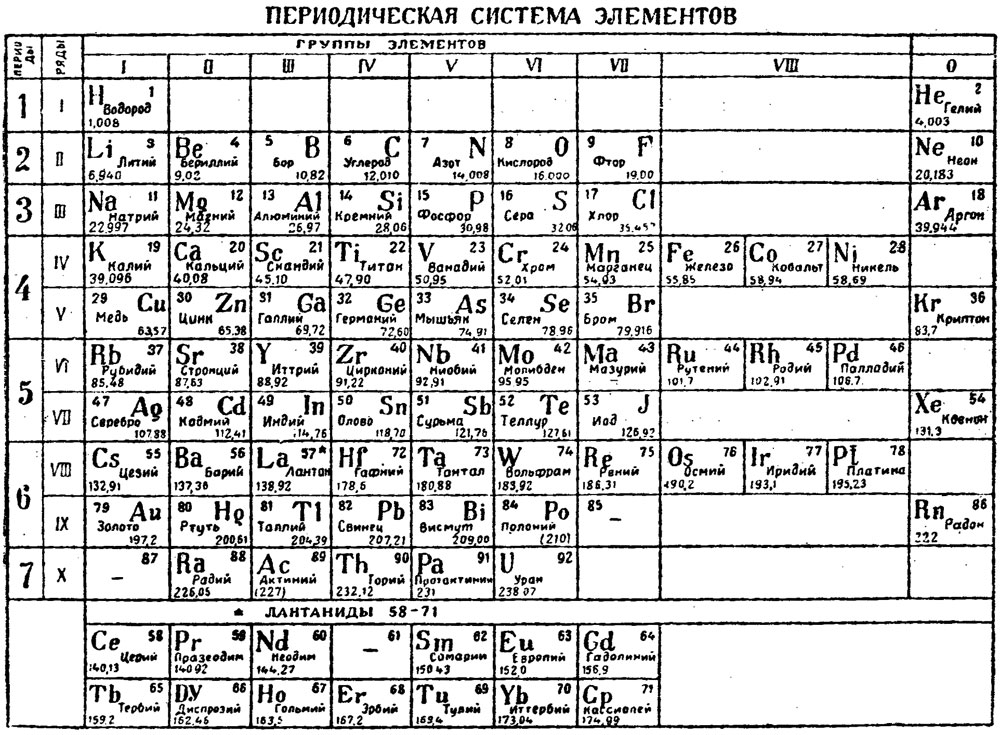
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира – то же самое, что человечество без детей – прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача – эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева – это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения? Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира.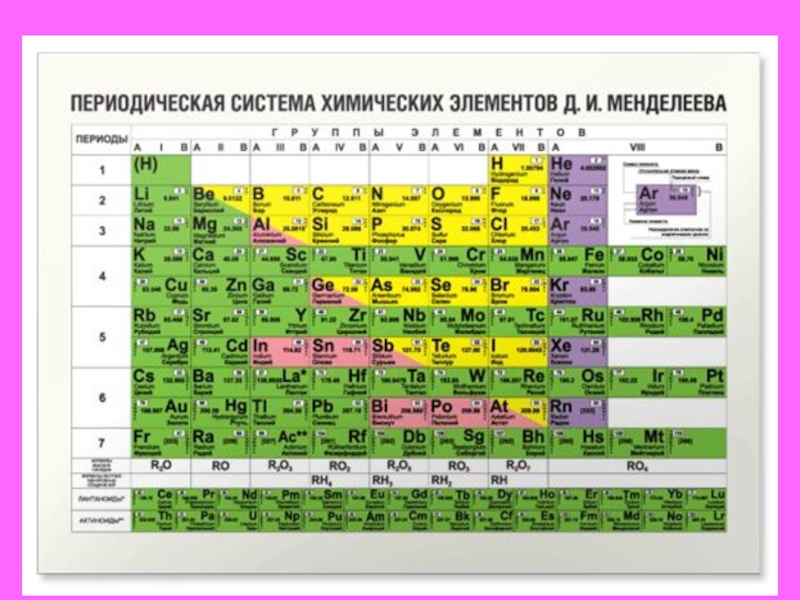 В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
Не вдохновляло это и прочих олигархов – угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» – из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто – солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева – его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а .
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д.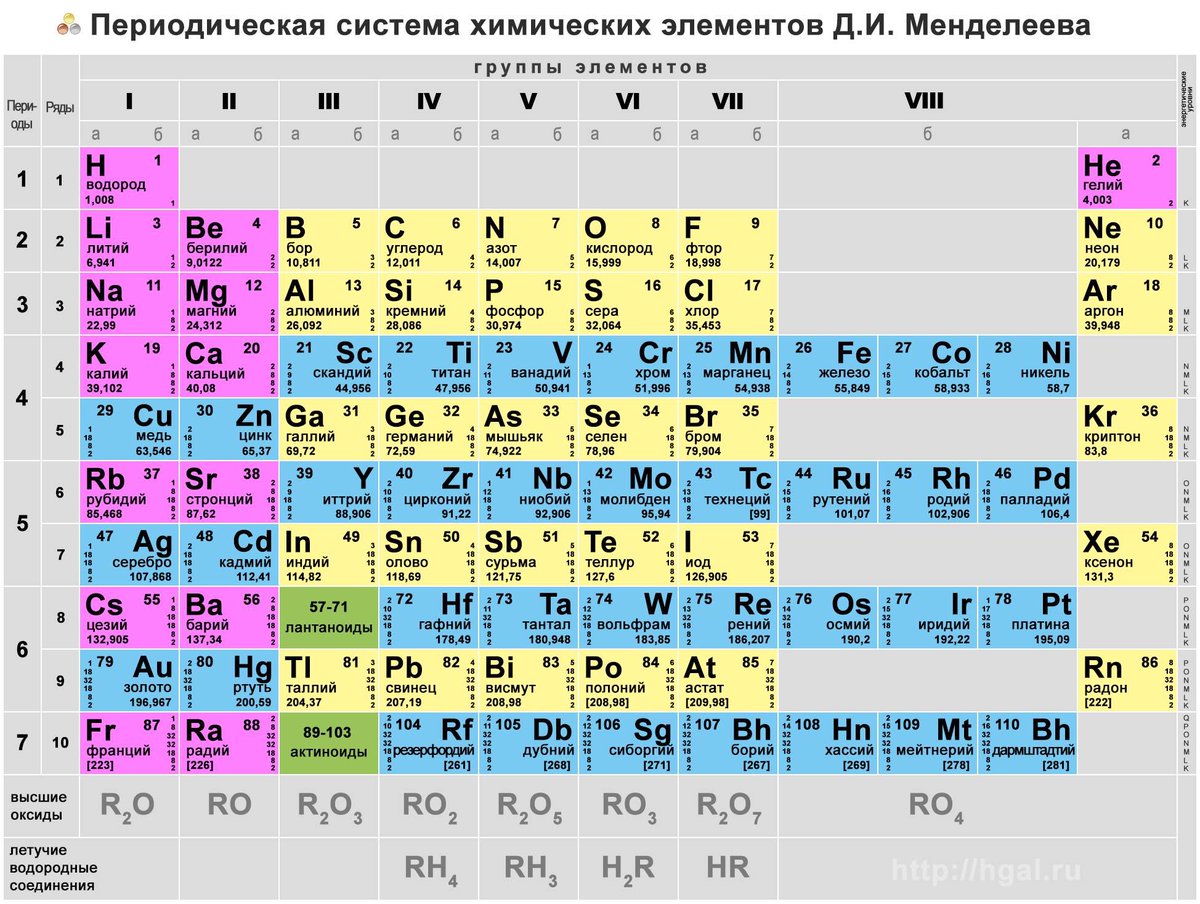 И. Менделеева был фальсифицирован.
И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности» («Попытка химического понимания мирового эфира». 1905 г. , стр. 27).
, стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Скачать статью В.Г. Родионова
Настоящая таблица Менделеева. Рыбников Юрий Степанович.
Запретная Физика. Теория Эфира
Полное видео лекции тут: Фальсификация таблицы Менделеева
Источники: 1, 2, 3, 4
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами – фононами в кристаллах.
Оригинал у digitall_angell
Периодическая система Менделеева • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Господин Менделеев не знал, а его последователи узнали, но начисто позабыли или антинаучно проигнорировали то, что атомы есть комплементарные пары из взаимно дополнительных вложенных друг в друга фундаментальных сущностей вещества: ядер атомов как внутренней сущности и электронных облаков как внешней сущности. Иначе говоря, атомы есть фракталы вложенностей – матрёшки.Отсюда следует, что на самом деле натуральный ряд элементов представляет собой не один ряд элементов, а два комплементарных ряда фундаментальных сущностей вещества – ядер атомов и электронных облаков!
Следующий грубейший научный промах Менделеева и его последователей: начало каждого периода щелочным металлом и окончание благородным газом. Ведь в первом периоде Периодической системы элементов в редакции Менделеева до 1902 года первым являлся не щелочной металл, а неметалл химически активный двух атомный газ водород, имеющий крайне низкую температуру кипения! В то время, как во всех последующих периодах первым был элемент группы щёлочноземельных металлов. Прокол в Периодической таблице элементов жутчайший! А в периодической таблице элементов в редакции Менделеева от 1902 и 1906 годов первым элементом в периодах являлся элемент группы благородных газов.
Правильные, естественные окончания абсолютно каждого периода атомного мира материи является не благородный газ, а щёлочноземельный металл – по Мейеру Ю.Л. (приоритет от 1862 года на правильное окончание периодов на элементе группы щёлочноземельных металлов), Менделееву Д.И. (приоритет от 1869 и 1870 годов на правильное предсказание свойств нескольких не известных тогда элементов и исправление атомных масс нескольких известных элементов, а также на формулировку формулы периодического явления, ошибочно названного и до сих пор ошибочно считающегося периодическим законом, и приоритет от 1902 года на гипотезу о двух элементах материального эфира – ньютония и корония, предшествующих водороду), Веберу А. (приоритет от 1905 года на идею отображать каждый из всех периодов одним рядом), Жанету Ч. (приоритет от 1928 года на отображение каждого из всех правильных периодов одним рядом), Резерфорду Э. (приоритет от 1911 года на правильное объяснение устройства атомов из компактного электростатически положительно заряженного ядра и обширного электростатически отрицательного заряженного электронного облака), Мозли Г. (приоритет от 1913 года на экспериментальное, по рентгеновскому спектру, доказательство того, что номер элемента равен количеству протонов я ядре атома или количеству электронов в электронном облаке не ионизированного атома), Бору Н. (приоритет от 1913 года на идею о стационарных орбитах не возбуждённых электронов в оболочках слоёв электронного облака атома), и Макееву А.К. (приоритет от 2000, 2010, 2013 годы на пакет свыше 20 настоящих периодических законов и фундаментальных научных положений, описывающих строение и порядок формирования электронного облака атома по мере роста электростатического заряда ядер атомов; на расширение периодической системы элементов перед водородом на 10 элементов вакуумных уровней материи; создание модели строения материи вакуума и фотона, теоретического доказательства того, что кванты электростатического и магнитного полей в составе материи фотона в их векторах движения имеют скорость в корень квадратный из двух раз быстрее движения всей системы материи фотона в его векторе движения)!
Тогда мировой науке официально следует принять то что первый правильный (естественный) период атомных уровней материи содержит 4 элемента, которые радикально отличаются друг от друга по физическим и химическим свойствам: водород (химический активный двух атомный газ), гелий (химически инертный одно атомный газ), литий (химически активный щелочной металл) и бериллий (химически активный щёлочноземельный металл-металлоид). Поэтому последние 4 элемента каждого последующего правильного (естественного) периода позиционно аналогичны неметаллу химически активному подобному галогенам двухатомному газу водороду, неметаллу химически инертному одноатомному газу гелию, химически активному щелочному металлу литию и химически активному щёлочноземельному металлу бериллию!
В Матрице автоматизма материи – периодической таблице элементов вакуумных и атомных уровней материи Мейера, Жанета и Макеева проявляется очень важный запрет-закон Макеева, не замеченный Паули – запрет каждому слою электронного облака атома заполнять больше чем одну его оболочку в пределах каждого такого естественного периода, в котором этот слой заполняется электронами.
Смотрите подробности здесь:
1. Makeyev A.K. Julius Lothar Meyer was first which built the periodic table of elements // Eropean applied sciences, April, 2013, 4 (2) – pp. 49-61. ISSN 2195-2183
2. Макеев А.К. Система естественных циклов автоматизмов материи. Материалы 1-ой международной научно-практической конференции “Перспективы развития естествознания в 21 веке” // Апробация. Ежемесячный научно-практический журнал, № 2, 2012. 110 с., С. 88-100. ISSN 2305-4484
3. Макеев А.К. Частицы электростатического и магнитного полей в системе материи фотона движутся намного быстрее, чем движется сам фотон. // Научная дискуссия: материалы IV международной заочной научно-практической конференции. Часть I. (20 августа 2012) – Москва: Изд. “Международный центр науки и образования”, 2012. 142 с., С. 47-65. ISBN 978-5-905945-37-3 УДК 08. ББК 94. Н 34. http://www.internauka.org/node/479
4. Макеев А.К. Матрица автоматизмов материи и матрица элементарных артикуляций в каркасе голограммы всезнания // Научно-техническая библиотека. 27 марта 2013. 84 с. http://www.sciteclibrary.ru/rus/catalog/pages/12751.html
Кстати, авторитет и приоритет России, как родины фундаментальной азбучной истины физикохимии – Естественной системы элементов нисколько не пострадал! Ведь автором этой “периодической таблицы” элементов в правильных границах всех периодов и пакета из более чем двадцати настоящих периодических законов и фундаментальных научных положений является гражданин России, москвич Макеев Александр Константинович, врач и мультидисциплинарный исследователь и изобретатель, с приоритетом от 2000 года! В соавторстве с немецким врачом, физиком и химиком Мейером Юлиусом Лотаром, с приоритетом от 1862 года. И в соавторстве с французским инденером и учёным, предпринимателем Жанетом Чарльзом, с приоритетом от 1928 года.
Менделеева по справедливости не наградили Нобелевской Премией в 1906 году. Ведь его Периодическая таблица химических элементов грубо не верна в окончаниях всех периодов! Он даже не смог сформулировать ни одного настоящего периодического закона!
Теперь Комитет по присуждению Премии им. Альфреда Нобеля может с чистой душой, не опасаясь проявления со временем подвоха, присудить свою высокую Премию настоящему создателю Естественной системы элементов и открывателю целого пакета настоящих периодических законов россиянину Макееву Александру Константиновичу! Ау, нынешние Нобелевские Лауреаты, имеющие на то право, замолвите словечко в Нобелевский Комитет, пожалуйста!
Менделеева первоначальная – Справочник химика 21
Теория электролитической диссоциации Аррениуса в своем первоначальном виде имела ярко выраженную механистическую окраску. Положения теории игнорировали химические отношения в растворах и подчеркивали чисто физические ее основы. К тому же, появление теории Аррениуса относится к периоду, когда в химии еще господствовало эмпирическое направление исследований (особенно в области органической химии), а связи химии с физикой только-только еще устанавливались. Сам Аррениус, считавший себя физиком, противопоставлял теорию электролитической диссоциации химическим теориям и прежде всего гидратной (химической) теории растворов Д. И. Менделеева . Менделеев же, вместе с многочисленными сторонниками своих воззрений полагал, что существование его гидратной теории исключает необходимость в создании особой теории электролитической диссоциации. [c.425]В первоначальной таблице Менделеева было помещено 63 химических элемента. Сейчас их известно 105. Из 42 элементов, открытых после 1869 г., Менделеев предсказал существование по крайней мере 20. В частности, Менделеев предусмотрел места, где сейчас расположены франций, скандий, галлий, германий, гафний, полоний, астат, технеций, рений, радий, актиний, протактиний и некоторые редкоземельные элементы. Он также разместил сам инертные газы, существо-ваниг которых вначале не предполагал. Свойства некоторых элементов Менделеев предсказал с удивительной точностью. Это предсказание было основано на правиле атом-аналогии, установленном самим Менделеевым. Сущность этого правила заключается в том, что физические константы (включая и атомные массы) элемента определяются как среднеарифметические значения из констант его ближайших четырех соседей. На основе того же принципа Менделеев предсказывал наиболее существенные химические свойства. Для названий не открытых еще элементов Менделеев предложил приставки, заимствованные из санскритского языка. Например, экабор, экакремний, экацезий, экаиод, экамарганец, двимарганец и т. д.
КЬ = 104,4, РЬ = 197,4 (см. ст. 1 и 2, стр. 9 и 23 в основном томе). В ст. 3 и 4 этого уже не делается, равно как и в ст. 5 и 6. Но в примечании к ст. 7 (стр. 167 в основном томе) вновь указывается, что возможными аналогами Мп окажутся Ки и Оз, которые займут соответственные места в гр. VII системы элементов. На ф. 23 видно, что Менделеев первоначально записал КЬ в одну подгруппу о Мп, но затем вычеркнул его и перенес ниже, поставив между N1 и Ое. В оригинале таблицы ф. 22) имеются дефекты и повреждения, вследствие чего цифры атомного веса экаалюминия (68) получились не полностью, а цифры атомного веса экасилиция (72) отсутствуют вовсе. [c.616]
Первоначально Д. И. Менделеев назвал железо, кобальт и никель переходными элементами. Как изменилось понятие переходные элементы в наше время Какие основные признаки характеризуют это понятие Дайте современное определение переходных элементов.
Успешное решение структурно-молекулярных вопросов во многом зависело от разработки эффективных методов разделения смол и асфальтенов — этих сложных гетерогенных смесей, на более простые группы близких по составу и строению веществ. Еще Д. И. Менделеев настойчиво пропагандировал и сам применял в своих опытах физические методы разделения и исследования нефтей. В статье По нефтяным делам , опубликованной в 1885 г., он писал, что …химический состав нефти не может быть иначе определяем, как при помощи первоначального физического разделения составных начал нефти на основании их летучести и различия в температуре кипения, растворимости и тому подобных свойств [1, с. 426], и далее …я убедился, что важнейший и новый материал лабораторные точные исследования нефти могут дать именно со стороны физического анализа нефти [1, с. 428]. [c.90]
В то же время Д. И. Менделеев предполагал, что образование нефти происходит глубоко в земной коре в результате действия воды на карбиды металлов. Углерод карбидов и водород, входящий в состав воды при этих реакциях, превращаются в углеводороды, которые в газообразном виде поднимаются по трещинам в земной коре в верхние более холодные слои. Пары жидких углеводородов здесь конденсируются, образуя в пористых пластах залежи нефти. В. Д. Соколовым была выдвинута космическая гипотеза происхождения нефти, согласно которой углеводороды находились в первоначальном земном газовом облаке и были поглощены при образовании земной коры. [c.67]
Разложение углеводородов при высокой температуре без доступа воздуха было известно еще в прошлом столетии. В 1875 г. ассистент Петербургского технологического института А. А. Летний, изучая действие высокой температуры на тяжелые нефти, установил, что при этом образуются летучие продукты (бензин). Д. И. Менделеев неоднократно указывал на необходимость изучения действия высокой температуры на тяжелые нефтяные масла, отмечая, что они претерпевают при этом изменения, и среди образующихся продуктов найдутся технически важные и полезные. В 1885 г. в Баку была построена установка для получения керосина путем нагрева нефтяных остатков. Промышленные крекинг-установки для получения бензина из нефтяных фракций стали строить в США, начиная с 1913 г. Первоначальные способы термической переработки нефти и применявшаяся для этого аппаратура подвергались в дальнейшем различным усовершенствованиям. В Советском Союзе первые крекинг-установки системы Виккерса были построены в Баку в 1927—1928 гг. [c.269]
В некоторых случаях Д. И. Менделеев расположил элементы в соответствии с закономерным изменением свойств, предполагая возможную неточность значений их атомных масс (Оз, 1г, Р1, Аи, Те, I, N1, Со). Этим была поставлена задача уточнения атомных масс указанных элементов, и для некоторых из них атомные массы были исправлены. Первоначально казалось, что открытие благородных газов нарушит периодичность изменения свойств элементов, однако затем были открыты остальные благородные газы, которые хорошо вписались в периодическую систему. [c.29]
Количественной оценки содержания элементов в земной коре Менделеев в то время не мог привести но современная наука располагает цифрами, характеризующими количества элементов в земной коре в процентах по весу. Эти весовые количества элементов принято называть весовыми кларками. Первоначально установленные кларки постоянно пополнялись и пересматривались рядом ученых, из которых особенно следует упомянуть В. И. Вернадского, А. Е. Ферсмана, А. П.” Виноградова, В. Г. Хлопина и др., а из зарубежных ученых — Кларка, Гольдшмидта, Вашингтона, Хевеши. [c.7]
Такое предположение все же не является единственно возможным Наличие в нефти веществ растительного и животного происхождения можно также объяснить тем, что нефть, образовавшаяся вначале неорганическим путем, например из карбидов металлов и воды (Д И Менделеев), могла в дальнейшем растворять органические вещества, не имеющие никакого отношения к ее первоначальному происхождению. [c.31]
В 1871 г. Менделеев формулирует периодический закон свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса. Он разрабатывает новый, клеточный вариант таблицы, которую называет естественной системой элементов. В этом варианте, в отличие от первоначального, Менделеев все элементы разделяет на восемь групп номер [c.74]
Наглядным процессом перехода гипотезы в закон, от одного уровня знаний к другому, более высокому, служит открытие и утверждение периодического закона. Первоначально положение о периодической зависимости свойств элементов от их атомного веса Менделеев сам рассматривал как гипотезу. Он прекрасно понимал, что выдвинутое им положение, хотя и в высшей степени вероятное, не будет являться законом, а будет считаться гипотезой до тех пор, пока его не проверили. Каков же путь проверки Утверждение закона возможно только при помощи вывода из него следствий, без него невозможных и не ожидаемых, и оправдания тех следствий в опытной проверке. Поэтому-то, увидев периодический закон, я со своей стороны (1869—1871) вывел нз него такие логические следствия, которые могли показать — верен он или нет . [c.296]
Чтобы придать наглядность тому или иному закону, мы выражаем его в виде (двухмерного) графика нередко график даже предшествовал открытию закона. Но при всем значении в науке графических методов нельзя забывать, что 1) чем сложнее закон, тем труднее поддается он графическому изображению, и на известном этапе сложности закона (например, при функциональной связи четырех переменных величин) услуги геометрии как вспомогательного аппарата химии и физики оказываются исчерпанными 2) одному и тому же закону можно придать различные графические выражения (например, меняя прямоугольную систему координат на косоугольную, угловую и т. д.). Этим объясняется появление сотен периодических таблиц, предлагавшихся разными авторами однако наиболее многосторонне и наглядно периодический закон изображается прямоугольной таблицей, представляющей — с малыми изменениями — первоначальную таблицу Менделеева (см. стр. 66). Впрочем, уже сам Менделеев наряду с так называемой короткой формой периодической таблицы приводил и длинную форму ее. [c.65]
В первоначальном варианте таблицы Менделеева групп было восемь. Номер группы (I, П, И1,. .., VHI) соответствовал высшей валентности элементов в кислородных соединениях. После открытия инертных газов (в 90-х годах прошлого века) Д. И. Менделеев прибавил в систему элементов девятую группу — нулевую — в соответствии с валентностью этих элементов, равной 0. [c.106]
Теоретические представления Менделеева о растворах обычно называются гидратной теорией растворов. Менделеев придерживался при объяснении свойств растворов химической трактовки процессов растворения и сольватации растворенных веществ. Он был противником первоначальной теории электролитической диссоциации С. Аррениуса и В. Оствальда. Гидратная теория Менделеева представляет собой крупное научное обобщение. Она получила особенно большое значение при разработке новейших теорий растворов. [c.374]
Только подготовка полноценных технических кадров, говорил он, может решить задачу подъема промышленности страны, внедрения широких теоретических обобщений в технологию, а это в свою очередь даст возможность дополнить эмпирический подход рационализмом и избежать ползучего эмпиризма. Чинить и даже строить мосты, лечить и совершать другие практические дела можно, конечно, к по рецептам, говорил Менделеев, но многолетний жизненный опыт показывает, что практические дела можно наиболее успешно решать, только исходя из общих начал, только при знакомстве с абстрактами, до них относящимися, с теми интегралами, атомами и невидимыми движениями, прямую пользу которых первоначально вовсе не улавливают. Только абстракт, соединенный с проверенными опытами и наблюдениями, дает уверенность в предстоящем еще невидимом результате, в ожидаемом, как в настоящем… В этом сочетании конкретного, или действительного, с абстрактным, или отвлеченным и должно видеть настоящий смысл высших учебных заведений и главную трудность их прохождения, состоящую поэтому преимущественно в согласовании слова (отвлечений, абстрактов) с делом (действительностью, конкретом) и в умении, насколько то доступно людям, предвидеть предстоящее на основании существующего и прошлого [c.79]
Законы сохранения вещества и сохранения энергии или вечности сил, движения, Менделеев считал основой науки о веществе. На этой основе, говорил он, могут рождаться гипо-тические представления о природе вещества, которые должны,, по меньшей мере, удовлетворять известным законам. Так, атомистическая гипотеза даже в своем первоначальном виде, даже у Демокрита, поясняет Менделеев, полностью соответствует закону вечности вещества, однако не гипотеза вызвала закон вечности вещества, хотя она появилась за много столетий до того, как был найден этот закон. Наоборот,— пишет великий химик,— лишь после утверждения закона вечности вещества… атомистическое учение стало укрепляться в сознании и прилагаться в научных исследованиях о веществе °. [c.124]
Первоначальное понятие о силе, говорил Менделеев, получается из личного опыта и из знакомства с силами животных, и только затем является отвлеченное понятие о силах вообще или об энергии . Менделеев замечает также, что при формировании понятия сила , вначале познается видимая, т. е. механическая сила, а затем и силы скрытые или молекулярные, т. е. прямо не видимые и непосредственно не ощущаемые. То же самое и в приложении. Сперва все делается работою людей и лошадей, потом силою ветра и воды, далее силою тепла в паровых и других термических машинах, а под конец силою электрическою и химическою [c.160]
Не соглашаясь с теми, кто искусственно противопоставляет виды промышленности друг другу, Менделеев доказывал, что в союзе с промышленностью и наукой сельское хозяйство постепенно, после долгих эволюций (т. е. последовательных форм развития), изменит свою первоначальную форму и постепенно приблизится к индустриальной форме. [c.172]
Менделеев пони.мал, что путь от первоначальной гипотезы к истине лежит через эксперимент, через проверку ее в опыте. Так, характеризуя свое открытие производной с15/с1р в растворах, он писал, что любое первоначальное объяснение будет сперва гипотезой, могущей превратиться в истину только после проверки. Надобно ясно отличать правду действительности от истины умозаключения,— подчеркивал он.— Разрыв сплошности производной ёз/с1р есть правда, в которой легко убедиться опытом, объяснение же его причины есть гипотеза, могущая стать истиною лишь после долгих новых проверок [c.202]
В самом деле, стоит только посмотреть на таблицу, приведенную в статье, Менделеевым, чтобы заметить, что он объединил в каждом ряду резко несходные элементы. И это сделано им неслучайно. Не могу не обратить внимания также на то,— пишет Менделеев,— что в низших членах рядов, сравнительно с высшими, заметна большая резкость и ясность свойств и реакций. Это подобно тому, что мы замечаем в ряду органических гомологов в высших членах гомологических рядов сглаживаются некоторые особенности, принадлежащие ряду так, напр., парафин, который относили первоначально к ряду этилена, можно с такою же (и, конечно, большею) справедливостью относить и к ряду болотного газа, потому что в столь высоких гомологах никаких резких особенностей ни в том, ни в другом ряду нельзя подозревать. Точно так же сглаживаются особенности простых тел, резко выставляющиеся в первых столбцах, в последнем столбце, образованном самыми тяжелыми элементами. Свинец, таллий, висмут, золото, ртуть, платина, иридий, осмий и вольфрам не только суть мало энергические элементы, но в то же время все суть элементы тяжелые, из которых можно даже во многих отношениях составить одну группу, не нарушая притом первых требований аналогии. Таллий и висмут в этом отношении стоят, однако, между собою дальше, чем свинец к таллию или висмут к золоту, ртути и платине. Притом элементы, стоящие ниже галоидного [c.298]
Соединяясь друг с другом, галоиды, как и щелочные металлы, образуют в химическом отношении непрочные соединения. Следовательно, говорит Менделеев, те и другие, соединяясь с себе подобными, образуют мало характерные соединения, обладающие свойствами составных частей, в них входящих. Соединяясь же со щелочными металлами (как единство противоположностей), галоиды образуют прочные во всех отношениях тела, в которых первоначальные свойства галоидов и щелочных металлов совершенно исчезают. Образование таких соединений сопровождается большим выделением тепла и глубоким изменением в физических и химических свойствах. [c.313]
Менделеев видел, что скачки имеют самые различные формы, что совершаются они самыми разнообразными способами. Это можно установить хотя бы из описания изменений, происходящих в свойствах в связи с изменением массы. По мере возрастания массы,— писал ученый,— сперва свойства последовательно и правильно изменяются, а потом возвращаются к первоначальным, и опять начинается новый, подобно прежнему, период изменения свойств. Тем не менее здесь, как и в других явлениях, есть случай, когда малое изменение массы атома влечет малое изменение свойств, определяет различия второго порядка это видно, напр., в УП1 группе… так, атомные веса Ре, Со и N1, Ни, НЬ и Рс1, Оз, 1г и очень близки между собою, но и свойства их очень близки, различия иногда два уловимы [c.336]
Ве = 14 между литием Ы=7 и бором В = 11 было неестественным, как и положение алюминия А1=27,4 между натрием Ка = 23 и магнием Мд = 24. Поэтому Менделеев снял с первоначально отведенного ему места алюминий и перенес его на пустовавшее до тех пор место между кремнием 81 = 28 и магнием. Для бериллия же открывалось свободное место между В = 11 иЫ = 7 —в ряду с магнием, но при условии, что его атомный вес будет изменен на такое значение, которое окажется промежуточным между значениями 7 (для лития) и 11 (для бора). Но так как при переносе сюда бериллия он оказался бы аналогом не алюминия, а магния, то для его окиси следовало бы в таком случае принять не глиноземную, а магнезиальную формулу — ВеО. [c.11]
В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет.Менделеев продолжает дальнейшую творческую разработку периодической системы элементов. В V111 издании Основ химии был помещен следующий вариант системы, который следует рассматривать как итог работы Менделеева в развитии периодического закона (табл. 25). [c.79]
Мы начнем с урана, а не с индия, хотя сам Менделеев ставил впереди, как мы уже видели, индий, а не уран, вероятно, потому, что индий был первым элементом, исправленный атомный вес которого получил опытное подтверждение. Однако, как увидим далее, индий занял при этом то самое место в периодической системе (между кадмием и оловом), которое первоначально Менделеев отвел урану [c.43]
Сущность периодического закона. Исследуя изменения свойств химических элементов, расположенных в ряд ио возрастаюн1им значениям их атомной массы, Менделеев установил, что сходные в химическом отношении элементы встречаются через правильные промежутки (числа элементов) и, таким образом, одни и те же свойства периодически повторяются в этом ряду. На этом основании Менделеев н вывел периодический закон, или, как он его назвал, закон периодичности, который сформулировал первоначально следующим образом [c.35]
Изучение распространенности химических элементов в природе началось в первой половине XIX столетия. Большое внимание этому уделяли классики геохимии Ф. Кларк, В. М. Гольдшмидт, В. И. Вернадский, А. Е. Ферсман. Уже первые анализы горных пород позволили установить ряд эмпирических закономерностей распространения химических элементов. Д. И. Менделеев впервые отметил, что в природе более распространены элементы начала построенной им таблицы, а более редкие находятся в ее конце. Позже было установлено, что преобладают четные элементы таблицы по сравнению с нечетными. Эта закономерность, как известно, получила название правила Оддо— Гаркннса. Изучение химического состава метеоритов, а впоследствии и состава звездных атмосфер с помощью спектрального анализа показало, что главные особенности распространения элементов или, вернее, основные черты первоначальной распространенности их в Солнечной системе в значительной мере являются общими для космических тел Галактики и Земли. В настоящее время не вызывает сомнения то обстоятельство, что главные особенности распространения элементов определяются ядерными свойствами их атомов. Поэтому для выяснения более детальных особенностей распространения элементов важно знать распространенность не только их самих, но и отдельных ядерных, видов — изотопов. Этот вопрос рассмотрен в главе, посвященной геохимии изотопов. [c.71]
Первоначальный вариант периодической системы Д. И. Менделеева имел длинную форму. (На втором форзаце книги этот вариант приведен в современном оформлении.) В декабре 1870 г. Д. И. Менделеев опубликовал короткую форму периодической системы. (На первом форзаце книги приведен вариант короткой формы таблицы.) Д. И. Менделеев отдавал преимущество короткому варианту. До настоящего времени продолжают поступать предложения о новых вариантах таблицы периодической системы элементов. Их известно уже несколько сотен. Но наилучшими из них, четко и глубоко передающими периодический закон, остаются вариагньг Д. И. Менделеева. [c.75]
Понятие о химическом элементе. Необходимость четко различать понятия элемент и простое вещество впервые отметил Д. И. Менделеев. Полезно сделать ясное различие между понятием о простом теле как об отдельном однородном веществе ио нем же как о вещественной части или элементе сложных вещестЕ . Можно дать первоначальное определение понятия элемента химический элемент есть вид атомов, входящих в состав простых и сложных веществ, характеризующийся определенной совокупностью свойств. [c.6]
Элементы, расположенные в порядке возрастания атомных весов, проявляют закономерное изменение химических свохктв. Если изять первые два и затем последующие восемь элементов, то этп изменения сводятся к периодическому убыванию и возрастанию соответствующих свойств элементов [1]. Такая картина повторяется в дальнейшем аналогичным образом. Элементы распределяются по девяти группам и семи периодам, последний из которых, очевидно, незакончен (табл. 1). Из рассмотренпя химических свойств следует, что расположение в порядке возрастания атомных весов нарушается в случае аргона и калия, кобальта и нпкеля, теллура и пода, тория и протактиния. Менделеев первый составил современную таблицу элементов, п она указывала на отсутствие значительного числа элементов подлинным триумфом периодического закона было иредсказание Менделеевым свойств недостающих элементов, которые были вскоре открыты. Более того, целая группа элементов, открытая Рамзаем (пулевая группа), уложилась в первоначальную систему. Необходимо отметить, что число элементов в законченных периодах равно 2, 8, 8, 18, 18 и 32 или 2Хп , где п последовательно принимает значения 1, 2, 3 и 4. Из табл. 1 и 2 видно, что лишь немногие элементы имеют целочисленные атомные веса по отношению к кислороду, атомный вес которого был принят за 16,0000, хотя для легких элементов отклонения от целочисленных значений часто очень невелики. Не только сами атомные веса, но и их отклонения от целочисленных величин имеют большое теоретическое значение. [c.187]
Оболочечная структура электронных состояний атомов, следуюшая из законов движения электронов, объясненных квантовой механикой, была в некоторой степени предугадана замечательным русским химиком Менделеевым в 1868 г., т. е. задолго до появления квантовой механики, Менделеев открыл периодический закон химических элементов, который он выразил в виде таблицы апериодической системы элементов по группам и рядам . Периодическая система элементов Менделеева состоит из десяти горизонтальных рядов, которые составляют семь периодов, и девяти групп (вертикальных столбцов), в которых один под другим расположены сходные между собой элементы. Первоначальная таблица Менделеева содержала только восемь групп, так как инертные газы в то время не были еше известны. Произведенное Менделеевым размещение элементов в периодической системе оказалось полностью отражающим строение атомов, найденное современной квантовой механикой. Каждому периоду системы элементов Менделеева соответствует одна электронная оболочка в атоме. [c.361]
Шведский ученый был одним из первых классиков в области определения атомных весов, и ему принадлежит заслуга установления атомных весов церия и иттрия, равно как и формул их окислов. Первоначально он рассматривал иттриевую и цериевую земли как двуокиси, имеющие соответственно формулы YO, и СеОг , кроме того, он приписывал высшему окислу церия формулу СеОз. Однако позднее ученый изменил свою точку зрения. На основании законов изоморфизма и правила атомных теплоемкостей Дюлона — Пти Берцелиус доказал существование полуторной окиси СегОз. Вопрос теперь заключался в следующем считать ее высшим или низшим окислом церия. Вряд ли Берцелиус мог предугадать, сколь многое будет зависеть от решения этого вопроса в дальнейшем, когда Менделеев столкнется с необходимостью разместить известные редкие земли в своей периодической системе. Берцелиус принял СегО за высшую окись, и низшие окислы получили формулы Y0 и СеО. Так могучий авторитет Берцелиуса заставил ученый мир признать, нет, скорее, поверить в двухвалентность редких земель тем самым был брошен первый камень в будущее русло развития периодической системы элементов. [c.13]
Новый этап в познании более глубокого порядка сущности химических веществ связан с открытием периодического закона. Это нашло свое отражение в дальнейшем развитии и углублении понятия валентности. До этого многие ученые (Кекуле, Вюрц и другие) считали валентность элемента в химических соединениях постоянной и неизменной. Вюрц, нанример, первоначально предполагал, что хлор всегда только одновалентен. Менделеев показал, что его валентность меняется. Она качественно различна в соединениях элемента с водородом и с кислородом. Так, С1 в НС1 одновалентный, отрицательный, а в СЬО и I2O7 соответственно одно- и семивалентный, положительный. [c.256]
Комплексные соединения первоначально изучались преимущественно в с1 андинавских странах, где сохранились традиции замечательного шведского химика Берцелиуса. Особенно существенную роль сыграли исследования Бломстранда, Клеве и Иергенсена. В конце XIX в. центр по изучению комплексных соединений переместился в лабораторию Вернера (Цюрих). После Великой Октябрьской социалистической революции обширные систематические исследования в области комплексных соединений ведутся в Советском Союзе. Это в особенности относится к комплексным соединениям платиновых металлов. Необходимость и важность развертывания исследовательских работ в этом направлении постоянно подчеркивал Д. И. Менделеев. Следует отметить, что в классическом труде Д. И. Менделеева Основы химии имеется ряд ценнейших соображений относительно причин образования, строения и свойств комплексных соединений. Принципиа.льно важные комплексно-химические работы были уже в конце прошлого века выполнены акад. Н. С. Курнаковым 1 . Особенно важную роль -в смысле создания центра по изучению комплексных соединений сыграла деятельность советского химика проф. Л. А. Чугаева который не только сам выполнил ряд классических исследований в этой области, но и создал советскую школу комплексистов, успешно развивающуюся в настоящее время. [c.10]
Составив первый набросок системы элементов, Менделеев сразу же увидел, что значение таблицы далеко выходит за пределы тех скромных задач, реализация которых и привела к созданию таблицы (которая должна была служить основой плана второй части курса химии). Уже из приведенных только что выдержек из первого сообщения о таблице видно, какие разнообразные выводы Менделеев сделал из таблицы. Об особой важности, придававшейся Менделеевьш таблице, свидетельствует и то обстоятельство, что он отложил дальнейшую работу над второй частью Основ химии и переключился на исследования с целью решения различных вопросов, возникших у него как в связи с замеченными закономерностями, вытекающими из сделанных сопоставлений, так и с несообразностями, которые имелись в первоначальной таблице. [c.384]
Первоначально Винклер принял вновь открытый элемент за аналог сурьмы. Однако после опубликования сообщения об этом открытии Менделеев и одновременно с ним В. Рихтер и Л. Мейер сообщили Винклеру, что открытый им элемент является в действи- тельности экасилицием, что впоследствии подтвердилось исследованиями самого Винклера. Винклер просил Менделеева дать согла- сие назвать вновь открытый элемент германием (в честь родины исследователя), на что Мендлеев прислал положительный ответ. Менделеев придавал большое значение открытию германия — последнего из подробно описанных им трех неизвестных элементов, так как германий, находясь в окружении хорошо изученных элементов и занимая среднее положение в периодической системе, способствовал проверке всей теории ученого [7]- [c.163]
Впервые К. с. наблюдал Каньяр де ла Тур (1822).Существование критической температуры первоначально установил Д. И. Менделеев (1860), к-рый назвал ее темп-рой абс. кипения. Диаграмму равновесия жидкость — пар для СОг, включавшую критич. точку, впервые опубликовал Т. Эндрюс (18fi9). Термодинамич. теорию К. с. разработал Дж. Гиббс (1 8 76). [c.433]
Историческое значение того или иного мыслителя измеряется его заслугами перед родиной, его человеческое достоинство — силой его патриотизма, учил И. Г. Чернышевский. Этому завету Чернышевского и следовал Менделеев — великий-продолжатель традиций Ломоносова. Любовь к отечеству, патриотиз.м, говорил он, составляет одно из возвышеннейших, отличий развитого, общежитного (общественного.— П. И.) состояния людей от их первоначального дикого или полуживот-НОГО состояния 0. [c.110]
Менделеев, правильно признавая вечную эволюцию хмате-рии, иногда абсолютизировал наиболее устойчивые категории, как, например, сущность вещей, общие законы. Изучая явления природы,— писал он в Основах химии ,— неизбежно прийти к понятию о том, что всюду царствующее подвижное равиовесие (между противоположными изменениями, напр., возрастаниями и уменьшениями, ускорениями и замедлениями и т. п.) составляет главную причину того стройного порядка, который поражает наблюдателей природы. Нередко мы не видим регуляторов порядка и стройности… поразительно именно то обстоятельство, что первоначально искали, и в случайных (недостаточно точных и отрывочных) наблюдениях даже находили условия для отсутствия стройного, строгого однообразия, а когда убедились в его господстве, нашли и регуляторов порядка… Изменения в частностях при этом, конечно,, возможны местные и временные, но общее сохраняется, и если [c.210]
Ясно что периодический закон Менделеев открыл, руководствуясь не однИ М только методом индукции. Он анализировал и обобщал прежние достижения физики и химии, исследовал попытки своих предшественников систематизировать химические элементы. Изучая старые классификации, Менделеев тут же синтезировал свои наблюдения, анализировал и синтезировал противоположные свойства химических элементов. Он различал химические элементы по их изменяющимся свойствам и одновременно синтезировал их в группы, разлагал общие групповые свойства и вскрывал закономерности изменения свойств. В периодической системе Менделеев дедуцировал свойства элементов из свойств предшествующих и последующих элементов как в ряду, так и в группе. Ни один из его предшественников не мог дойти до открытия периодического закона по той причине, что все они пользовались только индуктивным методом. Петтенкофер, Ленссен и другие ученые, основываясь на индукции, объединили элементы лишь в отдельные несвязные группы. Для Менделеева дедукция является не менее важным методом научного познания, чем индукция. Свой метод он противопоставлял одностороннему синтезу, не основанному на анализе. Он писал, что древние мыслители хотели сразу охватить самые основные категории изучения и потому не добились цели. Первоначальные обобщения, как показывает история науки, не опираются, говорил Менделеев, на точные данные, оттого они весьма шатки. [c.214]
История периодической таблицы
В 1669 Немецкий торговец и алхимик-любитель Хенниг Бранд попытался создать Философский камень ; объект, который якобы мог превращать металлы в чистое золото. Он нагрел остатки кипяченой мочи, и жидкость вылилась и загорелась. Это было первое открытие фосфора.В 1680 Роберт Бойль также открыл фосфор, и это стало достоянием общественности.
В 1809 было открыто по крайней мере 47 элементов, и ученые начали видеть закономерности в характеристиках.
В 1863 английский химик Джон Ньюлендс разделил тогда открытые 56 элементов на 11 групп, основываясь на характеристиках.
В 1869 Русский химик Дмитрий Менделеев начал разработку таблицы Менделеева, упорядочивая химические элементы по атомной массе. Он предсказал открытие других элементов и оставил для них свободные места в своей периодической таблице.
В 1886 французский физик Антуан Бекерель впервые обнаружил радиоактивность.Студент Томсона из Новой Зеландии Эрнест Резерфорд назвал три типа излучения; альфа-, бета- и гамма-лучи. Мари и Пьер Кюри начали работать над излучением урана и тория, а затем открыли радий и полоний. Они обнаружили, что бета-частицы заряжены отрицательно.
В 1894 сэр Уильям Рамзи и лорд Рэлей открыли благородные газы, которые были добавлены в периодическую таблицу как группу 0.
В 1897 Английский физик Дж.Дж. Томсон первым открыл электроны; маленькие отрицательно заряженные частицы в атоме. Джон Таунсенд и Роберт Милликен определили их точный заряд и массу.
В 1900 Бекерель обнаружил, что электроны и бета-частицы, идентифицированные Кюри, – это одно и то же.
В 1903 Резерфорд объявил, что радиоактивность вызвана распадом атомов.
В 1911 Резерфорд и немецкий физик Ганс Гейгер обнаружили, что электроны вращаются вокруг ядра атома.
В 1913 Бор обнаружил, что электроны движутся вокруг ядра с дискретной энергией, называемой орбиталями. Излучение испускается при движении с одной орбиты на другую.
В 1914 Резерфорд впервые идентифицировал протоны в атомном ядре. Он также впервые трансмутировал атом азота в атом кислорода. Английский физик Генри Мозли предоставил атомные номера, основанные на количестве электронов в атоме, а не на атомной массе.
В 1932 Джеймс Чедвик впервые открыл нейтроны и идентифицировали изотопы.Это была полная основа периодической таблицы. В том же году англичанин Кокрофт и ирландец Уолтон впервые расщепили атом, бомбардируя литий в ускорителе частиц, превратив его в два ядра гелия.
В 1945 Гленн Сиборг идентифицировал лантаноиды и актиниды (атомный номер> 92), которые обычно помещаются под периодической таблицей.
Источники
Манхэттенский проект
Википедия
150 лет назад периодическая таблица Менделеева началась с видения одного химика
У каждой области науки есть любимый юбилей.
Для физики это Principia Ньютона 1687 года, книга, которая ввела законы движения и гравитации. Биология отмечает Дарвина О происхождении видов (1859 г.) вместе с его днем рождения (1809 г.). Поклонники астрономии отмечают 1543 год, когда Коперник поместил Солнце в центр Солнечной системы.
Что касается химии, то ни один повод для праздника не превосходит происхождение периодической таблицы элементов, созданной 150 лет назад в марте этого года русским химиком Дмитрием Ивановичем Менделеевым.
Таблица Менделеева стала так же знакома студентам-химикам, как электронные таблицы – бухгалтерам. Он суммирует всю науку в примерно 100 квадратах, содержащих символы и числа. Он перечисляет элементы, из которых состоят все земные субстанции, расположенные таким образом, чтобы выявить закономерности в их свойствах, что определяет направление химических исследований как в теории, так и на практике.
Подпишитесь на последние новости
Science NewsЗаголовки и резюме последних научных новостей статей, доставленных на ваш почтовый ящик
«Периодическая таблица Менделеева, – писал химик Питер Аткинс, – возможно, является наиболее важным понятием в химии.”
Таблица Менделеева выглядела как специальная диаграмма, но он хотел, чтобы таблица выражала глубокую научную истину, которую он открыл: периодический закон. Его закон выявил глубокие семейные отношения между известными химическими элементами – они проявляли сходные свойства через равные промежутки времени (или периоды), когда они были расположены в порядке их атомного веса – и позволил Менделееву предсказать существование элементов, которые еще не были обнаружены.
«До обнародования этого закона химические элементы были лишь отрывочными, случайными фактами в Природе», – заявил Менделеев.«Закон периодичности впервые позволил нам воспринимать неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».
Таблица Менделеева не только предсказывала появление новых элементов. Это подтвердило тогдашнюю спорную веру в реальность атомов. Он намекнул на существование субатомной структуры и предвосхитил математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном итоге проявились в квантовой теории. Его таблица завершила трансформацию химической науки из средневекового магического мистицизма алхимии в область современной научной строгости.Таблица Менделеева символизирует не только составные части материи, но и логическую убедительность и принципиальную рациональность всей науки.
Заложить основу
Легенда гласит, что Менделеев задумал и создал свою таблицу за один день: 17 февраля 1869 года по русскому календарю (1 марта в большей части остального мира). Но это, наверное, преувеличение. Менделеев думал о группировке элементов в течение многих лет, а другие химики несколько раз рассматривали понятие взаимосвязи между элементами в предыдущие десятилетия.
На самом деле немецкий химик Иоганн Вольфганг Доберейнер заметил особенности в группировке элементов еще в 1817 году. В те дни химики еще не полностью осознали природу атомов, как описано в атомной теории, предложенной английским школьным учителем Джоном Дальтоном в 1808 году. В своей книге «Новая система химической философии » Дальтон объяснил химические реакции, предполагая, что каждое элементарное вещество состоит из определенного типа атома.
Химические реакции, предположил Дальтон, дают новые вещества, когда атомы разъединяются или соединяются.Он рассуждал, что любой данный элемент целиком состоит из одного вида атомов, отличающихся от других по весу. Атомы кислорода весили в восемь раз больше, чем атомы водорода; По мнению Дальтона, атомы углерода в шесть раз тяжелее водорода. Когда элементы объединяются, чтобы образовать новые вещества, количество, которое прореагировало, можно рассчитать, зная эти атомные веса.
Дальтон ошибался насчет некоторых весов – кислород действительно в 16 раз тяжелее водорода, а углерод в 12 раз тяжелее водорода.Но его теория сделала идею атомов полезной, что привело к революции в химии. Точное измерение атомного веса стало главной заботой химиков в последующие десятилетия.
Размышляя об этих весах, Доберейнер заметил, что определенные наборы из трех элементов (он назвал их триадами) обнаруживают своеобразную взаимосвязь. Бром, например, имел атомный вес посередине между весами хлора и йода, и все три элемента демонстрировали сходное химическое поведение.Литий, натрий и калий тоже были триадой.
Другие химики заметили связь между атомным весом и химическими свойствами, но только в 1860-х годах атомные веса были достаточно хорошо изучены и измерены для более глубокого понимания. В Англии химик Джон Ньюлендс заметил, что расположение известных элементов в порядке возрастания атомного веса приводит к повторению химических свойств каждого восьмого элемента – закономерность, которую он назвал «законом октав» в статье 1865 года.Но паттерн Ньюлендса не очень хорошо держался после первых двух октав, что побудило критика предположить, что ему следует вместо этого попытаться расположить элементы в алфавитном порядке. Очевидно, что соотношение свойств элементов и атомных весов было немного сложнее, как вскоре понял Менделеев.
Организация элементов
Менделеев родился в 1834 году в Тобольске в Сибири (17-й ребенок его родителей). Он жил разобщенной жизнью, преследуя множество интересов и путешествуя по запутанному пути к известности.Во время учебы в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни. После окончания школы он преподавал в средних школах (требование его стипендии в педагогическом институте) и, преподавая математику и естественные науки, проводил исследования для получения степени магистра.
Затем он работал наставником и лектором (наряду с некоторыми научно-популярными работами на стороне), пока не получил стипендию для длительной поездки по исследованиям в самых известных университетских химических лабораториях Европы.
Когда он вернулся в Санкт-Петербург, у него не было работы, поэтому он написал мастерский справочник по органической химии в надежде выиграть крупный денежный приз. Долгая попытка окупилась: в 1862 году ему была присуждена прибыльная Демидовская премия. Он также нашел работу редактором, переводчиком и консультантом в различных отраслях химической промышленности. В конце концов он вернулся к исследованиям, получив докторскую степень. в 1865 г., а затем стал профессором Петербургского университета.
Вскоре Менделеев начал преподавать неорганическую химию.Готовясь освоить эту новую (для него) область, он не был впечатлен имеющимися учебниками. Поэтому он решил написать свое собственное. Организация текста требовала систематизации элементов, поэтому он думал, как лучше их расположить.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов показывают регулярное увеличение атомного веса; другие элементы с примерно равным атомным весом обладали общими свойствами. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
По словам самого Менделеева, он структурировал свое мышление, записав свойства каждого из 63 известных элементов на отдельной карточке. Затем, с помощью своего рода игры в химический пасьянс, он нашел искомый паттерн. Располагая карточки в вертикальных столбцах от меньшего атомного веса к большему, в каждый горизонтальный ряд помещались элементы с аналогичными свойствами. Так родилась таблица Менделеева. 1 марта он набросал свою таблицу, отправил ее в типографию и включил в свой учебник, который скоро будет издан.Он быстро подготовил доклад для представления в Русское химическое общество.
«Элементы, расположенные в соответствии с размером их атомного веса, демонстрируют явные периодические свойства», – заявил Менделеев в своей статье. «Все сравнения, которые я сделал… привели меня к выводу, что размер атомной массы определяет природу элементов».
Тем временем немецкий химик Лотар Мейер также работал над организацией элементов. Он приготовил стол, похожий на стол Менделеева, возможно, даже раньше Менделеева.Но Менделеев опубликовал первым.
Однако более важным, чем победить Мейера в публикации, было то, что Менделеев использовал свою таблицу, чтобы делать смелые прогнозы относительно неоткрытых элементов. Готовя свой стол, Менделеев заметил, что пропало несколько карточек. Ему пришлось оставить пустые места, чтобы известные элементы правильно выровнялись. При его жизни три из этих пробелов были заполнены ранее неизвестными элементами галлием, скандием и германием.
Менделеев не только предсказал существование этих элементов, но и правильно подробно описал их свойства.Галлий, например, открытый в 1875 году, имел атомный вес (измеренный тогда) 69,9 и плотность в шесть раз больше плотности воды. Менделеев предсказал элемент (он назвал его эка-алюминий) именно с такой плотностью и атомным весом 68. Его предсказания для эка-кремния близко соответствовали германию (открытому в 1886 году) по атомному весу (72 предсказано, 72,3 наблюдаемых) и плотности. (5,5 против 5,469). Он также правильно предсказал плотность соединений германия с кислородом и хлором.
Стол Менделеева стал оракулом.Это было так, как если бы плитки Scrabble в конце игры раскрывали секреты вселенной. В то время как другие увидели силу периодического закона, Менделеев был мастером в использовании его.
Успешные предсказания Менделеева принесли ему легендарный статус маэстро химического волшебства. Но сегодня историки спорят, укрепило ли открытие предсказанных элементов принятие его периодического закона. Одобрение закона могло быть больше связано с его способностью объяснять установившиеся химические взаимосвязи.В любом случае точность прогнозов Менделеева, безусловно, привлекла внимание к достоинствам его таблицы.
К 1890-м годам химики широко признали его закон вехой в химических знаниях. В 1900 году будущий лауреат Нобелевской премии по химии Уильям Рамзи назвал это «величайшим обобщением, которое когда-либо было сделано в химии». И Менделеев сделал это, даже не понимая, почему это вообще работает.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными.Каким-то образом математика открывает некоторые секреты природы до того, как их обнаруживают экспериментаторы. Антивещество – один пример, расширение Вселенной – другой. В случае Менделеева предсказания новых элементов возникали без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала последствия квантовой механики, математических правил, управляющих атомной архитектурой.
В своем учебнике Менделеев отмечал, что «внутренние различия вещества, из которого состоят атомы», могут быть ответственны за периодически повторяющиеся свойства элементов.Но он не придерживался этой линии мысли. Фактически, на протяжении многих лет он болтал о том, насколько важна атомная теория для его таблицы.
Но другие могли прочитать сообщение в таблице. В 1888 году немецкий химик Йоханнес Вислиценус заявил, что периодичность свойств элементов при расчете по весу указывает на то, что атомы состоят из регулярного расположения более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвосхищала (и предоставляла доказательства) сложную внутреннюю структуру атомов в то время, когда никто не имел ни малейшего представления о том, как на самом деле выглядит атом, и даже есть ли у него какая-либо внутренняя структура.
Ко времени смерти Менделеева в 1907 году ученые знали, что у атомов есть части: электроны, несущие отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключ к разгадке того, как были устроены эти части, был получен в 1911 году, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, открыл атомное ядро. Вскоре после этого Генри Мозли, физик, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (количество протонов, которые оно содержит, или его «атомный номер») определяет правильный порядок элементов в периодической таблице.
Атомный вес был тесно связан с атомным номером Мозли – достаточно близко, чтобы упорядочение элементов по весу лишь в нескольких местах отличалось от упорядочения по номеру. Менделеев настаивал на том, что эти веса были неправильными и их нужно было повторно измерить, и в некоторых случаях он был прав. Осталось несколько несоответствий, но атомный номер Мозли определил положение вещей.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория управляет расположением электронов, окружающих ядро, и что самые удаленные электроны определяют химические свойства элемента.
Физик Нильс Бор пересмотрел периодическую таблицу в 1922 году. QWerk / Wikimedia CommonsПодобное расположение внешних электронов периодически повторялось, объясняя закономерности, которые изначально были обнаружены в таблице Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основанную на экспериментальных измерениях энергии электронов (наряду с некоторыми рекомендациями из периодического закона).
В таблицу Бора добавлены элементы, открытые с 1869 года, но, по сути, это была периодическая структура, которую открыл Менделеев.Не имея ни малейшего ключа к квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, продиктованную квантовой физикой.
Новый стол Бора не был ни первым, ни последним вариантом первоначального дизайна Менделеева. Были разработаны и опубликованы сотни версий таблицы Менделеева. Современная форма, горизонтальный дизайн в отличие от первоначальной вертикальной версии Менделеева, стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга (давнего члена правления Science Service, первоначального издателя книги). Новости науки ).
Сиборг и его сотрудники синтетическим путем получили несколько новых элементов с атомными номерами помимо урана, последнего встречающегося в природе элемента в таблице. Сиборг увидел, что эти элементы, трансурановые элементы (плюс три элемента, предшествующие урану), требуют новой строки в таблице, чего Менделеев не предвидел. В таблице Сиборга строка для этих элементов добавлена под аналогичной строкой для редкоземельных элементов, правильное место которых также никогда не было вполне ясным. «Потребовалось много смелости, чтобы противостоять Менделееву», – сказал Сиборг, умерший в 1999 году, в интервью 1997 года.
Вклад Сиборга в химию принес ему честь создать его собственный одноименный элемент, сиборгий, номер 106. Это один из немногих элементов, названных в честь известного ученого, список, который, конечно, включает элемент 101, открытый Сиборгом и его коллегами в 1955 году и назван менделевием – в честь химика, который прежде всего заслужил место в таблице Менделеева.
В своей редакции американский химик Гленн Сиборг повернул периодическую таблицу по горизонтали, добавив несколько синтетических элементов помимо урана.С любезного разрешения Национальной лаборатории Лоуренса Беркли.Эволюция периодической системы.
Примечание редактора. Ниже приводится текстовая версия. Полную версию с иллюстрациями можно приобрести здесь (PDF).
Периодическая таблица элементов – один из самых значительных символов в науке: единый документ, который обобщает большую часть наших знаний по химии. Версия висит на стене почти каждой химической лаборатории и лекционного зала в мире.Действительно, ничего подобного не существует в других научных дисциплинах.
История периодической системы классификации элементов насчитывает более 200 лет. На протяжении своей долгой истории периодическая таблица оспаривалась, изменялась и улучшалась по мере развития науки и открытия новых элементов [см. «Создание новых элементов» Питера Армбрастера и Фрица Питера Хессбергера]. Но несмотря на драматические изменения, произошедшие в науке за последнее столетие, а именно развитие теорий относительности и квантовой механики, не произошло революции в основной природе периодической системы.В некоторых случаях первоначально казалось, что новые открытия ставят под сомнение теоретические основы периодической таблицы Менделеева, но каждый раз ученым в конечном итоге удавалось учесть результаты, сохранив при этом фундаментальную структуру таблицы. Примечательно, что периодическая таблица Менделеева примечательна как своими историческими корнями, так и актуальностью в современном мире.
Термин «периодический» отражает тот факт, что элементы проявляют закономерности в своих химических свойствах через определенные регулярные промежутки времени. Если бы не упрощение, представленное в этой таблице, студентам-химикам пришлось бы изучить свойства всех 112 известных элементов.К счастью, периодическая таблица Менделеева позволяет химикам работать, усваивая свойства горстки типичных элементов; все остальные попадают в так называемые группы или семейства со схожими химическими свойствами. (В современной периодической таблице группа или семья соответствуют одному вертикальному столбцу.)
Открытие периодической системы классификации элементов представляет собой кульминацию ряда научных достижений, а не внезапный мозговой штурм со стороны одного человека.Тем не менее, историки обычно считают одно событие официальным рождением современной таблицы Менделеева: 17 февраля 1869 года русский профессор химии Дмитрий Иванович Менделеев завершил первую из своих многочисленных периодических таблиц. Он включал 63 известных элемента, расположенных в соответствии с возрастающим атомным весом; Менделеев также оставил места для еще неоткрытых элементов, для которых он предсказал атомный вес.
Однако до открытия Менделеева другие ученые активно разрабатывали какую-то организационную систему для описания элементов.Например, в 1787 году французский химик Антуан Лавуазье, работая с Антуаном Фуркроем, Луи-Бернаром Гайтоном де Морво и Клодом-Луи Бертолле, составил список из 33 элементов, известных в то время. Однако такие списки – это просто одномерные представления. Сила современной таблицы заключается в ее двух- или даже трехмерном отображении всех известных элементов (и даже тех, которые еще предстоит обнаружить) в логической системе точно упорядоченных строк и столбцов.
Немецкий химик Иоганн Дёберейнер в 1817 году в своей ранней попытке организовать элементы в осмысленную совокупность указал, что многие известные элементы могут быть организованы по их сходству в группы по три, которые он назвал триадами.Доберейнер выделил триады элементов лития, натрия и калия, а также хлора, брома и йода. Он заметил, что если три члена триады были упорядочены в соответствии с их атомным весом, свойства среднего элемента оказывались между свойствами первого и третьего элементов. Например, литий, натрий и калий активно взаимодействуют с водой. Но литий, самый легкий из триад, реагирует более мягко, чем два других, тогда как самый тяжелый из трех, калий, взрывается сильно.Кроме того, Доберейнер показал, что атомный вес среднего элемента близок к среднему весу первого и третьего членов триады. Работа Доберейнера побудила других искать корреляции между химическими свойствами элементов и их атомным весом. Одним из тех, кто в 19 веке продолжал развивать триадный подход, был Питер Кремерс из Кельна, который предположил, что определенные элементы могут принадлежать двум перпендикулярно расположенным триадам. Таким образом, Кремерс открыл новые горизонты, сравнив элементы в двух направлениях, что позже оказалось важным аспектом системы Менделеева.
В 1857 году французский химик Жан-Батист-Андре Дюма отказался от идеи триад и вместо этого сосредоточился на разработке набора математических уравнений, которые могли бы объяснить увеличение атомной массы среди нескольких групп химически похожих элементов. Но, как теперь признают химики, любая попытка создать структуру организации, основанную на атомном весе элемента, не увенчается успехом, потому что атомный вес не является фундаментальным свойством, характеризующим каждый из элементов.
Периодические свойства
Важнейшей характеристикой системы Менделеева было то, что она иллюстрировала периодичность или повторяемость свойств элементов через определенные регулярные промежутки времени.Эта особенность наблюдалась ранее в расположении элементов по атомному весу, разработанном в 1862 году французским геологом Александром-Эмилем Бегуайе де Шанкуртуа. Система опиралась на довольно сложную геометрическую конфигурацию: де Шанкуртуа располагал элементы в соответствии с возрастающим атомным весом по спирали, начертанной на поверхности цилиндра и наклоненной под углом 45 градусов от основания.
Первый полный оборот спирали совпал с кислородом элемента, а второй полный оборот произошел с серой.Элементы, расположенные вертикально на поверхности цилиндра, как правило, обладали схожими свойствами, поэтому такое расположение позволило уловить некоторые узоры, которые впоследствии стали центральными в системе Менделеева. Тем не менее, по ряду причин система де Шанкуртуа не оказала большого влияния на ученых того времени: в его оригинальную статью не входила диаграмма таблицы, система была довольно сложной, а химическое сходство между элементами не отображалось очень убедительно. .
В 1860-х годах несколько других исследователей выдвинули свои собственные версии периодической таблицы Менделеева. Используя новые стандартизованные значения атомного веса, английский химик Джон Ньюлендс в 1864 году предположил, что, когда элементы расположены в порядке атомного веса, любой из элементов проявляет свойства, аналогичные свойствам элементов на восемь позиций впереди и на восемь позиций позади в списке. – особенность, которую Ньюлендс назвал «законом октав».
В своей исходной таблице Ньюлендс оставил пустые места для отсутствующих элементов, но его более разрекламированная версия 1866 года не включала эти открытые места.Другие химики сразу же высказали возражения против таблицы, потому что она не сможет вместить какие-либо новые элементы, которые могут быть обнаружены. Фактически, некоторые исследователи открыто высмеивали идеи Ньюлендса. На собрании Химического общества в Лондоне в 1866 году Джордж Кэри Фостер из Университетского колледжа Лондона спросил Ньюлендса, рассматривал ли он возможность упорядочения элементов в алфавитном порядке, поскольку при любом расположении элементов будут случайные совпадения. В результате встречи Химическое общество отказалось опубликовать статью Ньюлендса.
Однако, несмотря на плохой прием, работа Ньюлендса действительно представляет собой первый случай, когда кто-либо использовал последовательность порядковых чисел (в данном случае, основанную на последовательности атомных весов) для организации элементов. В этом отношении Ньюлендс предвосхитил современную организацию периодической таблицы Менделеева, которая основана на последовательности так называемых атомных чисел. (Понятие атомного номера, которое указывает количество протонов, присутствующих в ядре атома, не существовало до начала 20 века.)
Современная периодическая таблица
Химик Юлиус Лотар Мейер из Университета Бреслау в Германии, в процессе пересмотра своего учебника химии в 1868 году, создал периодическую таблицу, которая оказалась удивительно похожей на знаменитую версию Менделеева 1869 года, хотя Лотар Мейер не смог правильно классифицировать все элементы. Но таблица не появлялась в печати до 1870 года из-за задержки издателя – фактор, который способствовал ожесточенному спору о приоритете, который последовал между Лотаром Мейером и Менделеевым.
Примерно в то же время Менделеев составил свою собственную таблицу Менделеева, в то время как он тоже писал учебник химии. В отличие от своих предшественников, Менделеев достаточно доверял своей периодической таблице, чтобы использовать ее для предсказания нескольких новых элементов и свойств их соединений. Он также исправил атомный вес некоторых уже известных элементов. Интересно, что Менделеев признался, что видел некоторые более ранние таблицы, например, из Newlands, но утверждал, что не знал о работе Лотара Мейера при разработке своей таблицы.
Хотя прогностический аспект таблицы Менделеева был большим достижением, кажется, что историки переоценили его, которые обычно предполагали, что таблица Менделеева была принята именно из-за этой особенности. Эти ученые не заметили, что цитата Лондонского королевского общества, сопровождавшая медаль Дэви (которую Менделеев получил в 1882 году), вообще не упоминает о его предсказаниях. Вместо этого способность Менделеева приспособиться к уже известным элементам, возможно, способствовала принятию периодической системы не меньше, чем его поразительные предсказания.Хотя многочисленные ученые помогли разработать периодическую систему, Менделеев получил наибольшую заслугу в открытии химической периодичности, потому что он возвысил это открытие до уровня закона природы и провел остаток своей жизни, смело исследуя его последствия и отстаивая его обоснованность.
Защита периодической таблицы Менделеева была непростой задачей – ее точность часто подвергалась сомнению в последующих открытиях. Один примечательный случай произошел в 1894 году, когда Уильям Рамзи из Университетского колледжа Лондона и лорд Рэлей (Джон Уильям Струтт) из Королевского института в Лондоне обнаружили элемент аргон; В течение следующих нескольких лет Рамзи объявил об идентификации четырех других элементов – гелия, неона, криптона и ксенона – известных как благородные газы.(Последний из известных благородных газов, радон, был открыт в 1900 году немецким физиком Фридрихом Эрнстом Дорном.)
Название «благородный» происходит от того факта, что все эти газы, кажется, стоят отдельно от других элементов, редко взаимодействуя с ними, образуя соединения. В результате некоторые химики предположили, что благородные газы даже не входят в периодическую таблицу. Эти элементы не были предсказаны Менделеевым или кем-либо еще, и только после шести лет напряженных усилий химики и физики смогли успешно включить благородные газы в таблицу.В новом устройстве была введена дополнительная колонка между галогенами (газообразные элементы фтор, хлор, бром, йод и астат) и щелочными металлами (литий, натрий, калий, рубидий, цезий и франций).
Вторым предметом разногласий был точный порядок элементов. В оригинальной таблице Менделеева элементы располагались в соответствии с атомным весом, но в 1913 году голландский физик-любитель Антон ван ден Брук предположил, что принцип упорядочения периодической таблицы лежит в ядерном заряде каждого атома.Физик Генри Мозли, работающий в Манчестерском университете, проверил эту гипотезу также в 1913 году, незадолго до своей трагической гибели в Первой мировой войне. Мозли начал с фотографирования рентгеновского спектра 12 элементов, 10 из которых занимали последовательные места в таблице. периодическая таблица. Он обнаружил, что частоты особенностей, называемых K-линиями в спектре каждого элемента, прямо пропорциональны квадратам целых чисел, представляющих положение каждого последующего элемента в таблице. As
Мозли сказал, что это доказательство того, что «в атоме есть фундаментальная величина, которая постепенно увеличивается по мере перехода от одного элемента к другому.Эта фундаментальная величина, впервые названная атомным номером в 1920 году Эрнестом Резерфордом, работавшим тогда в Кембриджском университете, теперь определяется как число протонов в ядре.
Работа Мозли предоставила метод, с помощью которого можно было точно определить, сколько пустых мест осталось в периодической таблице. После этого открытия химики обратились к использованию атомного номера в качестве фундаментального принципа упорядочения периодической таблицы вместо атомного веса. Это изменение решило многие давние проблемы с расположением элементов.Например, когда йод и теллур были упорядочены в соответствии с атомным весом (сначала йод), два элемента оказались неправильно расположены с точки зрения их химического поведения. Однако при заказе по атомному номеру (сначала теллур) два элемента находились на своих правильных позициях.
Знакомство с Atom
Таблица Менделеева вдохновила не только химиков, но и физиков-атомщиков, пытающихся понять структуру атома.В 1904 году, работая в Кембридже, физик Дж. Дж. Томсон (который также открыл электрон) разработал модель атома, уделяя пристальное внимание периодичности элементов. Он предположил, что атомы определенного элемента содержат определенное количество электронов, расположенных концентрическими кольцами. Кроме того, согласно Томсону, элементы с подобной конфигурацией электронов будут иметь аналогичные свойства; Таким образом, работа Томсона дала первое физическое объяснение периодичности элементов.Хотя Томсон представлял кольца электронов лежащими внутри основного тела атома, а не циркулирующими вокруг ядра, как это принято сегодня считать, его модель действительно представляет собой первый раз, когда кто-либо рассмотрел расположение электронов в атоме, концепцию, которая пронизывает весь мир. вся современная химия.
Датский физик Нильс Бор, первым применивший квантовую теорию к структуре атома, также был мотивирован расположением элементов в периодической системе.В модели атома Бора, разработанной в 1913 году, электроны населяют серию концентрических оболочек, окружающих ядро. Бор рассуждал, что элементы в одной и той же группе периодической таблицы могут иметь идентичные конфигурации электронов в их внешней оболочке и что химические свойства элемента будут в значительной степени зависеть от расположения электронов во внешней оболочке его атомов.
Модель атома Бора также служила для объяснения того, почему благородные газы не обладают реакционной способностью: благородные газы обладают полной внешней оболочкой из электронов, что делает их необычайно стабильными и маловероятными для образования соединений.Действительно, большинство других элементов образуют соединения, чтобы получить полные внешние электронные оболочки. Более поздний анализ того, как Бор пришел к этим электронным конфигурациям, показывает, что он действовал больше как химик, чем это обычно считается. Бор не выводил электронные конфигурации из квантовой теории, но получил их из известных химических и спектроскопических свойств элементов.
В 1924 году другой физик, австрийский Вольфганг Паули, попытался объяснить длину каждой строки или периода в таблице.В результате он разработал принцип исключения Паули, который гласит, что никакие два электрона не могут существовать в одном и том же квантовом состоянии, которое определяется тем, что ученые называют квантовыми числами. Длина различных периодов определяется экспериментальными данными о порядке заполнения электронной оболочки и квантово-механическими ограничениями на четыре квантовых числа, которые могут принимать электроны.
Модификации квантовой теории, сделанные Вернером Гейзенбергом и Эрвином Шредингером в середине 1920-х годов, привели к созданию квантовой механики в той форме, которая используется по сей день.Но влияние этих изменений на таблицу Менделеева было довольно минимальным. Несмотря на усилия многих физиков и химиков, квантовая механика не может больше объяснить периодическую таблицу. Например, он не может объяснить из первых принципов порядок, в котором электроны заполняют различные электронные оболочки. Электронные конфигурации атомов, на которых основано наше современное понимание периодической таблицы, не могут быть получены с помощью квантовой механики (это потому, что фундаментальное уравнение квантовой механики, уравнение Шредингера, не может быть решено точно для других атомов, кроме водорода).В результате квантовая механика может воспроизвести первоначальное открытие Менделеева только с помощью математических приближений – она не может предсказать периодическую систему.
Вариации на тему
В последнее время исследователи предложили различные подходы к отображению периодической системы. Например, Фернандо Дюфур, профессор химии на пенсии из Коллеж Ахунтик в Монреале, разработал трехмерную периодическую таблицу, которая отображает фундаментальную симметрию периодического закона, в отличие от обычной двумерной формы таблицы, которая широко используется.То же самое достоинство также проявляется в версии периодической таблицы в форме пирамиды, форма которой предлагалась много раз, но совсем недавно была усовершенствована Уильямом Б. Дженсеном из Университета Цинциннати.
Еще одним отличием было изобретение периодических систем, нацеленных на обобщение свойств соединений, а не элементов. В 1980 году Рэй Хефферлин из Южного адвентистского университета в Колледдейле, штат Теннеси, разработал периодическую систему для всех мыслимых двухатомных молекул, которые могли образоваться между первыми 118 элементами (на сегодняшний день обнаружено только 112).
ДиаграммаХефферлина показывает, что определенные свойства молекул – например, расстояние между атомами и энергия, необходимая для ионизации молекулы – проявляются в регулярных формах. Эта таблица позволила ученым успешно предсказать свойства двухатомных молекул.
В аналогичных усилиях Джерри Р. Диас из Университета Миссури в Канзас-Сити разработал периодическую классификацию типа органических молекул, называемых бензоидными ароматическими углеводородами. Нафталин (C10H8), содержащийся в нафталиновых шариках, является самым простым примером.Система классификации Диаса аналогична триадам элементов Дёберейнера: любая центральная молекула триады имеет общее количество атомов углерода и водорода, которое является средним значением фланкирующих записей, как в нижнем, так и в поперечном направлении таблицы. Эта схема была применена к систематическому изучению свойств бензоидных ароматических углеводородов и, с использованием теории графов, привела к предсказаниям стабильности и реакционной способности некоторых из этих соединений.
Тем не менее, именно периодическая таблица элементов оказала самое широкое и устойчивое влияние.Периодическая таблица Менделеева, эволюционировавшая в течение более 200 лет благодаря работе многих людей, остается в центре изучения химии. Она считается одной из самых плодотворных идей в современной науке, сравнимой, возможно, с теорией эволюции Чарльза Дарвина. В отличие от таких теорий, как механика Ньютона, она не была фальсифицирована или революционизирована современной физикой, но адаптировалась и созрела, оставаясь по существу невредимой.
Дополнительная литература
Периодическая система химических элементов: история первых ста лет.J. W. van Spronsen. Эльзевир, 1969.
Удивительная таблица Менделеева: десять примечательных фактов. Деннис Х. Руврей в журнале Chemical Intelligencer, Vol. 2, № 3, страницы 39–47; Июль 1996 г.
Классификация, симметрия и периодическая таблица. Уильям Б. Дженсен в “Вычислительной технике и математике с приложениями”, Vol. 12B, №№ 1–2, страницы 487–510; 1989.
Plus ça Change. Э. Р. Скерри по химии в Великобритании, Vol. 30, № 5, страницы 379–381; Май 1994.
Электрон и Периодическая таблица.Эрик Р. Скерри в American Scientist, Vol. 85, страницы 546–553; Ноябрь – декабрь 1997 г.
История Периодической таблицы
Рисунок \ (\ PageIndex {1} \). Менделеев Дмитрий
Периодическая таблица для многих является символом химии. Это единое изображение, которое содержит все известные элементы вселенной, объединенные в легко читаемую таблицу. В таблице также присутствует множество паттернов. Кажется, что все элементы подходят друг к другу и соединяются, образуя читаемую таблицу и, в свою очередь, образ химии.Идея элементов впервые возникла в 3000 г. до н. Э. Великий греческий философ Аристотель считал, что все на земле состоит из этих элементов. В древние времена такие элементы, как золото и серебро, были легко доступны, однако Аристотель выбрал такие элементы, как Земля, Вода, Огонь и Воздух.
В 1649 году идея элементов сделала огромный шаг вперед, когда Хенниг Бранд первым открыл новый элемент: фосфор. Бранд был алхимиком в поисках философского камня или предмета, который мог бы превратить любой обычный металл в золото.В своих поисках он перепробовал все, включая перегонку человеческой мочи. Когда был проведен этот эксперимент, Бранд обнаружил светящийся белый камень. Это был новый элемент, который он назвал бы фосфором. Алхимики и ученые эпохи Просвещения добавили невероятное количество знаний к идеям об элементах. В 1869 году было открыто уже 63 элемента. С каждым новым обнаруженным элементом ученые начали понимать, что возникают закономерности, и некоторые начали складывать элементы в таблицу.
Такие ученые, как Джон Ньюлендс и Александр-Эмиль Бегайе де Шанкуртуа, создали свои собственные версии периодических таблиц. Эти версии были относительно простыми, а также были несколько непонятными и трудными для чтения. Ученый, который собрал все это воедино, был Дмитрий Менделеев (1834–1907). Менделеев был химиком российского происхождения и первым опубликовал современную версию таблицы Менделеева. В его таблице элементы упорядочены по атомным весам (молярным массам). Когда элементы были упорядочены по их атомному весу, они показали аналогичные химические свойства.Таблица, которую составил Менделеев, была настолько хороша, что он мог предсказать элементы, которые ему тогда даже не были известны. Эти элементы включали германий, галлий и скандий. Однако в таблице были некоторые подводные камни. Поскольку не все элементы были обнаружены на момент публикации Менделеева, он не учел важные элементы, такие как благородные газы. После публикации Менделеева будущие ученые внесли свой вклад в добавление элементов на их должных местах. Сэр Уильям Рамзи добавил благородные газы, а Генри Мосли открыл способ количественного определения атомного номера элемента и изменил порядок таблицы Менделеева, чтобы она была организована по атомным номерам.Наконец, в 1945 году Манхэттенский проект привел к открытию многих новых радиоактивных элементов. Гленн Т. Сиборг предложил изменить таблицу в виде добавления ряда актинидов и лантанидов в нижней части таблицы. Эта идея пришла с открытием Америций и Кюрия и их уникальных свойств. Изменение сначала не было принято, но теперь оно включено во все периодические таблицы.
Рисунок \ (\ PageIndex {2} \). Периодическая таблица, показывающая, когда был обнаружен каждый элемент
- До 1800 года (36 элементов): двоечники во время и до Эпохи Просвещения.
- 1800-1849 (+22 элемента): импульс научной революции, теории атома и промышленной революции.
- 1850-1899 (+23 элемента): возраст классифицирующих элементов получил импульс от спектрального анализа.
- 1900-1949 (+13 элементов): импульс старой квантовой теории, уточнений периодической таблицы и квантовой механики.
- 1950-1999 (+15 элементов): Manhattan_Project и вопросы физики элементарных частиц, для атомных номеров 97 и выше
Подробнее о Периодической таблице Менделеева
Сходство макроскопических свойств внутри каждого из химических семейств приводит к тому, что можно ожидать и микроскопического сходства.Атомы натрия должны быть чем-то похожи на атомы лития, калия и других щелочных металлов. Это могло объяснить родственную химическую активность и аналогичные соединения этих элементов.
Согласно атомной теории Дальтона, разные виды атомов можно различать по их относительной массе (атомной массе). Поэтому кажется разумным ожидать некоторой корреляции между этим микроскопическим свойством и макроскопическим химическим поведением. Вы можете увидеть, что такая взаимосвязь существует, перечислив символы для первой дюжины элементов в порядке увеличения относительной массы.Получив атомные веса, имеем
Элементы, которые принадлежат к семействам, которые мы уже обсуждали, обозначены штриховкой вокруг их символов. Второй, третий и четвертый элементы в списке (He, Li и Be) представляют собой благородный газ, щелочной металл и щелочно-земельный металл соответственно. Точно такая же последовательность повторяется спустя восемь элементов (Ne, Na и Mg), но на этот раз благородному газу предшествует галоген (F). Если бы список был составлен из всех элементов, мы бы нашли последовательность галоген, благородный газ, щелочной металл и щелочно-земельный металл еще несколько раз.
Дмитрий Иванович Менделеев предложил периодический закон , лежащий в основе его составления таблицы Менделеева. Этот закон гласит, что , когда элементы перечислены в порядке возрастания атомного веса, их свойства периодически меняются . То есть похожие элементы не имеют одинаковых атомных весов. Скорее, когда мы спускаемся вниз по списку элементов в порядке атомных весов, соответствующие свойства наблюдаются через регулярные промежутки времени. Чтобы подчеркнуть это периодическое повторение схожих свойств, Менделеев расположил символы и атомные веса элементов в таблице, показанной ниже.Каждый вертикальный столбец этой периодической таблицы содержит группу или семейство связанных элементов. Щелочные металлы относятся к группе I ( Gruppe I), щелочноземельные металлы – к группе II, халькогены – к группе VI, а галогены – к группе VII. Менделеев не совсем понимал, куда девать чеканные металлы, поэтому они появляются дважды. Однако каждый раз медь, серебро и золото располагаются в вертикальном столбце. Благородные газы были открыты почти через четверть века после публикации первой таблицы Менделеева, но они тоже соответствовали периодической системе.При построении своей таблицы Менделеев обнаружил, что иногда не хватало элементов, чтобы заполнить все доступные пробелы в каждой горизонтальной строке периода . Когда это было правдой, он предполагал, что в конце концов кто-нибудь откроет элемент или элементы, необходимые для завершения периода. Поэтому Менделеев оставил пустые места для неоткрытых элементов и предсказал их свойства, усредняя характеристики других элементов в той же группе.
Рисунок \ (\ PageIndex {3} \) . Периодическая таблица Менделеева, перерисованная из Annalen der Chemie, дополнительный том 8, 1872 г. Немецкие слова Gruppe и Reihen обозначают, соответственно, группы и строки (или периоды) в таблице. Менделеев также использовал европейское соглашение о запятой вместо точки для десятичной дроби и J вместо I для йода. Благородные газы еще не были обнаружены, когда Менделеев разработал периодическую таблицу, и поэтому не отображаются.
В качестве примера этого процесса прогнозирования рассмотрим четвертую пронумерованную строку ( Reihen ).Скандий (Sc) в 1872 г. был неизвестен; поэтому титан (Ti) следует за кальцием (Ca) в порядке атомных весов. Это поместило бы титан ниже бора (B) в группу III, но Менделеев знал, что наиболее распространенный оксид титана, TiO 2 , имел формулу, аналогичную оксиду углерода CO 2 , а не бору B 2 О 3 . Поэтому он поместил титан в группу IV ниже углерода. Он предположил, что неоткрытый элемент, экаборон, в конечном итоге окажется подходящим ниже бора.(Префикс eka означает «ниже».) Свойства, прогнозируемые для ekaboron, показаны в следующей таблице. Они замечательно согласились с экспериментально измеренными для скандия, когда он был открыт 7 лет спустя. Это согласие было убедительным доказательством того, что периодическая таблица – хороший способ обобщить множество макроскопических экспериментальных фактов.
Таблица \ (\ PageIndex {1} \). Сравнение предсказаний Менделеева с наблюдаемыми свойствами элемента скандий .
| Объекты, предсказанные Менделеевым для Экаборана 1872 г. | Объекты скандия, найденные после его открытия в 1879 году | |
| Атомный вес | 44 | 44 † |
| Формула оксида | Eb 2 O 3 | Sc 2 O 3 |
| Плотность оксида | 3,5 | 3.86 |
| Кислотность оксида | Больше, чем MgO | Больше, чем MgO |
| Формула хлорида | EbCl 3 | ScCl 3 |
| Температура кипения хлорида | Выше, чем у | Выше, чем у |
| Цвет соединений | Бесцветный | Бесцветный |
* Менделеев использовал название «эка» бор, потому что пустое пространство, в которое должен помещаться элемент, находилось «под» бором в его периодической таблице.
† Современное значение атомной массы скандия составляет 44,96.
Современная таблица Менделеева в некоторых отношениях отличается от первоначальной версии Менделеева. Он содержит более 40 дополнительных элементов, а его строки длиннее, а не сдвинуты друг под друга в смещенных столбцах. Например, четвертая и пятая строки Менделеева содержатся в четвертом периоде современной таблицы. В результате под бор в периодической таблице помещается галлий, а не скандий.Эта перестройка связана с теорией электронной структуры атомов, в частности с идеями об орбиталях и связи электронной конфигурации с периодической таблицей. Чрезвычайно важная идея вертикальных групп связанных элементов все еще сохраняется, как и групповые числа Менделеева. Последние появляются в виде римских цифр вверху каждого столбца в современной таблице.
Менделеев был выдающимся химиком, который смог создать величайший химический инструмент всех времен.Не он один составлял элементы, и многие другие великие химики тоже внесли свой вклад. Идея элементов зародилась более 5000 лет назад и начала окончательно оформляться всего 200 лет назад с периодической таблицей Менделеева. Тем не менее, формирование таблицы Менделеева на этом не закончилось. Со временем он изменился и продолжает трансформироваться по мере того, как обнаруживается все больше и больше элементов.
Из ChemPRIME: 4.2: Периодическая таблица
Авторы и ссылки
Когда была изобретена Периодическая таблица?
© JacobH / iStock.comПериодическая таблица Менделеева была изобретена русским химиком Дмитрием Менделеевым в 1869 году. Однако до Менделеева химики десятилетиями размышляли о том, как классифицировать элементы. Начиная с 1789 года Антуан Лавуазье начал классифицировать элементы по их свойствам. Иоганн Вольфганг Доберейнер показал в 1817 году, что элементы могут быть организованы по их атомному весу в триады, так что, например, стронций имеет атомный вес между кальцием и барием.
В 1862 году французский геолог Александр-Эмиль-Бегайе де Шанкуртуа предложил периодическую таблицу элементов, в которой атомный вес элементов мог быть нанесен на цилиндр с окружностью 16 единиц, представляющий собой атомный вес кислорода.Атомные веса использовались английским химиком Джоном Ньюлендсом в 1864 году при классификации элементов. Расставив элементы по атомному весу, Ньюлендс заметил, что каждый восьмой элемент, похоже, имеет схожие химические свойства. По аналогии с семизначной музыкальной шкалой он назвал это законом октав.
Менделеев опирался на эту работу, располагая элементы в соответствии с атомным весом и их свойствами, но он также обращал особое внимание на валентность элемента (количество одинарных связей, которые элемент может образовывать).Его таблица 1869 года содержала 17 столбцов (или групп, как они теперь называются). Он переработал это в таблицу из восьми групп в 1871 году. В своей таблице 1871 года Менделеев правильно предсказал, что известные тогда атомные веса 17 элементов были неправильными. Он также предсказал существование трех тогда неизвестных элементов, скандия, галлия и германия, и их свойства, основываясь на пробелах в его таблице. В таблице Менделеева элементы не располагались в порядке возрастания атомного веса в зависимости от их свойств. Только в начале 20 века было обнаружено, что положение элемента в периодической таблице определяется его атомным номером (количеством протонов в его атомном ядре).
История Периодической таблицы
Развитие Периодической таблицы
Периодическая таблица Менделеева представляет собой систематическое расположение химических элементов, организованное на основе их электронных конфигураций.
Цели обучения
Обсудите происхождение и историю периодической таблицы Менделеева.
Основные выводы
Ключевые моменты
- Хотя работа алхимиков изначально была ошибочной попыткой превратить свинец в серебро и золото, их исследования заложили основу, которая помогла более позднему фундаментальному пониманию материи.
- Современная таблица Менделеева была разработана Дмитрием Менделеевым и представляет собой полезную основу для организации и анализа химического и физического поведения элементов.
- Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Ключевые термины
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента; ядро наиболее распространенного изотопа водорода, состоящее из двух верхних кварков и нижнего кварка.
- элемент : любое одно из простейших химических веществ, которое не может быть разложено в химической реакции или каким-либо химическим способом, состоящее из атомов, имеющих одинаковое количество протонов.
- алхимия : Древние поиски универсальной панацеи и философского камня. В конечном итоге этот процесс перерос в химию.
В современной периодической таблице известные элементы организованы несколькими способами: они перечислены в порядке атомного веса, электронной конфигурации, реакционной способности и электроотрицательности.Это настолько хороший метод организации и представления известных элементов, что его использовали для успешного прогнозирования существования определенных элементов. Сегодня он применяется не только химиками, но и во всех смежных науках, чтобы понять свойства и реакционную способность атомов и молекул. Стол известен своим происхождением из 17 века и основан на знаниях и опыте средневековья и более ранних эпох.
Краткая история Периодической таблицы – YouTube : От древнегреческих философов до Дмитрия Менделеева профессор Дэвис описывает, как человечество понимает элементы и как их каталогизировать с течением времени.
История Периодической таблицы
Атомная теория восходит к древнегреческим философам и философам эллинистического Египта. Они предположили, что все вещества состоят из фундаментальных строительных блоков; однако природа этих блоков была предметом ожесточенных споров.
Основные блоки были названы атомами, от греческого слова «атмосфера», что означает «неделимый». Ранняя атомная теория пыталась объяснить свойства материи, приписывая атомам атрибуты, которые могли бы соответствовать атрибутам различной материи, которую они объединяли в форму, например скользкость, текучесть, цвет и сплоченность.Философы классифицировали мир вокруг себя по свойствам и функциям – тип подхода, который позже привел к разработке периодической таблицы элементов.
В средние века алхимики стремились сделать золото и серебро из свинца. Хотя их усилия были напрасными, их исследование в конечном итоге привело к систематическому пониманию химического мира. Это также установило образ мышления, который дал нам периодическую таблицу элементов.
Алхимики находились под влиянием международной торговли, особенно вдоль Великого шелкового пути между Китаем и Европой.Химические знания распространились по культурам, и примерно к середине 18 века было уже 33 известных элемента. В начале XIX века Джозеф Пруст и другие экспериментально демонстрировали закон определенных пропорций. Это предоставило фундаментальное свидетельство того, что вещество существует в чистых соединениях, а не в смесях любых пропорций. Эти наблюдения укрепили атомную теорию и потребовали систематического метода организации элементов.
Обозначения в периодической таблице : Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Современный взгляд на Периодическую таблицу
Ученые начали замечать сходства и закономерности среди известных элементов, и большой исследовательский интерес XIX века заключался в разработке систематического метода их определения и классификации. Русский профессор химии Дмитрий Менделеев и немецкий химик Юлиус Мейер независимо друг от друга представили свои собственные версии таблицы Менделеева в 1869 и 1870 годах. В конечном итоге подход Менделеева был принят по нескольким причинам: во-первых, он оставил пробелы для элементов, которые еще не были обнаружены.При этом он предсказал элементы галлий и германий. Он также разместил атомы, основываясь в основном на их химических свойствах, а не на атомной массе. Как оказалось, организация по химическому семейству правильно сортирует большинство элементов по их атомным номерам; атомная масса не совсем коррелирует с атомным номером.
Периодическая таблица элементов : Современное представление периодической таблицы, показывающее организацию по атомному номеру и валентности. Обратите внимание, что атомные массы не включены в эту конкретную таблицу Менделеева, однако они обычно указываются под символом элемента.
Современная версия периодической таблицы Менделеева теперь содержит около 118 различных элементов. В периодической таблице число над символом элемента – это атомный номер, который представляет количество протонов в ядре. Атомная масса определяется суммой нейтронов и протонов.
Периоды с 1 по 3
Элементы одного периода имеют одинаковое количество электронных оболочек.
Цели обучения
Обсудите взаимосвязь между электронной структурой атома и его периодом (строкой) в периодической таблице.
Основные выводы
Ключевые моменты
- По мере того, как вы перемещаетесь через период (через таблицу справа), электронные оболочки элементов в этот период заполняются, приближаясь к стабильной конфигурации благородного газа в конце этой строки.
- Для любого элемента в периодах 1, 2 и 3 элементы, расположенные непосредственно над и под ним, являются членами одной группы и имеют аналогичные химические свойства, основанные на аналогичном расположении валентных электронов.
- Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, теперь известно, что оно состоит из ядра, окруженного электронами.
- электрон : субатомная частица, имеющая отрицательный заряд и вращающаяся вокруг ядра; поток электронов в проводнике составляет электричество.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Ранние философы и ученые понимали, что материя состоит из атомов и что многие элементы реагируют друг с другом в предсказуемых пропорциях. Периодическая таблица была создана для того, чтобы организовать эти наблюдения и измерения. Возник принцип валентности, связанный с наличием или отсутствием электронов и энергией этих электронов в объеме вокруг ядра атома. Электроны, отрицательно заряженные субатомные частицы, определяют химическую реакционную способность атома.Электроны организованы в энергетические уровни или электронные оболочки, которые соответствуют периодам в периодической таблице.
Атом Бора
Нилс Бор предложил упрощенную картину атома с центральным ядром, окруженным электронами на определенных энергетических уровнях (n). Таблица Менделеева систематизирует уровни энергии в периодах, строках таблицы. Самые простые атомы, водород и гелий, находятся в строке 1 или первом периоде. Эти атомы имеют электроны, занимающие уровень энергии n = 1.Спускаясь вниз, строка 2 или период 2 содержит элементы от Li (литий) до Ne (неон). Элементы в периоде 2 полностью заполнены энергией уровня n = 1; они продолжают заполнять свои n = 2 уровня, перемещаясь по таблице вправо. Аналогичным образом, переходя на один период вниз к строке 3, появляются элементы от Na (натрий) до Ar (аргон). Атомы периода-3 имеют заполненные уровни n = 1 и n = 2; они заполняют уровень n = 3, перемещаясь по таблице.
Упрощенное изображение атомной структуры : с ядром в центре с положительным зарядом электроны «организованы» в энергетические уровни или оболочки на увеличивающихся расстояниях от ядра.Расстояние между оболочками n = 2 и n = 3 на этом рисунке – это разница в энергии между ними.
Важно помнить, что периодическая таблица представляет собой представление атомов с нулевым чистым зарядом; у них столько электронов вокруг ядра, сколько протонов в ядре.
Периодическая таблица : Элементы расположены в соответствии с электронной конфигурацией с периодичностью по валентности.
Принцип Ауфбау
На уровнях энергии n = 1, n = 2 и n = 3 электроны организованы в орбитали, обозначенные как s, p, d и f.Например, атомный номер Ne (неона) равен 10 и содержит 5 орбиталей (1s, 2s, 2p x , 2p y и 2p z ). На каждой полной орбитали есть 2 электрона, что в сумме дает 10 для уравновешивания положительного заряда, обеспечиваемого 10 протонами в ядре.
Заполненные орбитали атома неона : Изображение орбиталей и их симметрии для атома неона (Ne). Уровни 1s и 2s показаны сфероидами, а три орбитали 2p показаны как разделенные сфероиды.Каждая полная орбиталь имеет 2 электрона, что дает всего 10 для этого элемента.
В периодической таблице есть 2 электрона в периоде 1, в то время как периоды 2 и 3 имеют 8 электронов на заполненном уровне. Для атомов с порядковыми номерами менее 20 применяется правило октетов добавления электронов и заполнения орбиталей. Это просто означает, что уровни n = 2 и n = 3, в частности, заполнены, когда есть 8 электронов. Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Принцип Ауфбау : Принцип Ауфбау описывает постепенное заполнение орбиталей и построение атомов с известными электронными конфигурациями.
Переходные металлы
Элементы d-блока широко известны как переходные металлы или переходные элементы.
Цели обучения
Определяет отличительные и характерные свойства переходных металлов.
Основные выводы
Ключевые моменты
- Переходные металлы – это элементы в десяти средних группах четвертого, пятого, шестого и седьмого периодов периодической таблицы.
- Переходные металлы и их соединения могут проявлять цвет из-за внутренних переходов электронов d-d.
- Переходные металлы и их соединения могут проявлять ферромагнетизм, парамагнетизм и диамагнетизм.
- Переходные металлы и их соединения хорошо известны своей каталитической активностью.
Ключевые термины
- парамагнитный : проявляющий парамагнетизм; тенденция магнитных диполей выравниваться с внешним магнитным полем.
- Степень окисления : Состояние атома с определенной степенью окисления.
- диамагнетик : проявляющий диамагнетизм; отталкивается магнитом.
D-блок Периодической таблицы
Переходные металлы также известны как переходные элементы или элементы d-блока. Как следует из названия, химический состав этой группы определяется степенью заполнения суборбитальных уровней d-электронов. Химическое сходство и периодичность можно легко увидеть по горизонтали через d-блок периодической таблицы.
D-блок периодической таблицы : D-блок состоит из групп 3-12 и периодов 4-7.
Однако химия далеко не проста, и есть много исключений из упорядоченного заполнения электронной оболочки. Принцип Ауфбау обеспечивает методическую основу для предсказания порядка, в котором большинство атомов будет заполнять свои электронные оболочки.
Принцип Ауфбау : Это иллюстрирует порядок, в котором большинство атомов заполняют свои электронные оболочки.
Химические свойства в периодической таблице сгруппированы по схожим химическим и физическим свойствам по вертикали по группам. Например, металлы в группе 11 имеют схожие характеристики электропроводности, блеска, кристаллической структуры, пластичности и прочности на разрыв. При движении по горизонтали через периодическую таблицу наблюдаются тенденции таких свойств, как атомный радиус, электроотрицательность и сродство к электрону.
Характерные свойства переходных металлов
Переходные металлы, можно сказать, обладают следующими характеристиками, которые обычно не встречаются в основной группе периодической таблицы.В основном это связано с неполным заполнением электронных d-уровней:
- Образование соединений, цвет которых обусловлен d – d электронными переходами.
- Образование соединений во многих степенях окисления из-за относительно низкой реакционной способности неспаренных d электронов.
- Образование многих парамагнитных соединений из-за наличия d неспаренных электронов. Некоторые соединения элементов основной группы также являются парамагнитными (например,г., оксид азота, кислород).
Переход лиганда с переносом заряда на металл (LMCT)
Цвет в соединениях металлов переходного ряда обычно возникает из-за электронных переходов двух основных типов переходов с переносом заряда. Электрон может перескакивать с орбитали, в которой преобладает лиганд, на орбиталь, в которой преобладает металл, что приводит к переходу с переносом заряда лиганда на металл (LMCT). Это наиболее легко может произойти, когда металл находится в высокой степени окисления. Например, цвет ионов хромата, дихромата и перманганата обусловлен переходами LMCT.Другой пример – йодид ртути (HgI 2 ) имеет красный цвет из-за перехода LMCT.
Комплексы с переносом заряда : I 2 • PPh 3 Комплексы с переносом заряда в CH 2 Cl 2 . Слева направо: (1) I 2 , растворенный в дихлорметане – нет комплекса CT. (2) Через несколько секунд после добавления избытка PPh 3 – формируется комплекс CT. (3) Через минуту после добавления избытка PPh 3 образовался комплекс CT [Ph 3 PI] + I – .(4) Сразу после добавления избытка I 2 , который содержит [Ph 3 PI] + [I 3 ] –.
Переход с переносом заряда металл-лиганд (MLCT) наиболее вероятен, когда металл находится в низкой степени окисления, а лиганд представляет собой легко восстанавливаемый переход d – d . Электрон перескакивает с одной d-орбитали на другую. В комплексах переходных металлов не все орбитали d имеют одинаковую энергию.
Парамагнитные и диамагнитные соединения
Соединения переходных металлов являются парамагнитными, если они имеют один или несколько неспаренных d электронов. Некоторые соединения диамагнитны. К ним относятся октаэдрические, низкоспиновые, d 6 и квадратно-плоские d 8 комплексы. В этих случаях расщепление кристаллического поля таково, что все электроны спарены. Ферромагнетизм возникает, когда отдельные атомы парамагнитны, а векторы спинов выровнены параллельно друг другу в кристаллическом материале.Металлическое железо и сплав альнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм – еще один пример магнитного свойства, возникающего из-за определенного выравнивания отдельных спинов в твердом состоянии.
Переходные металлы и их соединения известны своей гомогенной и гетерогенной каталитической активностью. Эта активность объясняется их способностью принимать несколько степеней окисления и образовывать комплексы.
Нижняя часть периодической таблицы
Периодическая таблица Менделеева в настоящее время содержит 7 периодов, но теоретики предсказывают, что могут существовать два дополнительных периода.
Цели обучения
Определите ключевые характеристики элементов f-блока.
Основные выводы
Ключевые моменты
- Ряды лантаноидов и актинидов получают свойства от электронов f-блока.
- Четыре элемента в ряду актинидов встречаются в природе, пять изотопов других иногда образуются при распаде урана, а остальные трансурановые соединения были произведены синтетическим путем.
- Наибольший атомный номер, синтезированный на сегодняшний день, составляет 118, элемент унунокций (Uuo).
Ключевые термины
- лантаноид : Любой из 14 редкоземельных элементов от лантана до лютеция в периодической таблице. Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними – актиниды.
- актинид : Любой из 14 радиоактивных элементов периодической таблицы, которые расположены под лантаноидами, с которыми они имеют схожий химический состав.
- трансуран : трансурановый.Трансурановый элемент – это любой синтетический элемент, атомный номер которого больше, чем у урана (92).
Есть несколько способов подойти к этой конкретной теме, и все они относятся к тому, как представлены элементы в самой таблице.
Самое классическое представление таблицы Менделеева показывает взаимное расположение известных элементов в таблице. Сама таблица состоит из 7 периодов и 18 групп, из которых самым последним известным элементом является номер 118, ununoctium.Однако в таблице наблюдается явный разрыв. В строке 6, столбце 3, пустое пространство появляется между Ba и Hf. Атомный номер, который должен быть здесь, 57, находится внизу таблицы в строке, называемой лантаноидами. Непосредственно под пространством в строке 6 в строке 7 находится еще одно пустое пространство, которое заполнено строкой, называемой актинидами, также видимой в нижней части диаграммы.
Периодическая таблица : это стандартное представление элементов в таблице с относительным расположением, знакомым химикам и физикам.
Расширение измерений Периодической таблицы
Увеличивая горизонтальные размеры стола, ряды актинидов и лантаноидов могут быть размещены в их правильных относительных положениях. Поскольку химический состав этой группы основан в основном на электронах f-оболочки и взаимодействиях на этом уровне энергии, это называется f-блоком. Это неуклюжее представление правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, unonoctium. Фактически, это представление является предсказательным, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Расширенная таблица Менделеева : лантаноиды и актиниды добавляются как отдельные, но связанные строки, образуя так называемый f-блок.
Продолжая расширение периодической таблицы, рассмотрим элемент с атомным номером 92 в ряду актинидов, называемый ураном. Когда в конце 19 века были открыты элементы этого диапазона атомных номеров, изотопы урана были самыми крупными и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансурановых элементов – элементов с атомным номером (z) больше или равным 93.В 1934 году было известно только 4 актинида, все меньше урана, поэтому не было известно, образуют ли они период или семейство, подобное лантаноидам. Первый трансурановый элемент, Np (нептуний), был синтезирован в 1940 году путем бомбардировки урана медленными нейтронами. В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Актиниды добавляли вместе с лантаноидами.
Два новых периода
Используя предсказательные свойства периодической таблицы, наряду с растущим опытом в атомной и субатомной теории, были предсказаны два совершенно новых периода.По совету Гленна Сиборга и других, периоды 8 и 9 были добавлены в таблицу Менделеева, включая g-блок. Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы квантовых чисел n и l будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p, с незаполненными оставшимися орбиталями.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Расширенная периодическая таблица с предсказанными периодами 8 и 9 : Периодическая таблица со всеми группами и периодами. Размещение неоткрытого G-блока является спекулятивным.
Существование элементов с такими высокими атомными номерами является спекулятивным, и ожидается, что изотопы будут иметь очень короткие периоды полураспада.Различные эксперты предсказывают, что z = приблизительно 130 является максимумом, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.
Положение таблицы Менделеева и электронная конфигурация
Положение элементов в периодической таблице напрямую связано с их электронной конфигурацией.
Цели обучения
Используйте периодическую таблицу для определения свойств атомов, таких как группы и электронные конфигурации.
Основные выводы
Ключевые моменты
- Элементы организованы по периоду и группе, причем период соответствует основному уровню энергии, а группа – степени заполнения подоболочек.
- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту для этих орбиталей, так что химические свойства могут быть выведены по положению элемента на таблице.
- Электроны во внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции.
Ключевые термины
- квантовое число : Одно из определенных целых или полуцелых чисел, которые определяют состояние квантово-механической системы (например, электрона в атоме).
- орбитальный : Спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Основные деления Периодической таблицы Менделеева
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7.Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбитали
Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома зависят в конечном итоге от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей. Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома.Модель оболочки, как и любая научная модель, – это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Мы рассмотрим несколько визуализаций таблицы Менделеева. Однако сначала было бы поучительно посмотреть, как это устроено с логической точки зрения. Сегодняшняя таблица является результатом более чем 100-летних усилий по наблюдениям, измерениям, предсказаниям и доказательству взаимосвязи химических и физических явлений с конфигурациями и зарядами электронов.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n = 1, n = 2 и n = 3.
Конфигурации электронных оболочек первых 18 элементов : Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие уровни энергии (n) указаны зелеными цифрами слева. Число электронов внешней оболочки представлено крайней правой цифрой в номерах групп.
Водород имеет 1 электрон на уровне 1s, а справа, гелий в Группе 18, имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий – первый из благородных газов. Переходя к периоду 2, литий является первым элементом в строке с заполненной конфигурацией единиц. В течение периода сначала заполняются 2s, а затем 2p орбитали, достигая конфигурации для неона, следуя правилу октетов. Период 3 следует аналогичной схеме. Обратите внимание, что количество электронов внешней оболочки является основным фактором, определяющим валентность элемента.
Конфигурации электронных оболочек элементов : Положение в периодической таблице в зависимости от конфигурации электронных оболочек. На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа.
Периодическая таблица с отображением электронных оболочек : Элементы в этой таблице расположены в стандартной конфигурации периодов и групп.Каждый блок включает представление структуры электронной оболочки элемента.
Электронная конфигурация катионов и анионов
Элементы периодической таблицы демонстрируют разные уровни реакционной способности в зависимости от количества электронов в их оболочках с наивысшей энергией.
Цели обучения
Предсказать, подвергнется ли атом ионизации с образованием аниона или катиона, на основе его электронной конфигурации валентной оболочки.
Основные выводы
Ключевые моменты
- Электронная конфигурация многих ионов – это ближайший к ним благородный газ в периодической таблице.
- Анион – это ион, который приобрел один или несколько электронов и приобрел отрицательный заряд.
- Катион – это ион, который потерял один или несколько электронов и приобрел положительный заряд.
Ключевые термины
- анион : отрицательно заряженный ион, в отличие от катиона
- ионизация : Любой процесс, который приводит к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- катион : положительно заряженный ион, в отличие от аниона.
Катионы и анионы образуются из нейтральных атомов
Каждый атом в основном состоянии незаряжен. В соответствии с его атомным номером, он имеет такое же количество протонов и электронов. Однако электроны довольно лабильны, и атом часто приобретает или теряет их в зависимости от своей электроотрицательности. Движущей силой для такого увеличения или уменьшения количества электронов является энергетически оптимальное состояние наличия полной валентной (самой внешней) оболочки электронов. В таком состоянии образующийся заряженный атом имеет электронную конфигурацию благородного газа.
Добавление электрона нарушит протон-электронный баланс и оставит атом с отрицательным зарядом. Удаление электрона, наоборот, оставит атом положительно заряженным. Эти заряженные атомы известны как иона .
Образование одноатомных ионов
Одноатомные ионы образуются путем добавления или удаления электронов из валентной оболочки атома. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в таком химическом взаимодействии, но валентная оболочка может быть очень реактивной в зависимости от атома и его электронной конфигурации.Процесс получения или потери электронов нейтральным атомом или молекулой называется ионизацией .
Атомы можно ионизировать путем бомбардировки излучением, но более чисто химический процесс ионизации – это перенос электронов между атомами или молекулами. Этот перенос осуществляется за счет стабилизации, которая достигается за счет получения стабильных (полностью покрытых оболочкой) электронных конфигураций. Атомы будут получать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, элемент натрия группы 1 (Na) имеет один электрон в валентной оболочке с полными оболочками из 2 и 8 электронов под ним.Удаление этого одного электрона делает натрий стабильным: его внешняя оболочка теперь содержит восемь электронов, что придает натрию электронную конфигурацию неона. Получив положительный заряд, ион натрия называется катионом . Ионизацию натрия можно проиллюстрировать химически следующим образом:
Na → Na + + е –
Натрий может получать электроны, но для достижения полной валентной оболочки потребуется еще семь. Удалить один электрон намного проще, чем получить семь, и поэтому натрий в каждом химическом сценарии достигнет своего октета, превратившись в катион.
С другой стороны, атом хлора (Cl) имеет семь электронов в валентной оболочке, что на один меньше стабильной полной оболочки с 8 электронами. Таким образом, атом хлора стремится к , получить дополнительных электронов и достичь стабильной 8-электронной конфигурации (такой же, как у аргона), становясь в процессе отрицательным анионом хлорида :
Cl + e− → Cl –
Комбинируя склонность натрия терять электрон и хлорида приобретать электрон, мы наблюдаем дополнительную реакционную способность.При объединении незаряженные атомы могут обмениваться электронами и при этом достигать полных валентных оболочек. Образующиеся ионы слипаются за счет ионных связей (притягиваются противоположные заряды), образуя структуру кристаллической решетки NaCl, более известную как каменная соль. Реакция следующая:
Na + + Cl – → NaCl
Многоатомные и молекулярные ионы
Ионизация не ограничивается отдельными атомами; также могут образовываться многоатомные ионы. Многоатомные и молекулярные ионы часто создаются добавлением или удалением элементарных ионов, таких как H + , в нейтральных молекулах.Например, когда аммиак NH 3 принимает протон H + , он образует ион аммония NH 4 + . Аммиак и аммоний имеют одинаковое количество электронов в одной и той же электронной конфигурации, но у аммония есть дополнительный протон (H + ), который придает ему чистый положительный заряд.
Химическое обозначение
При написании химической формулы иона его суммарный заряд записывается в верхнем индексе сразу после химической структуры молекулы или атома.Чистый заряд записывается с величиной перед знаком , то есть двухзарядный катион обозначается как 2 + вместо +2 . Однако величина заряда не указана для однозарядных молекул или атомов; например, катион натрия обозначается как Na + и , а не Na 1+ .
Альтернативный способ показать молекулу или атом с несколькими зарядами – это нарисовать знаки несколько раз; это часто наблюдается с переходными металлами.Химики иногда обводят знак; это просто орнамент и не меняет химического значения. Дважды положительно заряженный атом железа можно также выразить как Fe 2+ или Fe ++ .
В случае переходных металлов степени окисления могут быть указаны римскими цифрами; например, Fe 2+ иногда называют Fe (II) или Fe II . Римская цифра обозначает формальную степень окисления элемента , тогда как цифры в верхнем индексе обозначают чистый заряд.Таким образом, эти два обозначения можно заменить на одноатомные ионы, но римские цифры не могут применяться к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано на примере уранил-иона (UO 2 ).
Следует отметить, что из атома можно удалить много электронов. Энергия, необходимая для этого, может быть записана на диаграмме последовательной энергии ионизации.
Первая энергия ионизации : Периодические тенденции для энергии ионизации (IE) vs.атомный номер: обратите внимание, что в каждом из семи периодов IE (цветные кружки) элемента начинается с минимума для первого столбца Периодической таблицы (щелочные металлы) и увеличивается до максимума для последнего столбца (благородный газы), которые обозначены вертикальными линиями и помечены символом элемента благородного газа, а также служат линиями, разделяющими 7 периодов. Обратите внимание, что максимальная энергия ионизации для каждой строки уменьшается по мере продвижения от строки 1 к строке 7 в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
Периодическая таблица
Периодическая таблицаКРАТКАЯ ИСТОРИЯ РАЗРАБОТКИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
Хотя Дмитрия Менделеева часто считают «отцом» периодической таблицы Менделеева, работа многих ученых способствовала ее нынешней форме.
В начале
Необходимой предпосылкой к построению таблицы Менделеева было открытие отдельных элементов. Хотя такие элементы, как золото, серебро, олово, медь, свинец и ртуть известны с древних времен, это первое научное открытие элемента произошло в 1649 году, когда Хенниг Бранд открыл фосфор.В течение следующие 200 лет, обширные знания о свойствах элементов и их соединения были приобретены химиками (см. статья 1790 г. об элементах). К 1869 году было открыто 63 элемента. По мере того, как количество известных элементов росло, ученые начали распознавать закономерности в свойства и начали разрабатывать классификационные схемы.Закон триад
В 1817 году Иоганн Доберейнер заметил, что атомный вес стронция находится посередине между весами кальция и бария, элементов, обладающих схожими химическими свойствами.В 1829 году, после открытия триады галогенов, состоящей из хлора, брома и йода, и триады щелочных металлов из лития, натрия и калия, он предположил, что природа содержит триады элементов, средний элемент имел свойства, которые были средними для двух других членов, когда упорядочены по атомному весу (Закон триад).Эта новая идея триад стала популярной областью изучения. Между 1829 и 1858 годами ряд ученых (Жан Батист Дюма, Леопольд Гмелин, Эрнст Ленссен, Макс фон Петтенкофер и Дж.П. Кук) обнаружил, что эти типы химических отношений простираются за пределы триады. За это время к галогенной группе был добавлен фтор; кислород, сера, селен и теллур были сгруппированы в одно семейство, а азот, фосфор, мышьяк, сурьма и висмут были отнесены к другому. К сожалению, исследования в этой области были затруднены из-за того, что не всегда были доступны точные значения.
Первые попытки создания периодической таблицы
Если периодическая таблица рассматривается как упорядочение химических элементов, демонстрирующих периодичность химических и физических свойств, то за первую таблицу Менделеева (опубликованную в 1862 г.), вероятно, следует отдать должное французскому геологу А.Э. Бегайе де Шанкуртуа. Де Шанкуртуа записал список элементов, расположенных на цилиндре, с точки зрения увеличения атомного веса. Когда цилиндр был сконструирован так, что на цилиндр можно было записать 16 единиц массы за оборот, тесно связанные элементы были выстроены вертикально. Это привело де Шанкуртуа к предположению, что «свойства элементов являются свойствами чисел». Де Шанкуртуа был первым, кто осознал, что элементарные свойства повторяются каждые семь элементов, и, используя эту диаграмму, он смог предсказать стехиометрию нескольких оксидов металлов.К сожалению, в его диаграмму помимо элементов входили ионы и соединения.Закон октав
Джон Ньюлендс, английский химик, написал в 1863 году работу, в которой классифицировал 56 установленных элементы в 11 групп на основе схожих физических свойств, отмечая, что многие существовали пары одинаковых элементов, которые отличались кратностью восьми в атомный вес. В 1864 году Ньюлендс опубликовал свою версию таблицы Менделеева и предложил Закон октав (по аналогии с семью интервалами музыкального шкала).Этот закон гласил, что любой данный элемент будет демонстрировать аналогичное поведение. к восьмому элементу, следующему за ним в таблице.Кто является отцом Периодической таблицы?
Были некоторые разногласия по поводу того, кто заслуживает похвалы за то, что он «отец». периодической таблицы, немец Лотар Мейер (на фото) или россиянин Дмитрий Менделеев. Оба химика дали удивительно похожие результаты. при этом работая независимо друг от друга.Учебник Мейера 1864 года включены довольно сокращенная версия периодической таблицы, используемой для классификации элементы. Он состоял примерно из половины известных элементов, перечисленных в порядке их атомного веса и продемонстрировали периодические изменения валентности как функцию атомной массы. В 1868 году Мейер сконструировал удлиненный стол. которую он отдал коллеге на оценку. К несчастью для Мейера, менделеевская таблица стала доступна научному сообществу через публикацию (1869 г.) до того, как Появился Мейер (1870).
Менделеев Дмитрий Иванович (1834-1907), родился младший из 17 детей. в сибирском городе Тобольске, где его отец был учителем русской литературы и философия (портрет Ильи Репина). Менделеева не считали выдающийся ученик в раннем образовании отчасти из-за его неприязни к классические языки, которые были важным образовательным требованием в то время даже при том, что он проявил мастерство в математике и естественных науках.После того, как его отец После смерти он и его мать переехали в Санкт-Петербург, чтобы получить университетское образование. После отказа в приеме как в Московский, так и в Санкт-Петербургский университет Университет из-за его провинциального происхождения и безупречного академического образования, наконец-то он получил место в Главном педагогическом институте (Санкт-Петербург). Институт). По окончании учебы Менделеев занял позицию преподавателя естествознания в гимназия. Проработав учителем, он был допущен к работе в аспирантуре Св.Петербургский университет, в котором он получил степень магистра в 1856 году. Менделеев Т. на своих преподавателей произвел впечатление, что его пригласили читать лекции по химии. После проведя 1859 и 1860 гг. в Германии, продолжая свои химические исследования, он обеспечил должность профессора химии СПбГУ, должность он оставался до 1890 года. При написании учебника по систематической неорганической химии, Принципы химии , появившееся в тринадцати изданиях последних находясь в 1947 году, Менделеев организовал свой материал в терминах семей известные элементы, обладающие аналогичными свойствами.Первая часть Текст был посвящен хорошо известной химии галогенов. Далее он выбрал чтобы охватить химию металлических элементов в порядке объединения мощности – сначала щелочные металлы (объединяющие мощность одного), щелочноземельные металлы (два) и т. д. Однако было трудно классифицировать такие металлы, как медь и ртуть, которые имел несколько объединяющих способностей, иногда одну, а иногда две. Пока пытаюсь чтобы разобраться в этой дилемме, Менделеев заметил закономерности в свойствах и атомных свойствах. массы галогенов, щелочных и щелочных металлов.Он заметил сходство между сериями Cl-K-Ca, Br- / Rb-Sr и I-Cs-Ba. В попытке продлить это шаблон для других элементов, он создал карту для каждого из 63 известных элементов. Каждая карта содержала символ элемента, атомный вес и его характеристику. химические и физические свойства. Когда Менделеев разложил карты на столе в порядке возрастания атомного веса группируют элементы схожих свойств вместе в манере, напоминающей раскладку карт в его любимом пасьянсе карточная игра, терпение, периодическая таблица Менделеева была сформирована.Из этой таблицы Менделеев разработал свою формулировку периодического закона и опубликовал свою работу On Связь свойств элементов с их атомным весом в 1869 г. Преимущество таблицы Менделеева над предыдущими попытками было что он показал сходство не только в небольших единицах, таких как трезвучия, но и показали сходство во всей сети вертикальных, горизонтальных и диагональных отношения. В 1906 году Менделеев едва ли не одним голосом был удостоен награды. Нобелевская премия за свою работу.
В то время, когда Менделеев разработал свою таблицу Менделеева, экспериментально определенные атомные массы не всегда были точными, он переупорядочил элементы, несмотря на их принятые массы. Например, он изменил вес бериллия с С 14 по 9. Это поместило бериллий в группу 2 выше магния, свойства которого он больше походил на то, чем был расположен над азотом. В все Менделеев обнаружил, что 17 элементов пришлось переместить на новые позиции из тех указывается строго атомным весом, чтобы их свойства коррелировали с другими элементы.Эти изменения указали на то, что в принятом атомарном веса некоторых элементов (атомные веса рассчитывались путем объединения весов, вес элемента, который сочетается с данным весом стандарта.) Однако даже после того, как были внесены поправки путем переопределения атомных весов, некоторые элементы все еще нужно было расположить вне порядка их атомных весов. Из пробелов присутствующий в его таблице, Менделеев предсказал существование и свойства неизвестных элементы, которые он назвал эка-алюминием, эка-бором и эка-кремнием.Элементы Галлий, скандий и германий были обнаружены позже, чтобы полностью соответствовать его предсказаниям. хорошо. Помимо того, что таблица Менделеева была опубликована раньше Мейерса, его работа была более обширной, предсказывая новые или отсутствующие элементы. Во всем Менделеева предсказал существование 10 новых элементов, семь из которых были в конечном итоге открыты – остальные три, атомные веса 45, 146 и 175 не существуют. Он также был неверно в предположении, что пары элементов аргон-калий, кобальт-никель и теллур-йод следует поменять местами из-за неточной атомной веса.Хотя эти элементы и нужно было поменять местами, это произошло потому, что недостатка в рассуждении о том, что периодичность является функцией атомного веса.
Открытие благородных газов
В 1895 году лорд Рэлей сообщил об открытии нового газообразного элемента под названием аргон, который оказался химически инертным. Этот элемент не подходил ни к одной из известных периодических групп. В 1898 году Уильям Рэмси предложил поместить аргон в периодическую таблицу между хлором и калием в семье с гелием, несмотря на то, что атомный вес аргона был больше, чем у калия.Эта группа была названа «нулевой» из-за нулевой валентности элементов. Рэмси точно предсказал будущее открытие и свойства неона.Атомная структура и периодическая таблица
Хотя таблица Менделеева продемонстрировала периодическую природу элементов, на долю открытий ученых 20 века оставалось только объяснить, почему свойства элементов периодически повторяются.В 1911 году Эрнест Резерфорд опубликовал исследования рассеяния альфа-частиц тяжелыми ядра атомов, которые привели к определению заряда ядра.Он продемонстрировал что заряд ядра на ядре был пропорционален атомному весу элемент. В том же 1911 г. А. ван ден Брук в серии из двух работ предложил что атомный вес элемента был примерно равен заряду на атом. Этот заряд, позже названный атомным номером, можно было использовать для нумерации элементы в периодической таблице. В 1913 году Генри Мозли (см. рисунок) опубликовал результаты своих измерений длин волн рентгеновские спектральные линии ряда элементов, показавшие, что упорядочение длин волн рентгеновского излучения элементов совпадали с порядком элементов по атомному номеру.С открытием изотопов элементов, стало очевидно, что атомный вес не играл существенной роли в периодической закона, как предлагали Менделеев, Мейерс и другие, но, скорее, свойства элементы периодически менялись в зависимости от атомного номера.
На вопрос, почему существует периодический закон, ответили по мере развития ученых. понимание электронной структуры элементов, начиная с Нильса Исследования Бора организации электронов в оболочки через Г.Н. Льюис (см. картинку) открытия связывающих электронных пар.
Современная периодическая таблица
Последние важные изменения в таблице Менделеева явились результатом работы Гленна Сиборга. в середине 20 века. Начиная с его открытия плутония в 1940, он открыл все трансурановые элементы от 94 до 102.
