Изобразить строение атома – ядро, электронная оболочка. Понятие о химическом элементе. Схемы строения атомов на примере химических элементов третьего периода
- Комментариев к записи Изобразить строение атома – ядро, электронная оболочка. Понятие о химическом элементе. Схемы строения атомов на примере химических элементов третьего периода нет
- Советы абитуриенту
Строение атома. Детальные поурочные планы
Дополнительные сочиненияУрок посвящен формированию представлений о сложном строении атома. Рассматривается состояние электронов в атоме, вводятся понятия «атомная орбиталь и электронное облако», формы орбиталей (s-, p-, d-орбитали). Также рассматриваются такие аспекты, как максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням и подуровням в атомах элементов первых четырех периодов, валентные электроны s-, p – и d-элементов. Приводится графическая схема строения электронных слоев атомов (электронно-графическая формула).
Тема: Строение атома. Периодический закон Д. И. Менделеева
Урок: Строение атома
1. Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Табл. 1
атом | ||
ядро | электроны | |
протоны | нейтроны | |
p+ | no | e- |
Масса протона | Масса нейтрона | Масса электрона |
1,0073 а. е.м. | 1,0087 а. е.м. | 0,0005 а. е.м. |
Заряд протона | Заряд нейтрона | Заряд электрона |
+1 | 0 | -1 |
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами ( nucleus – ядро). Их заряды и массы в атомных единицах массы (а. е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов. «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
2. Изотопы
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12С или С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д. И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35Cl и37Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
Аr(Cl)=0,75.35+0,25.37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
3. Основные модели строения атома
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
4. Формы атомных орбиталей
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью. Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода, в котором находится данный элемент в таблице Д. И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей.
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1s). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали: 2s2ppp. На третьем уровне: 3s3ppp3ddddd.
Кроме движения вокруг ядра, электроны обладают еще движением, которое можно представить, как их движение вокруг собственной оси. Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Максимальное число электронов на энергетическом уровне определяется по формуле N=2n2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
Табл. 2
Энергетический уровень | N | Электронная конфигурация |
1-ый | 2 | 1s2 |
2-ой | 8 | 2s22p6 |
3-ий | 18 | 3s23p63d10 |
4-ый | 32 | 4s24p64d104f14 |
В зависимости от того, на какой орбитали находится последний электрон, различают s, p-, d-элементы. Элементы главных подгрупп относятся к s, p-элементам. В побочных подгруппах находятся d-элементы
5. Примеры написания электронно-графических формул атомов
Графическая схема строения электронных слоев атомов (электронно-графическая формула).
Для описания расположения электронов на атомных орбиталях используют электронную конфигурацию. Для её написания в строчку пишутся орбитали в условных обозначениях (s-, p-, d-, f-орбитали), а перед ними – числа, обозначающие номер энергетического уровня. Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
Рис. 5
Графически распределение электронов на атомных орбиталях можно представить в виде ячеек. Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали – семь. В одной ячейке может находиться 1 или 2 электрона. Согласно правилу Гунда, электроны распределяются на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одному, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Такие электроны называют спаренными. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
См. рис. 6 для атома 7N.
Рис. 6
Электронная конфигурация атома скандия
21Sc: 1s2 2s22p63s23p64s23d1
Электроны внешнего энергетического уровня называются валентными. 21Sc относится к d-элементам.
Подведение итога урока
На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Учащиеся узнали, что такое форма орбиталей (s, p-, d-орбитали), каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s-, p – и d-элементы. Приведена графическая схема строения электронных слоев атомов (электронно-графическая формула).
Список литературы
1. Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. А. В. Мануйлов, В. И. Родионов. Основы химии. Интернет-учебник.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok. ru .
2. Hemi. nsu. ru .
3. Chemport. ru .
4. Химик .
Домашнее задание
1. №№5-7 (с. 22) Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Напишите электронные формулы для следующих элементов: 6C, 12Mg, 16S, 21Sc.
3. Элементы имеют следующие электронные формулы: а) 1s2 2s2 2p4.б) 1s2 2s2 2p6 3s2 3p1. в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Какие это элементы? Напишите их латинские символы и названия на латинском и русском языках.
dp-adilet.kz
Строение атома. Квантово-механическая модель атома
В нижеприведенной статье рассказывается об атоме и его строении: как его открывали, как развивали теорию в своих умах и при проведении экспериментов мыслители и ученые. Квантово-механическая модель атома как самая современная на сегодняшний день наиболее полно описывает его поведение и частицы, входящие в состав. О ней и ее особенностях читайте ниже.
Понятие атома

Химически неделимой минимальной частью химического элемента с набором характерных для него свойств является атом. В него входят электроны и ядро, которое, в свою очередь, содержит положительно заряженные протоны и незаряженные нейтроны. Если в нем содержится одинаковое число протонов и электронов, то сам атом будет электрически нейтральным. В ином случае у него появляется заряд: положительный или отрицательный. Тогда атом называется ионом. Таким образом осуществляется их классификация: химический элемент определяется количеством протонов, а его изотоп — нейтронами. Связываясь друг с другом на основе межатомных связей, атомы образуют молекулы.
Немного истории
Впервые об атомах заговорили древнеиндийские и древнегреческие философы. А в период семнадцатого и восемнадцатого веков химики подтвердили идею, экспериментально доказав, что некоторые вещества нельзя расщеплять на составляющие их элементы посредством химических опытов. Однако с конца девятнадцатого до начала двадцатого веков физики открыли субатомные частицы, благодаря чему стало понятно, что атом не является неделимым. В 1860 году химики сформулировали понятия атома и молекулы, где атом стал наименьшей частицей элемента, который входил в состав как простых, так и сложных веществ.
Модели строения атома
- Кусочки материи. Демокрит считал, что свойства веществ могут быть определены массой, формой и другими параметрами, которые характеризуют атомы. Например, огонь имеет острые атомы, из-за чего имеет способность обжигать; твердые тела содержат шероховатые частицы, благодаря чему сцепляются друг с другом очень крепко; в воде они гладкие, поэтому она имеет возможность течь. По Демокриту, даже человеческая душа состоит из атомов.
- Модели Томсона. Ученый рассматривал атом как положительно заряженное тело, внутри которого находятся электроны. Эти модели опроверг Резерфорд, проведя свой знаменитый опыт.
- Ранние планетарные модели Нагаоки. В начале двадцатого века Хантаро Нагаока предложил модели ядра атома, подобные планете Сатурн. В них вокруг маленького ядра, заряженного положительно, вращались объединенные в кольца электроны. Эти версии так же, как и предыдущие, оказались ошибочными.
- Планетарные модели Бора-Резерфорда. После проведения нескольких экспериментов Эрнест Резерфорд предположил, что атом подобен планетной системе. В нем электроны передвигаются по орбитам вокруг ядра, которое заряжено положительно и находится в центре. Но классическая электродинамика противоречила этому, так как, по ней, электрон, двигаясь, излучает электромагнитные волны, а потому теряет энергию. Бор ввел специальные постулаты, по которым электроны не излучали энергию, находясь при этом в некоторых специфических состояниях. Получалось, что классическая механика оказалась неспособной описать эти модели строения атома. Это в дальнейшем привело к появлению квантовой механики, позволяющей объяснить как данное явление, так и многие другие.
Квантово-механическая модель атома

Эта модель является развитием предыдущей. Квантово-механическая модель атома предполагает, что в ядре атома находятся не имеющие заряд нейтроны и положительно заряженные протоны. Вокруг него расположены отрицательно заряженные электроны. Но по квантовой механике, электроны не движутся по заранее заданным определенным траекториям.Так, в 1927 году В. Гейзенберг озвучил принцип неопределенности, по которому представляется невозможным точное определение координаты частицы и ее скорости или импульса.
Химические свойства электронов определены их оболочкой. В таблице Менделеева атомы расположены согласно электрическим зарядам ядер (речь идет о количестве протонов), нейтроны при этом не влияют на химические свойства. Квантово-механическая модель атома доказала, что основная его масса приходится на ядро, а доля электронов при этом остается незначительной. Она измеряется в атомных единицах массы, которая равна 1/12 массы атома изотопа углерода С12.
Волновая функция и орбиталь
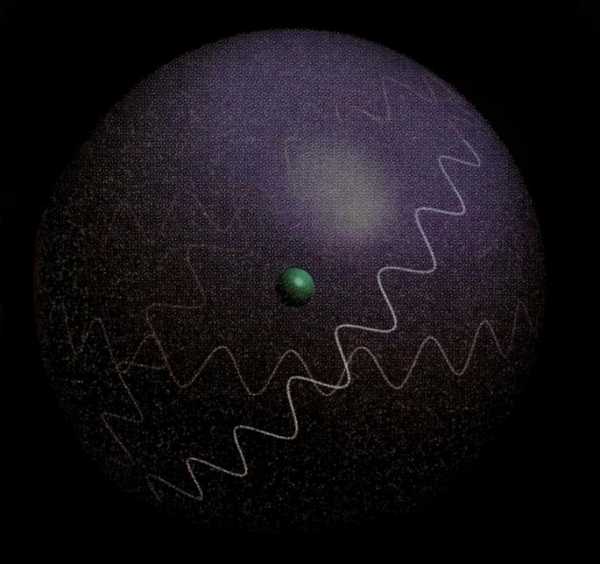
Согласно принципу В. Гейзентберга, нельзя говорить со стопроцентной уверенностью о том, что электрон, который имеет определенную скорость, находится в какой-либо конкретной точке пространства. Для того чтобы описать свойства электронов, используют волновую функцию пси.
Вероятность обнаружения частицы в конкретное время прямо пропорциональна квадрату ее модуля, который вычислен для определенного времени. Пси в квадрате называют плотностью вероятности, которая характеризует электроны вокруг ядра в виде электронного облака. Чем она будет больше, тем вероятность электрона в определенном пространстве атома будет выше.
Для лучшего понимания можно представить наложенные фотографии одна на другую, где зафиксированы положения электрона в разные моменты времени. В том месте, где точек будет больше и облако станет самым плотным, и наиболее высока вероятность нахождения электрона.
Рассчитано, например, что квантово-механическая модель атома водорода включает в себя наибольшую плотность электронного облака, находящегося на расстоянии 0,053 нанометра от ядра.
Орбита из классической механики заменена в квантовой электронным облаком. Волновая функция электрона пси здесь называется орбиталью, которая характеризуется формой и энергией электронного облака в пространстве. Применительно к атому имеется в виду пространство вокруг ядра, в котором нахождение электрона является наиболее вероятным.
Невозможное — возможно?

Как и вся теория, квантово-механическая модель строения атома совершила поистине революцию в научном мире и среди обывателей. Ведь и по сей день трудно представить, что одна и та же частица в один и тот же момент времени может находиться одновременно не в одной, а в разных местах! Для защиты устоявшихся укладов говорят, что в микромире происходят события, которые немыслимы и не являются таковыми в макромире. Но так ли это на самом деле? Или люди просто боятся даже допустить возможность того, что «капля подобна океану и океан — капле»?
fb.ru
Строение атома и Периодическая система
05-Янв-2015 | комментария 2 | Лолита Окольнова
Задание А1 ГИА по химии —
Строение атома. Строение электронных оболочек атомов
В этом вопросе традиционно рассматривается:
- строение s-, p- и d-элементов
- соединения элементов (высшие оксиды, гидриды и т.д.)
- графические схемы строения атомов
1 вариант:
Электронные слои соответствуют периодам в Периодической системе.
В каком периоде находится элемент, столько у него электронных слоев.
Al и S оба в третьем периоде, значит, у них одинаковое число слоев, остальные в разных.
Ответ: 1)
2 вариант:
Количество электронов во внешнем слое соответствует № группы в Периодической системе
в III группе находится Al, у него 3 электрона на внешнем слое
Ответ: 3)
3 вариант:
Здесь нужно сначала определить элемент, потом уже выбрать соединение, которое он образует.
Итого у атома 16 электронов (2+8+6). Получается, что этот элемент — S. Можно проверить себя — у атома серы 3 энергетических уровня (3 период), электроны расписаны в задании по трем слоям.
У элемента высшая с.о. (степень окисления) соответствует номеру группы в Периодической системе
Низшая с.о. у элементов I-III групп равна № группы, с IV по VII = № группы-8
Низшая степень окисления проявляется в соединениях с окончанием -ид — гидриды, сульфиды, галогениды и т.д. (кроме оксидов)
В нашем случае высший оксид образует элемент в высшей с.о. У серы высшая с.о. = № группы = 6, значит, оксид будет SO3
Ответ: 2)
Итого 2+8+4 = 14 электронов. Кремний — Si. Элемент находится в IV группе, значит, низшая с.о. = -4. Водородное соединение — гидрид — Sih5.
Ответ: 3)
4 вариант:
«обратная» задача
С.о.+6 возможна для элемента, располагающегося в VI группе периодической системы. Посчитаем данные количества электронов:
1) 16 — S
2) 20 — Ca
3) 13 — Al
4) 8 — O
В VI группе находятся два подходящих элемента — O и S. Для кислорода с.о.+6 невозможна, значит, подходящий нам вариант — S
Ответ: 1)
5 вариант
схемы
Считаем электроны — на рисунке их 7. Такое количество соответствует элементу азоту — N — 2 период V группа главная подгруппа (ее часто обозначают буквой А)
Ответ: 1)
Элемент, находящийся во 2-м периоде VI группе (главной подгруппе), — кислород O — 8 электронов.
Т.к. он находится во втором периоде, то электронных уровней будет всего 2. 2 электрона — на 1s-подуровне и 6 на втором
Ответ: 4)
3-й период V группа главная подгруппа — фосфор P. 15 электронов
можно выбрать ответ просто по сумме, можно рассмотреть электронное строение подробно: 1S22S22p63S23p3 (на первом уровне 2 электрона, на втором — 8, на 3 — 5)
Ответ: 1)
Еще на эту тему:
Обсуждение: “Строение атома и Периодическая система”
(Правила комментирования)distant-lessons.ru
ядро, электронная оболочка. Понятие о химическом элементе. Схемы строения атомов на примере химических элементов третьего периода
Билет № 17
Строение атома: ядро, электронная оболочка. Химический элемент. Схемы строения атомов на примере химических элементов третьего периода.
Опыт. Проведение реакций, подтверждающих качественный состав выданной кислоты (серной или хлороводородной).
1. ПЛАН ОТВЕТА
Строение атома: ядро, электронная оболочка.
Понятие о химическом элементе.
Схемы строения атомов на примере химических элементов третьего периода.
В результате экспериментов, посвященных изучению строения атома, было установлено, что атом состоит из положительно заряженного ядра и электронной оболочки.
Ядро образовано протонами и нейтронами.
Протон — это частица, имеющая положительный заряд (+1).
Нейтрон — это нейтральная частица, заряд ее равен 0.
Из определений следует, что величина заряда ядра атома равна числу протонов и имеет положительное значение.
Электронная оболочка образована электронами, заряд у которых отрицательный. Число электронов равно числу протонов, поэтому заряд атома в целом равен 0 (т. е. атом электронейтральная частица).
Число протонов, а следовательно, заряд ядра и число электронов численно равны порядковому номеру химического элемента.
Практически вся масса атома сосредоточена в ядре. Это связано с тем, что масса электрона настолько меньше массы протона или нейтрона, что ею пренебрегают (не учитывают).
Электроны двигаются вокруг ядра атома, не беспорядочно, а в зависимости от энергии, которой они обладают, образуя так называемый электронный слой.
На каждом электронном слое может располагаться определенное число электронов:
на первом — не больше двух,
на втором — не больше восьми,
на третьем — не больше восемнадцати.
Число электронных слоев определяется по номеру периода, в котором расположен химический элемент.
Число электронов на последнем (внешнем) слое определяется по номеру группы рассматриваемого элемента.
Так, например, кислород расположен во втором периоде VI группы. Из этого следует, что у него два электронных слоя и на внешнем (втором) расположено шесть электронов.
Электронные слои заполняются у атомов постепенно, по мере увеличения общего числа электронов, которое соответствует порядковому номеру химического элемента. В сумме на первых двух электронных слоях может располагаться не более 10 электронов, т. е. элементом, завершающим второй период, является неон (Ne).
У атомов третьего периода в атоме находится три электронных слоя. Первый и второй электронные слои заполнены электронами до предела. Для первого представителя элементов третьего периода натрия схема расположения электронов в атоме выглядит так:
Na
2 8 1
Из схемы видно, что атом натрия имеет заряд ядра + 11. Электронную оболочку атома составляют 11 электронов. На первом электронном слое находится два электрона, на втором — восемь, а на третьем — один электрон. У магния, как элемента II группы этого периода, на внешнем электронном слое находится уже два электрона:
Mg
2 8 2
Для остальных элементов периода изменение строения атома происходит аналогично. У каждого последующего элемента, в отличие от предыдущего, заряд ядра больше на одну единицу и на внешнем электронном слое расположено на один электрон больше. Число электронов, располагающихся на внешнем электронном слое, равно номеру группы.
Завершает период аргон. Заряд его ядра +18. Это элемент VIII группы, поэтому на внешнем электронном слое его атома находится восемь электронов:
Ar
2 8 8
Далее можно сделать выводы и об изменении свойств элементов в периоде.
Любой период (кроме первого) начинается типичным металлом. В третьем периоде это натрий Na. Далее следует магний Mg, также обладающий ярко выраженными металлическими свойствами. Следующий элемент в периоде — алюминий А1. Это ам-фотерный элемент, проявляющий двойственные свойства (и металлов и неметаллов). Остальные элементы в периоде — неметаллы: кремний Si, фосфор Р, хлор С1. И заканчивается период инертным газом аргоном Аг.
Таким образом, в периоде происходит постепенное ослабление металлических свойств и возрастание свойств неметаллов. Такое изменение свойств объясняется увеличением числа электронов на внешнем электронном слое: от 1—2, характерных для металлов, и заканчивая 5—8 электронами, соответствующими элементам-неметаллам.
2. ОПЫТ
Серная и хлороводородная кислоты при диссоциации в водном растворе образуют ионы Н+, Сl–, SO42-
НС1 Н+ + Сl–
H2S04 2Н+ + SO42–
Реактивом на ион Н+ служит раствор индикатора: лакмус краснеет, а метиловый оранжевый — розовеет.
Реактивом на сульфат-ион SO42- является ион Ва2+ . Если к серной кислоте добавить раствор хлорида бария, то выпадет белый осадок сульфата бария:
ВаС12 + H2SO4 = BaSO4↓ + 2НС1
Ва2+ + SO42-= BaSO4↓
3. Реактив на хлорид-ион Сl– — растворимые соли серебра, например нитрат AgN03. При их взаимодействии образуется белый осадок хлорида серебра:
AgNO3 + НС1 = AgCl↓ + HNO3
Ag+ + Сl– = AgCl↓
koledj.ru



