Строение атома кто открыл – “Строение атома. Кто открыл явление радиоактивности? Кто ввел в физику термин «радиоактивность»? Какой химический элемент стал первым известным радиоактивным.”. Скачать бесплатно и без регистрации.
- Комментариев к записи Строение атома кто открыл – “Строение атома. Кто открыл явление радиоактивности? Кто ввел в физику термин «радиоактивность»? Какой химический элемент стал первым известным радиоактивным.”. Скачать бесплатно и без регистрации. нет
- Советы абитуриенту
- Атом — Википедия
- История открытия атома и его строения
- Открытие атома
- История развития представлений о строении атома » HimEge.ru
- Атом — сложная частица
- Открытие атома
- Строение атома | himiyaklas.ru
- У каждого вещества есть свои свойства, которые отличают его от других веществ. Чем обусловлены эти свойства?
- Как устроен атом?
- Чем отличаются атомы разных химических элементов друг от друга?
- Теперь поговорим о массе.
- Теперь следующий резонный вопрос: почему если число нейтронов и протонов в ядре число целое, масса их по 1 а.е.м., то в периодической системе масса атома – дробное число. У серы, например: 32,066.
- Строение электронной оболочки.
- Заполнение электронных орбиталей.
- Основное и возбужденное состояния атома.
- Электронная конфигурация иона.
Атом — Википедия
Материал из Википедии — свободной энциклопедии
 Сравнительный размер атома гелия и его ядра
Сравнительный размер атома гелия и его ядраА́том (от др.-греч. ἄτομος «неделимый[1], неразрезаемый[2]») — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств[1][3].
Атомы состоят из ядра и электронов (точнее электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом[1]. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер[5].
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
ru.wikipedia.org
История открытия атома и его строения
09.10.2015Физика относится к науке полной тайн и загадок, а одной из увлекательных страниц ее истории, несомненно, является открытие строения сложного атома. Так к концу XIX века в обществе витало много предположений, что строение атома не так уж и просто. Все это стало известно благодаря открытию электролиза и самого электрона. Теории о существовании атома, как неделимой частицы, которая нас окружает, уходит своими корнями еще в далекое прошлое. Само понятие атом существовало еще и до н.э. Ученый Демокрит был убежденным исследователем атома. Он представлял себе картину мира следующим образом.
Все тела состоят из атомов, у которых неделимая и неизменная форма, число этих атомов неограниченно, так же как и число их типов, они смело могут образовывать различные соединения, благодаря различным крючкам и выступам, ну и ко всему они находятся в постоянном движении. В России огромное значение в исследовании атомной теории внес Ломоносов, разделяя две части материи – элементы и корпускулы. Основываясь на этих данных, ученые физики продолжали философствовать о строении атома, и, вскоре, после открытия электрона в 1897 году, Дж. Дж. Томсоном была представлена модель атомного строение.
Согласно модели Томсона атом имеет положительный заряд, который равномерно заполняет весь его объем, внутри его расположены электроны, тем самым атом несколько напоминает пудинг с изюмом. Предполагалось, что электронов большое количество, и они могут находиться в движении. Сам атом являлся электро-нейтральным. Устойчивость атома определяло расположение электронов. Своей разработкой Томсон трактовал ряд физических явлений у некоторых веществ.
Вскоре была доказана несостоятельность этой теории. Модель строения атома Томсона противоречила опытам, которые были проведены Резерфордом. Резерфорд – это выдающийся ученый, основатель некоторых направлений в физики, лауреат Нобелевской премии. В начале 19 столетия, благодаря своим исследованиям, он доказал то, что атом имеет ядро. Оно заряжено положительно и занимает небольшую часть у атома, вокруг самого ядра двигаются электроны. Эти данные были опубликованы в Лондонском журнале по философии 1911 года.
Д.И. Менделеев, открыв свой закон, подтвердил то, что между химическими элементами есть своя закономерность. Отсюда следовал вывод – все атомы тоже имеют что-то общее. До конца XIX века, считалось, что атом не может разрушаться, но в дальнейшем были сделаны открытия по строению атома, оно достаточно сложное, ко всему у него есть способность к превращениям. Так было доказано выделение электронов, получение рентгеновских лучей (В. Рентген в 1895 году) и радиоактивного излучения (А. Беккерелей в 1896 году).
Большой шаг в исследовании строения атома сделал Н. Бор. Им был сделан анализ всех данные, что привело его к выводу – описание систем атомов не должно ограничиваться привычными представлениями в физики. Им были написаны постулаты – о стационарных состояниях и правило частот. Его теория оказала огромный клад в развитие физики, химии, выяснении структуры атома, спектроскопии и т.д. Но оставались вещи, которые она и не могла объяснить. Так Бор представлял, что движение электронов просто механическое, хотя оно не являлось таковым. В дальнейшем это было объяснено с помощью новой теории кванта.
Открытие урана в 1939 году доподлинно подтвердило, что атом способен делится. Ко всему он состоит не только из мелких частиц. Эти части способны к самопроизвольному испусканию при радиоактивном разрушении. Атом еще и способен давать излучение, и которое может быть не только видимое, но также и электромагнитное (пример: х-лучи).
Рейтинг статьи: 14468 просмотров
Автор: Елена Мазина
Открытия и атом [ВИДЕО]
geo-storm.ru
Открытие атома
План:
- Введение: строение атома.
- Атом как целое
- Структура атома
а) Опыты Резерфорда
б) Планетарная модель атома Резерфорда
в) Квантовые постулаты Бора
- Лазеры
а) История создания лазера
б) Устройство лазера
в) Свойства лазера
· применения лазера в ювелирной отрасли
· применения лазера в военном деле
· применения лазера в медицине
· лазеры как средство записи и обработки информации
- Заключение.
- Список использованной литературы.
Раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм. Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1–2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм. Атомы очень малы – их размеры порядка 10
АТОМ КАК ЦЕЛОЕ
Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита , много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур принял атомную теорию, и в первом веке до н.э., один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель, один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент.
В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе «неделимых частиц». Р.Бойль (1627–1691) и Исаак Ньютон (1643–1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах «атомов». попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие – английскому физику Д.Д. Томсону.
Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся “планеты” – электроны. При незначительных смещениях электроны возбуждают электромагнитные волны. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис.1.). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Рисунок 1.Модель атома Дж. Томсона .
В атоме Томсона положительное электричество “распределено” по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома – были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например, при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно, атомы являются сложными образованиями, построенными из более мелких «составных частей». Уподобление атома планетной системе делалось еще в конце 19 века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Представления о строении атома радикально изменились в начале 20 века под влиянием новых теоретических идей и экспериментальных данных.
Другие доказательства сложной структуры атома. В то самое время, когда Томсон и другие исследователи экспериментировали с катодными лучами, открытие рентгеновского излучения и радиоактивности принесло дополнительные доказательства сложной структуры атома. В 1895 В.Рентген (1845–1923) случайно обнаружил таинственное излучение («Х -лучи»), проникавшее сквозь черную бумагу, которой он оборачивал трубку Крукса при исследовании зеленой люминесцирующей области электрического разряда. Х -лучи вызывали свечение удаленного экрана, покрытого кристаллическим платиноцианидом бария. Рентген выяснил, что различные вещества разной толщины, введенные между экраном и трубкой, ослабляют свечение, но не гасят его полностью. Это свидетельствовало о чрезвычайно высокой проникающей способности Х -лучей. Рентген установил также, что эти лучи распространяются прямолинейно и не отклоняются под действием электрических и магнитных полей. Возникновение такого невидимого проникающего излучения при бомбардировке электронами различных материалов было чем-то совершенно новым. Было известно, что видимый свет от трубок Гейсслера состоит из отдельных «спектральных линий» с определенными длинами волн и, значит, связан с «колебаниями» атомов, имеющими дискретные частоты. Существенная особенность нового излучения, отличавшая его от оптических спектров, помимо высокой проникающей способности, состояла в том, что оптические спектры элементов с последовательно возраставшим числом электронов полностью отличались друг от друга, тогда как спектры X -лучей очень незначительно изменялись от элемента к элементу.
mirznanii.com
История развития представлений о строении атома » HimEge.ru
Все тела живой и неживой природы, несмотря на их разнообразие, состоят из мельчайших частиц — атомов. Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»). Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.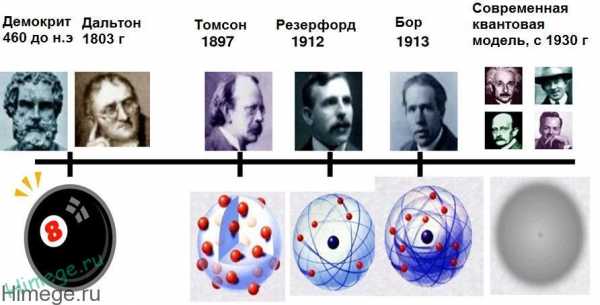
Первые представления об атоме
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.е. неделимой частью яблока). Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению; все атомы одинаковы, но они различаются внешне (атомы воды, например, гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они зацепляются друг за друга, что придает железу свойства твердого тела). Представления Демокрита были умозрительными.
Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Атоми́зм — натурфилософская теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц — атомов. (В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы).
Основы атомной теории строения вещества
 В 1808 г. физик Дальтон Джон (1766–1844) возродил атомизм, доказал реальность существования атомов. Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
В 1808 г. физик Дальтон Джон (1766–1844) возродил атомизм, доказал реальность существования атомов. Он писал: «Атомы — химические элементы, которые нельзя создать заново, разделить на более мелкие частицы, уничтожить путем каких-либо химических превращений. Любая химическая реакция просто изменяет порядок группировки атомов». Джон Дальтон ввёл понятие «атомный вес», первым рассчитал атомные веса (массы) ряда элементов и составил первую таблицу их относительных атомных весов, заложив тем самым основу атомной теории строения вещества.
Дальтон был одним из самых знаменитых и уважаемых учёных своего времени, ставший широко известным благодаря своим новаторским работам в разных областях знания. Он впервые (1794) провёл исследования и описал дефект зрения, которым страдал сам, — цветовая слепота, позже названный в его честь дальтонизмом; открыл закон парциальных давлений (закон Дальтона) (1801), закон равномерного расширения газов при нагревании (1802), закон растворимости газов в жидкостях (закон Генри-Дальтона). Установил закон кратных отношений (1803), обнаружил явление полимеризации (на примере этилена и бутилена).
Однако вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
В 1897 г. английский физик Дж. Томсон изучая катодные лучи, пришел к выводу, что атомы любого вещества содержат отрицательно заряженные частицы, которые он назвал электронами. Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества. Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью,в положительно заряженной сфере находится несколько электронов, так что атом подобен кексу, в котором роль изюминок играют электроны.
Ядерная модель атома (планетарная)
Резерфорд бомбардировал α-частицами атомы тяжелых элементов (золото, серебро, медь и др.). α-частицы – это полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
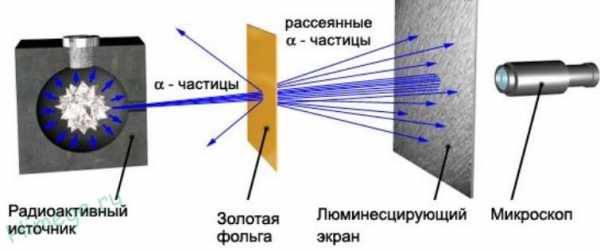
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Он находился в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад.
Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома (планетарная):
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование. В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома. Отсюда следует, что к явлениям атомных масштабов законы классической физики неприемлемы.
Датским физик Нильс Бор (1885 — 1962) считал что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и «спасающих») атом Резерфорда. Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.
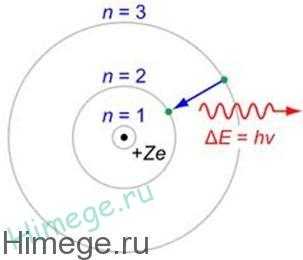 Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E. В стационарном состоянии атом не излучает.
Первый постулат Бора гласит: атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия E. В стационарном состоянии атом не излучает.
Согласно второму постулату Бора излучение света происходит при переходе атома из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излученного фотона равна разности энергий стационарных состояний.
Квантовая теория строения атома
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности Гейзенберга служит соотношение
∆x∙m∙∆v > ћ/2,
где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
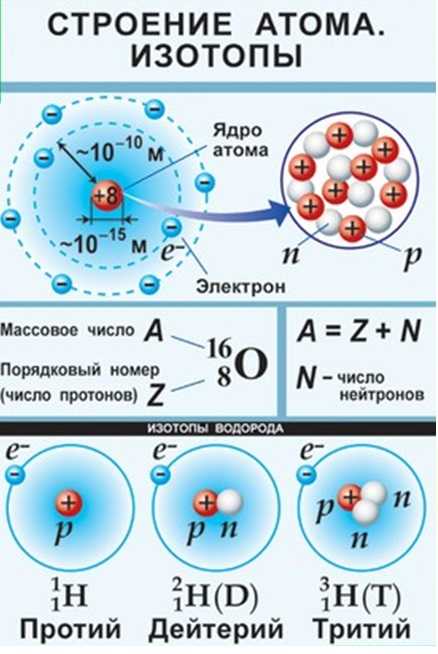
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
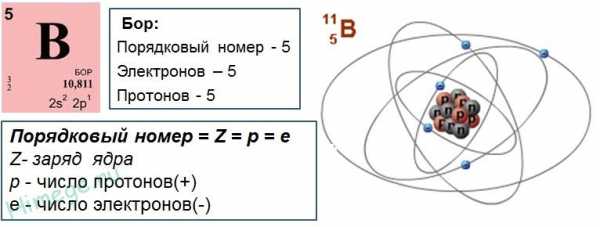
Последнее положение было сформулировано после того, как в 1920 г. Э.Резерфорд открыл протон, а в 1932 г. Дж.Чедвик — нейтрон.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями:
Z = А — N,
N = А — Z,
А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики (механику, применимую к движению обычных тел и описываемую законами Ньютона, стали называть классической механикой). Наибольший вклад в развитие этой теории внесли француз Л. де Бройль, немец В.Гейзенберг, австриец Э.Шредингер, англичанин П.Дирак. Впоследствии каждый из этих ученых был удостоен Нобелевской премии.
Квантовая механика — математически очень сложная теория. Но главная трудность не в этом. Процессы, которые описывает квантовая механика, — процессы микромира — недоступны не только восприятию нашими органами чувств, но и воображению. Люди лишены возможности представить их себе наглядно в полной мере, так как они совершенно отличны от тех макроскопических явлений, которые человечество наблюдало на протяжении миллионов лет. Человеческое воображение не создает новые, а лишь комбинирует известные, поэтому практически невозможно на нашем макроскопическом языке описать поведение фотонов и других частиц.
См. также Современная теория строения атома
himege.ru
Атом — сложная частица
История развития представлений о строении атома
Понятие «атом» было известно ещё в древности и использовалось для описания представлений об устройстве окружающего мира древнегреческими философами, так Левкипп (500-200 гг. до н.э.) утверждал, что мир состоит из мельчайших частиц и пустоты, а Демокрит назвал эти частицы атомами и считал, что они существуют вечно и способны двигаться. По представлениям древних философов атомы были настолько малы, что не могли быть измерены, а форма и внешнее различие придают свойства определенным телам. Например, атомы железа должны обладать «зубцами», чтобы зацепляться друг за друга и образовывать твердое тело, атомы же воды, напротив, должны быть гладкими и перекатываться, чтобы обеспечивать воде текучесть. Первое предположение о способности атомов самостоятельно взаимодействовать друг с другом было сделано Эпикуром.
Создателем атомно-молекулярного учения считают М.В. Ломоносова, он различал в строении вещества две ступени: элементы (атомы, в нашем понимании) и корпускулы (молекулы). Ломоносов утверждал, что простые вещества состоят из атомов одного вида, а сложные – из различных атомов.
Всемирное признание атомно-молекулярная теория получила благодаря Дж. Дальтону, который, в отличии от древнегреческих философов при формулировании своих утверждений опирался только на экспериментальные данные. Дж. Дальтон ввел одну из важнейших характеристик атома – атомную массу, относительные значения которой были установлены для ряда элементов. Но, несмотря сделанные им открытия атом считали неделимым.
После получения экспериментальных доказательств (конец XIX начало XX века) сложности строения атома: открытие фотоэффекта (испускание носителей электрического заряда с поверхности металлов при их освещении), катодных (поток отрицательно заряженных частиц – электронов, в трубке, в которой имеется катод и анод) и рентгеновских лучей (испускание веществами сильного электромагнитного излучения, подобного видимому свету, но более высокочастотного, при действии на эти вещества катодных лучей), радиоактивности (самопроизвольное превращение одного элемента в другой, при котором происходит испускание электронов, положительно заряженных и других частиц, а также рентгеновского излучения) было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой. Эти открытия дали толчок к созданию первых моделей строения атома.
Модели строения атома
Одна из первых моделей атома была разработана У. Томсоном (1902) По мнению У. Томсона атом – сгусток положительно заряженной материи, внутри – равномерно распределены электроны, а атом водорода представляет собой положительно заряженный шар, внутри которого электрон (рис. 1а). Эту модель была доработана Дж. Томсоном (1904) (рис.1б). В том же году японский физик Х. Нагаока предложил «сатурнианскую модель» строения атома, предполагая, что атом подобен планете Сатурну – в центре ядро, окруженное кольцами, по которым движутся электроны (рис.1в).
Ещё одну модель предложил немецкий физик Филипп фон Ленард, согласно которой атом состоит из нейтральных частиц крайне малых размеров (вследствие чего, большая часть атома – пустота), каждая из которых – электрический дуплет (рис. 1г).
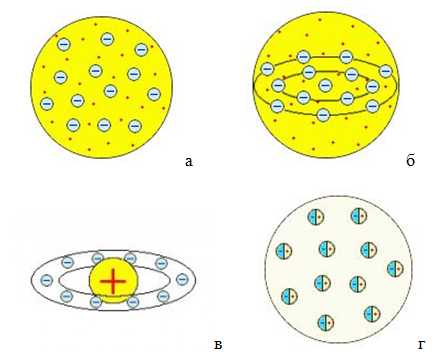
Рис. 1. Модели строения атома: а – У. Томсона; б – Дж.Томсона; в – Х. Нагаока; г – Ф.Ленарда
После опытов с -частицами, в 1911г. Резерфорд предложил так называемую планетарную модель строения атома, похожую на строение солнечной системы (маленькое положительно заряженное ядро в центре атома, в котором заключена почти вся масса атома, вокруг которого по орбитам движутся электроны). Планетарная модель подверглась дальнейшему развитию в работах Н. Бора, А. Зоммерфельда и др.
Современная модель строения атома основана на знаниях квантовой механики, главный тезис которой – микрочастицы имеют волновую природу, а волны — свойства частиц. Квантовая механика рассматривает вероятность нахождения электрона вокруг ядра. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Изотопы
Изотопы – атомы, обладающие одинаковым зарядом ядра, но разной массой. Такие атомы обладают практически одинаковым строением электронной оболочки и принадлежат одному элементу. Исследование природных соединений разных элементов показывает существование устойчивых изотопов у большинства элементов периодической системы. Для всех элементов периодической системы число изотопов, встречающихся в природе, достигает 280.
Самым ярким примером изотопии можно назвать изотопы водорода –водород, дейтерий и тритий. В природе встречаются водород и дейтерий. Тритий получается искусственно.
Неустойчивые изотопы, т.е., обладающие способностью самопроизвольно распадаться называют радиоактивными изотопами. Они также могут встречаться в природных соединениях некоторых элементов.
Состав ядра атома. Ядерные реакции
В ядре атома содержится множество элементарных частиц, самые важные из которых – протон (p) и нейтрон (n). Масса протона 1,0073 а.е.м., заряд +1, в то время как нейтрон электронейтрален (заряд 0) и обладает массой 1,0087 а.е.м.
Согласно протонно-нейтронной теории строения ядра (Д.Д. Иваненко, Е.Н. Гапон, 1932) ядра всех атомов, исключая водород, состоят из Z протонов и (А-Z) нейтронов (Z – порядковый номер элемента, А – массовое число). Число электронов равно числу протонов.
где N – число нейтронов.
Свойства ядра определяются его составом (чиcлом p и n). Так, например, в атоме кислорода 168О 8 протонов и 16-8=8 нейтронов, что кратко записывается 8p, 8n.
Внутри ядер p и n могут превращаться (при определенных условиях) друг в друга:
где e+ — позитрон (элементарная частица с массой, равной массе электрона т зарядом +1), а и — нейтрино и антинейтрино, элементарные частицы с массой и зарядом равными нулю, отличающимися только спином.
Ядерные реакции – превращения атомных ядер, в результате их взаимодействия с элементарными частицами или друг с другом. При написании уравнений ядерных реакций необходимо учитывать законы сохранения массы и заряда. Например: 2713Al + 42He = 3014Si + 11H.
Особенность ядерных реакций – выделение огромного количества энергии в форме кинетической энергии образующихся частиц или излучения.
Задания:
1. Определите число протонов, нейтронов и электронов в атомах S, Se, Al, Ru.
2. Закончите ядерные реакции: 147N + 42He = ; 126C + 10n =.
Ответы:
1. S: Z= 16, А = 32, следовательно 16p, 16e, 32-16=16n
Se: Z= 34, А = 79, следовательно 34p, 34e, 79-34=45n
Al: Z= 13, А = 27, следовательно 13p, 13e, 27-13=14n
Ru: Z= 44, А = 101, следовательно 44p, 44e, 101-44=57n
2. 147N + 42He = 178О + 11Н
126C + 10n =94Be + 42He
ru.solverbook.com
Открытие атома
План:- Введение: строение атома.
- Атом как целое
- Структура атома
б) Планетарная модель атома Резерфорда
в) Квантовые постулаты Бора
- Лазеры
б) Устройство лазера
в) Свойства лазера
· применения лазера в ювелирной отрасли
· применения лазера в военном деле
· применения лазера в медицине
· лазеры как средство записи и обработки информации
- Заключение.
- Список использованной литературы.
Раздел физики, изучающий внутреннее устройство атомов. Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы. Они имеют массивное ядро, состоящее из протонов и нейтронов, вокруг которого в пустом пространстве движутся электроны. Чтобы составить представление о размерах атома и незаполненности занимаемого им пространства, рассмотрим атомы, составляющие каплю воды диаметром 1 мм. Если мысленно увеличить эту каплю до размеров Земли, то атомы водорода и кислорода, входящие в молекулу воды, будут иметь в поперечнике 1–2 м. Основная же часть массы каждого атома сосредоточена в его ядре, поперечник которого при этом составил всего 0,01 мм. Атомы очень малы – их размеры порядка 10–10–10–9 м, а размеры ядра еще примерно в 100 000 раз меньше (10–15–10–14 м). Поэтому атомы можно «увидеть» только косвенным путем, на изображении с очень большим увеличением . Но и в этом случае атомы не удается рассмотреть в деталях. Наши знания об их внутреннем устройстве основаны на огромном количестве экспериментальных данных, которые косвенно, но убедительно свидетельствуют в пользу сказанного выше.
АТОМ КАК ЦЕЛОЕ
Историю возникновения самых общих представлений об атоме обычно ведут со времен греческого философа Демокрита , много размышлявшего о наименьших частицах, на которые можно было бы поделить любое вещество. Группу греческих философов, придерживавшихся того взгляда, что существуют подобные крошечные неделимые частицы, называли атомистами. Греческий философ Эпикур принял атомную теорию, и в первом веке до н.э., один из его последователей, римский поэт и философ Лукреций Кар, изложил учение Эпикура в поэме «О природе вещей», благодаря которой оно и сохранилось для следующих поколений. Аристотель, один из крупнейших ученых древности, атомистическую теорию не принимал, и его взгляды на философию и науку преобладали впоследствии в средневековом мышлении. Атомистической теории как бы не существовало до самого конца эпохи Возрождения, когда на смену чисто умозрительным философским рассуждениям пришел эксперимент.В эпоху Возрождения начались систематические исследования в областях, именуемых ныне химией и физикой, принесшие с собой новые догадки о природе «неделимых частиц». Р.Бойль (1627–1691) и Исаак Ньютон (1643–1727) исходили в своих рассуждениях из представления о существовании неделимых частиц вещества. Однако ни Бойлю, ни Ньютону не потребовалось детальной атомистической теории для объяснения интересовавших их явлений, и результаты проведенных ими экспериментов не сказали ничего нового о свойствах «атомов». попытки построить модель атома на основе представлений классической электродинамики и механики. В 1904 году появились публикации о строении атома, одни из которых принадлежали японскому физику Хантаро Нагаока, другие – английскому физику Д.Д. Томсону.
Нагаока представил строение атома аналогичным строению солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся “планеты” – электроны. При незначительных смещениях электроны возбуждают электромагнитные волны. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис.1.). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Рисунок 1.
Модель атома Дж. Томсона.
В атоме Томсона положительное электричество “распределено” по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д.И. Менделеева. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том, что в основе всех атомов лежит нечто общее. До конца XIX века в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И, наконец, в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома – были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например, при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно, атомы являются сложными образованиями, построенными из более мелких «составных частей». Уподобление атома планетной системе делалось еще в конце 19 века. Но эту модель было трудно совместить с моделями электродинамики, и она была оставлена, уступив место модели Томсона. Представления о строении атома радикально изменились в начале 20 века под влиянием новых теоретических идей и экспериментальных данных.
Другие доказательства сложной структуры атома. В то самое время, когда Томсон и другие исследователи экспериментировали с катодными лучами, открытие рентгеновского излучения и радиоактивности принесло дополнительные доказательства сложной структуры атома. В 1895 В.Рентген (1845–1923) случайно обнаружил таинственное излучение («Х-лучи»), проникавшее сквозь черную бумагу, которой он оборачивал трубку Крукса при исследовании зеленой люминесцирующей области электрического разряда. Х-лучи вызывали свечение удаленного экрана, покрытого кристаллическим платиноцианидом бария. Рентген выяснил, что различные вещества разной толщины, введенные между экраном и трубкой, ослабляют свечение, но не гасят его полностью. Это свидетельствовало о чрезвычайно высокой проникающей способности Х-лучей. Рентген установил также, что эти лучи распространяются прямолинейно и не отклоняются под действием электрических и магнитных полей. Возникновение такого невидимого проникающего излучения при бомбардировке электронами различных материалов было чем-то совершенно новым. Было известно, что видимый свет от трубок Гейсслера состоит из отдельных «спектральных линий» с определенными длинами волн и, значит, связан с «колебаниями» атомов, имеющими дискретные частоты. Существенная особенность нового излучения, отличавшая его от оптических спектров, помимо высокой проникающей способности, состояла в том, что оптические спектры элементов с последовательно возраставшим числом электронов полностью отличались друг от друга, тогда как спектры X-лучей очень незначительно изменялись от элемента к элементу.
Подобное явление было обнаружено в 1896 А. Беккерелем (1852–1908). Беккерель открыл радиоактивность, используя соли урана в процессе изучения люминесценции солей под действием света и ее связи с люминесценцией стекла в рентгеновской трубке. В одном из опытов наблюдалось почернение фотопластинки, завернутой в черную бумагу и находившейся около урановой соли в полной темноте. И хоть вскоре Беккерель потерял интерес к этому предмету, все же это случайное открытие стимулировало интенсивные поиски других примеров естественной радиоактивности и постановку опытов по определению природы испускаемого излучения. И все же большая часть наших основных знаний в области радиоактивности происходит из широких исследований Резерфорда. (В 1898 году Мари и Пьер Кюри открыли еще два радиоактивных элемента – полоний и радий, но не сделали открытий фундаментального значения.) Эрнест Резерфорд считается величайшим физиком-экспериментатором двадцатого столетия. Он является центральной фигурой в области радиоактивности, а также человеком, который положил начало ядерной физике. Помимо своего огромного теоретического значения его открытия получили широкий спектр применения, включая: ядерное оружие, атомные электростанции, радиоактивные исчисления и исследования радиации. Влияние трудов Резерфорда на мир огромно. Оно продолжает расти и, похоже, еще увеличится в будущем.
Резерфорд родился 1871 и вырос в Новой Зеландии. Там он поступил в Кентерберийский колледж и к двадцати трем годам получил три степени (бакалавра гуманитарных наук, бакалавра естественных наук, магистра гуманитарных наук). На следующий год ему присудили право на обучение в Кембриджском университете в Англии, где он провел три года как студент-исследователь под руководством Дж. Дж. Томсона, одного из ведущих ученых того времени. В двадцать семь лет Резерфорд стал профессором физики в университете Макджил в Канаде. Там он работал девять лет и в 1907 году вернулся в Англию, чтобы возглавить физический факультет Манчестерского университета. В 1919 году Резерфорд вернулся в Кембридж, на этот раз как директор Кавендишской лаборатории, и оставался на этом посту до конца жизни. Личность Резерфорда постоянно поражала всех, кто с ним встречался. Он был крупным человеком с громким голосом, беспредельной энергией и заметным недостатком скромности. Когда коллеги отмечали сверхъестественную способность Резерфорда всегда находиться “на гребне волны” научных исследований, он сразу отвечал: “А почему бы и нет? Ведь это я вызвал волну, не так ли?” Немногие ученые стали бы возражать против этого утверждения.
Э. Резерфорд начал свою научную карьеру с разгадки тайн радиоактивности – явления, открытого в 1896 году А. Беккерелем. Важная черта радиоактивности – это связанная с ней энергия. Беккерель, супруги Кюри и множество других ученых считали энергию внешним источником. Но Резерфорд доказал, что данная энергия, которая намного мощнее, чем освобождаемая при химических реакциях, – исходит изнутри отдельных атомов урана! Этим он положил начало важной концепции атомной энергии.
Ученые всегда предполагали, будто отдельные атомы неделимы и неизменяемы. Но Резерфорд (с помощью очень талантливого молодого помощника Фредерика Содди) смог показать, что когда атом испускает альфа – или бета-лучи, он преобразуется в атом иного сорта. Сначала химики не могли в это поверить. Однако Резерфорд и Содди провели целую серию экспериментов с радиоактивным распадом и трансформировали уран в свинец. Также Резерфорд измерил скорость распада и сформулировал важную концепцию “полураспада”. Это вскоре привело к технике радиоактивного исчисления, которое стало одним из важнейших научных инструментов и нашло широкое применение в геологии, археологии, астрономии и во многих других областях.
Э.Резерфорд, исследовав проникающую способность излучения урана, показал, что имеются два типа излучений: очень «мягкое» излучение, которое легко поглощается веществом и которое Резерфорд назвал альфа-лучами, и более проникающее излучение, которое он назвал бета-лучами. Бета-лучи оказались тождественными обычным электронам, или «катодным лучам», возникающим в разрядных трубках. Альфа-лучи, как выяснилось, имеют такие же заряд и массу, как и атомы гелия, лишенные двух своих электронов. Третий тип излучения, названный гамма-лучами, оказался сходен с X-лучами, но обладал еще большей проникающей способностью.
Эта ошеломляющая серия открытий принесла Резерфорду в 1908 году Нобелевскую премию (позже Нобелевскую премию получил и Содди), но его величайшее достижение было еще впереди. Он заметил, что быстродвижущиеся альфа-частицы способны проходить сквозь тонкую золотую фольгу (не оставляя видимых следов!), но при этом слегка отклоняются. Возникло предположение, что атомы золота, твердые, непроницаемые, как “крошечные бильярдные шары” – как ранее считали ученые, – были мягкими внутри! Все выглядело так, будто меньшие и более твердые альфа-частицы могут проходить сквозь атомы золота как высокоскоростная пуля через желе.
Резерфорд с помощью своих сотрудников. Э.Мардсена и Х. Гейгера в 1909-1911 годах применил зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 2.
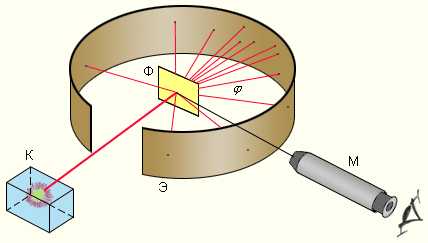 |
| Рисунок 2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп. |
coolreferat.com
Строение атома | himiyaklas.ru
Содержание статьи:
- Почему у атомов разных веществ разные свойства?
- Из чего “сделан” атом?
- Чем отличаются друг от друга атомы разных химических элементов?
- Масса атома.
- Строение электронной оболочки (электронные орбитали, основное и возбужденное состояние, электронные конфигурации атома и электрона).
У каждого вещества есть свои свойства, которые отличают его от других веществ. Чем обусловлены эти свойства?
Тем, какой состав имеет молекула. То есть какими атомами образована молекула, в каком количестве, какими связями соединены эти атомы. Все это определяет свойство молекулы, и соответственно свойство вещества, которое эти молекулы образуют.
Например, свойства воды: прозрачность, текучесть, способность вызывать ржавчину обусловлено именно наличием двух атомов водорода и одного атома кислорода.
Поэтому прежде, чем приступить к изучению свойств молекул (то есть свойств веществ), нужно рассмотреть «кирпичики», которыми эти молекулы образованы. Разобраться в строении атома.
Как устроен атом?
Атомы – это частицы, которые, соединяясь друг с другом, образуют молекулы.
Сам атом состоит из положительно заряженного ядра (+) и отрицательно заряженной электронной оболочки (-). В целом атом электронейтрален. То есть заряд ядра равен по модулю заряду электронной оболочки.
Ядро образовано следующими частицами:
- Протоны. Один протон несет заряд +1. Масса его равна 1 а.е.м (атомная единица массы). Эти частицы обязательно присутствуют в ядре.
- Нейтроны. Нейтрон не имеет заряда (заряд = 0). Масса его равна 1 а.е.м. Нейтронов может не быть в ядре. Это не обязательный компонент атомного ядра.
Таким образом за общий заряд ядра отвечают протоны. Поскольку один нейтрон имеет заряд +1, то заряд ядра равен числу протонов.
Электронная оболочка, как видно из названия образована частицами, которые называются электронами. Если сравнивать ядро атома с планетой, то электроны – это ее спутники. Вращаясь вокруг ядра (пока представим, что по орбитам, а на самом деле по орбиталям), они образуют электронную оболочку.
- Электрон – это очень маленькая частица. Ее масса на столько мала, что принимается за 0. А вот заряд у электрона -1. То есть по модулю равен заряду протона, отличается знаком. Поскольку один электрон несет заряд -1, то общий заряд электронной оболочки равен числу электронов в ней.
Одно важное следствие, раз атом – частица, не имеющая заряда (заряд ядра и заряд электронной оболочки равны по модулю, но противоположены по знаку), то есть электронейтральная, следовательно, число электронов в атоме равно числу протонов.
Чем отличаются атомы разных химических элементов друг от друга?
Атомы разных химических элементов отличаются друг от друга зарядом ядра (то есть числом протонов, и, следовательно, числом электронов).
Как узнать заряд ядра атома элемента? Гениальный отечественный химик Д. И. Менделеев, открыв периодический закон, и разработав таблицу, названную его именем, дал нам возможность сделать это. Его открытие забегало далеко вперед. Когда еще не было известно о строении атома, Менделеев расположил элементы в таблице в порядке возрастания заряда ядра.
То есть порядковый номер элемента в периодической системе – это заряд ядра атома данного элемента. Например, у кислорода порядковый номер 8, соответственно заряд ядра атома кислорода равен +8. Соответственно число протонов равно 8, и число электронов равно 8.
Именно электроны в электронной оболочке определяют химические свойства атома, но об этом чуть позже.
Теперь поговорим о массе.
Один протон – это одна единица массы, один нейтрон – это тоже одна единица массы. Поэтому сумма нейтронов и протонов в ядре называется массовым числом. (Электроны на массу никак не влияют, так как мы пренебрегаем его массой и считаем ее равной нулю).
Атомная единица массы (а. е. м.) – специальная физическая величина для обозначения малых масс частиц, образующих атомы.
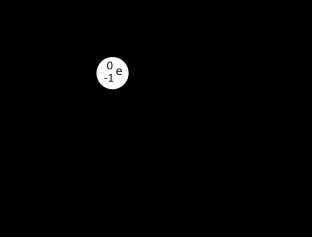
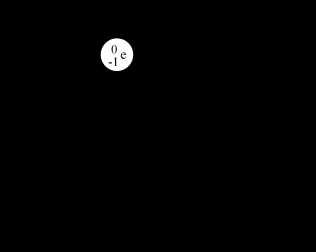

Все эти три атома – атомы одного химического элемента – водорода. Поскольку у них одинаковый заряд ядра.
Чем они будут отличаться? У этих атомов разные массовые числа (из-за разного числа нейтронов). У первого атома массовое число равно 1, у второго 2, у третьего 3.
Атомы одного элемента, различающиеся количеством нейтронов (и, следовательно, массовыми числами) называются изотопами.
У представленных изотопов водорода даже есть свои названия:
- Первый изотоп (с массовым числом 1) называется протий.
- Второй изотоп (с массовым числом 2) называется дейтерий.
- Третий изотоп (с массовым числом 3) называется тритий.
Теперь следующий резонный вопрос: почему если число нейтронов и протонов в ядре число целое, масса их по 1 а.е.м., то в периодической системе масса атома – дробное число. У серы, например: 32,066.
Ответ: у элемента есть несколько изотопов, они отличаются друг от друга массовыми числами. Поэтому атомная масса в периодической таблице – это среднее значение атомных масс всех изотопов элемента с учетом их встречаемости в природе. Эта масса, указанная в периодической системе, называется относительной атомной массой.
Для химических расчетов используются показатели именно такого «усредненного атома». Атомная масса округляется до целого.

Строение электронной оболочки.
Химические свойства атома определяются строением его электронной оболочки. Электроны вокруг ядра располагаются не абы как. Электроны локализуются на электронных орбиталях.
Электронная орбиталь – пространство вокруг атомного ядра, где вероятность нахождения электрона наибольшая.
У электрона есть один квантовый параметр, который называется спин. Если брать классическое определение из квантовой механики, то спин – это собственный момент импульса частицы. В упрощенном виде это можно представить, как направление вращения частицы вокруг своей оси.
Электрон – это частица с полуцелым спином, у электрона спин может быть либо +½ либо -½. Условно это можно представить, как вращение по часовой и против часовой.
На одной электронной орбитали могут находиться не более двух электронов с противоположенными спинами.
Общепринятым обозначением электронной обитали является клетка либо черточка. Электрон обозначается стрелкой: стрелка вверх ↑ – электрон с положительным спином +½, стрелка вниз ↓ – электрон с отрицательным спином -½.
Электрон, одинокий на орбитали называется неспаренным. Два электрона, располагающиеся на одной орбитали, называются спаренными.
Электронные орбитали подразделяются в зависимости от формы на четыре вида: s, p, d, f. Орбитали одинаковой формы формируют подуровень. Число орбиталей на подуровне определяется числом возможных вариантов расположения в пространстве.
- s-орбиталь.
s-орбиталь имеет форму шара:
В пространстве s-орбиталь может располагаться только одним способом:
Поэтому s-подуровнь формируется только одной s-орбиталью.
- р-орбиталь.
p-орбиталь имеет форму гантели:
В пространстве p-орбиталь может располагаться только тремя способами:
Поэтому p-подуровнь формируется тремя p-орбиталями.
- d-орбиталь.
d-орбиталь имеет сложную форму:
В пространстве d-орбиталь может располагаться пятью разными способами. Поэтому d-подуровнь формируется пятью d-орбиталями.
- f-орбиталь
f-орбиталь имеет еще более сложную форму. В пространстве f-орбиталь может располагаться семью разными способами. Поэтому f-подуровнь формируется семью f-орбиталями.
Электронная оболочка атома похожа на слоеное кондитерское изделие. В нем тоже есть слои. Электроны, находящиеся на разных слоях, имеют разную энергию: на слоях ближе ядру – меньше, на удаленных от ядра – бо̀льшую. Слои эти называются энергетическими уровнями.
Заполнение электронных орбиталей.
Первый энергетический уровень имеет только s-подуровень:

На втором энергетическом уровне есть s-подуровень и появляется p-подуровень:
На третьем энергетическом уровне есть s-подуровень, p-подуровень и появляется d-подуровень:
На четвертом энергетическом уровне, в принципе, прибавляется f-подуровень. Но в школьном курсе f-орбитали не заполняются, поэтому мы можем не изображать f-подуровень:
Число энергетических уровней в атоме элемента равно номеру периода. При заполнении электронных орбиталей нужно следовать следующим принципам:
- Каждый электрон старается занять в атоме то положение, где его энергия будет минимальной. То есть сначала идет заполнение первого энергетического уровня, потом второго и так далее.
Для описания строения электронной оболочки так же используется электронная формула. Электронная формула – это краткая запись в одну строку распределения электронов по подуровням.
- На подуровне сначала каждый электрон заполняет свободную орбиталь. И каждый имеет спин +½ (стрелка вверх).
И только после того как на каждой орбитали подуровня будет по одному электрону, следующий электрон становится спаренным – то есть занимает орбиталь, на которой уже есть электрон:
- d-подуровень заполняется по-особому.
Дело в том, что энергия d-подуровня выше, чем энергия s-подуровня СЛЕДУЮЩЕГО энергетического слоя. А как мы знаем, электрон старается занять то положение в атоме, где его энергия будет минимальной.
Поэтому после заполнения 3p-подуровня, заполняется сначала 4s-подуровень, после чего заполняется 3d-подуровень.



И только после того как 3d-подуровень заполнен полностью, заполняется 4p-подуровень.

Так же и с 4 энергетическим уровнем. После заполнения 4p-подуровня, следующим заполняется 5s-подуровень, после него 4d-подуровень. И после него только 5p.



- И есть еще один момент, одно правило касаемо заполнения d-подуровня.
То происходит явление, называемое провалом. При провале один электрон с s-подуровня следующего энергетического уровня, в прямом смысле проваливается на d-электрон.


Основное и возбужденное состояния атома.
Атомы, электронные конфигурации которых мы сейчас строили, называются атомами в основнóм состоянии. То есть, это обычное, естественное, если угодно, состояние.
Когда атом получает энергию извне, может произойти возбуждение.
Возбуждение – это переход спаренного электрона на пустую орбиталь, в пределах внешнего энергетического уровня.
Например, у атома углерода:
Возбуждение характерно для многих атомов. Это необходимо помнить, потому как возбуждение определяет способность атомов связываться друг с другом. Главное помнить условие, при котором может произойти возбуждение: спаренный электрон и пустая орбиталь на внешнем энергетическом уровне.

Есть атомы, у которых несколько возбужденных состояний:

Электронная конфигурация иона.
Ионы – это частицы, в которые превращаются атомы и молекулы, приобретая или теряя электроны. Эти частицы имеют заряд, так как у них либо «не хватает» электронов, либо их избыток. Положительно заряженные ионы называются катионами, отрицательные – анионами.
Атом хлора (не имеет заряда) приобретает электрон. У электрона заряд 1- (один минус), соответственно образуется частица, имеющая избыточный отрицательный заряд. Анион хлора:
Cl0 + 1e → Cl–

Атом лития (тоже не имеющий заряда) теряет электрон. У электрона заряд 1+ (один плюс), образуется частица, с недостатком отрицательного заряда, то есть заряд у нее положительный. Катион лития:
Li0 – 1e → Li+

Превращаясь в ионы, атомы приобретают такую конфигурация, что внешний энергетический уровень становится «красивым», то есть полностью заполненным. Такая конфигурация наиболее термодинамически стабильная, поэтому атомам есть резон превращаться в ионы.
И поэтому атомы элементов VIII-A группы (восьмой группы главной подгруппы), как сказано в следующем параграфе это благородные газы, такие химически малоактивны. У них в основном состоянии такое строение: внешний энергетический уровень полностью заполнен. Другие атомы, как бы стремятся приобрести конфигурацию этих самых благородных газов, поэтому и превращаются в ионы и образуют химические связи.
himiyaklas.ru



