Строение атома открытие – Атомная теория — Википедия
- Строение атома. История открытия.
- Related documents
- (adsbygoogle = window.adsbygoogle || []).push({}); электроны.
- Модели атомов
- Позиция Демокрита: «Существует предел деления – атом».
- Урок по физике по теме «Строение атома» 9 класс
- СОСТАВ АТОМНОГО ЯДРА.
- Опыт Резерфорда. Ядерная модель атома. Постулаты Бора.
- 1.Содержание лекций.
- Химическая связь. Строение вещества 1. Кристаллическая
- Строение атома Работа учителя физики Сабировой Г.Г.
- Слайды в Microsoft Power Point по теме
- Строение атома Открытие электрона Многие исследователи изучали
- Строение атома.
- Строение атома
Строение атома. История открытия.
Documents войти Загрузить ×- No category
Related documents
электроны.
Модели атомов

Позиция Демокрита: «Существует предел деления – атом».
Урок по физике по теме «Строение атома» 9 класс
СОСТАВ АТОМНОГО ЯДРА.

Опыт Резерфорда. Ядерная модель атома. Постулаты Бора.

1.Содержание лекций.

Химическая связь. Строение вещества 1. Кристаллическая
Строение атома Работа учителя физики Сабировой Г.Г.
Слайды в Microsoft Power Point по теме
Скачать advertisement StudyDoc © 2019 DMCA / GDPR Пожаловаться studydoc.ruСтроение атома Открытие электрона Многие исследователи изучали
 Строение атома
Строение атома
 Открытие электрона Многие исследователи изучали поток частиц в стеклянных трубках, наполненных газом при низких давлениях. Такие трубки, названные трубками Гейсслера по имени немецкого стеклодува Г. Гейсслера (1815– 1879), который первым начал изготовлять их, испускали яркое свечение, будучи подключены к высоковольтной обмотке индукционной катушки. Этими электрическими разрядами заинтересовался У. Крукс Уильям Крукс (1832 -1919)
Открытие электрона Многие исследователи изучали поток частиц в стеклянных трубках, наполненных газом при низких давлениях. Такие трубки, названные трубками Гейсслера по имени немецкого стеклодува Г. Гейсслера (1815– 1879), который первым начал изготовлять их, испускали яркое свечение, будучи подключены к высоковольтной обмотке индукционной катушки. Этими электрическими разрядами заинтересовался У. Крукс Уильям Крукс (1832 -1919)
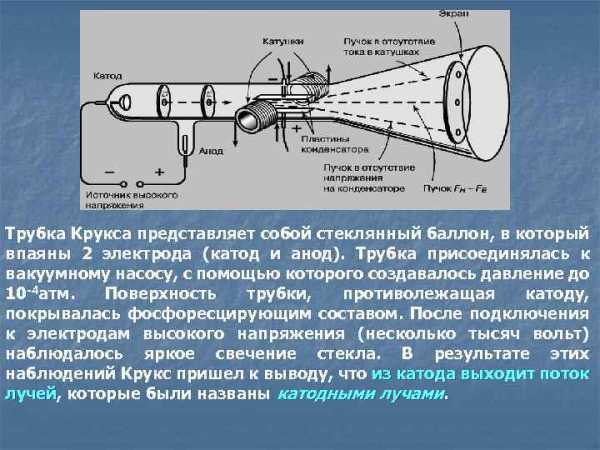 Трубка Крукса представляет собой стеклянный баллон, в который впаяны 2 электрода (катод и анод). Трубка присоединялась к вакуумному насосу, с помощью которого создавалось давление до 10 -4 атм. Поверхность трубки, противолежащая катоду, покрывалась фосфоресцирующим составом. После подключения к электродам высокого напряжения (несколько тысяч вольт) наблюдалось яркое свечение стекла. В результате этих наблюдений Крукс пришел к выводу, что из катода выходит поток лучей, которые были названы катодными лучами. лучей
Трубка Крукса представляет собой стеклянный баллон, в который впаяны 2 электрода (катод и анод). Трубка присоединялась к вакуумному насосу, с помощью которого создавалось давление до 10 -4 атм. Поверхность трубки, противолежащая катоду, покрывалась фосфоресцирующим составом. После подключения к электродам высокого напряжения (несколько тысяч вольт) наблюдалось яркое свечение стекла. В результате этих наблюдений Крукс пришел к выводу, что из катода выходит поток лучей, которые были названы катодными лучами. лучей
 Если на пути катодных лучей находится какое-либо препятствие, то на препятствие фосфоресцирующей поверхности наблюдается тень этого предмета. Отсюда был этого предмета сделан вывод, что катодные лучи, как любое другое излучение, распространяется прямолинейно Если на пути катодных лучей вместо пластинки поместить легкое колесико с лопастями, оно вращается. Значит катодные лучи представляют собой поток частиц. Поместив частиц трубку в электрическое и магнитное поля, Крукс обнаружил отклонение катодных лучей под влиянием этих полей. Направление отклонения указывало на то, что катодные лучи – это поток отрицательно заряженных частиц.
Если на пути катодных лучей находится какое-либо препятствие, то на препятствие фосфоресцирующей поверхности наблюдается тень этого предмета. Отсюда был этого предмета сделан вывод, что катодные лучи, как любое другое излучение, распространяется прямолинейно Если на пути катодных лучей вместо пластинки поместить легкое колесико с лопастями, оно вращается. Значит катодные лучи представляют собой поток частиц. Поместив частиц трубку в электрическое и магнитное поля, Крукс обнаружил отклонение катодных лучей под влиянием этих полей. Направление отклонения указывало на то, что катодные лучи – это поток отрицательно заряженных частиц.
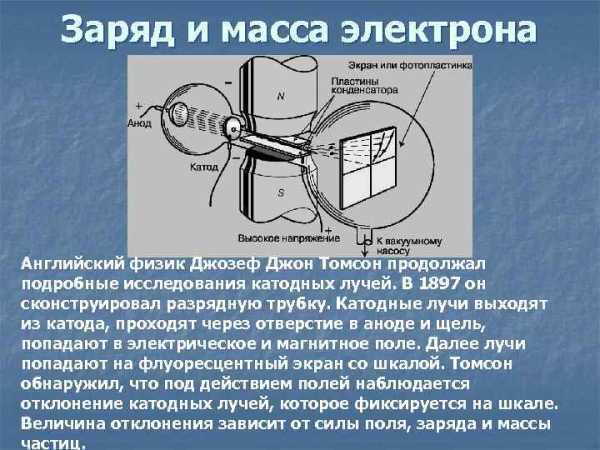 Заряд и масса электрона Английский физик Джозеф Джон Томсон продолжал подробные исследования катодных лучей. В 1897 он сконструировал разрядную трубку. Катодные лучи выходят из катода, проходят через отверстие в аноде и щель, попадают в электрическое и магнитное поле. Далее лучи попадают на флуоресцентный экран со шкалой. Томсон обнаружил, что под действием полей наблюдается отклонение катодных лучей, которое фиксируется на шкале. Величина отклонения зависит от силы поля, заряда и массы частиц.
Заряд и масса электрона Английский физик Джозеф Джон Томсон продолжал подробные исследования катодных лучей. В 1897 он сконструировал разрядную трубку. Катодные лучи выходят из катода, проходят через отверстие в аноде и щель, попадают в электрическое и магнитное поле. Далее лучи попадают на флуоресцентный экран со шкалой. Томсон обнаружил, что под действием полей наблюдается отклонение катодных лучей, которое фиксируется на шкале. Величина отклонения зависит от силы поля, заряда и массы частиц.
 Заряд и масса электрона Измеряя отклонение пучка электронов в зависимости от напряженности поля, Томсон рассчитал отношение заряда электрона к его массе: е/m. Это отношение оставалось постоянным независимо от того, каким газом была заполнена трубка. На этом основании Джозеф Джон Томсон был сделан важный вывод, что (1856 – 1940) электроны присутствуют в любом веществе. Отношение е/m, найденное Томсоном, оказалось равным 1, 76· 1011 Кл·кг-1 . Учитывая важность исследований Томсона, его считают Томсона первооткрывателем электрона.
Заряд и масса электрона Измеряя отклонение пучка электронов в зависимости от напряженности поля, Томсон рассчитал отношение заряда электрона к его массе: е/m. Это отношение оставалось постоянным независимо от того, каким газом была заполнена трубка. На этом основании Джозеф Джон Томсон был сделан важный вывод, что (1856 – 1940) электроны присутствуют в любом веществе. Отношение е/m, найденное Томсоном, оказалось равным 1, 76· 1011 Кл·кг-1 . Учитывая важность исследований Томсона, его считают Томсона первооткрывателем электрона.
 Точно величина заряда электрона была измерена Милликеном, который в своих измерена Милликеном опытах добивался, чтобы заряженные капельки масла висели в воздухе между пластинами конденсатора. Заряд электрона оказался равным 1, 6 · 10 -19 Кл. Этой минимальной величине заряда приписывают значение -1. Зная отношение, найденное Томсоном, и величину заряда электрона, нетрудно найти массу электрона. Она равна 9, 11· 10 -31 кг. В настоящее время характеристики электрона известны с большой точностью: е = (1, 60217733 ± 0, 00000049)· 10 -19 Кл m = (9, 1093897 ± 0, 00000054)· 10 -31 кг
Точно величина заряда электрона была измерена Милликеном, который в своих измерена Милликеном опытах добивался, чтобы заряженные капельки масла висели в воздухе между пластинами конденсатора. Заряд электрона оказался равным 1, 6 · 10 -19 Кл. Этой минимальной величине заряда приписывают значение -1. Зная отношение, найденное Томсоном, и величину заряда электрона, нетрудно найти массу электрона. Она равна 9, 11· 10 -31 кг. В настоящее время характеристики электрона известны с большой точностью: е = (1, 60217733 ± 0, 00000049)· 10 -19 Кл m = (9, 1093897 ± 0, 00000054)· 10 -31 кг
 Другие доказательства сложной структуры атома В 1895 В. Рентген случайно обнаружил таинственное излучение ( «Х-лучи, рентгеновские лучи). В 1896 А. Беккерелем (1852– 1908) В 1896 А. Беккерелем была открыта радиоактивность. В 1898 П. Кюри (1859– 1906) и М. Кюри В 1898 П. Кюри и М. Кюри (1867– 1934) обнаружили два радиоактивных элемента – полоний и радий. Все эти открытия ясно показали, что атом не является «неделимым» . Вильгельм Конрад Рентген (1845 – 1923)
Другие доказательства сложной структуры атома В 1895 В. Рентген случайно обнаружил таинственное излучение ( «Х-лучи, рентгеновские лучи). В 1896 А. Беккерелем (1852– 1908) В 1896 А. Беккерелем была открыта радиоактивность. В 1898 П. Кюри (1859– 1906) и М. Кюри В 1898 П. Кюри и М. Кюри (1867– 1934) обнаружили два радиоактивных элемента – полоний и радий. Все эти открытия ясно показали, что атом не является «неделимым» . Вильгельм Конрад Рентген (1845 – 1923)
 Модель атома У. Томсона Уильям Томсон представляет атом как некую положительно заряженную субстанцию, в которую вкраплены электроны, как «изюм в пудинге» . Эта модель строения атома была предложена в 1902 году. Уильям Томсон (1824 – 1907)
Модель атома У. Томсона Уильям Томсон представляет атом как некую положительно заряженную субстанцию, в которую вкраплены электроны, как «изюм в пудинге» . Эта модель строения атома была предложена в 1902 году. Уильям Томсон (1824 – 1907)
 Модель атома Дж. Томсона Джозеф Джон Томсон (1856 – 1940) Джозеф Джон Томсон представил свою модель строения атома в 1904 году. Он представляет атом, как положительно заряженную субстанцию, в которой в определенном месте находятся электроны, как «прослойка в сливовом пироге» .
Модель атома Дж. Томсона Джозеф Джон Томсон (1856 – 1940) Джозеф Джон Томсон представил свою модель строения атома в 1904 году. Он представляет атом, как положительно заряженную субстанцию, в которой в определенном месте находятся электроны, как «прослойка в сливовом пироге» .
 Модель атома Ленарда Филипп Фон Ленард (1862 – 1947) Ленард предложил свою модель строения атома в 1904 году. Он считает, что атом состоит из электронейтральных частиц, несущих в себе как положительный так и отрицательный заряд.
Модель атома Ленарда Филипп Фон Ленард (1862 – 1947) Ленард предложил свою модель строения атома в 1904 году. Он считает, что атом состоит из электронейтральных частиц, несущих в себе как положительный так и отрицательный заряд.
 Модель атома Нагаока Хантаро Нагаока (1865 – 1950) Хантаро Нагаока предложил свою модель строения атома в 1904 году. Он считал, что в центре находится положительно заряженное ядро, а вокруг него отрицательно заряженные электроны. Эта модель называется сатурноподобной.
Модель атома Нагаока Хантаро Нагаока (1865 – 1950) Хантаро Нагаока предложил свою модель строения атома в 1904 году. Он считал, что в центре находится положительно заряженное ядро, а вокруг него отрицательно заряженные электроны. Эта модель называется сатурноподобной.
 Опыт Резерфорда Эрнест Резерфорд (1871 -1937) Решающий эксперимент, Ганс Вильгельм совершенно изменивший Гейгер (1882 – 1945) представления о пространственной структуре атома, был проведен в 1910 г. Э. Резерфордом и его сотрудниками Х. Гейгером и Эрнест Марсден Э. Марсденом. (1889 – 1970)
Опыт Резерфорда Эрнест Резерфорд (1871 -1937) Решающий эксперимент, Ганс Вильгельм совершенно изменивший Гейгер (1882 – 1945) представления о пространственной структуре атома, был проведен в 1910 г. Э. Резерфордом и его сотрудниками Х. Гейгером и Эрнест Марсден Э. Марсденом. (1889 – 1970)
 Постулаты Бора 1. Электроны находятся на определенных стационарных орбитах, двигаясь по которым они не поглощают и не излучают энергию. 2. Излучение возникает только при переходе электрона с одной стационарной орбиты на другую. Нильс Хенрик Давид Бор (1885 -1962) 3. Величина этого излучения определяется изменением полной энерги, т. е. разностью энергий атома в начальном и конечном состояниях. Таким образом, Нильс Бор предложил соединить модельные представления Резерфорда с идеей квантов, впервые высказанной Планком в 1900.
Постулаты Бора 1. Электроны находятся на определенных стационарных орбитах, двигаясь по которым они не поглощают и не излучают энергию. 2. Излучение возникает только при переходе электрона с одной стационарной орбиты на другую. Нильс Хенрик Давид Бор (1885 -1962) 3. Величина этого излучения определяется изменением полной энерги, т. е. разностью энергий атома в начальном и конечном состояниях. Таким образом, Нильс Бор предложил соединить модельные представления Резерфорда с идеей квантов, впервые высказанной Планком в 1900.
 Принцип неопределенности Гейзенберга Невозможно одновременно определить точно и координату электрона и его энергию. Вернер Карл Гейзенберг (1901 -1976) Принцип вытекает из корпускулярно-волновой природы электрона.
Принцип неопределенности Гейзенберга Невозможно одновременно определить точно и координату электрона и его энергию. Вернер Карл Гейзенберг (1901 -1976) Принцип вытекает из корпускулярно-волновой природы электрона.
present5.com
Строение атома.
Тема:«Строение атома».
Цели урока: Познакомиться с историей развития представлений о строении атома, моделями атома, доказательствами сложности строения атома. Рассмотреть строение ядра и электронные конфигурации атома.
Задачи:
образовательные: знакомство с историей развития представлений о строении атомов, открытия и доказательства сложности строения атома на основе межпредметных связей с физикой; повторение умения составлять электронные и электронно-графические формулы атомов.
развивающие: совершенствование умения краткого изложения полученной информации, выбора из сказанного главного; формирование умения анализировать, выявлять причинно-следственные связи, оценивать свои знания.
воспитательные: развитие умения работать в коллективе.
Ход урока:
Организационный момент. Инструктаж по технике безопасности в кабинете химии ( повторный вводный).
Введение в тему урока:
1)Развитие представлений о строении атома.
Понятие атом (греч. «atomos» – неделимый) ввел Демокрит. У Демокрита атомы выступают в роли первоначала. Они неделимы, различаются по величине, весу, форме и находятся в вечном движении. После Демокрита учение об атомах было на много веков забыто. Возродил атомистическую теорию английский физик и химик Джон Дальтон. Он основывался на открытых в то время законах химии и экспериментальных данных о строении вещества. Таким образом, установил, что атомы одного элемента имеют одинаковые свойства, а разных элементов – различаются по свойствам. Дальтон ввел важную характеристику атома – атомную массу и для очень многих элементов были установлены ее относительные значения. В своем атомно-молекулярном учении Дальтон дает характеристику атому: «Атом неделим, вечен и неразрушим».
2) Атом делим, как доказали следующие экспериментальные открытия, сделанные в науке на рубеже конца 19-начала 20 века.
В 1897 году Крукс открыл катодные лучи, представляющие собой поток электронов в вакуумной трубке, содержащей катод и анод. Английский физик Джозеф Томпсон назвал частицы катодных лучей электронами.
Русский ученый Столетов открыл явление фотоэффекта – испускания металлом электронов под действием падающего на него света.
Значимым стало открытие Рентгеном «Х»-лучей, позже названных рентгеновскими в честь ученого. Эти лучи представляют собой электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
Большой вклад в развитие представлений об элементарных частицах внесли французский физик Антуан Анри Беккерель и супруги Кюри, открыв явление радиоактивности. Радиоактивность – это явление самопроизвольного превращения одного химического элемента в другой, сопровождаемое испусканием электронов или других частиц и рентгеновского излучения.
Эти экспериментальные данные свидетельствуют о том, что атом – сложноустроенная система.
3)Модели атома.
Одной из первых моделей строения атома явилась модель английского физика Джозефа Томсона, предложенная им в в1904 г. – так называемый «пудинг с изюмом»: атом представляет собой сферу положительного электричества с вкрапленными электронами.
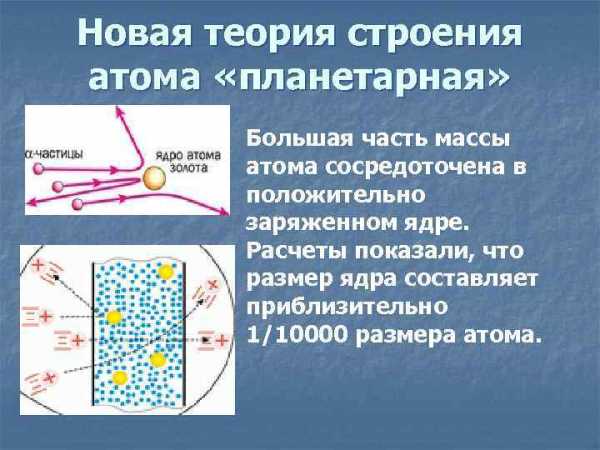
Для проверки этой модели в 1899-1911 гг. английский физик Эрнест Резерфорд провел опытные исследования и сформулировал планетарную (ядерную) теорию строения атома. Согласно этой модели, в центре атома находится очень маленькое ядро, размеры которого приблизительно в 100’000 раз меньше размеров самого атома. В ядре сосредоточена практически вся масса атома. Оно имеет положительный заряд. Вокруг ядра движутся электроны, заряженные отрицательно. Их число определяется зарядом ядра.
Однако такая модель имела свои недостатки:
1. Резерфорд не смог объяснить устойчивости атома. Двигаясь вокруг ядра, электрон расходует энергию и в какой-то момент, израсходовав ее всю, он должен остановиться – упасть на ядро, что равносильно гибели атома. Но на самом деле атомы – структуры довольно стабильные.
2. Резерфорд не смог объяснить линейный характер атомных спектров. Согласно его модели, электрон должен излучать энергию постоянно и поэтому атомный спектр должен быть сплошным, но экспериментальные данные доказывали обратное: спектр не сплошной, а прерывистый. Это означает, что электрон излучает энергию порциями.
Свою теорию строения атома, основанную на планетарной модели и квантовой теории, в 1913 году предложил датский физик Нильс Бор. Основные положения он сформулировал в виде постулатов:
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
Но и эта модель не явилась совершенством, в ней также присутствовали противоречия. «Спасти» теорию Бора пытались многие ученые.
В 1932 году Иваненко предложил протонно-нейтронную модель ядра. Эту теорию развил Гейзенберг. Эта модель строения атома существует до сих пор, сочетает в себе все предыдущие модели и «исправляет» их недостатки. Суть теории в том, что атомное ядро состоит из протонов и нейтронов. В совокупности они называются нуклоны. Число протонов в ядре («+» заряд) характеризует его заряд. Количество электронов («-» заряд), движущихся вокруг ядра, соответствует количеству протонов в нем. Электроны движутся по определенным атомным орбиталям, которые могут существовать в различных формах. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
4)Основные характеристики нуклонов и электрона. Массовое число. Изотопы.
5) Электронное облако.
3.Закрепление материала осуществляется поэтапно.
1.Определите число протонов и нейтронов в ядрах атомов 40Ca, 35Cl, 127I.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.
3.Какими величинами характеризуется изотоп?
4. Почему изотопы одного элемента имеют разные массовые числа?
5.Почему в периодической системе у химических элементов указаны дробные значения относительной атомной массы?
6.Запишите электронные конфигурации атомов элементов, имеющих порядковые
номера 6,15,20,25. К каким электронным семействам относят эти элементы?
4.Подведение итогов урока. Рефлексия.
5. Постановка домашнего задания.
Литература:
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.
intolimp.org
Строение атома
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Модель Томсона
Хотя слово атом в первоначальном значении — частица, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, которые называют субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны. Не сразу ученые пришли к правильным представлениям о строении атома. Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом — атом водорода — представляет собой положительно заряженный шар радиусом около 10-8 см, внутри которого находится электрон. У более сложных атомов в положительно заряженном шаре находятся несколько электронов. Однако модель Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
Опыт Резерфорда
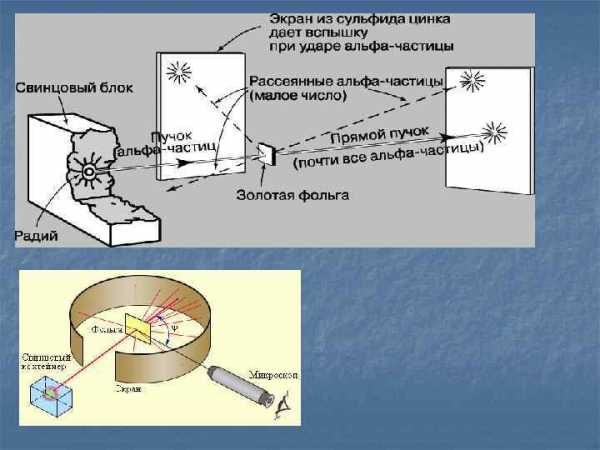
Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Эти частица возникают при распаде радия и некоторых других элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. Это не что иное, как полностью ионизированные атомы гелия. Скорость α-частиц очень велика: они составляет 1/15 скорости света. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов. Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы. Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома. Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на бо́льшие углы. Для этого он окружил фольгу сцинтилляционными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одно из двух тысяч) отклонилось на углы, большие 90º. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на бо́льшие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Другие заметки по физике
edu.glavsprav.ru



