Упрощенная таблица менделеева – Как научиться читать таблицу химических элементов Д.И. Менделеева 🚩 железо в таблице менделеева 🚩 Естественные науки
- Комментариев к записи Упрощенная таблица менделеева – Как научиться читать таблицу химических элементов Д.И. Менделеева 🚩 железо в таблице менделеева 🚩 Естественные науки нет
- Советы абитуриенту
- Современная форма таблицы Менделеева | Наука и жизнь
- Таблица Менделеева в нынешнем виде ложьИВДИВО 176 Высокой Цельности, Севастополь
- Периодическая таблица Менделеева в хорошем качестве
- Когда была открыта периодическая таблица Д.И. Менделеева и сколько элементов в ней
- Почему таблица Менделеева периодическая и в чем её суть
- Как расположены металлы в периодической таблице Менделеева
- Периодическая таблица Менделеева металлы неметаллы
- Валентность всех химических элементов таблица
- Группы периодической таблицы Менделеева
- История создания и развития
- А теперь о “Таблице Менделеева”
- Таблица Менделеева
Современная форма таблицы Менделеева | Наука и жизнь
В этом году исполняется 170 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 135 лет со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК – Междунаpодного союза теоpетической и пpикладной химии (International Union of Pure and Applied Chemistry – IUPAC). Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой.ИЗ ИСТОРИИ СОЗДАНИЯ И РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие – таблицу элементов. В 1870 году он назвал систему “естественной”, а спустя год – “периодической”. Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием “Опыт системы элементов, основанный на их атомном весе и химическом сходстве”. Им же была дана формулировка закона: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса”. Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня – групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных “укрепителями периодического закона”.
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные (“инертные”) газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие “атомный вес” элемента было заменено словами “порядковый (или атомный) номер”, что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (
Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц.
Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трех вариантах – из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп:
а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп “типических” элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой.
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит “типических” элементов, подгрупп, рядов и семейств. Ее упрощенные варианты появлялись гораздо раньше, но чаще всего с одним отличием – групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счет приставок а и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
НОВАЯ ФОРМА ТАБЛИЦЫ
До 80-90-х годов прошлого века были распространены две первые формы таблицы. Первая – архаичная короткая форма с “насильственной” упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три “типических” элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, “главная” или “побочная”).
При выборе и утверждении длинного варианта таблицы были соблюдены “интересы” большинства элементов и принцип “золотой середины” без нарушения основы закона Менделеева – периодичности в свойствах элементов. Сорок элементов (по 10 d-элементов в каждом из периодов с 4 по 7), относимые ранее к “переходным”, или “вставным” (между s- и p-элементами), и называемые “побочными”, после 1989 года перестали быть таковыми. Они стали полноправными компонентами своих новых десяти групп.
С официальным принятием новой формы таблицы исчезли, став лишними, надуманные или принятые вынужденно термины: “типические элементы”, “подгруппа” (главная и побочная), “триада”, “ряды”, “семейства” (железа или платиновых металлов). Все элементы одной группы (кроме водорода и гелия – они всегда на особом положении), расположенные вертикально в один ряд, имеют в принципе одинаковые две наружные (определяющие степень окисления) s- + p- или s- + d-орбитали электронов. Лантаноиды и актиноиды (f-элементы), как и раньше, остаются в третьей группе в соответствии с наличием в их электронных орбиталях условно s2d1-электронов. Различия в электронной структуре атомов актиноидов здесь не обсуждаются.
Длинная форма таблицы лишена несоответствий, недостатков и очевидных противоречий, присущих ее короткой форме, заметных при первом же взгляде на свойства элементов, искусственно собранных в одну и ту же группу. Так, например, в I группу короткой таблицы попали и металлы Cu, Ag, Au,и противоположные по активности щелочные металлы Na, K, Rb, Cs. Несовместимость свойств “одногрупповых” элементов прослеживается и по всем остальным группам. Обратим внимание лишь на бывшие конечные (VI-VIII)
Максимально противоречива структура VIII группы. В нее включены подгруппа VIIIb с “триадой” (“семейство железа” – Fe, Co, Ni) и “семейство платиновых металлов” (Ru, Rh, Pd, Os, Ir, Pt), куда, естественно, должны входить в виде трех вертикальных рядов и только что полученные элементы 108-110, которые никогда не относились к платиновым. В эту же группу входит, противореча здравому смыслу, и подгруппа VIII a, куда отнесены благородные газы (He, Ne и другие).С уверенностью можно утверждать, что исторически эти триады-семейства были “втиснуты” в прокрустово ложе последней (VIII) группы вынужденно, вопреки логике, так как эта группа, согласно электронной структуре атомов, предназначена природой только для указанных газовых элементов. Причина образования такого “Ноева ковчега” проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
В официально принятой длинной форме таблицы понятия “семейство железа” и “семейство платиновых металлов” исчезают логически, так как к ним, согласно их свойствам, совместному распространению в природе, изоморфизму и последовательному изменению электронной структуры, можно было бы присоединить соседей по таблице и справа и слева. Иными словами, первое семейство можно расширить, например, до ванадия и цинка включительно, а во второе – поместить другие благородные металлы – серебро, золото, ртуть; старые понятия надуманы искусственно, будучи привязаны к структуре бывшей VIII группы.
В предложенную таблицу для каждого элемента введены также две альтернативные величины относительной электроотрицательности (ОЭО) атомов (их способности в молекуле притягивать электроны, участвующие в образовании химических связей) и основные физические параметры соответствующих простых веществ. Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, H2О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов – от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всем мире, ее использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках – в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование ее длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I – VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощенные варианты рациональной длинной таблицы были распространены еще задолго до 1989 года, в том числе в СССР, с одним отличием – номеров групп было восемь (они обозначались римскими цифрами), но они “растягивались” до восемнадцати за счет приставок а и b и искусственного создания триад элементов. В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
Авторы благодарныпрофессорам С. Г. Дьяконову,Н. В. Коровину, А. М. Кочневу, А. М. Кузнецову, Г. В. Лисичкину, А. И. Михайличенко, Ю. И. Сальникову, С. Н. Соловьеву, Н. А. Улаховичу, А. И. Хацринову и др., поддержавшим высказанные идеи или давшим полезные советы при оформлении современной таблицы Д. И. Менделеева.
ЛИТЕРАТУРА
Лидин Р. А. и др. Химия в помощь абитуриенту. – М.: Дрофа, 2001. 576 с.
Никольский А. Б., Суворов А. В. Химия. – СПб.: Химиздат, 2001. 512 с.
Новый справочник химика и технолога. – СПб.: НПО “Мир и семья”, 2002. Т. 1, 954 с. Т. 2, 1276 с.
Сайфуллин Р. С., Сайфуллин А. Р. Универсальный лексикон: химия, физика и технология; R.S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. – М.: Логос, 2001, 2002. 548 с.
Хаускрофт К., Констебле Э.. Современный курс общей химии/ Пер. с англ. – М.: Мир, 2002. Т. 1, 252 с. Т. 2, 250 с.
Химия, справочник школьника и студента / Коллектив авторов. Пер. с нем. Изд. 2-е. – М.: Дрофа, 2000. 384 с.
Хисамиев Г. Г. Общая химия, задачи и упражнения (для вузов). – Казань: Магариф, 1999. 368 с.
Эмсли Дж. Элементы. – М.: Мир, 1993. 258 с.
Oxford Dictionary of Science / Ed. Isaacs A., Daintith J., Martin E. Oxford University Press, Oxford, New York, 1999. 858 p.
The New Encyclopedia Britannica, 15-th Ed., Encyclopedia Britannica, Inc. Chicago, 1974-1994.
Hawley’s Condensed Chemical Dictionary, 11-nd Ed Rev. N.I. Sax, R.J. Lewis, Sr. Van Nostrand Rheinhold Co., N.Y., 1987. 1303 p.
WebElementsTM Periodic table (professional edition) (http://www.webelements.com/. 1993-2003).
Krzysztof M. Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Подписи к иллюстрациям
Илл. 1. В современном варианте таблицы Менделеева приведены уточненные в 1995 году значения атомных масс и утвержденные в 1997 году названия девяти полученных искусственно элементов №№ 101-109.
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
Наука и жизнь // Иллюстрации
‹
›
www.nkj.ru
Таблица Менделеева в нынешнем виде ложьИВДИВО 176 Высокой Цельности, Севастополь
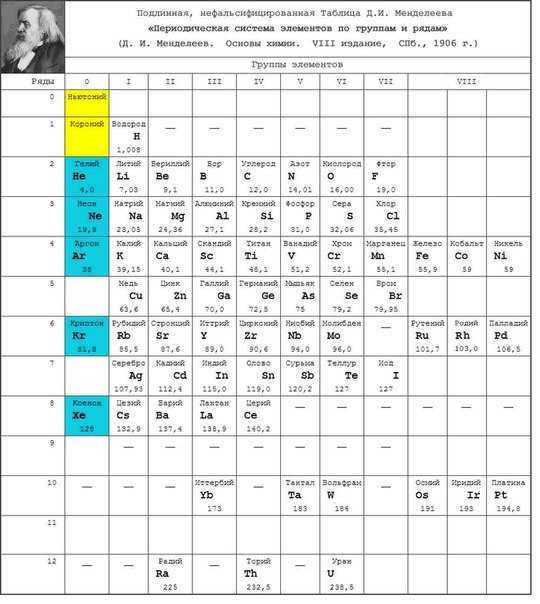
Таблица Менделеева в нынешнем виде ложь и подстава.
В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 – не видно, 2 – и не угадывается (из-за отсутствия нулевой группы). Такой целенаправленный подлог сдерживает развитие прогресса цивилизации. Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Подлинная нефальсифицированная таблица Менделеева. Опубликована в учебнике «Основы химии» в 1906г. Вот так выглядит подлинная таблице Менделеева, в которой должен быть Эфир. Ячейка для Эфира (выделено желтым солнечным цветом) располагалась в нулевой группе с инертными газами и в нулевом ряду. Такое расположение ячейки подчеркивает значение Эфира как главного системообразующего фактора для построения всех химических элементов и как главного методологического звена для построения всех химических соединений Именно в таком виде таблица Менделеева отражает и химию и физику и вообще систему построения мироздания, когда малые субстанции формируют более крупные построения «первокирпичика материи». После смерти Менделеева таблицу исказили, убрав из неё Эфир и, тем самым, скрыв фундаментальное открытие концептуального значения. Выделенная синим цветом нулевая группа, в которой у Менделеева находились инертные газы, была тоже упразднена путем объединения её с восьмой группой.
Источники: Д.И.Менделеев. «Попытка химического понимания мирового эфира».
СПБ, 1905г. Д.И.Менделеев. «Учебник «Основы химии» VII издание,
СПБ, 1906г. В.Г.Родионов. «Место и роль мирового эфира в истинной таблице Д.И.Менделеева».
Изд. ЖРФМ, 2001г. Д.Н.Трифонов. «Столетие нулевой группы».
 Более подробнее по данной теме здесь. Междисциплинарный Концептуальный Семинар — МКС
Более подробнее по данной теме здесь. Междисциплинарный Концептуальный Семинар — МКС
xn--80adaggqzudaktdo8m.xn--p1ai
Периодическая таблица Менделеева в хорошем качестве
Разумеется, любой, кто учился в школе знает о том, что среди обязательных предметов уже долгие годы располагается химия. В каждом классе обязательно присутствовала периодическая таблица Менделеева в хорошем качестве, без нее никак. Большинству учеников предмет не нравился, а кто-то им увлекался – сейчас главное не это. Скорее всего, все знания, полученные в ходе долгих лет обучения, уже полностью забыты и никак не пригодились в жизни. Однако, как выглядит таблица помнит каждый ученик. Для большинства учеников она осталась обычным полотном на стене, с кучей непонятных квадратиков и букв, вписанных в них.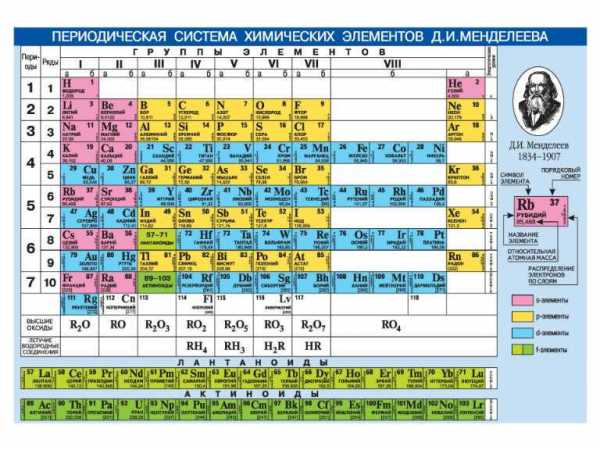
Когда была открыта периодическая таблица Д.И. Менделеева и сколько элементов в ней
Будущий легендарный химик Д.И. Менделеев появился на свет 8 февраля по новому календарю, и 27 января по-старому, в 1834 году. Семья ученого была многодетной, он был самым младшим из 14 детей. В 10 лет умер отец, мать занималась воспитанием детей. В школе Дмитрий не выделялся на фоне остальных своими способностями. Однако в институте он начал демонстрировать неплохие знания, закончив его с золотой медалью в 1855 году. После чего ученый переезжает в Одессу, после в Германию и Петербург, где и начинается его тернистый путь к великим открытиям.
На сегодняшний день в таблице находится 118 химических элемента, но так было не всегда. Еще во второй половине 19 века было обнаружено лишь 63 элемента. И многие ученые мира безуспешно пытались соединить их в одну определенную концепцию. Сперва предлагали распределить элементы по возрастанию их атомной массы и поделить на группы схожести химических свойств.
Шел 1863 год, Джон Ньюленд, меломан по совместимости химик, предложил собственную версию расстановки химических элементов. Очень похожую на ту, которую открыл сам Менделеев. Однако, все попытки ученого доказать свою правому были отклонены другими химиками. Поскольку автор идеи увлекался музыкой, и искал ее связь с химией, его попросту считали несерьезным.
Именно в 1869, когда была открыта периодическая таблица Д.И. Менделеева и сколько элементов в ней уже было известно, но не до конца. Ученый выложил свою схему в журнале одного из сообществ химиков. Разумеется, в будущем таблица много раз корректировалась, пока не стала, такой, какой ее можно наблюдать сегодня.

На дворе 1871 год, великий химик окончательно доработал свою идею в закон. Также, Менделеев говорил о якобы открытии в будущем новых элементов и даже уточнил их свойства. В дальнейшем, все предсказания ученого случились. Все новые открытые элементы располагают такими же свойствами, какими еще в 19 веке предсказал их Дмитрий Иванович.
Это интересно: Менделеев Дмитрий Иванович краткая биография
Существует былина о том, что Менделеев увидел готовую таблицу во сне. Якобы ученый долгое время не мог представить таблицу в виде четкого и строгого решения без изъянов. Как то, после нескольких дней упорного труда он прилег отдохнуть и уснул. По рассказам Дмитрия Ивановича, во все он увидел таблицу, где все было выстроено, как необходимо. После пробуждения он тут же записал всю нужную информацию, которая оказалось верной практически на 100%. Пришлось внести лишь одну поправку.
Почему таблица Менделеева периодическая и в чем её суть
Данная таблица систематично раскладывает не только элементы, но все разнообразие их свойств. Поэтому, зачастую, ученому достаточно просто взглянуть на нее, чтобы правильно ответить на необходимый вопрос. Почему таблица Менделеева периодическая и в чем её суть – ответ на данный вопрос весьма прост.
Название «периодическая» она получила благодаря тому, что основные горизонтальные ряды называются – периодами. Также смысл великого открытия в том, что с увеличением атомной массы химические характеристики всех элементов меняются с некой периодичностью. Отсюда и название.
В чем тогда ее смысл — для полноценного понимания, следует еще разок направить взор на таблицу. Кроме крепкой связи между составляющими, она показывает ряд очень полезных для изучения химических закономерностей.
Как расположены металлы в периодической таблице Менделеева
В обсуждаемой таблице, металлы прочно заняли свою нишу в главных подгруппах первой и третьей групп. А также в побочных подгруппах, где сформировали отдельное семейство. Они находятся в начале и середине периодов, за счет чего их радиусы выглядят сравнительно больше.
Не глядя в таблицу очень сложно представить расположения элементов, особенно тому, кто не разбирается в химии.
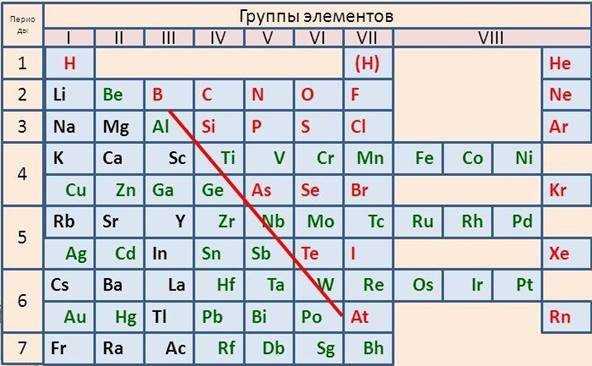
Изображение: Как расположены металлы в периодической таблице Менделеева
На изображении видно диагональ, она является условной и в оригинальной таблице ее конечно же нет. Линия берет начало от B к At через другие элементы. Под диагональю на изображении свою позицию занимают – металлы. Из всех элементов в системе к металлам относят 88.
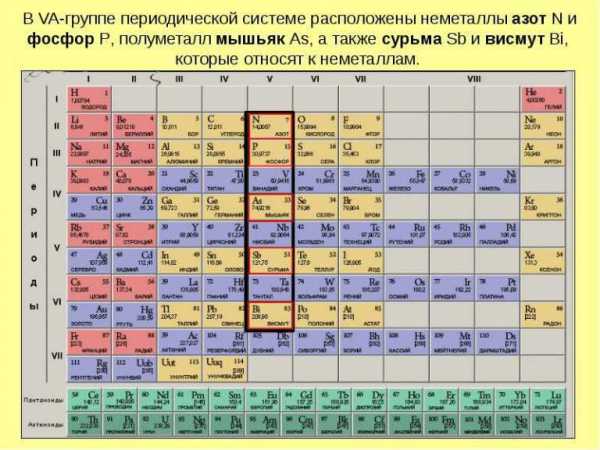
Периодическая таблица Менделеева металлы неметаллы
Периодический закон является полноценной химической структурой, и дает шанс проанализировать местоположение элементарных веществ с учетом их уникальных свойств. Все знают по школьной программе, что все простые вещества делят на пару категорий – металлы и соответственно неметаллы. Данная классификация базируется на том, что физические свойства элемента имеют значительные отличия от химических свойств.
Итак, периодическая таблица Менделеева, металлы, неметаллы, как распознать где что? Для этого снова потребуется заглянуть в таблицу и провести воображаемую диагональ от элемента B, то есть – Бериллия, к элементу At – Астат.
Таблица разделена, теперь слева под линией располагаются металлы. Кстати, чем ниже от воображаемой черты находится элемент, тем более сильны его характеристики, как металла. В этом невероятно просто убедиться, все что нужно – глянуть в систему. В самом нижнем углу слева уже более столетия расположен Франций. Данный элемент самый мощный из щелочных металлов.
Разумеется, элементы, которые расположены вверху справа являются неметаллами. В данном случае действует то же правило. Чем правее и выше элемент, чем сильнее его неметаллические характеристики. Самый сильный неметалл в таблице Дмитрия Ивановича – Фтор. Он является очень мощным окислителем. Его активность просто невероятна, за что химики ранее давали ему кличку – «Все разгрызающий».

Валентность всех химических элементов таблица
Изначально за одну единицу измерения брали валентность водорода. Данный показатель у иных элементов при этом выражался количеством атомов водорода. Которые подключают к себе или заменяют один из атомов иного элемента.
Что такое валентность — проще говоря, это атом, который может создавать некое число связей с другими атомами.

Принято считать, что валентность определяется колонкой в таблице. На самом деле, все очень правдоподобно, однако на практике химические элементы ведут себя куда сложнее. Причина большого количества значений валентности состоит в том, что имеются разнообразные способы заполнения, с помощью которых происходит стабилизация оболочки электрона. Для простоты понимания и нахождения такого понятия, как валентность всех химических элементов, таблица который была создана еще в 19 веке.
Группы периодической таблицы Менделеева
Что из себя представляют группы периодической таблицы Менделеева? Это построение атомов по усилению ядерного заряда, при этом они обладают одинаковым строением.
Порядковый номер подобных групп вычисляется по количеству расположенных электронов на внешней атомной оболочке. Существует правило, что номер группы равен максимальной валентности атома.
Также имеется некий вариант системы с короткими периодами, в нем группы разделяются на подгруппы – главные и побочные группы. Подгруппы тоже имеют названия по элементу с минимальным зарядом. Элементы с такой же подгруппой имеют очень похожие химические свойства.
Мы рассмотрели статью периодическая таблица Менделеева в хорошем качестве. А вы верите, что она могла ему присниться? Оставьте свое мнение или отзыв для всех на форуме.
womaninc.ru
История создания и развития
Как всё начиналось?
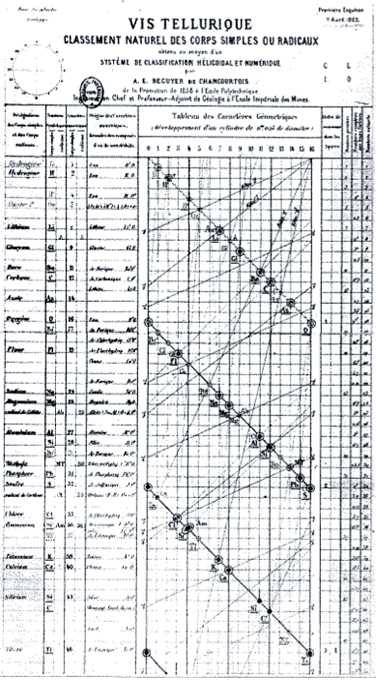
Многие известные именитые химики на рубеже XIX-XX веков уже давно заметили, что физические и химические свойства многих химических элементов очень похожи друг на друга. Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
В отличие от многих учёных, Д.И. Менделеев взял атомную массу (в те времена ещё “Атомный вес”) как ключевой параметр при классификации элементов. В своём варианте Дмитрий Иванович расположил элементы по возрастанию их атомных весов и вот тут обозначилась закономерность, что через определённые промежутки элементов их свойства периодически повторяются. Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Первый вариант таблицы был опубликован учёным в статье “Соотношение свойств с атомным весом элементов” в 1869 и вариант этот был далек от идеала и совсем не похож на современный.
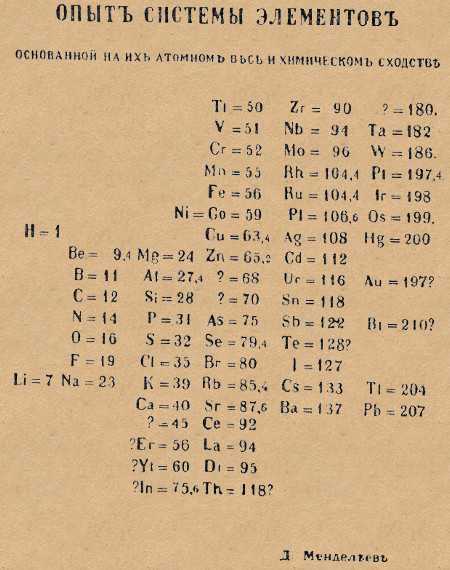
Как мы можем видеть, расположение элементов в этом варианте совсем не такое, какое мы видим в совремнном виде. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато – девятнадцать, вместо принятых на сегодня восемнадцати.
Однако, спустя всего год, в 1870-м Менделеев сформировал новый вариант таблицы, который уже более узнаваем нами: подобные элементы выстроены по вертикали, образуя группы, а 6 периодов расположены по горизонтали. Особенно примечательно то, что и в первом и во втором варианте таблицы виднеются существенные достижения, коих не было у его предшественников: в таблице заботливо оставлены места под элементы которые, по мнению Менделеева, ещё предстояло открыть. Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
В дальнейшем, после разрешения многих актуальных загадок химии того времени – открытие новых элементов, выделение группы благородных газов совместно с участием Уильяма Рамзая, установления того факта, что Дидимий вовсе не является самостоятельным элементом, а является смесью двух других, – были опубликованы всё новые и новые варианты таблицы, подчас имеющих даже вовсе и не табличный вид. Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Переход от атомных весов к заряду ядра.
К сожалению, Дмитрий Иванович не дожил до планетарной теории строения атома и не видел триумф опытов Резерфорда, хотя именно с его открытиями начинается новая эпоха в развитии периодического закона и всей периодической системы. Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
“Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов”
Теперь стало понятно, почему некоторые более лёгкие элементы были поставлены Менделеевым позади их более тяжёлых предшественников, – всё дело в том, что так они стоят по порядку зарядов их ядра. Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
После открытия строения атома и атомного ядра, периодическая система претерпевала ещё несколько изменений, пока, наконец, не достигла вида, уже знакомого нам со школы, короткопериодного варианта таблицы Менделеева.
 В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго – в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше – до 10х годов нынешнего столетия.
В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго – в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше – до 10х годов нынешнего столетия.
Современный вариант таблицы Менделеева.
Однако, тот вариант, которые многие из нас проходили в школе на деле оказывается весьма запутанным, а путаница выражается в разделении подгрупп на главные и побочные и запоминание логики отображения свойств элементов становится достаточно сложным. Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.

На смену восьми группам пришли восемнадцать, среди которых нет уже никакого разделения на главные и побочные, а все группы продиктованы расположением электронов в атомной оболочке. Заодно избавились и от двухрядных и однорядных периодов, теперь все периоды содержат только один ряд. Чем же удобен такой вариант? Теперь периодичность свойств элементов просматривается более наглядно. Номер группы, по сути, обозначает количество электронов во внешнем уровне, в связи с чем все главные подгруппы старого варианта расположились в первой, второй и с тринадцатой по восемнадцатую группу, а все “бывшие побочные” группы разместились в середине таблицы. Тем самым теперь из таблицы хорошо видно, что если это первая группа – то это щелочные металлы и никаких вам меди или серебра, и видно, что все транзитные металлы хорошо демонстрируют схожесть их свойств в связи с заполнением d-подуровня, в меньшей степени влияющим на внешние свойства, также как и лантаноиды и актиноиды проявляют подобные свойства по причине разного лишь f-подуровня. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
К сожалению, в нашей стране этот вариант включился в школьные учебники лишь в последние 2-3 года, да и то не во все. И очень напрасно. С чем это связано? Ну во-первых, с застойными временами в лихие 90-е, когда в стране не было вообще никакого развития, не говоря уж о сфере образования, а именно в 90е годы мировое химическое сообщество перешло на этот вариант. Во-вторых, с лёгкой инертностью и тяжестью восприятия всего нового, ведь нашим преподавателям привычен именно старый, короткопериодный вариант таблицы, несмотря на то, что при изучении химии он гораздо сложнее и менее удобен.
Расширенный вариант периодической системы.
Но время не стоит на месте, наука и технологии тоже. Уже открыт 118 элемент периодической системы, а значит скоро придётся открывать следующий, восьмой, период таблицы. Кроме того, появится новый энергетический подуровень: g-подуровень. Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
В этом варианте ни f-элементы (лантаноиды и актиноиды) ни g-элементы (“элементы будущего” с №№ 121-128) не вынесены отдельно, а делают таблицу шире на 32 клетки. Также элемент Гелий помещён во вторую группу, так как он входит в s-блок.
В целом, же вряд ли будущие химики будут пользоваться этим вариантом, скорее всего на смену таблице Менделеева придёт одна из альтернатив, которые уже выдвигаются смелыми учёными: система Бенфея, “Химическая галактика” Стьюарта или иной вариант. Но это будет уже только после достижения второго острова стабильности химических элементов и, скорее всего, нужно будет больше для наглядности в ядерной физике, чем в химии, ну а нам пока хватит старой доброй периодической системы Дмитрия Ивановича.
xn—-7sbbaecnhbaa5b5ahdr7gqd.xn--p1ai
А теперь о “Таблице Менделеева”
Каждый советский школьник, знавший химию на отлично (я, например), был уверен в следующем факте: Периодический закон и Периодическая система химических элементов были изобретены великим русским ученым Менделеевым, и точка. Первенство, уникальность и гений Менделеева не подлежали никакому сомнению.
Но на первом курсе университета, в учебнике немецкого языка мной с удивлением был обнаружен текст под названием Lothar Meyer, из которого я узнал, что у периодической системы как минимум два автора, которые сделали открытия вроде бы как независимо друг от друга. И это зародило серьезные сомнения в уникальности гения, тем более что своё открытие немец Лотар Мейер опубликовал… в 1864 году, на 5 лет раньше Менделеева (1869).
Сегодня вы можете узнать настоящую историю открытия Периодического Закона.
Немаловажным является тот факт, что оба ученых – и Лотар Мейер, и Дмитрий Менделеев, в 1860-м году посетили съезд химиков в Карлсруэ, Германия. На этом съезде идея зависимости свойств химических элементов от их атомных весов просто витала в воздухе.
Но еще задолго до этого съезда попытка систематизации элементов была сделана Дёберайнером (в 1829 году). Идеи Дёберайнера в 1843 году развил другой немецкий химик Леопольд Гмелин, который показал, что взаимосвязь между свойствами элементов и их атомными массами значительно сложнее, чем триады Дёберайнера.
Француз де Шанкуртуа в 1862 предложил систематизацию химических элементов, основанную на закономерном изменении атомных масс – «земную спираль». Де Шанкуртуа был одним из первых учёных, отметивших периодичность свойств элементов; его винтовой график действительно фиксирует закономерные отношения между атомными массами элементов.
Таблица де Шанкуртуа (1862):
Химик Джон Ньюлендс в августе 1864 года составил таблицу, в которой расположил все известные элементы в порядке увеличения их атомных весов. Он, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Но его таблица имела ряд недостатков (напр. в некоторых ячейках было по два элемента), поэтому была воспринята научным обществом скептически.
Таблица Ньюлендса:
В 1864 же году Уильям Одлинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, однако не сопроводил её какими-либо комментариями.
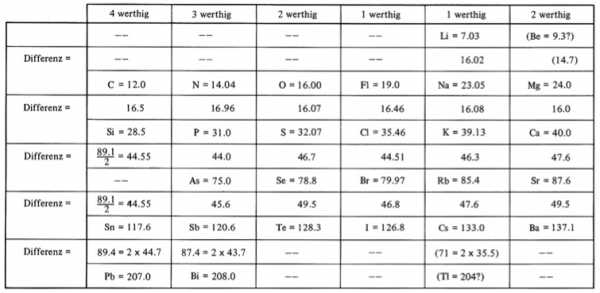
И в том же 1864 году опубликована книга Лотара Мейера “Die modernen Theorien der Chemie” (Современная Теория Химии), и его первая таблица из 28 элементов, размещённых в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах сходных элементов. Мейер указал, что если элементы располагаются в порядке их атомных весов, они попадают в группы, в которых подобные химические и физические свойства повторяются через определенные промежутки.
Ранняя версия таблицы Мейера (1862):
Доработанная версия таблицы (1870):
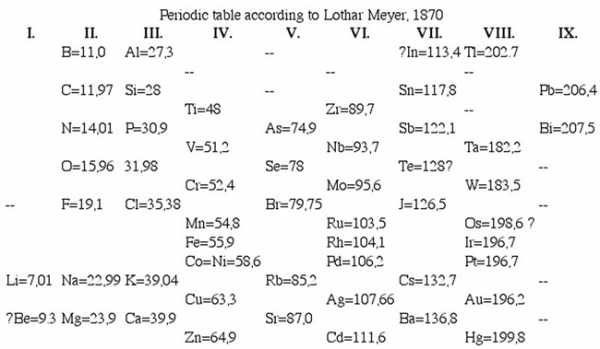
Через пять лет после Мейера, в 1969 году Менделеев опубликовал доклад, в котором сообщил об открытии им зависимости между атомными весами элементов и их химическими свойствами. В том же году он опубликовал «Основы химии», в которых был приведен первый вариант его таблицы, содержащей 19 горизонтальных рядов и 6 вертикальных. Таблица Менделеева весьма значительно отличались от той, которую Вы видели на уроках химии. На то время было известно только 63 элемента, из которых один – дидим – оказался смесью празеодима и неодима.
Первый вариант таблицы Менделеева (1869):

В 1870 году вышла работа Мейера, содержащая обновленную таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин «периодичность».
В ноябре 1870 года Менделеев опубликовал статью «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», в которой он впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов и предсказал их свойства (так же, как и у Мейера, таблица Менделеева имела незаполненные ячейки).
В 1871-м году Менделеев сформулировал закон как: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В 1882 году Мейер и Менделеев одновременно получили медали от Royal Society (Королевского общества) за их исследования в области Периодического закона. Необходимо знать, что таблицы Мейера и Менделеева и в 1870-м, и в 1871-м, и в 1891-м годах все еще значительно отличались от привычной нам и по форме, и по содержанию: даже в 1891-м году, к примеру, там не было благородных газов.
Таблица элементов версии 1871 года:

Доработанная таблица Менделеева, 1891 год, благородные газы все еще отсутствуют, зато есть дидим:

Еще одна версия таблицы 1891 года (напоминает таблицу де Шанкуртуа, не находите?):

Но самое главное заключается в том, что заблуждались и Мейер, и Менделеев. Современный закон звучит так: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от ЗАРЯДА ЯДЕР атомов элементов». То есть не от атомного веса (массы), а от заряда ядер. Это в корне меняет всю суть закона. Ведь существуют изотопы – атомы одного элемента с одним зарядом ядер, практически одинаковыми химическими свойствами, но разной атомной массой (водород, дейтерий и тритий; уран 235 и уран 238 и т.п.).
Для того, чтобы прийти к этой формулировке Закона и современному виду Таблицы элементов, потребовались многие годы работы и исследования Рамзая, Браунера, Сведберга, Содди, Мозли и других ученых.
В 1911 году голландец Ван Дер Брук предположил совпадение атомного номера с величиной положительного заряда ядра атома, что стало основой современной классификации химических элементов. В 1920-м году англичанин Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт физический смысл порядкового номера элемента в Периодической системе, а закон приобрел современную формулировку (зависимость от заряда ядер).
И, наконец, в 1923 году Нильс Бор заложил основы современного представления о теории Периодического закона: причина периодичности свойств элементов заключается в периодическом повторении строения внешнего электронного уровня атома.
Нужно ли говорить, что на сегодня в Таблице присутствуют (существуют в природе и синтезированы) 118 химических элементов, в отличие от 63-х, известных во второй половине 19 века; а короткая версия Таблицы, которую вы видели в школе, официально отменена на международном уровне в 1989 году (хоть и продолжает приводиться в большом числе российских справочников и пособий и после этого времени). Кроме основного общепринятого вида таблицы, существует множество форм (иногда довольно вычурных), предложенных разными учеными.
Современная таблица:
Резюме: при всем уважении к Менделееву и его работам, он внес важный вклад, но был лишь одним из многих, приложивших руку к тому, что мы сегодня называем Периодическим законом и Периодической системой химических элементов. И да, в тех исследованиях Мейер его в общем-то опередил, хотя в 19 веке разница в пять лет считалась «практически одновременно» 🙂 Сравнив вид таблиц Менделеева и современной (и формулировки законов), становится понятно, почему во всем мире таблицу и закон называют просто Периодической таблицей элементов и Периодическим законом – из уважения к огромному труду большого количества ученых.
Если Вы дочитали до этого места – Вы молодец 🙂
brandexpert.livejournal.com
Таблица Менделеева
В этом году исполняется 170 лет со дня рождения выдающегося российского химика Дмитрия Ивановича Менделеева и 135 лет со дня создания им периодической системы элементов. За истекшее время таблица, наглядно демонстрирующая периодический закон, неоднократно дополнялась и расширялась. До последнего времени в научной и учебной литературе приводилась так называемая короткая форма таблицы. Современный, расширенный вариант таблицы Менделеева составлен авторами статьи на основании последних решений ИЮПАК – Междунаpодного союза теоpетической и пpикладной химии (International Union of Pure and Applied Chemistry – IUPAC). Эта оpганизация, созданная в 1919 году, кооpдиниpует исследования, тpебующие междунаpодного согласования, контpоля и стандаpтизации, pекомендует и утверждает химическую теpминологию, включая названия элементов. Россия, будучи полноправным членом союза, выполняет его решения и рекомендации. Новая форма таблицы была одобрена XVII Менделеевским съездом в сентябре 2003 года. В таблицу внесены самые последние характеристики всех известных на сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой.
ИЗ ИСТОРИИ СОЗДАНИЯ И РАЗВИТИЯ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Первого марта 1869 года Д. И. Менделеев обнародовал периодический закон и его следствие – таблицу элементов. В 1870 году он назвал систему “естественной”, а спустя год – “периодической”. Таблица (далекий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием “Опыт системы элементов, основанный на их атомном весе и химическом сходстве”. Им же была дана формулировка закона: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их атомного веса”. Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались еще не полные ряды элементов, прообразов будущих подгрупп (сегодня – групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных “укрепителями периодического закона”.
Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял ее и вносил в ее структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были еще известны благородные (“инертные”) газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие “атомный вес” элемента было заменено словами “порядковый (или атомный) номер”, что отвечает числу протонов в ядре атома и, соответствен но, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s-элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определенном энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде. На первом энергетическом уровне дозволено быть только двум электронам (на s-уровне). Они привели к наличию в первом периоде двух элементов: водорода и гелия. На втором энергетическом уровне восемь разных электронов отвечают появлению восьми новых элементов – от лития до неона. Аналогичная картина наблюдается и в третьем периоде. В нем, вместо ожидаемых восемнадцати, также восемь элементов – от натрия до аргона. Здесь произошла задержка с образованием десяти d-элементов из-за того, что 3d-электроны оказались на более высоком энергетическом уровне, чем 4s-электроны. По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвертом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина – “переходные элементы”, “вставная декада”. В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4d-элементы; они также оказываются переходными. Описанные естественные явления были одной из причин создания таблицы из восьми групп. Однако “запаздывают” также по четырнадцать 4f- и 5f-элементов уже на два периода. Из-за их большего числа и расположения этих электронов в третьем снаружи слое (близость свойств) в обеих обсуждаемых здесь формах таблиц они выделены вне групп. Общее правило при образовании периодов системы – все они начинаются со щелочных металлов с первым ns1-электроном, образующим n-период (n – номер периода системы). Завершает каждый период “инертный” газ с последним np6-электроном. Исключение – первый период системы, он находится всегда на особом положении.
Так выглядел первый вариант таблицы элементов, составленный Менделеевым в 1869 году.
Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц.
Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трех вариантах – из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп:
а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп “типических” элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой.
б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит “типических” элементов, подгрупп, рядов и семейств. Ее упрощенные варианты появлялись гораздо раньше, но чаще всего с одним отличием – групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счет приставок а и b и искусственным созданием триад элементов).
в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода.
НОВАЯ ФОРМА ТАБЛИЦЫ
До 80-90-х годов прошлого века были распространены две первые формы таблицы. Первая – архаичная короткая форма с “насильственной” упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделенных дополнительно еще на ряды (8 или 10) и подгруппы, содержавшие два или три “типических” элемента, предшествующих, в свою очередь, двум спорным по названиям (A, B или a, b, “главная” или “побочная”).
При выборе и утверждении длинного варианта таблицы были соблюдены “интересы” большинства элементов и принцип “золотой середины” без нарушения основы закона Менделеева – периодичности в свойствах элементов. Сорок элементов (по 10 d-элементов в каждом из периодов с 4 по 7), относимые ранее к “переходным”, или “вставным” (между s- и p-элементами), и называемые “побочными”, после 1989 года перестали быть таковыми. Они стали полноправными компонентами своих новых десяти групп.
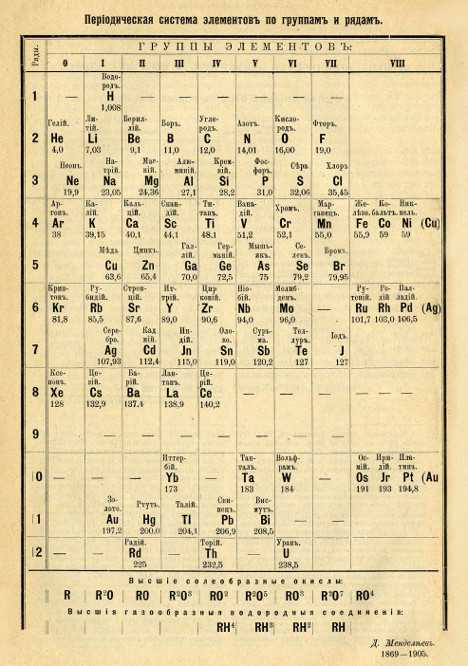
Современный вариант таблицы Менделеева, составленный по форме, утвержденной ИЮПАК в 1989 году и принятой международным научным сообществом. В нем приведены уточненные в 1995 году значения атомных масс и утвержденные в 1997 году названия девяти полученных искусственно элементов №№ 101-109.
С официальным принятием новой формы таблицы исчезли, став лишними, надуманные или принятые вынужденно термины: “типические элементы”, “подгруппа” (главная и побочная), “триада”, “ряды”, “семейства” (железа или платиновых металлов). Все элементы одной группы (кроме водорода и гелия – они всегда на особом положении), расположенные вертикально в один ряд, имеют в принципе одинаковые две наружные (определяющие степень окисления) s- + p- или s- + d-орбитали электронов. Лантаноиды и актиноиды (f-элементы), как и раньше, остаются в третьей группе в соответствии с наличием в их электронных орбиталях условно s2d1-электронов. Различия в электронной структуре атомов актиноидов здесь не обсуждаются.
Периодическая система элементов, предложенная Нильсом Бором в 1921 году. Она отражает и строение электронных оболочек, и химические свойства атомов.
Длинная форма таблицы лишена несоответствий, недостатков и очевидных противоречий, присущих ее короткой форме, заметных при первом же взгляде на свойства элементов, искусственно собранных в одну и ту же группу. Так, например, в I группу короткой таблицы попали и металлы Cu, Ag, Au,и противоположные по активности щелочные металлы Na, K, Rb, Cs. Несовместимость свойств “одногрупповых” элементов прослеживается и по всем остальным группам. Обратим внимание лишь на бывшие конечные (VI-VIII) группы. Это – соседство в VI группе двух “типических” элементов – O и S и их аналогов Se, Te, Po с тугоплавкими металлами – Cr, Mo, W; в VII группе – элементов, отвечающих агрессивным летучим галогенам F, Cl, Br, I, с не менее тугоплавкими металлами Mn, Tc, Re.
Д. Менделеев и Д. Коновалов на закладке химической лаборатории Санкт-Петербургского университета. 1892.
Максимально противоречива структура VIII группы. В нее включены подгруппа VIIIb с “триадой” (“семейство железа” – Fe, Co, Ni) и “семейство платиновых металлов” (Ru, Rh, Pd, Os, Ir, Pt), куда, естественно, должны входить в виде трех вертикальных рядов и только что полученные элементы 108-110, которые никогда не относились к платиновым. В эту же группу входит, противореча здравому смыслу, и подгруппа VIIIa, куда отнесены благородные газы (He, Ne и другие).С уверенностью можно утверждать, что исторически эти триады-семейства были “втиснуты” в прокрустово ложе последней (VIII) группы вынужденно, вопреки логике, так как эта группа, согласно электронной структуре атомов, предназначена природой только для указанных газовых элементов. Причина образования такого “Ноева ковчега” проста: четырем триадам из 3(4) декад в каждом периоде при компоновке таблицы из восьми групп не хватило места в ее предшествующих семи группах.
Группа русских ученых, обследовавших уральские заводы в 1899 году. Слева направо: С. Вуколов, К. Егоров, Д. Менделеев, П. Земятченский.
В официально принятой длинной форме таблицы понятия “семейство железа” и “семейство платиновых металлов” исчезают логически, так как к ним, согласно их свойствам, совместному распространению в природе, изоморфизму и последовательному изменению электронной структуры, можно было бы присоединить соседей по таблице и справа и слева. Иными словами, первое семейство можно расширить, например, до ванадия и цинка включительно, а во второе – поместить другие благородные металлы – серебро, золото, ртуть; старые понятия надуманы искусственно, будучи привязаны к структуре бывшей VIII группы.
В предложенную таблицу для каждого элемента введены также две альтернативные величины относительной электроотрицательности (ОЭО) атомов (их способности в молекуле притягивать электроны, участвующие в образовании химических связей) и основные физические параметры соответствующих простых веществ. Использовать значения ОЭО важно, в частности, для исключения и исправления устаревших ошибочных названий и написания химических формул бинарных соединений. Например, водородные соединения элементов второго периода Н4С, Н3N, h3О, НF согласно значениям ОЭО (для водорода около 2,0, для других элементов – от 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведенные написания формул аммиака и метана более справедливы, нежели традиционные (NH3 и СН4).
Д. И. Менделеев с братом Павлом. 1890.
Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всем мире, ее использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках – в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы.
Д. И. Менделеев в мантии доктора прав Эдинбургского университета. Акварельный портрет работы И. Е. Репина. 1885 год.
Д. И. Менделеев в своем рабочем кабинете. 1904 год. Фото Ф. Блумбаха.
Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование ее длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I – VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощенные варианты рациональной длинной таблицы были распространены еще задолго до 1989 года, в том числе в СССР, с одним отличием – номеров групп было восемь (они обозначались римскими цифрами), но они “растягивались” до восемнадцати за счет приставок а и b и искусственного создания триад элементов. В новой таблице приведены исправленные атомные массы элементов, утвержденные ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утвержденные, также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе.
Тобольская губернская классическая гимназия, в которой в 1841-1849 годах учился Д. И. Менделеев.
Авторы благодарныпрофессорам С. Г. Дьяконову,Н. В. Коровину, А. М. Кочневу, А. М. Кузнецову, Г. В. Лисичкину, А. И. Михайличенко, Ю. И. Сальникову, С. Н. Соловьеву, Н. А. Улаховичу, А. И. Хацринову и др., поддержавшим высказанные идеи или давшим полезные советы при оформлении современной таблицы Д. И. Менделеева.
Доктор технических наук Р. Сайфуллин, профессор, действительный член Академии наук Республики Татарстан; кандидат химических наук А. САЙФУЛЛИН.
ЛИТЕРАТУРА
Лидин Р. А. и др. Химия в помощь абитуриенту. – М.: Дрофа, 2001. 576 с.
Никольский А. Б., Суворов А. В. Химия. – СПб.: Химиздат, 2001. 512 с.
Новый справочник химика и технолога. – СПб.: НПО “Мир и семья”, 2002. Т. 1, 954 с. Т. 2, 1276 с.
Сайфуллин Р. С., Сайфуллин А. Р. Универсальный лексикон: химия, физика и технология; R.S.Saifullin, A.R.Saifullin. Universal Concise Dictionary: Chemistry, Physics andTechnology. – М.: Логос, 2001, 2002. 548 с.
Хаускрофт К., Констебле Э.. Современный курс общей химии/ Пер. с англ. – М.: Мир, 2002. Т. 1, 252 с. Т. 2, 250 с.
Химия, справочник школьника и студента / Коллектив авторов. Пер. с нем. Изд. 2-е. – М.: Дрофа, 2000. 384 с.
Хисамиев Г. Г. Общая химия, задачи и упражнения (для вузов). – Казань: Магариф, 1999. 368 с.
Эмсли Дж. Элементы. – М.: Мир, 1993. 258 с.
Oxford Dictionary of Science / Ed. Isaacs A., Daintith J., Martin E. Oxford University Press, Oxford, New York, 1999. 858 p.
The New Encyclopedia Britannica, 15-th Ed., Encyclopedia Britannica, Inc. Chicago, 1974-1994.
Hawley’s Condensed Chemical Dictionary, 11-nd Ed Rev. N.I. Sax, R.J. Lewis, Sr. Van Nostrand Rheinhold Co., N.Y., 1987. 1303 p.
WebElementsTM Periodic table (professional edition) (http://www.webelements.com/. 1993-2003).
Krzysztof M. Pazdro, Chemia dla licealistov (Budowa materii w ochach chemika), Wyd. II. Oficyna Edukacyjna, Warszawa, 1996. 246 p.
Новые книги
НЕИЗВЕСТНЫЙ МЕНДЕЛЕЕВ
В представлении большинства людей Менделеев – великий химик. Но оказывается, из всего количества его трудов собственно химии посвящено лишь 9%. С гораздо большим основанием Дмитрия Ивановича можно было бы назвать физико-химиком, физиком или технологом, ибо каждой из этих областей он посвятил примерно 20% своих работ. Наконец, немалая доля его исследований приходится на геофизику (5%) и экономику (8%).
Общественный фонд “Возрождение Тобольска” выпустил к 170-летию со дня рождения Дмитрия Ивановича Менделеева (1834-1907) избранные произведения ученого в двух томах (“Тобольский гений России”. Тобольск, 2003).
Менделеев родился в Тобольске, первой столице сибирского края. Здесь жили его предки. Первые книги, изданные в Сибири в XVIII веке, были напечатаны в Тобольске в типографии прадеда Дмитрия Ивановича – В. Я. Корнильева. Детство и юность, проведенные в Сибири, определили во многом последующие увлечения ученого.
Юбилейное издание готовили к печати Надежда Полунина и Герман Смирнов. Из огромного количества произведений, оставленных Менделеевым (более 500), им предстояло отобрать для двухтомника наиболее интересные и значимые работы. В последнее время сочинения Менделеева издаются очень редко. А между тем многие “заветные мысли”, высказанные ученым, актуальны до сих пор. Вот, например: “Велико заблуждение тех, которые думают, что предстоящее России можно выполнить легко и просто, одним мановением руки или одними пламенными речами…”
Первый том издатели назвали “Неизвестный Менделеев”. Книгу открывают отрывки из последних работ ученого – “Заветные мысли” (1903-1905) и “К познанию России” (1906). Вот как сформулировал автор те задачи, что ставил перед собой при написании “Заветных мыслей”: “Вся предлагаемая книга для того, между прочим, и писана, чтобы увеличить существующую у нас меру понимания условий для возможности увеличения средних народных достатков”. Составители книги выделили на полях некоторые мысли – заповеди ученого: “… надо еще немало поработать мозгами в Государственной Думе, чтобы законами поощрить труд и вызвать порывы долга перед Родиной”. И вновь о том же: “… нужно развивать мысли о накоплении в народе личной инициативы и трудолюбия…” Развитие образования, науки всегда волновало ученого: “Затраты на науку окупаются тем, что она видит многое зараньше, предупреждает, разбирает возможное, отбирает существенное из кучи практических подробностей”.
Каких только проблем не коснулся ученый: тончайшие химические исследования и сыроварение, пульсирующий насос и действие удобрений, температура верхних слоев атмосферы и наиболее удобные конструкции керосиновых ламп. Он летал на воздушном шаре и интересовался проблемами мореходства и судостроения, занимался выработкой таможенного тарифа, работал в Главной палате мер и весов. Менделеев писал о мировом эфире и о картине Куинджи, о ледоколе “Ермак” и о разработке донецких углей…
Сохранилось письмо Дмитрия Ивановича, адресованное министру финансов С. Ю. Витте. Письмо написано за несколько месяцев до смерти автора и не отправлено адресату. Вот что ученый говорит о себе, подводя итоги прожитой жизни: “Начав (1855) с учительства в Симферопольской гимназии, я выслужил 48 лет Родине и Науке. Плоды моих трудов, прежде всего, в научной известности, составляю щей гордость – не одну мою личную, но и общую русскую, так как все главнейшие научные академии, начиная с Лондонской, Римской, Бельгийской, Парижской, Берлинской и Бостонской, избрали меня своим сочленом, как и многие ученые общества России, Западной Европы и Америки, всего более 50-ти обществ и учреждений.
Лучшее время жизни и ее главную силу взяло преподавательство во 2-ом кадетском корпусе, в Инженерной академии, в Институте путей сообщения, в Технологическом институте и в Университете. Из тысяч моих учеников много теперь повсюду видных деятелей, профессоров, администраторов, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность.
Третья служба моя Родине наименее видна, хотя заботит меня с юных лет до сих пор. Эта служба, по мере сил и возможности, на пользу роста русской промышленности, начиная с сельскохозяйственной, в которой лично действовал, показав на деле возможность и выгодность еще в 60-х годах интенсивного хозяйства и организовав первые у нас опытные исследования по разведению хлебов. Личные усилия убедили меня, однако, очень скоро в том, что с одним земледелием Россия не двинется к надобным ей прогрессу, богатству и силе, останется страною бедною, что настоятельнее всего рост других видов промышленности: горного дела, фабрик, заводов, путей сообщения и торговли. Мои, так сказать, теоретические усилия начались с настойчивой пропаганды в пользу возможности развития – при определенных условиях – выработки бакинской нефти в эпоху, когда к нам ввозились миллионы пудов американского керосина”.
“Сам удивляюсь – чего только я не делывал на своей научной жизни. И сделано, думаю, неплохо”, – заметил как-то ученый.
Составители двухтомника использовали воспоминания людей, близко знавших Дмитрия Ивановича. “Если в какой-нибудь специальности достигнешь сути дела, – говорил Менделеев своей племяннице, – взберешься по лестнице всех предварительных знаний, а потом самостоятельно поработаешь сам, то и достигнешь того, что все легко будет даваться и сущность всякой науки будет легко усваивать”.
А вот как видел Менделеева Александр Блок, имевший возможность наблюдать ученого в непринужденной домашней обстановке: “Он давно ВСЕ знает, что бывает на свете. Во все проник. Не скрывается от него ничего. Его знание самое полное. Оно происходит от гениальности, у простых людей такого не бывает… При нем вовсе не страшно, но всегда – неспокойно, это оттого, что он все и давно знает, без рассказов, без намеков, даже не видя и не слыша. Это всепознание лежит на нем очень тяжело. Когда он вздыхает и охает, он каждый раз вздыхает обо всем вместе; ничего отдельного или отрывочного у него нет – все неразделимо. То, что другие говорят, ему почти всегда скучно, потому что он все знает лучше всех…”
З. КОРОТКОВА.
nauka.relis.ru



