Увеличение металлических свойств в таблице менделеева – Положение металов в переодической таблице особенности строения атомов металов? Физические св-ва?
- Комментариев к записи Увеличение металлических свойств в таблице менделеева – Положение металов в переодической таблице особенности строения атомов металов? Физические св-ва? нет
- Советы абитуриенту
- Металлические и неметаллические свойства химических элементов.
- Металлические и неметаллические свойства: таблица как ориентир
- Металлические и неметаллические свойства простых веществ
- Нужна помощь! Пожалуйста объясните, что такое металлические и неметаллические свойства.
- что это такое и как определить самый мягкий элемент
- Металлические свойства химических элементов
- Некоторые закономерности в периодической таблице д.и. менделеева
Металлические и неметаллические свойства химических элементов.
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
1. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении
2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов.
3. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
1. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ.
2. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
Вопрос 3.
Строение вещества. Гибридизация орбиталей. Типы химических связей. Потенциал ионизации и электроотрицательность.
Строение вещества
Все тела состоят из отдельных частиц — молекул и атомов. Молекулы — это наименьшие частицы вещества. Молекулы состоят из атомов.
Основные сведения о составе вещества:
1) Все тела состоят из отдельных частиц (молекул и атомов), между которыми есть промежутки.
2) Молекулы непрерывно и хаотично движутся.
3) Молекулы взаимодействуют между собой (притягиваются и отталкиваются).
Свойства молекул:
1) Молекулы одного и того же вещества одинаковы.
2) При нагревании промежутки между молекулами увеличиваются, а при охлаждении — уменьшаются.
3) С увеличением температуры, скорость движения молекул возрастает.
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических – немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO 2, SiC и другие) образуют очень прочные кристаллы (исключение – слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников – кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде.
Гибридизация орбиталей
Гибридизация орбиталей – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp3– Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые “гибридные” орбитали, угол между осями которых равен 109°28′. Молекулы, в которых осуществляется sp
sp2– Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые “гибридные” орбитали, угол между осями которых равен 120°.
Молекулы, в которых осуществляется sp2– гибридизация, имеют плоскую геометрию.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые “гибридные” орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Типы химических связей.
1) Ионная (металл + неметалл)
2) Ковалентная (неметалл + неметалл с помощью общих электронных пар)
Виды: * полярная (разные неметаллы)
* неполярная (одинаковые неметаллы)
Виды: * образована обменным механизмом
Обменный механизм – в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону:
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора) .
3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами)
4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой)
Потенциал ионизации атома – минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Вопрос 4.
infopedia.su
Металлические и неметаллические свойства: таблица как ориентир
Понятие «металлы» все себе так или иначе представляют. Железо, серебро, золото, медь, свинец. Эти названия постоянно встречаются в новостях, так что мало кто будет задавать вопрос о том, что такое металлы. И все же не мешало бы узнать о том, что такое металлы с позиций химика и физика, если вы хотите иметь в голове системную картину мира. А уж для полноты знаний по этой теме не мешало бы узнать и о других группах – неметаллах и металлоидах. Что такое металлические и неметаллические свойства?
Если память подвела

Неметаллы кажутся более загадочными, особенно для тех, кто плохо помнит школьный курс химии, поэтому сконцентрируемся на неметаллических свойствах, а металлические, соответственно, нужно считать противоположными. В том, что вы не помните, нет ничего позорного, человеческому мозгу трудно удерживать в сознании информацию, которая не нужна каждый день. Итак, перечислим неметаллические свойства и прокомментируем их, чтобы сделать более понятными.
Ни тепла, ни электричества
Неметаллы гораздо хуже металлов проводят электричество, а также теплоту. Поэтому керамическая кружка, во-первых, лучше держит тепло, чем металлическая, а во-вторых, вероятность обжечь руки о такую кружку гораздо меньше, чем о солдатскую железную кружку. И помните, по технике безопасности оттаскивать от источника тока пораженного человека нельзя с помощью металлических предметов. А вот деревом пользоваться можно, углерод в составе дерева – неметалл. Свойство металлов – проводить ток хорошо, неметаллические свойства включают низкую проводимость.
Хрупкость или пластичность

Чистые вещества из неметаллов обычно хрупки или вообще нередко в твердом состоянии существуют в виде порошка. Металлы ковкие, могут принимать под воздействием инструментов и температуры самые необычные застывшие формы (этим качеством пользуются в литейном деле). Неметаллы так не обработаешь. Неметаллы часто, даже если и встречаются в виде кусочков, все равно имеют низкую плотность и нередко на вид пористые.
Таблица как карта местности
Если вы «идете» по таблице Менделеева слева направо, обязательно заметите, что неметаллические свойства усиливаются слева направо. Гелий – самый большой «отличник неметаллов». А вот если спускаться вниз по таблице, то неметаллические свойства угасают. Металлы же становятся все более агрессивными по мере того, как вы спускаетесь вниз по таблице Менделеева. Таким образом, по таблице Менделеева можно примерно предполагать свойства простых веществ, состоящих из атомов конкретных элементов. Вещества «посередине» называются металлоидами и применяются нередко в электротехнике как полупроводники.
Польза неметаллов

Общей сферы применения для всех неметаллов нет. У каждого своя «специализация», ведь неметаллические материалы – разные. Инертные газы используют для наружной рекламы, селен – для тонеров в печатной индустрии, сера идет на спички. Мы постоянно встречаемся в повседневной жизни с материалами, которые состоят из производных неметаллов.
Таким образом, неметаллические свойства, как и металлические, можно предсказать по таблице Менделеева. И эти закономерности очень интересны, ведь таблица хранит еще много неоткрытых тайн, которые позволяют ученым заглянуть далеко в прошлое, а возможно, и в будущее. Особенно интересно будущее металлоидов.
fb.ru
Металлические и неметаллические свойства простых веществ

У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным. Вам необходимо включить JavaScript, чтобы проголосовать
Нужна помощь! Пожалуйста объясните, что такое металлические и неметаллические свойства.
Закономерности, связанные с металлическими и неметаллическими свойствами элементов.1. При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении – возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Например, углерод – более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!) , все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того – в левой или правой части таблицы они находятся.
У d- и f-элементов, как мы знаем, есть “резервные” электроны из “предпоследних” оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный “блок” (это сделано в “длинной” форме таблицы) , то обнаружится закономерность. Левая нижняя часть блока содержит типичные металлы, правая верхняя – типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности) . Валентных электронов у них либо недостаточно для образования полноценной “октетной” ковалентной связи (как в боре) , либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них – существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
Источник: http://www.hemi.nsu.ru/text146.htm
otvet.mail.ru
что это такое и как определить самый мягкий элемент
Свойства химических элементов позволяют объединять их в соответствующие группы. На этом принципе была создана периодическая система, изменившая представление о существующих веществах и позволившая предположить существование новых, ранее неизвестных элементов.
…
Вконтакте
Google+
Мой мир
Периодическая система Менделеева
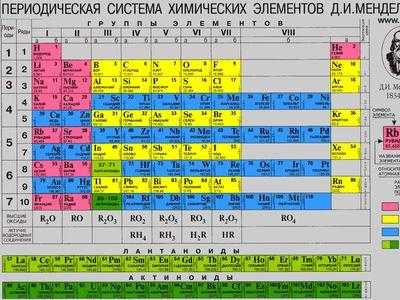 Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая таблица химических элементов была составлена Д. И. Менделеевым во второй половине XIX века. Что такое это, и для чего она нужна? Она объединяет все химические элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система Менделеева в химии свела в единую систему все существующие элементы, прежде считавшиеся просто отдельными веществами.
На основании ее изучения были предсказаны, а впоследствии — синтезированы новые химические вещества. Значение этого открытия для науки невозможно переоценить, оно значительно опередило свое время и дало толчок к развитию химии на многие десятилетия.
Существует три наиболее распространенных варианта таблицы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная таблица, она утверждена официально. Отличием между ними является компоновка элементов и длина периодов.
Что такое период
Система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период может иметь одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка периодической таблицы. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность — свойства элементов изменяются внутри одного периода, вновь повторяясь в следующем. Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18 элементов.
Что такое группа
Группа — это вертикальный столбец, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью. Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет свое название, облегчающее поиск или классификацию элементов. Усиливаются металлические свойства в независимости от элемента по направлению сверху-вниз. Это связано с увеличением количества атомных орбит — чем их больше, тем слабее электронные связи, что делает более ярко выраженной кристаллическую решетку.
Металлы в периодической таблице
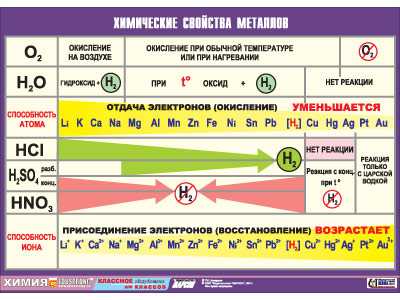 Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Металлы в таблице Менделеева имеют преобладающее количество, список их достаточно обширен. Они характеризуются общими признаками, по свойствам они неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные могут существовать только доли секунды и в природе абсолютно не встречаются (по крайней мере, на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа имеет собственные признаки, название и довольно заметно отличается от других. Особенно это различие выражено у первой группы.
Положение металлов
Какого положение металлов в периодической системе? Элементы расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Как определить металлы, и возможно ли это сделать по таблице Менделеева? Для того, чтобы упростить вопрос, придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что оказываются слева — металлы, справа — неметаллы. Это было бы очень просто и здорово, но есть исключения — Германий и Сурьма.
Важно! Это работает только в длинной системе, на коротком варианте таблицы Менделеева многие металлы оказываются справа.
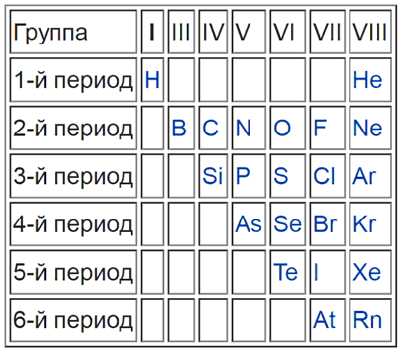 Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
Такая «методика» — своего рода шпаргалка, она придумана лишь для упрощения процесса запоминания. Для более точного представления следует запомнить, что список неметаллов составляет всего 22 элемента, поэтому отвечая на вопрос, сколько всего металлов всего содержится в таблице Менделеева
На рисунке можно наглядно увидеть, какие элементы являются неметаллами и как они располагаются в таблице по группам и периодам.
Это интересно! Каково содержание кислорода в воздухе: процентный состав и норма
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллическими элементами. Последняя группа состоит из инертных (или благородных) газов.
Определение металлов и неметаллов в таблице Менделеева. Простые и сложные вещества.
Простые вещества (металлы и неметаллы)
Вывод
Соотношение металлов и неметаллов в таблице Менделеева явно перевешивает в пользу первых. Такое положение свидетельствует о том, что группа металлов объединена слишком широко и требует более подробной классификации, что признается научным сообществом.
Это интересно! Основной закон Гесса и следствия из него
uchim.guru
Металлические свойства химических элементов
В настоящий момент науке известно сто пять химических элементов, систематизированных в виде периодической таблицы. Подавляющее большинство из них причисляют к металлам, что подразумевает наличие у этих элементов особых качеств. Это так называемые металлические свойства. К таким характеристикам, в первую очередь, относятся пластичность, повышенная тепло- и электропроводимость, способность к образованию сплавов, низкое значение потенциала ионизации.

Металлические свойства того или иного элемента обусловлены способностью его атомов при возникновении взаимодействия с атомными структурами других элементов смещать в их направлении электронные облака или же «отдавать» им свои свободные электроны. Самыми активными металлами являются те, что имеют низкую энергию ионизации и электроотрицательность. Также ярко выраженные металлические свойства характерны для элементов, имеющих максимально большой радиус атома и предельно малое число внешних (валентных) электронов.

По мере наполнения валентной орбиты количество электронов во внешнем слое атомной структуры возрастает, и радиус, соответственно, уменьшается. В связи с этим атомы начинают стремиться к присоединению свободных электронов, а не к их отдаче. Металлические свойства таких элементов приобретают тенденцию к уменьшению, а их неметаллические свойства – к увеличению. И, наоборот, при увеличении атомного радиуса отмечается усиление металлических свойств. Поэтому характерной общей чертой всех металлов являются, так называемые, восстановительные качества – та самая способность атома отдавать свободные электроны.
Наиболее ярко металлические свойства элементов проявляются у веществ первой, второй групп главных подгрупп периодической таблицы, а также у щелочных и щелочноземельных металлов. Но самые сильные восстановительные качества наблюдаются у франция, а в водной среде – у лития благодаря более высокому показателю энергии гидратации.

Количество элементов, у которых проявляются металлические свойства, в пределах периода возрастает с увеличением номера периода. В периодической таблице металлы от неметаллов отделены диагональной линией, которая тянется от бора к астату. По этой разделительной черте расположены элементы, у которых в равной степени проявляются и те, и другие качества. К таким веществам относятся кремний, мышьяк, бор, германий, астат, сурьма и теллур. Данная группа элементов называется металлоидами.
Каждый период характеризуется наличием своеобразной «пограничной зоны», в которой располагаются элементы с двойственными качествами. Следовательно, переход от ярко выраженного металла к типичному неметаллу осуществляется постепенно, что и нашло отражение в периодической таблице.
Общие свойства металлических элементов (высокая электропроводимость, теплопроводность, ковкость, характерный блеск, пластичность и др.) обусловлены схожестью их внутреннего строения, а точнее – наличием кристаллической решетки. Однако существует немало качеств (плотность, твердость, температура плавления), которые придают всем металлам сугубо индивидуальные физико-химические свойства. Эти характеристики зависят от строения кристаллической решетки каждого конкретного элемента.
fb.ru
Некоторые закономерности в периодической таблице д.и. менделеева
НЕКОТОРЫЕ ЗАКОНОМЕРНОСТИ В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ
Д.И. МЕНДЕЛЕЕВА
Периодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей.
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении СПРАВА НАЛЕВО вдоль периода МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении – возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Например, углерод – более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!), все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того – в левой или правой части таблицы они находятся.
У d- и f-элементов, как мы знаем, есть “резервные” электроны из “предпоследних” оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный “блок” (это сделано в “длинной” форме таблицы), то обнаружится закономерность, Левая нижняя часть блока содержит типичные металлы, правая верхняя – типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной “октетной” ковалентной связи (как в боре), либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них – существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой “шубой” из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
3. Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ – ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. У “тяжелых” благородных газов криптона и ксенона, которые находятся в нижней части группы, удается “отобрать” электроны и получить их соединения с сильными окислителями (фтором и кислородом), а для “легких” гелия, неона и аргона это осуществить не удается.
В правом верхнем углу таблицы находится самый активный неметалл-окислитель фтор (F), а в левом нижнем углу – самый активный металл-восстановитель цезий (Cs). Элемент франций (Fr) должен быть еще более активным восстановителем, но его химические свойства изучать крайне трудно из-за быстрого радиоактивного распада.
4. По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
5. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
6. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ.
Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода.
7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
8. Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
9. s-Элементы имеют валентности, совпадающие с номером их группы.
10. p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
11. d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
12. Не только элементы, но и многие их соединения – оксиды, гидриды, соединения с галогенами – обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически “повторяются” (то есть могут быть записаны в виде обобщенной формулы). Например:
LiCl BeO BCl3 h4O . HF NaCl MgO AlCl3 h4S … HCl KCl CaO GaCl3 h4Se … HBr . . . . . . . . . . . . . . . . . . . . . . . . . . . . | Обобщенная формула RCl RO RCl3 h4R HR хлориды оксиды хлориды гидриды гидриды |
Мы с вами рассмотрели важнейшие закономерности, наблюдаемые внутри периодов и групп Периодической таблицы Д.И. Менделеева. Теперь мы сможем их активно использовать в дальнейшем изучении химии. Как вы убедитесь, это во многом облегчит нам понимание и даже предсказание свойств самых разнообразных химических веществ.
ИСТОРИЯ-ШУТКА
Изучение химии не только в школе, но и в университете начинается с понятий “атом” и “элемент”. Всем начинающим химикам приходится заучивать названия элементов. Кому-то это занятие может показаться скучным, но только не студентам. Любое скучное занятие они могут сделать веселым и даже озорным. Студенты Ростовского университета однажды придумали сказку, в которой вместо привычных слов использовались названия химических элементов. В студенческом фольклоре эта сказка имеет несколько вариантов. Здесь мы приводим только один из них. А впервые читатели узнали об этой сказке из журнала “Химия и жизнь” в 1989 году. В этом журнале вообще много интересного не только для взрослых, но и для юных естествоиспытателей. Итак:
Зашли мы как-то с БЕРКЛИЕМ к ВАНАДИЮ на его ФЕРМИЙ. Сидим, скучаем, на душе СЕРА. Тут БЕРКЛИЙ нам вдруг и СКАНДИЙ: “А не сходить ли нам в ЦИРКОНИЙ?” А надо сказать, что от нас неподалеку как раз ЦИРКОНИЙ остановился проездом то ли из ТУЛИЯ в САМАРИЙ, то ли из ФРАНЦИЯ в АМЕРИЦИЙ, а может быть даже из ИНДИЯ в ЕВРОПИЙ.
Мы говорим: “Ну ты, БЕРКЛИЙ, ТИТАН!” Стали считать РУБИДИИ. Как раз на три билета хватило. Тут ВАНАДИЙ и говорит: “А я НЕОДИМ, я с ГАЛЛИЙ”. А БЕРКЛИЙ ему: “Раз НЕОДИМ, давай еще рубидии” – и нам подМАРГАНЕЦ. А ВАНАДИЙ, известный ПЛУТОНИЙ, давай АНТИМОНИи разводить: “У меня, мол, одна МЕДЬ АСТАТ, АРГЕНТУМ весь кончился”.
Я говорю: “Может, ну ее, ГАЛЛИЙ – вредная она, как МЫШЬЯК!” А ВАНАДИЙ ни в какую – прямо КРЕМНИЙ! Впился в нас, как БОР. Тогда я, как самый АКТИНИЙ, у него ИТТЕРБИЙ: “ПЛАТИНА, – говорю, – и все тут!” С большим трудом ПАЛЛАДИЙ.
“А кто за билетами-то пойдет? – говорит ВАНАДИЙ – Я вчера с ДУБНИЯ упал, совсем ХРОМ…” Тогда БЕРКЛИЙ сБЕРИЛЛИЙ наши РУБИДИИ, сунул их в карман и побежал. А ВАНАДИЙ РАДОН, как ТОРИЙ – давай звонить своей ГАЛЛИЙ и что-то ей там про ИНДИЙ заЛИТИЙ.
Вдруг из окна слышим: “АУРУМ, АУРУМ!” Я говорю: “Никак БЕРКЛИЙ?” А ВАНАДИЙ: “Нет, НЕОН”. ГАДОЛИНИЙ мы, ГАДОЛИНИЙ, кто бы это был. Слышим опять: “АУРУМ, АУРУМ!”
Вышли мы во двор и видим – по двору БЕРКЛИЙ кругами бегает, а за ним соседский КОБАЛЬТ АРГОН и ГАФНИЙ, ГАФНИЙ на него. Догнал он БЕРКЛИЯ, да как УКСУС его сзади за карман, где наши РУБИДИИ лежат!. Наш БЕРКЛИЙ парень ЖЕЛЕЗО, не уступает: “СУРЬМА, – кричит, – СВИНЕЦ, ПРАЗЕОДИМ проклятый!” А тот знай его ТЕРБИЙ.
Тут БЕРКЛИЙ совсем ЛЮТЕЦИЙ стал. Руками машет, орет: “Кто мне брюки ЛАНТАН будет?” Ну, думаю, все – сейчас БЕРКЛИЙ ГОЛЬМИЙ останется. Подбегаем мы и видим – РУБИДИИ-то наши уже у КОБАЛЬТА во РТУТИ! Я к нему: “АРГОНЧИК, – говорю, – скажи “ГАФНИЙ”, ну, скажи!” А он только сквозь зубы ЦЕЗИЙ: р-р-р…
Вдруг ВАНАДИЙ СТАННУМ на четвереньки да как рявкнет: “ГАФНИЙ!!!” От неожиданности АРГОН наши РУБИДИИ проглотил и бегом со двора. Я – за ним: “ПОЛОНИЙ, кричу, РУБИДИИ на место!” А ВАНАДИЙ грустно так говорит: “Что он тебе, РОДИЙ их, что ли?”
ПЛЮМБУМ мы на вредного КОБАЛЬТА и ушли. Вот так мы ЦИРКОНИЙ посмотрели, не выходя со двора. Чтобы мы еще когда-нибудь БЕРКЛИЯ за чем-нибудь посылали – ни НИКЕЛЬ!”
Задачи .
Все химические термины, использованные в сказке, обозначают вещества, являющиеся ЭЛЕМЕНТАМИ. Кроме одного, которое является не элементом, а сложным веществом. Найдите его.
В сказке используются либо русские, либо латинские названия элементов. Исключение составляют два элемента: название одного из них встречается в русском и в латинском варианте, а другого – в русском и английском. Какие это элементы?
ПОЛУЧЕНИЕ КИСЛОРОДА
Большое количество кислорода используется в промышленности, в медицине, в других областях человеческой деятельности. Промышленные количества кислорода получают из жидкого воздуха. Сначала воздух сжимают мощными компрессорами – при этом он, как любой сжимаемый газ, сильно нагревается. Если вам приходилось энергично накачивать велосипедную камеру, то вы должны помнить, что корпус насоса и шланг нагреваются довольно заметно.
Сжатый воздух в больших баллонах-емкостях охлаждается. Затем его подвергают быстрому расширению через узкие каналы, снабженные турбинками для дополнительного отбора энергии у молекул газа. Эти устройства называются турбодетандерами. При расширении любого газа всегда происходит его охлаждение. Если газ был сжат очень сильно, то его расширение может привести к такому сильному охлаждению, что часть воздуха сжижается. Жидкий воздух собирают в специальные сосуды, называемые сосудами Дьюара.
Из пространства между внутренней и внешней стенками сосуда откачан воздух. Вакуум практически не проводит тепло, поэтому жидкий газ, даже имея очень низкую температуру, может сохраняться в таком сосуде длительное время.
Как вы уже знаете, жидкий кислород кипит при более “высокой” температуре (-183 оС), чем жидкий азот (-196 оС). Поэтому при “нагревании” жидкого воздуха, когда температура этой очень холодной жидкости медленно повышается от -200 оС до -180 оС, прежде всего при -196 оС перегоняется азот (который опять сжижают) и только следом перегоняется кислород. Если такую перегонку жидких азота и кислорода произвести неоднократно, то можно получить весьма чистый кислород. Обычно его хранят в сжатом виде в стальных баллонах, окрашенных в голубой цвет. Характерная голубая окраска баллонов нужна для того, чтобы нельзя было спутать кислород с каким-нибудь другим сжатым газом.
Аппаратура для промышленного получения кислорода, как мы видим, очень сложна и энергоемка. В лаборатории кислород удобнее получать из его соединений с другими элементами.
Чаще всего кислород получают нагреванием таких веществ (в состав которых кислород входит в связанном виде), как перманганат калия (марганцовка), хлорат калия (бертолетова соль), нитрат калия (селитра):
2 KMnO4
=
K2MnO4
+
MnO2
+
O2
перманганат калия
нагревание
манганат калия
диоксид марганца
кислород
2 KClO3
=
2 KCl
+
3 O2
хлорат калия
нагревание
хлорид калия
кислород
2 KNO3
=
2 KNO2
+
O2
нитрат калия
нагревание
нитрит калия
кислород
Удобно получать кислород в лаборатории из пероксида водорода:
2 h4O2
=
2 h4O
+
O2
пероксид водорода
катализатор
кислород
Пероксид водорода обычно используется в виде 3%-ного водного раствора. Многие из вас знакомы с ним, потому что такой раствор применяется как дезинфицирующее средство при обработке царапин и мелких ран. Он мало устойчив и уже при стоянии медленно разлагается на кислород и воду. Попав на царапину или ранку, пероксид начинает выделять кислород гораздо интенсивнее (сильно пузырится, шипит). Дело здесь в том, что кровь содержит особые вещества (катализаторы), которые ускоряют реакцию разложения пероксида водорода. Катализаторы – это вещества, способные ускорять химические превращения, сами оставаясь при этом неизменными (более подробно о них рассказывается в следующей книге).
Катализаторами разложения Н2О2 могут служить многие вещества, в том числе и неорганические: диоксид марганца (MnO2), древесный уголь (углерод), железный порошок. Существуют и “антикатализаторы” – то есть вещества, замедляющие химическое превращение. Такие замедлители химических реакций называются ингибиторами. Например, фосфорная кислота Н3РО4 по каким-то причинам препятствует разложению пероксида водорода.
Интересен способ получения кислорода из пероксидов металлов, который раньше применяли на подводных лодках, потому что одновременно с выделением кислорода происходит поглощение углекислого газа:
2 Na2O2
+
2 CO2
=
2 Na2CO3
+
O2
пероксид натрия
углекислый газ
сода
кислород
На современных атомных подводных лодках, где имеется мощный и почти неисчерпаемый источник электрической энергии, есть возможность получать кислород разложением воды под действием электрического тока (электролизом воды):
2 h4O
=
2 h4
+
O2
электрический ток
водород
кислород
История открытия кислорода интересно переплетается с историей появления подводных лодок. Есть сведения, что кислород был открыт еще в XVII веке голландским ученым К. Дреббелем. Он использовал этот газ для дыхания в подводной лодке собственной конструкции. Но это открытие относилось к военной технике и держалось в секрете, поэтому не оказало никакого влияния на дальнейшие исследования.
До официального открытия кислорода химики, вероятно, уже получали этот газ разными способами, но не знали, что держат в руках новый элемент.
Первооткрывателями кислорода считаются шведский химик Карл Шееле и английский естествоиспытатель Джозеф Пристли. Шееле получил кислород несколько раньше, но опубликовал свои исследования позднее, чем Пристли.
Карл Шееле по профессии был аптекарем, а по призванию – химиком-экспериментатором. В течение многих лет он изучал разложение нагреванием множества веществ (среди которых была и селитра KNO3) и получил газ, который поддерживал дыхание и горение. Свои исследования он опубликовал в 1777 году в книге “Химический трактат о воздухе и огне”.
Джозеф Пристли был священником, а в естественных науках его интересовала прежде всего “пневмохимия”, т.е. изучение свойств различных газов. Он был первым, кто специально растворил газ в воде и обнаружил, что вода стала удивительно вкусной. Так была изобретена газированная вода.
Затем Пристли, как и Шееле, стал изучать газы, выделяемые различными веществами при нагревании. Получаемый газ он выводил через трубку в сосуд, заполненный не водой, а ртутью. Пристли уже убедился в том, что вода слишком хорошо растворяет газы.
Среди веществ, разложение которых изучил Пристли, оказалось одно, известное еще алхимикам под названием “меркуриус кальцинатус пер се” или жженая ртуть. Это вещество на современном химическом языке называется оксидом ртути, а уравнение его разложения при нагревании выглядит следующим образом:
2 HgO
=
2 Hg
+
O2
оксид ртути
нагревание
ртуть
кислород
Вы можете теперь представить, как трудно было изучать химию во времена, когда химические формулы еще не были изобретены. То, что мы только что записали коротким химическим уравнением, Пристли описал в 1774 году следующим образом: “Я поместил под перевернутой банкой, погруженной в ртуть, немного порошка “меркуриус кальцинатус пер се”. Затем я взял небольшое зажигательное стекло и направил лучи Солнца прямо внутрь банки на порошок. Из порошка стал выделяться воздух, который вытеснил ртуть из банки. Я принялся изучать этот воздух. И меня удивило, даже взволновало до глубины моей души, что в этом воздухе свеча горит лучше и светлее, чем в обычной атмосфере”.
Разумеется, такое описание реакции выглядит весьма поэтично по сравнению с обычным химическим уравнением. Зато уравнение точнее и короче отражает суть произошедшей химической реакции, его легче понять и запомнить.
Задачи.
6.1. Человеку для дыхания требуется примерно 1 моль кислорода в час. Рассчитайте, сколько нужно взять с собой пероксида натрия Na2O2 для суточного путешествия в одноместной подводной лодке.
6.2. Сколько кислорода (в молях) содержится в заправленном кислородном баллоне, если его емкость составляет 40 л, давление в нем 150 атм и температура газа 20 оС? Какое количество воздуха (м3) оказалось переработанным в кислород (содержание O2 в воздухе примите 21 объемн. %)?
6.3. Сколько граммов селитры KNO3 требуется разложить нагреванием для того, чтобы заполнить кислородом сосуд емкостью 5л (при н.у.)?
6.4. В лаборатории имеется по 10 граммов следующих реактивов: KMnO4, KClO3, KNO3. Сколько кислорода (в литрах при н.у.) можно получить из каждого?
6.5. Тлеющая лучинка самопроизвольно вспыхивает в воздухе, если количество кислорода в нем не менее 28 объемных %. Какое минимальное количество оксида ртути HgO требуется разложить в закрытой литровой банке с воздухом, чтобы тлеющая лучинка, внесенная в эту банку, вспыхнула?
Примерный перечень рекомендуемых программ:
Химический вечер «Поле чудес»
Внеклассное мероприятие «Химики шутят»
Мероприятие «Неделя химии»
Химический брейн – ринг
Интеллектуальная игра «Малахитовая шкатулка»
Конкурс «Знатоки химии»
Мероприятие для старшеклассников «Химия и тайны красоты»
ПРИЛОЖЕНИЕ 10
refdb.ru



