Внутренняя энергия идеального одноатомного газа формула – “Формула Выразить из формулы Формула Внутренней энергии идеального одноатомного газа Абсолютную температуру Изменения внутренней энергии идеального двух.”. Скачать бесплатно и без регистрации.
- Комментариев к записи Внутренняя энергия идеального одноатомного газа формула – “Формула Выразить из формулы Формула Внутренней энергии идеального одноатомного газа Абсолютную температуру Изменения внутренней энергии идеального двух.”. Скачать бесплатно и без регистрации. нет
- Советы абитуриенту
- Идеальный одноатомный газ, теория и примеры
- Внутренняя энергия тел – формулы и определения
- Внутренняя энергия идеального газа, теория и примеры
- Внутренняя энергия идеального газа — Мегаэнциклопедия Кирилла и Мефодия — статья
- Внутренняя энергия. 1-й закон термодинамики.
- Внутренняя энергия идеального газа – особенности, теория и формула
- Внутренняя энергия идеального газа
Идеальный одноатомный газ, теория и примеры
Определение идеального одноатомного газа
Количество атомов в молекуле оказывает влияние на то, как распределяется энергия по степеням свободы. Так для одноатомного газа молекула имеет три степени свободы (). Формулу для расчета внутренней энергии идеального одноатомного газа очень просто получить.
Внутренняя энергия одноатомного идеального газа
Учтем, что молекулы идеального газа представлены как материальные точки, которые не взаимодействуют на расстоянии. Отсутствие сил взаимодействия между молекулами обозначает, что потенциальная энергия взаимодействия молекул постоянна. Суммарная энергия покоя самих молекул также неизменна, так как молекулы при тепловых процессах не изменяются. Следовательно, внутренняя энергия идеального одноатомного газа является суммой кинетических энергий поступательного движения молекул и еще некоторая постоянная.
Обозначим внутреннюю энергию газа как U, тогда сказанное выше запишем как:
где – сумма кинетических энергий поступательного движения молекул; N – число молекул в газе. Примем во внимание то, что средняя кинетическая энергия молекулы () равна:
По закону о равномерном распределении энергии по степеням свободы имеем:
для одноатомного газа:
– постоянная Больцмана; T – температура по шкале Кельвина.
Внутреннюю энергию одноатомного идеального газа можно записать как:
Обычно постоянную величину в выражении (5) опускают, так как в расчётах она роли не играет.
Выражение (5) говорит о том, что внутренняя энергия идеального газа определена его температурой. Она является функцией состояния и не зависит от процесса который провели для того чтобы газ пришел в состояние с этой температурой. При этом изменение внутренней энергии идеального газа определено только его начальным и конечным состояниями, и не связано с характером процесса.
Выражение (5) часто используют в виде:
где m – масса газа; – молярная масса газа; – универсальная газовая постоянная; – количество вещества.
Теплоемкость одноатомного идеального газа
Для изохорного процесса, проводимого в идеальном газе работа равна нулю (A), поэтому первое начало термодинамики:
запишем как:
где – теплоемкость газа при постоянном объеме. Используя выражения (8) и (6) получим:
Используя формулу (10) можно вычислить молярную теплоемкость любого одноатомного газа при постоянном объеме:
Молярная теплоемкость одноатомного газа при изобарном процессе () связана с соотношением Майера:
Примеры решения задач
ru.solverbook.com
Внутренняя энергия тел – формулы и определения
Все окружающие нас макроскопические тела в своем составе имеют частицы: атомы или молекулы. Находясь в постоянном движении, они одновременно обладают двумя видами энергии: кинетической и потенциальной и формируют внутреннюю энергию тела:
U = ∑ Еk+∑ Еp
В это понятие входит также энергия взаимодействия друг с другом электронов, протонов, нейтронов.
Возможно ли изменение внутренней энергии
Существует 3 способа ее изменения:
- благодаря процессу теплопередачи;
- путем совершения механической работы;
- с помощью проведения химических реакций.
Рассмотрим более подробно все варианты.
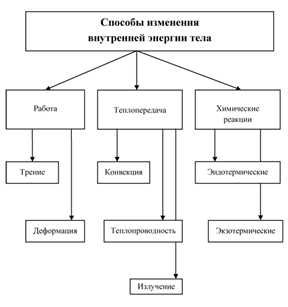
Если работу будет совершать само тело, то его внутренняя энергия станет уменьшаться, а когда работу совершают над телом, внутренняя его энергия будет увеличиваться.
Простейшими примерами увеличения энергии являются случаи добывания огня с помощью трения:
- с применением трута;
- с помощью огнива;
- с использованием спичек.
Тепловые процессы, связанные с изменениями температуры, также сопровождаются изменениями внутренней энергии. Если нагревать тело, его энергия будет возрастать.
Результатом химических реакций является превращение веществ, которые отличны друг от друга строением и составом. Например, в процессе горения топлива после соединения водорода с кислородом образуется оксид углерода. При соединении соляной кислоты с цинком выделится водород, а в результате горения водорода выделится водяной пар.
Внутренняя энергия тела будет меняться и из-за перехода электронов с одной электронной оболочки на другую.
Энергия тел — зависимость и характеристики
Внутренняя энергия является характеристикой теплового состояния тела. Она зависит от:
- агрегатного состояния, и меняется при кипении и испарении, кристаллизации или конденсации, плавлении или сублимации;
- массы тела;
- температуры тела, характеризующей кинетическую энергию частиц;
- рода вещества.
Внутренняя энергия одноатомного идеального газа
Эта энергия, в идеале, складывается из кинетических энергий каждой частицы, которая беспорядочно и непрерывно движется, и потенциальной энергии их взаимодействия в рамках конкретного тела. Происходит это благодаря изменению температуры, что подтверждают проведенные эксперименты Джоуля.
Для расчета внутренней энергии одноатомного газа пользуются уравнением:
, где в зависимости от изменения температуры будет меняться внутренняя энергия (возрастать с увеличением температуры, и уменьшаться с ее убыванием). Внутренняя энергия – это функция состояния.
fizikatyt.ru
Внутренняя энергия идеального газа, теория и примеры
Определение и общие сведения о внутренней энергии идеального газа
Она включает энергию, которая возникает, как результат взаимодействия и перемещения частиц, составляющих сложные частицы. К внутренней энергии относят кинетическую энергию, связанную с перемещением центра масс системы (движение системы как целого), потенциальную энергию системы во внешнем поле. Условно считают, что изменение внутренней энергии является положительным, если внутренняя энергия системы растет, и отрицательной, при уменьшении внутренней энергии.
Обычно внутреннюю энергию в термодинамике обозначают буквой U.
В идеальном газе взаимная потенциальная энергия молекул равна нулю, внутренняя энергия его равна сумме кинетических энергий молекул:
где i – число степеней свободы молекулы идеального газа; m – масса газа; – молярная масса газа; — постоянная Больцмана; – число Авогадро; – универсальная газовая постоянная; – количество вещества; T – температура по абсолютной шкале. Внутренняя энергия идеального газа определена его термодинамической температурой (T) и пропорциональна массе.
Внутренняя энергия является функцией состояния, что означает: при любом переходе из одного состояния в другое изменение внутренней энергии () будет равно:
где – внутренняя энергия первого состояния системы; – внутренняя энергия второго состояния. не зависит от хода процесса.
Внутренняя энергия смеси из m идеальных газов равна сумме внутренних энергий газов (), составляющих эту смесь:
Внутренняя энергия и первое начало термодинамики
Внутренняя энергия системы может изменяться в результате проведения различных процессов, например, при совершении над системой работы или отведения (подведения) от нее тепла. При превращении энергии выполняется закон сохранения, который в термодинамике носит название первого начала:
где Q – количество теплоты, полученное системой; A – работа, которую совершает система против внешних сил.
Примеры решения задач
ru.solverbook.com
Внутренняя энергия идеального газа — Мегаэнциклопедия Кирилла и Мефодия — статья
Если идеальный газ одноатомный, то кинетическая энергия обусловлена только поступательным движением молекулы, и ее средняя кинетическая энергия связана с температурой соотношением: \(E_0 = \frac 3 2 kT\)Для газа массой m, в котором содержится N молекул, внутреннюю энергию U можно выразить следующим образом:
\(U = E_0 N = \frac 3 2 \frac m M R T \)
R = 8, 310 Дж/К*моль — универсальная газовая постоянная, Т — температура.
Следовательно, внутренняя энергия идеального газа однозначно определяется его температурой. Изменение температуры газа приводит к изменению его внутренней энергии.Для многоатомного идеального газа выражение для внутренней энергии будет зависеть от числа атомов в молекуле. Следует учитывать кинетическую энергию не только поступательного движния молекул, но вращательного движения молекул, а в некоторых случаях и энергию колебания атомов в молекуле друг относительно друга. Учесть этот вид энергии помогает закон равнораспределения энергии по степеням свободы. Этот закон можно считать обобщением энергетического определения температуры. Он утверждает, что на каждую степень свободы молекулы приходится в среднем энергия \(\frac 1 2 kT\)(в расчете на одну молекулу). То есть независимо от числа степеней свободы молекул три степени всегда поступательные и ни одна из них не имеет преимущества перед другими.Число степеней свободы — число независмых переменных, полностью определяющих положение системы в пространстве.
| Газ | Число степеней свободы | ||
| поступательных | вращательных | всего | |
| Одноатомный | 3 | — | 3 |
| Двухатомный | 3 | 2 | 5 |
| Многоатомный | 3 | 3 | 6 |
- Виртуальная школа Кирилла И Мефодия. Физика. 10 класс. 2006-2010 гг.
- Внутренняя энергия идеального газа. А. Черноуцан // Квант, 2000, № 1
- Справочник школьника по физике. Т.И. Трофимова. Оникс 21 век. 2005
megabook.ru
Внутренняя энергия 1-й закон термодинамики. | |
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. | |
Внимание!
| U=U(T,V) |
Для идеального газа: U=U(T), т.к. взаимодействием на расстоянии пренебрегаем. – внутренняя энергия идеального одноатомного газа. Внутренняя энергия – однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) – одной и той же энергии могут соответствовать разные состояния. | Идеальный газ:
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т.е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты. |
|
Р.Майер, Д.Джоуль, Г.Гельмгольц – закон сохранения энергии для тепловых процессов – 1-й закон термодинамики. |
|
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
| |
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют процесс изменения внутренней энергии, но не саму внутреннюю энергию. |
|
Если А – работа внешних сил, а А’ – работа газа, то А = – А’ (в соответствии с 3-м законом Ньютона). Тогда: – другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. | |
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода – устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A’= – ΔU. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|
www.eduspb.com
Внутренняя энергия идеального газа – особенности, теория и формула
Рассмотрение того или иного физического явления или класса явлений удобно производить при помощи моделей разной степени приближения. Например, при описании поведения газа используется физическая модель – идеальный газ.
Любая модель имеет границы применимости, при выходе за которые требуется ее уточнение либо применение более сложных вариантов. Здесь мы рассмотрим простой случай описания внутренней энергии физической системы исходя из наиболее существенных свойств газов в определенных пределах.
Идеальный газ
Эта физическая модель для удобства описания некоторых основополагающих процессов следующим образом упрощает реальный газ:
- Пренебрегает размерами молекул газа. Это означает, что существуют явления, для адекватного описания которых данный параметр несущественен.
- Пренебрегает межмолекулярными взаимодействиями, то есть принимает, что в интересующих ее процессах они проявляются в ничтожно малые промежутки времени и не оказывают влияния на состояние системы. При этом взаимодействия носят характер абсолютно упругого удара, при котором не происходит энергопотерь на деформации.
- Пренебрегает взаимодействием молекул со стенками резервуара.
- Принимает, что система «газ – резервуар» характеризуется термодинамическим равновесием.
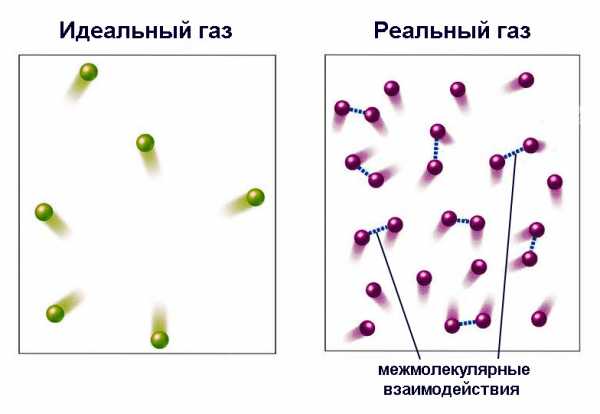
Такая модель подходит для описания реальных газов, если давления и температуры относительно невелики.
Энергетическое состояние физической системы
Всякая макроскопическая физическая система (тело, газ или жидкость в сосуде) обладает, помимо собственной кинетической и потенциальной, еще одним видом энергии – внутренней. Эту величину получают, суммируя энергии всех составляющих физическую систему подсистем – молекул.
Каждая молекула в составе газа тоже имеет свою потенциальную и кинетическую энергию. Последняя обусловлена непрерывным хаотическим тепловым движением молекул. Различные взаимодействия между ними (электрическое притяжение, отталкивание) определяются потенциальной энергией.
Нужно помнить, что если энергетическое состояние каких-либо частей физической системы не оказывает никакого влияния на макроскопическое состояние системы, то оно не принимается во внимание. Например, при обычных условиях ядерная энергия не проявляет себя в изменениях состояния физического объекта, поэтому ее учитывать не нужно. Но при больших температурах и давлениях это уже необходимо делать.
Таким образом, внутренняя энергия тела отражает характер движения и взаимодействия его частиц. Это означает, что данный термин является синонимом часто употребляемого понятия «тепловая энергия».
Одноатомный идеальный газ
Одноатомные газы, то есть такие, атомы которых не объединены в молекулы, существуют в природе – это инертные газы. Такие газы, как кислород, азот или водород, могут существовать в подобном состоянии только в условиях, когда извне затрачивается энергия на постоянное возобновление этого состояния, поскольку их атомы химически активны и стремятся соединиться в молекулу.
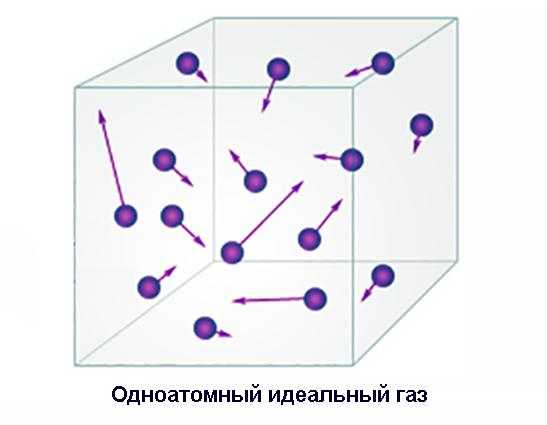
Рассмотрим энергетическое состояние одноатомного идеального газа, помещенного в сосуд некоторого объема. Это простейший случай. Мы помним, что электромагнитное взаимодействие атомов между собой и со стенками сосуда, а, следовательно, и их потенциальная энергия пренебрежимо малы. Так что внутренняя энергия газа включает в себя только сумму кинетических энергий его атомов.
Ее можно вычислить, умножив среднюю кинетическую энергию атомов в газе на их количество. Средняя энергия равна E = 3/2 х R / NA х T, где R – универсальная газовая постоянная, NA – число Авогадро, Т – абсолютная температура газа. Число атомов подсчитываем, умножая количество вещества на постоянную Авогадро. Внутренняя энергия одноатомного газа будет равна U = NA х m / M х 3/2 х R/NA х T = 3/2 х m / M х RT. Здесь m – масса и М – молярная масса газа.
Предположим, что химический состав газа и его масса всегда остаются одинаковыми. В таком случае, как видно из полученной нами формулы, внутренняя энергия зависит только от температуры газа. Для реального газа нужно будет учитывать, помимо температуры, изменение объема, поскольку оно влияет на потенциальную энергию атомов.
Молекулярные газы
В приведенной выше формуле число 3 характеризует количество степеней свободы движения одноатомной частицы – оно определяется числом координат в пространстве: x, y, z. Для состояния одноатомного газа вообще безразлично, вращаются ли его атомы.
Молекулы же сферически асимметричны, поэтому при определении энергетического состояния молекулярных газов нужно учитывать кинетическую энергию их вращения. Двухатомные молекулы, кроме перечисленных степеней свободы, связанных с поступательным движением, имеют еще две, связанные с вращением вокруг двух взаимно перпендикулярных осей; у многоатомных молекул таких независимых осей вращения три. Следовательно, частицы двухатомных газов характеризуются количеством степеней свободы f=5, у многоатомных же молекул f=6.
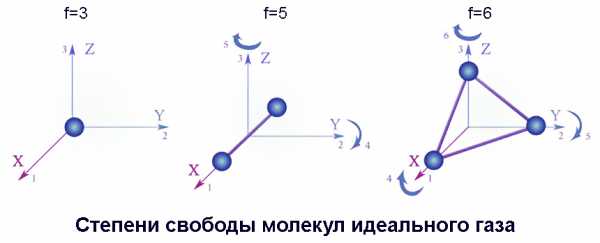
Вследствие хаотичности, присущей тепловому движению, все направления и вращательного, и поступательного перемещения совершенно равновероятны. Средняя кинетическая энергия, вносимая каждым видом движения, одинакова. Поэтому мы можем подставить величину f в формулу, что позволяет рассчитать внутреннюю энергию идеального газа любого молекулярного состава: U = f / 2 х m / M х RT.
Конечно, мы видим из формулы, что эта величина зависит от количества вещества, то есть от того, сколько и какого газа мы взяли, а также от структуры молекул этого газа. Однако, поскольку мы условились не менять массу и химический состав, то учитывать нам нужно только температуру.
Теперь рассмотрим, как величина U связана с другими характеристиками газа – объемом, а также давлением.
Внутренняя энергия и термодинамическое состояние
Температура, как известно, является одним из параметров термодинамического состояния системы (в данном случае газа). В идеальном газе она связана с давлением и объемом соотношением PV = m / M х RT (так называемое уравнение Клапейрона – Менделеева). Температура же определяет тепловую энергию. Так что последнюю можно выразить через набор других параметров состояния. Она безразлична к предыдущему состоянию, а также к способу его изменения.
Посмотрим, как изменяется внутренняя энергия, когда система переходит из одного термодинамического состояния в другое. Ее изменение при любом подобном переходе определяется разностью начального и конечного значений. Если система через некоторое промежуточное состояние возвратилась к первоначальному, то эта разность будет равна нулю.
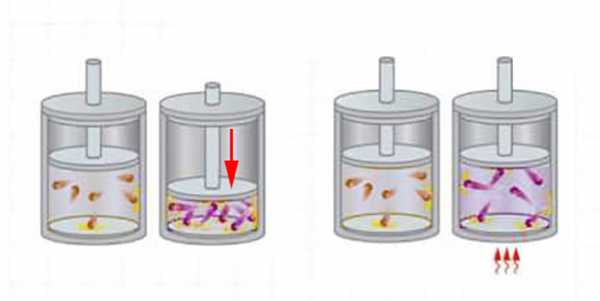
Допустим, мы нагрели газ в резервуаре (то есть подвели к нему дополнительную энергию). Термодинамическое состояние газа изменилось: возросли его температура и давление. Такой процесс идет без изменения объема. Внутренняя энергия нашего газа увеличилась. После этого наш газ отдал подведенную энергию, остыв до исходного состояния. Такой фактор, как, например, скорость этих процессов, не будет иметь никакого значения. Результирующее изменение внутренней энергии газа при любой скорости нагревания и охлаждения равняется нулю.
Важным моментом является то, что одному и тому же значению тепловой энергии может соответствовать не одно, а несколько термодинамических состояний.
Характер изменения тепловой энергии
Для того чтобы изменить энергию, требуется совершить работу. Работа может совершаться самим газом или внешней силой.
В первом случае затрата энергии на совершение работы производится за счет внутренней энергии газа. Например, мы имели в резервуаре с поршнем сжатый газ. Если отпустить поршень, расширяющийся газ станет поднимать его, совершая работу (чтобы она была полезной, пусть поршень поднимает какой-нибудь груз). Внутренняя энергия газа уменьшится на величину, затраченную на работу против силы тяжести и сил трения: U2 = U1 – A. В этом случае работа газа положительна, поскольку направление силы, приложенной к поршню, совпадает с направлением движения поршня.
Начнем опускать поршень, совершая работу против силы давления газа и опять-таки против сил трения. Тем самым мы сообщим газу некоторое количество энергии. Здесь уже считается положительной работа внешних сил.
Помимо механической работы, существует и такой способ отнять у газа или сообщить ему энергию, как теплообмен (теплопередача). Мы уже встречались с ним в примере с нагреванием газа. Энергия, переданная газу в ходе процессов теплообмена, называется количеством теплоты. Теплообмен бывает трех видов: теплопроводность, конвекция и лучистый перенос. Рассмотрим их немного подробнее.
Теплопроводность
Способность вещества к теплообмену, осуществляемому его частицами путем передачи друг другу кинетической энергии в ходе взаимных столкновений при тепловом движении – это теплопроводность. Если некоторая область вещества нагрета, то есть ей сообщено определенное количество теплоты, внутренняя энергия через некоторое время посредством столкновений атомов или молекул окажется распределена между всеми частицами в среднем однородно.
Понятно, что теплопроводность сильно зависит от частоты столкновений, а та, в свою очередь – от среднего расстояния между частицами. Поэтому газ, особенно идеальный, характеризуется весьма низкой теплопроводностью, и это свойство часто используют для теплоизоляции.

Из реальных газов теплопроводность выше у тех, чьи молекулы наиболее легкие и при этом многоатомные. Этому условию в наибольшей степени отвечает молекулярный водород, в наименьшей – радон, как самый тяжелый одноатомный газ. Чем более разрежен газ, тем худшим проводником тепла он является.
В целом передача энергии за счет теплопроводности для идеального газа – очень малоэффективный процесс.
Конвекция
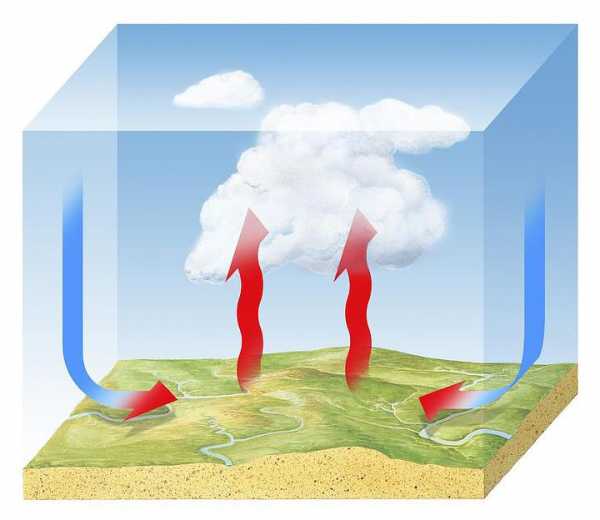
Гораздо эффективнее для газа такой вид теплообмена, как конвекция, при которой внутренняя энергия распределяется посредством потока вещества, циркулирующего в поле тяготения. Восходящий поток горячего газа формируется за счет архимедовой силы, поскольку он менее плотный вследствие теплового расширения. Смещающийся вверх горячий газ постоянно замещается более холодным – устанавливается циркуляция газовых потоков. Поэтому для того, чтобы обеспечить эффективный, то есть наиболее быстрый, нагрев через конвекцию, необходимо подогревать резервуар с газом снизу – как и чайник с водой.
Если же необходимо отнять у газа какое-то количество теплоты, то холодильник эффективнее размещать вверху, так как отдавший энергию холодильнику газ будет устремляться вниз под действием тяготения.
Примером конвекции в газе является обогрев воздуха в помещениях при помощи отопительных систем (их размещают в комнате как можно ниже) или охлаждение с применением кондиционера, а в природных условиях явление тепловой конвекции служит причиной перемещения воздушных масс и влияет на погоду и климат.
При отсутствии силы тяжести (при невесомости в космическом корабле) конвекция, то есть циркуляция воздушных потоков, не устанавливается. Так что нет смысла зажигать на борту космического корабля газовые горелки или спички: горячие продукты сгорания не будут отводиться вверх, а кислород – подводиться к источнику огня, и пламя затухнет.
Лучистый перенос
Вещество может нагреваться и под действием теплового излучения, когда атомы и молекулы приобретают энергию, поглощая электромагнитные кванты – фотоны. При низких частотах фотонов этот процесс не очень эффективен. Вспомним, что, когда мы открываем микроволновую печку, то обнаруживаем там горячие продукты, но не горячий воздух. С повышением частоты излучения эффект лучевого нагрева повышается, например, в верхней атмосфере Земли сильно разреженный газ интенсивно нагревается и ионизируется солнечным ультрафиолетом.
Различные газы в разной степени поглощают тепловое излучение. Так, вода, метан, углекислый газ поглощают его довольно сильно. На этом свойстве основано явление парникового эффекта.
Первое начало термодинамики
Вообще говоря, изменение внутренней энергии через нагревание газа (теплообмен) также сводится к совершению работы либо молекул газа, либо над ними посредством внешней силы (что обозначается так же, но с обратным знаком). Какая же работа совершается при таком способе перехода из одного состояния в другое? Ответить на этот вопрос нам поможет закон сохранения энергии, точнее, его конкретизация применительно к поведению термодинамических систем – первое начало термодинамики.
Закон, или универсальный принцип сохранения энергии, в наиболее обобщенной форме гласит, что энергия не рождается из ничего и не пропадает бесследно, а лишь переходит из одной формы в другую. В отношении термодинамической системы это надо понимать так, что работа, совершаемая системой, выражается через разность между сообщаемым системе (идеальному газу) количеством теплоты и изменением ее внутренней энергии. Иначе говоря, на это изменение и на работу системы затрачивается сообщенное газу количество теплоты.
В виде формул это записывается гораздо проще: dA = dQ – dU, и соответственно, dQ = dU + dA.
Мы уже знаем, что эти величины не зависят от способа, которым совершается переход между состояниями. От способа зависит скорость этого перехода и, как следствие, эффективность.
Что касается второго начала термодинамики, то оно задает направление изменения: теплота не может быть переведена от более холодного (а значит, менее энергичного) газа к более горячему без дополнительных затрат энергии извне. Второе начало также указывает, что часть энергии, расходуемой системой на совершение работы, неизбежно диссипирует, теряется (не исчезает, а переходит в непригодную для использования форму).
Термодинамические процессы
Переходы между энергетическими состояниями идеального газа, могут иметь разный характер изменения тех или иных его параметров. Внутренняя энергия в процессах переходов разного типа также будет вести себя по разному. Рассмотрим кратко несколько видов таких процессов.
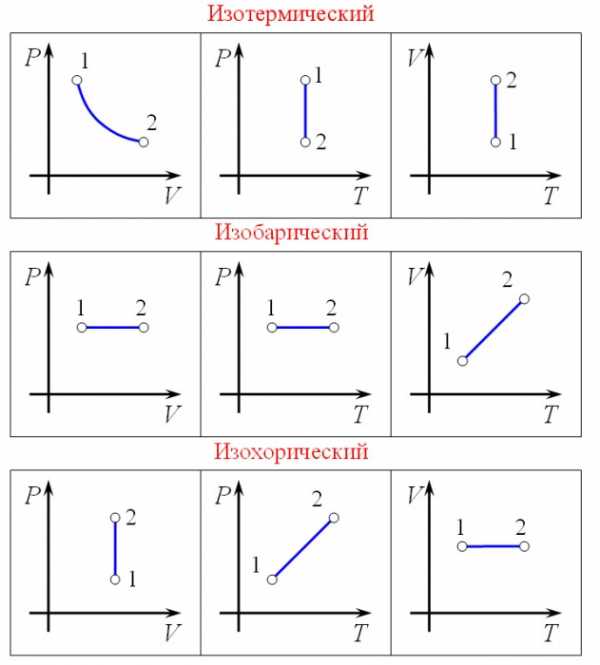
- Изохорный процесс протекает без изменения объема, следовательно, газ никакой работы не совершает. Внутренняя энергия газа изменяется как функция разности конечной и начальной температур.
- Изобарный процесс происходит при неизменном давлении. Газ совершает работу, а его тепловая энергия рассчитывается так же, как и в предыдущем случае.
- Изотермический процесс характеризуется постоянной температурой, а, значит, и тепловая энергия не меняется. Количество теплоты, получаемое газом, целиком уходит на совершение работы.
- Адиабатический, или адиабатный процесс протекает в газе без теплопередачи, в теплоизолированном резервуаре. Работа совершается только за счет затрат тепловой энергии: dA = – dU. При адиабатическом сжатии тепловая энергия увеличивается, при расширении – соответственно уменьшается.
Различные изопроцессы лежат в основе функционирования тепловых машин. Так, изохорный процесс имеет место в бензиновом двигателе при крайних положениях поршня в цилиндре, а второй и третий такты двигателя – это примеры адиабатического процесса. При получении сжиженных газов адиабатическое расширение играет важную роль – благодаря ему становится возможна конденсация газа. Изопроцессы в газах, при исследовании которых не обойтись без понятия о внутренней энергии идеального газа, характерны для многих явлений природы и находят применение в самых разных отраслях техники.
fb.ru
Внутренняя энергия идеального газа
Молекулы газа, совершая хаотическое движение, в соударениях изменяют свою скорость, поэтому в газе есть молекулы с различными скоростями в интервале от 0 до (но следует иметь в виду, что даже большие скорости молекул , равной Соответственно, и кинетические энергии молекул газа различны. Поэтому вводят средние характеристики молекул. Согласно закону Больцмана о равномерном распределении энергии молекул по степеням свободы, средняя энергия молекулы зависит от температуры газа T следующим образом:
, (5)
где i – суммарное число степеней свободы молекулы газа:
.
Для молекул при невысоких температурах ( ) величина . Число степеней свободы молекулы связано с числом атомов в молекуле и ее структурой (см. таблицу).
Таблица
Внутренняя энергия идеального газа U – это функция состояния газа, равная сумме кинетических энергий всех молекул, так как для невзаимодействующих молекул идеального газа . Таким образом, величина внутренней энергии
;
внутренняя энергия идеального газа
, (6)
где m и M – масса газа и молярная масса; R – молярная газовая постоянная.
4.1.3. Распределение молекул идеального газа по скоростям –
Закон Максвелла
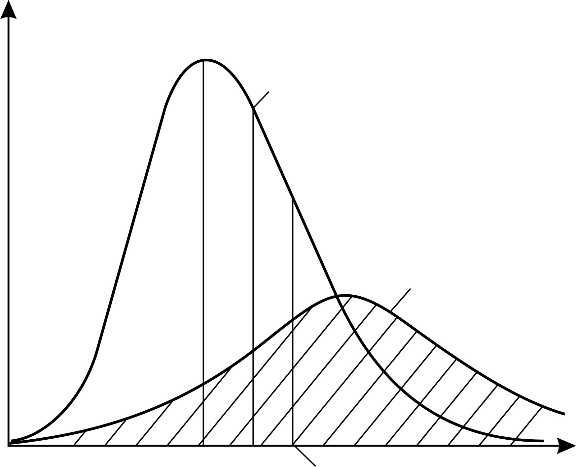
Закон Максвелла описывается функцией
.
Здесь – функция распределения молекул по скоростям; она равна доле молекул, имеющих скорости в единичном интервале вблизи данной скорости . Закон распределения молекул идеального газа по скоростям имеет следующий вид:
 , (7)
, (7)
,
, (8)
Средняя квадратичная скорость молекулы определяется по величине средней кинетической энергии поступательного движения молекулы (см. формулу (5)):
; . (9)
Средняя скорость молекулы (средняя арифметическая скорость) определяется с помощью закона статистического распределения
(10)
Сравнивая средние значения скоростей молекулы с учетом формул (8), (9) и (10), получаем соотношения, справедливые для молекул идеального газа и удобные в расчетах:
(11)
Похожие статьи:
poznayka.org



