И строение атома – Лекция № 3 “Строение атома и периодическая система химических элементов” – Лекции по химии – Студентам – Каталог файлов
- Комментариев к записи И строение атома – Лекция № 3 “Строение атома и периодическая система химических элементов” – Лекции по химии – Студентам – Каталог файлов нет
- Советы абитуриенту
Строение атома и все что с этим связано

Содержание:
История строения атома
Еще с давних времен мыслители, философы и первые ученые мужи предполагали, что все сущее, материя, воздух, вода, все состоит из неких мельчайших частиц — атомов. Основоположником атомарной теории строения мира был древнегреческий философ и ученый Демокрит, хотя, скорее всего не он был первым автором этой идеи – Демокрит много путешествовал по тогдашней ойкумене и учение о строении атомов мог перенять у халдейских и/или египетских жрецов, по совместительству блестящих ученых древнего мира.
Согласно учению Демокрита даже человеческая душа состоит из атомов. Он также объяснял многие особенности разных веществ, например, огонь, согласно Демокриту, потому печет, что атомы из которых он состоит острые, а твердые тела именно потому твердые, что атомы из которых они состоят крепко сцеплены между собой.
Учение Демокрита вызвало многие споры среди античных философов (в целом охочих к этому занятию), в частности частым предметом дискуссий и рассуждений был вопрос о делимости/неделимости атома и если атом таки делится, рассуждали философы, то делятся ли в свою очередь его мельчайшие частицы, и до каких пор происходит это деление? Некоторые же мудрецы считали атом мельчайшей неделимой частицей, ведь само название этого слова «atomos» на древнегреческом означало «неделимый».
Правда античные мудрецы дальше теоретических дискуссий так и не зашли, затем на смену античности пришло мрачное средневековье и стало не до атомов. Новый интерес к атомам, основным сведениям об их строении уже возник в XIX веке, времени нового расцвета науки и техники. Так уже с практическими опытами ученым стало понятно, что атом не является неделимым, а в 1860 году было сформулировано академическое понятие атома и молекулы.
XX век стал подлинным временем прорыва наших знаний об атоме, в том числе блестящие ученые физики Нильс Бор и Эрнест Резерфорд предложили так званую планетарную модель атома, сравнив его с планетной системой, где подобно тому как планеты вращаются вокруг Солнца, электроны в атоме вращаются вокруг атомного ядра, состоящего из протонов и нейтронов. Любопытно, что подобные рассуждения перекликаются с представлениями древних, ведь еще легендарный Гермес Трисмегист говорил «что вверху, то внизу», или другими словами строение планетных систем и галактик подобно строению мельчайшей частицы – атома.
Модели строения атома
Помимо модели Бора/Резерфорда были и другие, например, модель Томпсона, полагавшего, что атом является положительно заряженным телом, внутри которого располагаются электроны. Эту модель опроверг Резерфорд.
Также стоит отметить планетарную модель атома Нагаоки, предполагавшего, что строение атома подобно планете Сатурн, у которого вокруг ядра вращаются объединенные в кольца электроны.
Закономерным развитием общепризнанной планетарной модели Бора/Резерфорда стала квантовая модель строения атома, утверждающая, что в ядре атома находятся не имеющие заряда нейтроны, положительно заряженные протоны, а вокруг летают отрицательно заряженные электроны. При этом траектории движения электронов согласно законам квантовой механики наперед не заданы.
Разумеется, все модели строение атомы являются весьма упрощенными вариантами, подлинное строение атома куда более сложное.
Периодический закон Менделеева и строение атомов
Строение и свойства атомов различных химических элементов прямо связаны с местом последних в знаменитой таблице Менделеева. Там они расположены согласно электрическим зарядам своих ядер, зависящего от количества протонов (как помним заряженных положительно) и электронов, летающих вокруг ядра и заряженных отрицательно.
Электронная оболочка атомов
Электронная оболочка атомов имеет ровно столько электронов, сколько есть в его ядре протонов, именно благодаря этому атом является нейтрально заряженным – количество положительно и отрицательно заряженных частиц уравнивают друг друга.
Формула строения атома
Наряду с появлением планетарной теории строения атома появились и формулы, описывающие это самое строение для атомов разных химических элементов. Например, формулу строения атома азота можно описать как — 1s22s22p3, строение атома натрия — 1s22s22p63s1. Эти формулы показывают, какое количество электронов движется по каждой из орбит того или иного химического элемента.
Современная модель строения атома
В наше время физика не стоит на месте и с момент создания канонической планетарной модели атома Бора/Резерфорда было сделано много интересных открытий относительно устройства атома. Так, например, мы уже знаем что протоны, из которых состоит атомное ядро, сами в свою очередь состоят из еще более мелких элементарных частиц – кварков. Но кварки, также далеко не самые мелкие частицы, меньше их открытые загадочные нейтрино, о которых на нашем сайте есть интересная статья.
Строение атома, видео
И в завершение познавательное видео про электронное строение атома и атомного ядра.
www.poznavayka.org
Строение атома
В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». Некоторые из них утверждали, что вещество состоит из мельчайших частиц, называемых атомами. Научные основы атомно-молекулярного учения были заложены позднее в работах русского учёного М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Д. Дальтона, итальянского физика А. Авогадро и других исследователей.
Периодический закон Д.И. Менделеева показывает существование закономерной связи между всеми химическими элементами. Это говорит о том что в основе всех атомов лежит нечто общее. До конца XIX века в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И наконец в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
Это послужило толчком к образованию и развитию нового раздела химии «Строение атома». Первым указанием на сложную структуру атома – были опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение. На их пути легко подвижные тела откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света. Также удалось определить массу и величину их заряда. Масса каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких «составных частей».
Резерфорд Эрнест (1871-1937)
a- частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости a-частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути a-частиц образуются положительно и отрицательно заряженные ионы газа. Способность a-частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их.
Впоследствии аппарат для фотографирования частиц получил название камеры Вильсона. (Первый трековый детектор заряженных частиц. Изобретена Ч. Вильсоном в 1912. Действие Вильсона камеры основано на конденсации пересыщенного пара (образовании мелких капелек жидкости) на ионах, возникающих вдоль следа (трека) заряженной частицы. В дальнейшем вытеснена другими трековыми детекторами.)
Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку, они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку.
Модель атома Бор-Резерфорд
Исходя из этих наблюдений, Резерфорд предложил свою схему строения атома: в центре атома находится положительное ядро, вокруг которого по разным орбиталям вращаются отрицательные электроны. Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения a- частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство a-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда a-частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние a-частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. (Дифракционная РЕШЕТКА, оптический прибор; совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равноотстоящих друг от друга, на которых происходит дифракция света. Дифракционная решетка разлагает падающий на нее пучок света в спектр, что используется в спектральных приборах. )
Для рентгеновских лучей требовалась решётка с очень большим количеством делений на один миллиметр (примерно 1млн./1мм.). Такую решётку искусственно приготовить было невозможно. В 1912 г. у швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей.
Модель кристалла
Упорядоченное расположение атомов в кристалле и малое расстояние между ними давало повод предполагать что как раз кристаллы и подойдут на роль требуемой дифракционной решётки.
Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектр рентгеновских лучей почти всех элементов. Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента. Экраном для спектра служит фотобумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулировано следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов.
Еще до работ Мозли некоторые учёные предполагали, что порядковый номер элемента указывает число зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание a-частиц при прохождении через тонкие металлические пластинки, выяснил, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента. Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров.
Бор (Bohr) Нильс Хенрик Давид (1885-1962)
Линейчатые спектры получаются при разложении света испускаемого раскаленными парами или газами. Каждому элементу отвечает свой спектр, отличающийся от спектров других элементов. Большинство металлов дает очень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются и сравнительно простые спектры.
Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен “упасть” на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, “падение” электрона на ядро означало бы разрушение атома и прекращения его существования. Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении
Планк (Planck) Макс
(1858-1947)
линий спектра, ни и само существование линейчатых спектров. В 1913 г. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями – квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения: чем больше частота излучения, тем больше величина кванта. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты. Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : … n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра .Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторым трудностями из-за ее новизны.
Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается
на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, могущих находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя:
N=2n*n
где n-номер слоя. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла.
Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: «Карпускулярно-вролновой дуализм».
И так, электрон в атоме характеризуется:
1. Главным квантовым числом n, указывающим на энергию электрона;
2. Орбитальным квантовым числом l , указывающим на характер орбиты;
3. Магнитным квантовым числом, характеризующим положение облаков в пространстве;
4. И спиновым квантовым числом, характеризующим веретенообразное движение электрона вокруг своей оси.
… В далёком прошлом философы Древней Греции предполагали, что вся материя едина, но приобретает те или иные свойства в зависимости от её «сущности». А сейчас, в наше время, благодаря великим учёным, мы точно знаем, из чего на самом деле она состоит.
Используемая литература:
1) Курс общеё химии (Н.В. Коровин)
2) Курс общей химии (А.Н. Харин )
3) Строение вещества (В.К. Васильев, А.Н. Шувалова)
4) Физическая химия ( А.Л. Дайнэко )
www.examen.ru
Строение атома (ядро и электронная оболочка)
Строение атома (ядро и электронная оболочка). Состав атомных ядер (протоны и нейтроны). Протонное число. Нуклонного число
После открытия периодического закона долгое время оставалось неясным, почему свойства элементов находятся в периодической зависимости от их относительной атомной массы. Была непонятна сама причина периодичности. Необходимо было выяснить физический смысл периодического закона. Это стало возможным после установления строения атома. Долгое время в науке господствовало представление о том, что атомы являются неразделенными частицами. Однако в конце девятнадцатого века были зафиксированы факты, свидетельствующие о сложное строение атома. Особую роль сыграло викриття радиоактивности (самотеком распада атомов некоторых элементов).
В 1896 году французский физик А. Беккерель определил, что материалы, содержащие уран засвитлюють в темноте фотопластинку, ионизируют газы, вызывают свечение веществ, которые способны флюоресциюваты. Потом выяснилось, что эту способность имеет не только уран. Польской химик Склодовская-Кюри вместе с франзузьким физиком П. Кюри открыли два новых радиоактивных элемента: полоний и радуйся. Впоследствии английский физик Э. Резерфорд обнаружил, что радиоактивное излучение неоднородно и под воздействием электрического поля разделяется на α-, β-и γ-лучи. α-частицами являются ядра атомов гелия, β-частицы являются электронами, а γ-частицы — электромагнитными волнами. Изучение радиоактивности подтвердило сложность строения атома.
В 1911 году Э. Резерфорд при проведении опытов с α-частицами выяснил, что помимо электронов, каждый атом содержит другую частицу, называемую ядром атома. Он предложил ядерную (планетарную) модель атома, согласно которой атом состоит из положительно заряженного ядра, очень малого по размерам, в котором сосредоточена почти вся его масса. Вокруг ядра вращаются электроны, как планеты вокруг солнца.
Экспериментальные факты подтвердили сложность строения атома и показали, что атом состоит из отрицательно заряженных частиц — электронов и положительно заряженного ядра. В 1932 году российские физики Д. Д. Иваненко и Е. М. Гапон и независимо от них немецкий физик Гейзенберг предложили протонно-нейтронную строении атома. Согласно этой теории атомное ядро состоит из протонов и нейтронов. Эти частицы имеют общее название — нуклоны. Протоны, нейтроны, так же как и электроны, относятся к элементарным частицам. Протон p-это частица с относительной массой примерно равной единице и относительным зарядом +1. Нейтрон n-это электронейтральна частица с относительной массой примерно равной единице.
Многочисленные экспериментальные исследования показали, что заряд ядра атома в относительных единицах равно порядковому номеру элемента в периодической системе. Это физическим содержанием порякового номера. Число протонов в ядре Z определяет положительный заряд ядра, равно порядковому номеру элемента. Поэтому порядковый номер элемента называется его протонным числом. Относительная масса ядра состоит из массы протонов, которая также равна Z, и массы нейтронов, в относительных единицах равно числу нейтронов N. Поскольку практически вся масса атома сосредоточена в ядре (масса протона практически равна массе нейтрона и в 1836 раз превышает массу электрона), можно считать, что относительная атомная масса равна сумме масс протонов и нейтронов: Ar = Z + N
Поскольку протоны и нейтроны имеют общее название — нуклоны, относительная атомная масса определяется общим числом протонов и нейтронов и называется нуклонных числом. Нуклонного число (относительная атомная масса) и протонное число (порядковый номер) обозначаются соответственно верхним и нижним индексами слева от символа элемента. Например, из записи, определяем, что протонное число кислорода равна восьми, а нуклонного — шестнадцати.
Выясним, как, пользуясь положением химического элемента в периодической системе, можно определить число элементарных частиц (электронов, протонов и нейтронов) в атоме. Найдем в периодической системе химических элементов Алюминий. Из записи в клетке определяем, что порядковый номер алюминия равен 13, а относительная атомная масса 27. Так, заряд ядра атома алюминия равен +13. Ядро атома алюминия содержит 13 протонов и 14 (27 — 13 = 14) нейтронов. Пространство вокруг ядра заполняют 13 электронов.
xn—-7sbfhivhrke5c.xn--p1ai
Строение атома | Физика
В 1897 г. было сделано открытие, позволившее объяснить большинство электрических явлений: английский ученый Дж. Дж. Томсон открыл частицу, являющуюся носителем элементарного заряда. Эту частицу назвали электроном.
Масса электрона оказалась почти в 2000 раз меньше массы самого легкого атома в природе — атома водорода. Заряд электрона отрицательный:
qэл = –e = –1,6·10–19 Кл.
Этот заряд является неотъемлемой характеристикой электрона. В отличие от обычных тел, которые можно зарядить или, наоборот, разрядить, «избавить» электрон от его заряда невозможно. Более того, заряд электрона нельзя ни увеличить, ни уменьшить. Он всегда имеет одно и то же значение.
Из курса химии вы знаете, что электроны входят в состав атомов. Электроны внутри атома обращаются вокруг положительно заряженного атомного ядра.
Строение атома было открыто в 1911 г. в результате экспериментов, которыми руководил английский ученый Э. Резерфорд. Идея опытов состояла в том, чтобы выяснить, что происходит с быстролетящими частицами, когда на их пути оказываются атомы вещества.
Нужно сказать, что за несколько лет до этого было открыто явление радиоактивности: были обнаружены невидимые лучи, которые испускались некоторыми (теперь их называют радиоактивными) веществами (ураном, радием и др.). Изучение этих лучей показало, что в общем случае они состоят из трех компонентов, отличающихся друг от друга электрическим зарядом. Для обозначения отдельных видов радиоактивных излучений было предложено использовать первые три буквы греческого алфавита: α (альфа), β (бета) и γ (гамма).
Альфа-лучи состоят из положительно заряженных частиц (альфа-частиц), бета-лучи — из отрицательно заряженных частиц (электронов), гамма-лучи — никаким зарядом не обладают. Эти лучи опасны для человека. Поэтому, работая с радиоактивными препаратами, следует соблюдать особые меры предосторожности: использовать специальные защитные экраны и, конечно, никогда не брать эти препараты руками.
Резерфорд предложил использовать альфа-частицы в качестве тех «снарядов», которыми можно было бы «бомбардировать» атомы вещества. Направив узкий пучок этих частиц на тонкую пластинку (фольгу) исследуемого вещества, он обнаружил, что большинство альфа-частиц пролетало через фольгу почти беспрепятственно и лишь очень небольшая их часть, столкнувшись с чем-то внутри атома, отскакивала от фольги назад. Более подробно об опытах Резерфорда будет рассказано в старших классах. Здесь же мы ограничимся тем выводом, к которому он пришел на основе анализа полученных данных.
Согласно Резерфорду, атом по своему строению напоминает Солнечную систему. Подобно тому как планеты, притягиваясь к Солнцу, движутся вокруг него, так и электроны в атоме движутся вокруг ядра, удерживаемые силами притяжения к нему. Из-за этого сходства модель строения атома (рис. 11), предложенную Резерфордом, назвали планетарной моделью.
Расстояния между ядром и электронами очень велики по сравнению с размерами этих частиц. Если бы весь атом увеличился так, что ядро приняло бы размеры десятикопеечной монеты, то расстояние между ядром и электронами стало бы равным примерно километру!
Подсчитано, что если бы все электроны примкнули вплотную к атомным ядрам, то объем тела взрослого человека стал бы равным одной миллионной доле кубического миллиметра! Это означает, что более 99% внутри тела человека (как и любого другого тела) занимает пустота! Именно через пустоту внутри атомов и пролетали те альфа-частицы в опыте Резерфорда, которые не отклонялись фольгой назад.
Совокупность атомов одного вида называют химическим элементом. Атомы разных химических элементов отличаются друг от друга зарядом своих ядер и числом электронов, обращающихся вокруг них. Так, например, в атоме водорода движется всего лишь один электрон, в атоме кислорода — восемь электронов, в атоме урана — девяносто два.
Число электронов в атоме совпадает с порядковым номером элемента в таблице Д. И. Менделеева. Через этот же номер выражается и заряд атомного ядра. Введем обозначение:
Z — порядковый номер элемента = число электронов в атоме.
Тогда для заряда атомного ядра и общего заряда всех электронов в атоме можно записать:
qядра = +Ze,
qэл-нов = –Ze.
Сложив общий заряд электронов в атоме с зарядом атомного ядра, мы получим нуль. Это означает, что в целом атом нейтрален. Нейтральными являются и молекулы вещества, так как они состоят из нейтральных атомов.
В некоторых случаях (например, при столкновениях) атомы могут потерять один или несколько своих электронов. Вместе с электронами атомы теряют часть своего отрицательного заряда и перестают быть нейтральными. Образующийся в результате этого положительно заряженный атом называют положительным ионом.
Бывают и обратные случаи: нейтральный атом присоединяет к себе лишний электрон и становится отрицательно заряженным. Такой атом называют отрицательным ионом.
??? 1. Кто и когда открыл электрон? 2. Как заряжен электрон? 3. Вокруг чего обращаются электроны внутри атома? 4. Как заряжено атомное ядро? 5. Докажите, что атом в целом нейтрален. 6. Кто и когда открыл строение атома? 7. Чем отличаются альфа-, бета- и гамма-лучи друг от друга? 8. Приведите примеры радиоактивных веществ. 9. Почему большинство альфа-частиц в опыте Резерфорда практически беспрепятственно пролетало сквозь фольгу? 10. На что наталкивались внутри атома альфа-частицы, которые в опыте Резерфорда отскакивали от фольги назад? 11. Чем отличаются друг от друга атомы разных химических элементов? 12. Что представляют собой положительные и отрицательные ионы? Как они образуются?
phscs.ru
Строение атома
Строение атома интересовало ученых еще задолго до того, как существование его было доказано научно. Еще тысячи лет назад Демокрит, древнегреческих философ и мудрец, высказал предположение о том, что любое вещество состоит из мельчайших частиц. И именно он первым употребил слово «атом». После его смерти возникла группа греческих философов, члены которой пытались развить его взгляды. Их называли атомистами. Все эти взгляды изложил римлянин Лукреций Кар в своем известном труде «О природе вещей». Однако в более поздние времена, вплоть до начала эпохи Возрождения, преобладали взгляды другого греческого мудреца, Аристотеля, который категорически отрицал существование атомов.
Первым, кто сделал попытку возродить учение Демокрита, был англичанин Бойль, который обосновывал свою теорию «неделимых частиц». Ему вторил Ньютон. Однако научно обосновал это учение Дальтон, учитель математики. Проводя опыты с газами, он заметил, что соотношение тех частиц водорода и кислорода, которые участвовали в химической реакции, всегда соответствует определенной пропорции. Последние, как правило, представляют собой соотношение небольших чисел. Это дало возможность английскому учителю математики сформулировать свой закон «кратных соотношений», а со временем – и закон «постоянных отношений», исходя из которого, в каждом химическом соединении соотношение масс исходных веществ всегда одинаковое. Его исследования были продолжены Берцеллиусом и Авогадро.
То, что строение атома достаточно сложное, было доказано физиками еще столетие назад. Вклад в такое большое открытие внесли: Томсон, доказавший существование катодных лучей, Складовская-Кюри и ее муж Пьер Кюри, открывшие естественную радиоактивность веществ, Резефорд, который заявил о наличии в центре атома положительно заряженного ядра и о возможности искусственного превращения одного элемента в другой, Чедвик, обнаруживший наличие нейтральных элементов, или нейтронов. Строение атома первым всерьез начал изучать Томпсон, который и открыл электрон в 1897 году. Он смог доказать существование еще более микроскопических тел. Благодаря его деятельности строение атома стало во многом понятным. Он открыл, что данная частица представлена сферическим распределением положительных зарядов, которые полностью компенсируются отрицательными. По этой причине атом является электрически нейтральным.
В результате ряда исследований, проведенных этими и другими учеными, было выяснено, что атом не является однородным телом, а состоит из таких частиц, как нейтроны, протоны и электроны.
В ядре атома протонов столько же, сколько и электронов в его оболочке, кроме того, количество протонов соответствует номеру элемента в таблице Менделеева. Массы протона и нейтрона практически идентичны. Эти элементы удерживаются в ядре атома особыми силами, которые еще называются ядерными; эти силы очень мощные, но действуют на сверхкоротких расстояниях, при этом многократно превосходя силы отталкивания частиц. Вес электронов весьма незначителен. Практически вся масса атома заключается в его ядре, строение ядра атома включает нейтроны и протоны. Свойства этой его части определяются его основными компонентами, указанными выше. Среди атомов встречаются так называемые изотоны. Эти частицы одного и того же вещества имеют разную массу из-за того, что количество их нейтронов может различаться. Количество же их протонов, однако, всегда одно и то же. К примеру, строение атома углерода обычно предполагает наличие в его ядре шести положительно заряженных частиц и шести нейтральных – всего 12, то есть так называемое массовое число углерода чаще всего – 12. Однако имеются и изотопы этого элемента, в которых число протонов стабильно соответствует 6, а число нейтронов может отличаться.
Оболочка атома является достаточно сложной системой. Состоит она из различных подоболочек с разными энергетическими уровнями, которые, в свою очередь, делятся на подуровни, а подуровни – на орбитали. Последние различаются по форме и своему размеру.
fb.ru
строение атома и атомного ядра
Атом является наименьшей частицей элемента, сохраняющей его характеристики.
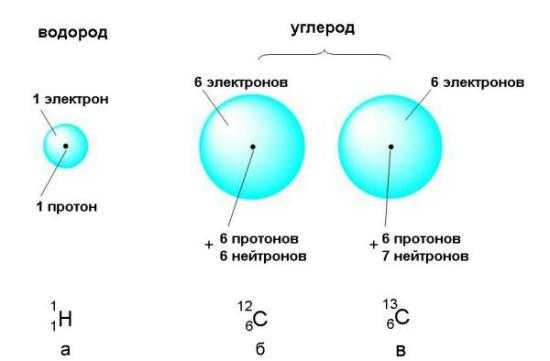
Строение атомного ядра.
Атомы различных элементов отличаются друг от друга. Поскольку существует свыше 100 различных элементов, то существует и свыше 100 различных видов атомов.
Рис 1-2. Части атома.
Каждый атом имеет ядро, расположенное в центре атома. Оно содержит положительно заряженные частицы – протоны и незаряженные частицы – нейтроны.
Электроны, отрицательно заряженные частицы, вращаются вокруг ядер (см. Рис. 1-2).
Количество протонов в ядре атома называется атомным номером элемента.
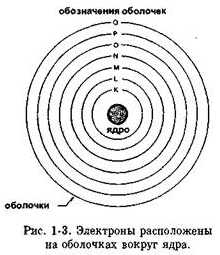
Рис. 1-3. Электроны, расположенные на оболочках вокруг ядра.
Атомные номера позволяют отличить один элемент от другого. Каждый элемент имеет атомный вес. Атомный вес — это масса атома, которая определяется общим числом протонов и нейтронов в ядре. Электроны практически не дают вклада в общую массу атома, масса электрона составляет только 1/1845 часть массы протона и ею можно пренебречь.
Электроны вращаются по концентрическим орбитам вокруг ядра. Каждая орбита называется оболочкой. Эти оболочки заполняются в следующей последовательности: сначала заполняется оболочка К, затем L, М, N и т.д. (см. Рис. 1-3). Максимальное количество электронов, которое может разместиться на каждой оболочке, показано на Рис. 1-4.
Внешняя оболочка называется валентной, и количество электронов, содержащееся в ней, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшее притяжение со стороны ядра испытывает каждый валентный электрон. Таким образом, потенциальная возможность атома присоединять или терять электроны увеличивается, если валентная оболочка не заполнена и расположена достаточно далеко от ядра.
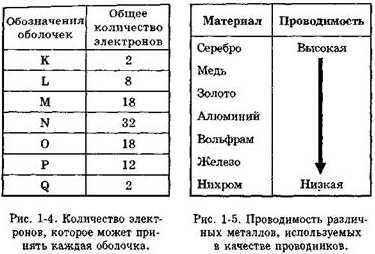
Рис. 1-4 и 1-5. Состав атома.
Электроны валентной оболочки могут получать энергию. Если эти электроны получат достаточно энергии от внешних сил, они могут покинуть атом и стать свободными электронами, произвольно перемещающимися от атома к атому. Материалы, содержащие большое количество свободных электронов, называются проводниками.
Рис. 1-6. Валентность меди.
На Рис. 1-5 сравниваются проводимости различных металлов, используемых в качестве проводников. В таблице серебро, медь и золото имеют валентность, равную единице (см. Рис. 1-6). Однако серебро является лучшим проводником, поскольку его валентные электроны слабее связаны.
Изоляторы, в противоположность проводникам, препятствуют протеканию электричества. Изоляторы стабильны благодаря тому, что валентные электроны одних атомов присоединяются к другим атомам, заполняя их валентные оболочки, препятствуя, таким образом, образованию свободных электронов.

Рис. 1-7. Диэлектрические свойства различных материалов, используемых в качестве изоляторов.
Материалы, классифицируемые как изоляторы, сравниваются на Рис. 1-7. Слюда является наилучшим изолятором, потому что она имеет наименьшее число свободных электронов на своих валентных оболочках.
Промежуточное положение между проводниками и изоляторами занимают полупроводники.Полупроводники не являются ни хорошими проводниками, ни хорошими изоляторами, но они важны, потому что их проводимость можно изменять от проводника до изолятора. Кремний и германий являются полупроводниковыми материалами.
Об атоме, который имеет одинаковое число электронов и протонов, говорят, что он электрически нейтрален. Атом, получающий один или более электронов, не является электрически нейтральным. Он становится отрицательно заряженным и называется отрицательным ионом. Если атом теряет один или более электронов, то он становится положительно заряженным и называется положительным ионом. Процесс присоединения или потери электронов называется ионизацией. Ионизация играет большую роль в протекании электрического тока.
Поделитесь полезной статьей:
Topfazaa.ru
строение атома, схема и примеры. Электронное строение атома железа
Рассмотрим электронное строение атома железа, а также его расположение в таблице Менделеева. Выявим основные физические и химические свойства данного элемента, области использования.
Положение в ПС
Железо является д-элементом 8 группы (побочной подгруппы). Имеет 26 порядковый номер, относительную атомную массу – 56, в его атоме содержится 26 протонов, 26 электронов, а также 30 нейтронов. Данный металл имеет среднюю химическую активность, проявляет восстановительные свойства. Характерные степени окисления: +2, +3.
Особенности строения атома
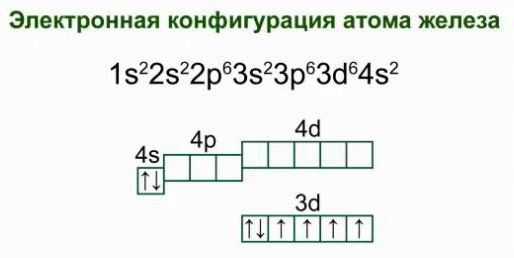
Что собой представляет электронная схема строения атома железа? Если рассматривать распределение электронов по энергетическим уровням, получим следующий вариант:
2е; 8е; 14 е; 2е. Такое строение электронной оболочки атома железа свидетельствует о его расположении в побочной подгруппе, подтверждает принадлежность к д-семейству элементов.

Нахождение в природе
Железо является одним из наиболее распространенных в природе химических элементов. В земной коре его процентное содержание составляет около 5,1%. В большем количестве в недрах нашей планеты присутствует только три элемента: кремний, алюминий, кислород.
Железные руды встречаются в разных регионах Земли. Алхимиками были обнаружены соединения данного металла в почвах. При производстве железа выбирают руды, в которых его содержание превышает 30 процентов.
В магнитном железняке содержится около семидесяти двух процентов металла. Основные месторождения магнетита располагаются в Курской магнитной аномалии, а также на Южном Урале. В кровавике процентное количество железа достигает 65 процентов. Гематит был обнаружен в Криворожском районе.

Значение для растений и животных
Какую роль в живых организмах выполняет железо? Строение атома поясняет его восстановительные свойства. Данный химический элемент входит в состав гемоглобина, придавая ему характерную красную окраску. Около трех граммов чистого железа, большая часть которого включена в гемоглобин, обнаружена в организме взрослого человека. Основным предназначением является перенос к тканям из легких активного кислорода, а также вывод образующегося углекислого газа.
Необходим этот металл и растениям. Входя в состав цитоплазмы, он принимает активное участие в процессах фотосинтеза. Если в растении недостаточно железа, его листья имеют белую окраску. При минимальных подкормках солями железа листья растений приобретают зеленый цвет.
Физические свойства
Мы рассмотрели строение атома железа. Схема подтверждает наличие у данного элемента металлического блеска (есть валентные электроны). У серебристо-белого металла довольно высокая температура плавления (1539 градусов по Цельсию). Благодаря хорошей пластичности данный металл легко поддается прокатке, штамповке, ковке.
Способность к намагничиванию и размагничиванию, характерная для железа, сделала его отличным материалом для производства сердечников мощных электромагнитов в разных аппаратах и электрических машинах.
Насколько активно железо? Строение атома показывает наличие на внешнем уровне двух электронов, которые будут отданы в ходе химической реакции. Для увеличения его твердости и прочности осуществляют дополнительную прокатку и закалку металла. Такие процессы не сопровождаются изменением строения атома.

Разновидности железа
Электронное строение атома железа, схема которого была рассмотрена выше, объясняет его химические характеристики. В технически чистом металле, являющемся низкоуглеродистой сталью, основным компонентом является железо. В качестве примесей выявлено около 0,04 процента углерода, также присутствуют фосфор, азот, сера.
Химически чистое железо по своим внешним параметрам аналогично платине. Оно обладает повышенной стойкостью к процессам коррозии, устойчиво к действию кислот. При малейшем введении примесей в чистый металл его уникальные характеристики исчезают.
Варианты получения
Строение атомов алюминия и железа свидетельствуют о принадлежности амфотерного алюминия к главной подгруппе, возможности использования его в процессе выделения железа из его оксидов. Алюмотермия, осуществляемая при повышенной температуре, позволяет выделять чистый металл из природных руд. Кроме алюминия в качестве сильных восстановителей выбирают водород, оксид углерода (2), уголь.
Особенности химических свойств
Какие химические свойства имеет железо? Строение атома поясняет его восстановительную активность. Для железа характерно образование двух рядов соединений, имеющих степени окисления +2, +3.
Во влажном воздухе происходит процесс ржавления (коррозии) металла, в результате образуется гидроксид железа (3). С кислородом нагретая железная проволока реагирует с появлением черного порошка оксида железа (2,3), называемого железной окалиной.
При высокой температуре металл способен взаимодействовать с парами воды, образуя при этом смешанный оксид. Процесс сопровождается выделением водорода.
Реакция с неметаллами происходит только при предварительном нагревании исходных компонентов.
Железо можно растворить в разбавленной серной или соляной кислотах без предварительного подогрева смеси. Концентрированные серная и соляная кислоты пассивируют этот металл.
Какими еще химическими свойствами обладает железо? Строение атома данного элемента свидетельствует о его средней активности. Это подтверждается расположением железа до водорода (Н2) в ряду напряжений. Следовательно, оно может вытеснять из солей все металлы, располагающиеся правее в ряду Бекетова. Так, в реакции с хлоридом меди (2), осуществляемой при нагревании, происходит выделение чистой меди и получение раствора хлорида железа (2).
 Области применения
Области применения
Основную часть всего железа используют в производстве чугуна и стали. В чугуне процентное содержание углерода составляет 3-4 процента, в стали – не больше 1,4 процентов. Этот неметалл выполняет функцию элемента, повышающего прочность соединения. Кроме того, он позитивно воздействует на коррозионные свойства сплавов, повышает устойчивость материала к повышенной температуре.
Добавки ванадия необходимы для повышения механической прочности стали. Хром увеличивает стойкость к действию агрессивных химических веществ.
Ферромагнитные свойства этого химического элемента сделали его востребованным в промышленных установках, включающих в состав электромагниты. Кроме того, железо нашло свое использование и в сувенирной промышленности. На его основе изготавливают различные сувениры, например красочные магнитики на холодильник.
Прочность и ковкость позволяют применять металл для создания брони, различных видов оружия.
Хлорид железа (3) применяют для очистки воды от примесей. В медицине 26 элемент периодической системы Менделеева применяют при лечении такого заболевания, как анемия. В случае недостатка красных кровяных телец возникает быстрая утомляемость, кожа приобретает неестественный бледный цвет. Препараты железа помогают устранять подобную проблему, возвращать организм к полноценной деятельности. Особое значение железо имеет для деятельности щитовидной железы, печени. Чтобы в организме человека не возникало серьезных проблем, достаточно употреблять в день около 20 мг этого металла.
fb.ru

 Области применения
Области применения

